El desarrollo eficaz de fármacos debe agilizar el número de fármacos candidatos que entran en el ciclo, para reducir el costo y el tiempo del proceso. Estudios recientes recomiendan la integración de una variedad de técnicas para desarrollar procesos de investigación y desarrollo (I + D), así como el uso de datos genéticos para identificar los nuevos medicamentos con mayor probabilidad de éxito. La proteómica y la transcriptómica se encuentran entre los campos más valiosos para este fin.
En el presente, Hay más de 150 ensayos clínicos que prueban medicamentos que se cree que son posiblemente efectivos para aumentar la supervivencia y mejorar la recuperación de los pacientes con COVID-19. Estos incluyen hidroxicloroquina, cloroquina, y baricitinib.
Otra vía para recopilar evidencia sobre fármacos potencialmente útiles contra COVID-19 es encontrar las proteínas del huésped que facilitan la entrada e infección viral. y al examinar la posibilidad de reutilizar objetivos de fármacos anteriores en el SARS-CoV para combatir el virus actual, síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2).
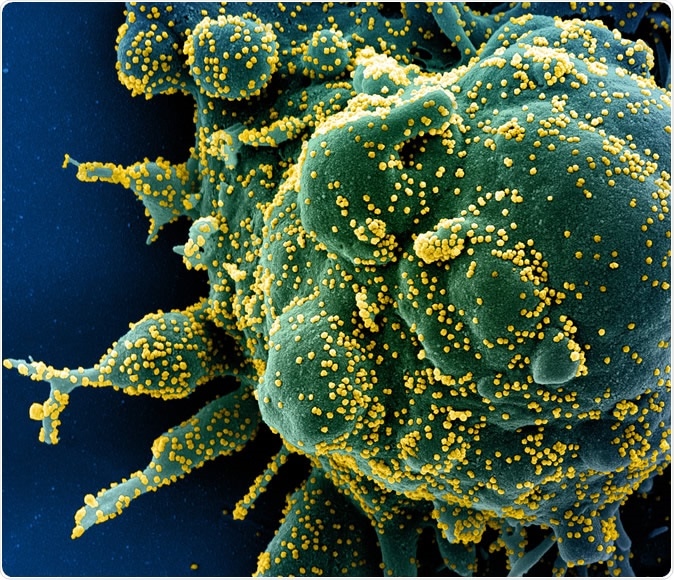 Nuevo coronavirus SARS-CoV-2 Micrografía electrónica de barrido coloreada de una célula apoptótica (verde) muy infectada con partículas del virus SARS-COV-2 (amarillo), aislado de una muestra de un paciente. Imagen capturada en la Instalación de Investigación Integrada (IRF) del NIAID en Fort Detrick, Maryland. Crédito:NIAID
Nuevo coronavirus SARS-CoV-2 Micrografía electrónica de barrido coloreada de una célula apoptótica (verde) muy infectada con partículas del virus SARS-COV-2 (amarillo), aislado de una muestra de un paciente. Imagen capturada en la Instalación de Investigación Integrada (IRF) del NIAID en Fort Detrick, Maryland. Crédito:NIAID Un estudio reciente encontró más de 330 proteínas del huésped humano que son necesarias para que el virus infecte a los humanos. Estos interactúan con 26 proteínas virales. Esto podría ayudar a impulsar la I + D a lo largo de la primera ruta.
El segundo método ha sido utilizado por algunos estudios, que han producido 59 genes de ratón que están relacionados con la infección anterior por SARS-CoV. Entre estos, hay 44 que tienen equivalentes en el genoma humano. Al bloquear las interacciones de proteínas virales-humanas, puede ser posible atacar los mecanismos de infección viral de manera más eficaz con una menor probabilidad de resistencia a los medicamentos, en comparación con apuntar directamente al virus.
Un problema principal con este enfoque es el peligro de producir inadvertidamente otros efectos que podrían empeorar las enfermedades complejas, o incluso beneficiarlas. El estudio actual tiene como objetivo evaluar cómo estos objetivos farmacológicos podrían afectar el funcionamiento del cuerpo humano, basado en una comprensión de la genética subyacente.
Los investigadores utilizaron el protocolo para la priorización de medicamentos, que desarrollaron con éxito anteriormente, para probar 353 dianas farmacológicas que posiblemente interactúen con el virus. Querían observar cómo estos medicamentos causaban otros efectos visibles de la infección, así como también cómo lograron los efectos previstos y no deseados sobre enfermedades complejas.
Primero construyeron un atlas de enfermedades que muestra las proteínas y genes humanos que participan en la entrada viral. Esto fue a través de estudios de aleatorización mendeliana, proporcionando más de 372, 000 predicciones únicas de cómo el fármaco afecta a una enfermedad. Esto se basó en la proteómica del plasma, así como en la transcriptómica específica de tejido.
Como resultado, pudieron evaluar cómo estos 353 fármacos potenciales podrían actuar en 49 fenotipos de infección viral, cómo podrían afectar a más de 500 enfermedades complejas, y cambiar 72 fenotipos de enfermedad. Estos resultados se evaluaron con respecto a los datos de los ensayos de medicamentos, así como el genoma drogadicto, para identificar los principales medicamentos con la mayor posibilidad de reutilización, y los menores efectos secundarios.
Han creado una plataforma de acceso abierto en línea que contiene los resultados de todas las pruebas, para que cualquiera pueda examinar rápidamente los resultados de cualquiera de los fármacos.
El atlas de interacciones fármaco-objetivo-enfermedad proporciona más de 370, 000 asociaciones de enfermedades diana en 11 tejidos que son relevantes en el escenario COVID-19. De ellos, 833 tenían una fuerte evidencia de la resonancia magnética de los 11 tejidos. 726 de estos también mostraron una colocalización robusta, para una probabilidad de colocalización superior al 70%. Estos fueron los hallazgos más sólidos del estudio.
La importancia de detectar tales asociaciones radica en la capacidad de realizar análisis de cómo la expresión de determinadas dianas afecta a enfermedades específicas, dependiendo del tejido. Por ejemplo, los efectos de las dianas farmacológicas sobre la enfermedad de Crohn, hipertensión, trastornos atópicos, y se podría evaluar la diabetes. En cualquier lugar, entre 11 y 17 de los genes diana tenían asociaciones con estas cuatro enfermedades, basado en qué tejido se estudió.
En segundo lugar, se analizaron las dianas del fármaco para determinar su asociación con 49 fenotipos de infección viral. Hubo dos asociaciones fuertes, a saber, el gen NEU1 con hepatitis crónica y el gen DPY19L1 con enteritis viral. También hubo tres asociaciones menos fuertes pero sugerentes, como el gen JAK2 con hepatitis crónica.
En tercer lugar, el estudio mostró 45 formas potenciales en las que las proteínas podrían afectar los rasgos de la enfermedad y 430 asociaciones similares con la expresión del ARNm. Entre estos, hubo 95 blancos asociados con 105 enfermedades o expresiones de enfermedades. El gen JAK2, por ejemplo, está asociado con nueve fenotipos de enfermedades, que van desde la atopia hasta la obesidad, lo que sugiere acciones potencialmente pleiotrópicas para este gen.
Finalmente, encontraron 249 asociaciones en las que la diana del fármaco afectaba un fenotipo de enfermedad de manera diferente según el tejido analizado. Entre estos se encontraban 52 genes únicos expresados en 7 tejidos para afectar 47 enfermedades únicas.
Hubo 29 efectos dependientes del tejido fuertemente asociados del objetivo del fármaco sobre la enfermedad en más de un tejido, entre los cuales, sólo dos no mostraron la misma dirección de efecto cuando se expresaron en sangre, así como en una variedad de otros tejidos.
Por ejemplo, el gen DHODH afecta el colesterol de lipoproteínas de baja densidad (LDL). Un fármaco que se comercializa contra las LDL altas, llamado leflunomida, funciona inhibiendo este gen. La leflunomida también se está considerando como una terapia COVID-19.
El análisis mostró que este fármaco se expresa solo en relación al LDL sin muchas otras acciones diversas, sobre un amplio espectro de tejidos desde el pulmón hasta el colon.
Los investigadores puntuaron las 726 asociaciones encontradas por MR entre el objetivo y la enfermedad, utilizando datos de ensayos clínicos, así como la supuesta evidencia de que causaron diferentes efectos fenotípicos en una variedad de tejidos, para llegar a las asociaciones más drogadictas. 499 de ellos eran combinaciones únicas de objetivo y enfermedad, observándose los demás en más de un tejido.
Establecieron cuatro clases de puntuación, como la puntuación ómica, la puntuación de prueba, la puntuación de la drogadicción, y la puntuación de infección. Cada puntaje se escaló de 1 a 100. Hubo puntajes altos para 2 de las 499 asociaciones en 3 de 4 clases, lo que los convirtió en los objetivos con mayor prioridad de desarrollo. 77 puntuaron alto en dos clases y 97 en una. Los 323 restantes obtuvieron puntajes universalmente bajos y, por lo tanto, se consideran los objetivos farmacológicos de menor prioridad.
Algunos objetivos incluyen el gen ITGB5 que es el objetivo del fármaco Cilengitide, que estaba destinado a glioblastomas y tumores similares. Sus puntajes altos y el perfil genético sugieren que tiene el potencial de reducir la presión arterial alta. Entre los 5 primeros, todos carecían de asociaciones fuertes con afecciones como arritmias cardíacas, lo que podría afectar su uso en COVID-19.
Por otra parte, el gen TLR9, que es el objetivo del fármaco hidroxicloroquina tiene puntuaciones altas en dos categorías, pero una puntuación baja para las otras dos. Aún no se ha acumulado evidencia clínica en cuanto al beneficio clínico o antivírico de una combinación de este medicamento con azitromicina. Es más, este gen puede aumentar la posibilidad de un accidente cerebrovascular embólico, asma, y ciertas condiciones inmunológicas.
El estudio pudo promover la priorización de los objetivos de los medicamentos de tres maneras:examinando los problemas de seguridad que pueden surgir de la reutilización de los medicamentos para el tratamiento de COVID-19; identificar objetivos farmacológicos prometedores; y descubrir cómo la diana del fármaco afecta el fenómeno humano en diferentes tejidos.
Usando este enfoque, una droga potencial, Baricitinib, se está probando su eficacia en COVID-19. Se cree que inhibe la proteína JAK2, y así reducir la inflamación sistémica. Sin embargo, el estudio actual propuso que también podría causar hepatitis crónica. De hecho, la literatura sugiere que la hepatitis B se reactiva después del tratamiento con el inhibidor de JAK 2 ruxolitinib.
Los tres fármacos de alto potencial de este estudio incluyen el fármaco inmunosupresor Leflunomida, utilizado en la artritis reumatoide, entre otras condiciones, y Cilengitide. El primero tiene actividad antiviral contra múltiples virus, y el estudio actual también sugiere que tiene propiedades reductoras de lípidos, mientras que este último tiene actividad antihipertensiva, posiblemente.
Finalmente, algunos de estos objetivos se expresan en múltiples tejidos para producir el mismo fenotipo, pero otros muestran una expresión cambiante específica del tejido.
Si bien existen algunas limitaciones, el estudio proporciona una canalización para el estudio de genética estadística y una plataforma de acceso abierto para organizar los objetivos de los medicamentos contra COVID-19 en orden de prioridad. Los estudios de asociación de todo el genoma (GWAS) podrían mejorar aún más la calidad de los datos, haciéndolo aún más útil para encontrar objetivos farmacológicos prometedores entre los medicamentos potencialmente reutilizados.
medRxiv publica informes científicos preliminares que no son revisados por pares y, por lo tanto, no debe considerarse concluyente, orientar la práctica clínica / comportamiento relacionado con la salud, o tratada como información establecida.
 Si tiene más de 50 años,
Si tiene más de 50 años,
 Los hallazgos iniciales del Proyecto del Microbioma Humano provocaron "cientos de estudios posteriores"
Los hallazgos iniciales del Proyecto del Microbioma Humano provocaron "cientos de estudios posteriores"
 La investigación muestra cómo los microbios intestinales afectan la gripe estomacal
La investigación muestra cómo los microbios intestinales afectan la gripe estomacal
 Los científicos desarrollan un enfoque para vacunar contra la inflamación intestinal
Los científicos desarrollan un enfoque para vacunar contra la inflamación intestinal
 Diabetes tipo 1 relacionada con el microbioma intestinal y factores genéticos
Diabetes tipo 1 relacionada con el microbioma intestinal y factores genéticos
 Los microbios podrían predecir resultados fatales en pacientes ventilados con COVID-19
Los microbios podrían predecir resultados fatales en pacientes ventilados con COVID-19
 El trasplante de líquido vaginal podría ayudar a tratar la vaginosis bacteriana recurrente
La vaginosis bacteriana es un problema común y molesto para muchas mujeres. Ahora, los investigadores han descubierto que el trasplante de fluidos vaginales de una mujer sana a mujeres con vaginosis b
El trasplante de líquido vaginal podría ayudar a tratar la vaginosis bacteriana recurrente
La vaginosis bacteriana es un problema común y molesto para muchas mujeres. Ahora, los investigadores han descubierto que el trasplante de fluidos vaginales de una mujer sana a mujeres con vaginosis b
 ¿Qué nos pueden decir las heces antiguas sobre la evolución del microbioma intestinal humano?
La información de la microbiota antigua representa un recurso vital para estudiar la evolución bacteriana y explorar la propagación biológica de enfermedades crónicas a lo largo de la historia. Un e
¿Qué nos pueden decir las heces antiguas sobre la evolución del microbioma intestinal humano?
La información de la microbiota antigua representa un recurso vital para estudiar la evolución bacteriana y explorar la propagación biológica de enfermedades crónicas a lo largo de la historia. Un e
 Infliximab puede obstaculizar la eficacia de algunas vacunas COVID-19
Dado que muchos países se ven gravemente afectados por oleadas repetidas de infección por coronavirus 2 (SARS-CoV-2), síndrome respiratorio agudo severo, con altas tasas asociadas de enfermedad sintom
Infliximab puede obstaculizar la eficacia de algunas vacunas COVID-19
Dado que muchos países se ven gravemente afectados por oleadas repetidas de infección por coronavirus 2 (SARS-CoV-2), síndrome respiratorio agudo severo, con altas tasas asociadas de enfermedad sintom