SARS-CoV-2 on RNA-virus, joka kuuluu perheeseen Coronaviridae sukuun Betacoronavirus. Tämän viruksen Spike (S) -proteiini välittää ensisijaisesti vuorovaikutusta ihmisen isäntäsolujen kanssa. S-proteiinin pinnalla oleva reseptoria sitova domeeni (RBD) sitoutuu isännän angiotensiiniä konvertoivan entsyymin 2 (ACE2) reseptoriin. ACE2 on läsnä useissa isäntäkudoksissa, kuten GI -epiteelisolut ja maksasolut.
Tutkijat ovat havainneet tämän viruksen esiintymisen useissa kudoksissa, kuten ruokatorvi, vatsa, pohjukaissuoli, ja peräsuoleen. Myös, sairaalahoitopotilaiden, joilla on vaikea COVID-19-infektio, endoskopia on osoittanut ruokatorven verenvuotoa eroosioiden ja haavaumien kanssa.
Ihmiset, joilla on muita sairauksia, kärsivät yleensä vakavasta COVID-19-infektiosta. Näillä potilailla ACE2 -pitoisuudet keuhkoissa ovat korkeammat kuin potilailla, joilla ei ole muita sairauksia. Äskettäinen tutkimus on osoittanut, että ACE2 ilmeni merkittävästi ihmisten keuhkoissa, jotka kärsivät kroonisista obstruktiivisista keuhkosairauksista ja keuhkoverenpaineesta. Koska ACE2:n ilmentyminen riippuu tietyistä olosuhteista, kuten kohonneista glukoositasoista, hypoksia, ja solustressi, tutkijat uskovat, että muut GI:hen liittyvät liitännäissairaudet voivat liittyä erilaisiin COVID-19-muotoihin.
Uusi tutkimus julkaistiin lehdessä Lääketieteen rajat osoitti, että Barrettin ruokatorvi (BE) ja gastroesofageaalinen refluksitauti (GERD) voivat olla uusia SARS-CoV-2-tautiin liittyviä liitännäissairauksia. Aiemmassa tutkimuksessa arvioitiin, että Yhdysvalloissa 5,6% aikuisista on BE, sairaus, jossa GERD vaurioittaa ruokatorven okasolukalvon.
Tässä tutkimuksessa tutkijat paljastivat, että ACE2 ilmentyy voimakkaasti BE -potilaiden ruokatorvessa. Näillä potilailla hapon pH indusoi ACE2:n ilmentymisen. Ryhmä viljelti ihmisen primaarisia monosyyttejä alennetussa pH:ssa, joka paljasti ACE2:n ilmentymisen lisääntymisen ja merkittävämmän viruskuormituksen SARS-CoV-2-infektion yhteydessä.
Tutkijat ehdottavat, että hapon pH parantaa COVID-19-infektiota säätelemällä ACE2-reseptoria, ja tämä, vuorostaan, voi olla kliinisiä vaikutuksia potilaille, jotka kärsivät GERD:stä tai BE:stä. Vaikka ei ole näyttöä mekanismeista, jotka yhdistävät pH -muutokset ja ACE2 -ilmentymisen, aiemmat tutkimukset ovat osoittaneet, että hypoksiset olosuhteet voivat lisätä ACE2:n ilmentymistä. Tämä tutkimus paljasti, että kaksi ACE2:n tunnetuista säätelijöistä, nimittäin, HNF1B ja FOXA2, raportoitiin olevan ylisääteisiä kuudessa kahdeksasta BE-transkriptistutkimuksessa. Tämä osoittaa, että nämä säätimet voivat liittyä pH:n aiheuttamaan ACE2-ilmentymiseen BE:ssä.
Yksi COVID-19-taudin pääpiirteistä on keuhkovaurio, joka voi johtaa akuuttiin hypoksiaan ja toiseen hengitysteiden asidoosiin. Lisäksi, tutkijat uskovat, että joillakin vakavasti tartunnan saaneilla COVID-19-potilailla esiintyy veren asidoosia. Tämä tila heikentää potilaan tilaa lisäämällä ACE2 -ilmentymistä, joka parantaa SARS-CoV-2:n pääsyä ihmisen soluihin. Myös, lisääntynyt laktaattidehydrogenaasientsyymipitoisuus, joka muuntaa laktaatin pyruvaatista, on yhdistetty vakavaan COVID-19-tautiin. Tämä lisääntynyt laktaattitaso voi muuttaa suoraan solunulkoista ja solunsisäistä pH:ta, joka muuttaa ACE2 -ilmentymää. Lisää tutkimusta tarvitaan arvioimaan, missä määrin akuutti systeeminen asidoosi vaikuttaa COVID-19-vakavuuteen. Tässä tutkimuksessa tutkijat ovat osoittaneet, että pH yksin saattaa muuttaa ACE2-ilmentymistä ja estää sen jälkeen potilaiden SARS-CoV-2-infektion.
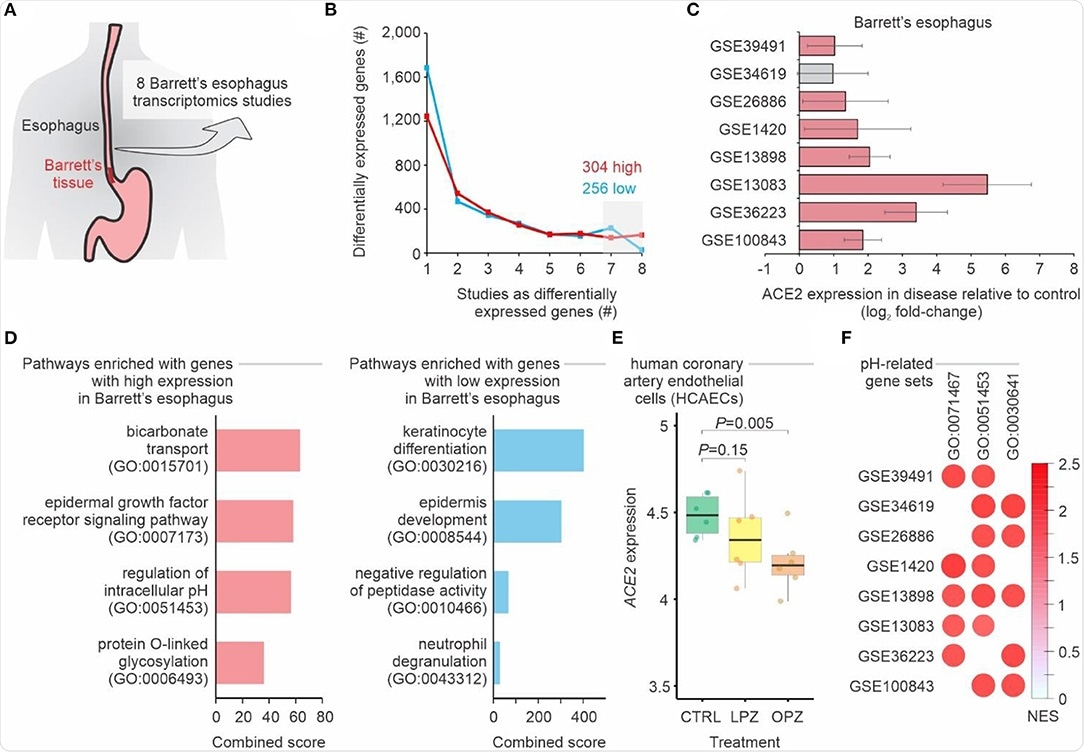 Barrettin ruokatorvea sairastavien potilaiden gastroesofageaalisen liitoksen transkriptomien meta-analyysi. (A) Meta-analyysi 8 tutkimuksesta Barrettin ruokatorven transkriptoomeista. (B) Eri tavalla ekspressoitujen geenien määrä Barrettin ruokatorvessa verrattuna ei-Barrettin ruokatorveen. Viivat osoittavat geenien (y-akseli) lukumäärän, jota pidetään ylös- tai alasäädeltynä (siniset viivat) Barrettin ruokatorvessa (P-arvo <0,05; log2-kertainen muutos> 1; yhdistetty FDR <0,01) yhdessä tai useammassa tietojoukossa (x-akseli). Ylös- ja alasäädeltyjen geenien lukumäärä vähintään seitsemässä tutkimuksessa on ilmoitettu. (C) ACE2 on ylisääteinen potilailla, joilla on Barrettin ruokatorvi. Jokainen palkki edustaa log2-lausekkeen taitemuutosta potilaiden ja kontrollipotilaiden välillä. Virhepalkit osoittavat 95%:n luottamusvälin. Punaiset palkit edustavat P-arvoa <0,05 ja harmaina ei-merkittävää P-arvoa. (D) Polun rikastumisanalyysi käyttäen ylös- ja alaspäin säädeltyjä geenejä vähintään seitsemässä tutkimuksessa. Palkit edustavat yhdistettyä pistemäärää (x -akseli), jonka Enrichr -työkalu on laskenut valituille geeniantologian geenisarjoille (y -akseli). (E) ACE2 -ilmentyminen soluissa, joita on käsitelty protonipumpun estäjillä. Jokainen laatikko kuvaa käsittelemättömien (CTRL) solujen ja joko omepratsolilla (OPZ) tai lansopratsolilla (LPZ) käsiteltyjen solujen log2 -ilmentymistä. (F) Geenijoukon rikastamisanalyysi (GSEA) kahdeksasta Barrettin ruokatorven transkriptomeista tehdystä tutkimuksesta käyttäen pH-arvoisia geenijoukkoja. Ympyröiden koko ja väri ovat verrannollisia kunkin tutkimuksen (rivit) geenijoukkojen (sarakkeiden) normalisoituun rikastumispisteeseen (NES). Geenien ontologiatunnukset on merkitty yläreunaan.
Barrettin ruokatorvea sairastavien potilaiden gastroesofageaalisen liitoksen transkriptomien meta-analyysi. (A) Meta-analyysi 8 tutkimuksesta Barrettin ruokatorven transkriptoomeista. (B) Eri tavalla ekspressoitujen geenien määrä Barrettin ruokatorvessa verrattuna ei-Barrettin ruokatorveen. Viivat osoittavat geenien (y-akseli) lukumäärän, jota pidetään ylös- tai alasäädeltynä (siniset viivat) Barrettin ruokatorvessa (P-arvo <0,05; log2-kertainen muutos> 1; yhdistetty FDR <0,01) yhdessä tai useammassa tietojoukossa (x-akseli). Ylös- ja alasäädeltyjen geenien lukumäärä vähintään seitsemässä tutkimuksessa on ilmoitettu. (C) ACE2 on ylisääteinen potilailla, joilla on Barrettin ruokatorvi. Jokainen palkki edustaa log2-lausekkeen taitemuutosta potilaiden ja kontrollipotilaiden välillä. Virhepalkit osoittavat 95%:n luottamusvälin. Punaiset palkit edustavat P-arvoa <0,05 ja harmaina ei-merkittävää P-arvoa. (D) Polun rikastumisanalyysi käyttäen ylös- ja alaspäin säädeltyjä geenejä vähintään seitsemässä tutkimuksessa. Palkit edustavat yhdistettyä pistemäärää (x -akseli), jonka Enrichr -työkalu on laskenut valituille geeniantologian geenisarjoille (y -akseli). (E) ACE2 -ilmentyminen soluissa, joita on käsitelty protonipumpun estäjillä. Jokainen laatikko kuvaa käsittelemättömien (CTRL) solujen ja joko omepratsolilla (OPZ) tai lansopratsolilla (LPZ) käsiteltyjen solujen log2 -ilmentymistä. (F) Geenijoukon rikastamisanalyysi (GSEA) kahdeksasta Barrettin ruokatorven transkriptomeista tehdystä tutkimuksesta käyttäen pH-arvoisia geenijoukkoja. Ympyröiden koko ja väri ovat verrannollisia kunkin tutkimuksen (rivit) geenijoukkojen (sarakkeiden) normalisoituun rikastumispisteeseen (NES). Geenien ontologiatunnukset on merkitty yläreunaan. Tämä tutkimus sisälsi kaksi riippumatonta kohorttia, joihin kuului 1, 357 SARS-CoV-2-tartunnan saanutta potilasta. Yksi ryhmä oli aiemmin käyttänyt protonipumpun estäjiä (PPI) ja toinen ryhmä sisälsi henkilöitä, jotka eivät käyttäneet lääkettä. Tämä tutkimus paljasti, että potilailla, joita hoidettiin PPI:llä (käytetään GERD-hoitoon), oli suurempi riski saada vaikea SARS-CoV-2 -infektio. Tämä arvioitiin havaitsemalla lisääntyneitä tehohoitoa.
Edelleen, tiedemiehet kertoivat myös, että kuolleisuus lisääntyi 2-3 kertaa PPI-hoitoa saaneessa ryhmässä, verrattuna niihin, jotka eivät käytä tätä lääkettä. Tämä tulos vastaa aikaisempia tutkimuksia, joissa tehtiin meta-analyysi, joka paljasti, että PPI:t nostivat etenemisen riskin vakavaan COVID-19-tautiin. Aiemmassa tutkimuksessa raportoitiin myös, että PPI-hoidetuilla henkilöillä oli suurempi riski saada COVID-19-infektio, ehkä siksi, että PPI vähensi maha-esteen SARS-CoV-2:ksi.
Tämän tutkimuksen tekijät uskovat, että pH voi vaikuttaa suuresti SARS-CoV-2 -infektioon ja taudin vakavuuteen. Kuitenkin, lisää tutkimuksia, joissa käytetään suurempia kohortteja, tarvitaan tämän havainnon validoimiseksi ja myös pH-indusoidun ACE2-ilmentymisen molekyylimekanismin määrittämiseksi.
 Rotaviruksella on rooli tyypin 1 diabeteksen kehittymisessä
Rotaviruksella on rooli tyypin 1 diabeteksen kehittymisessä
 Tutkimuksessa tarkastellaan aerobiomeja,
Tutkimuksessa tarkastellaan aerobiomeja,
 Äidistä vauvaan SARS-CoV-2-tartunta mahdollista raskauden aikana, mutta harvinainen,
Äidistä vauvaan SARS-CoV-2-tartunta mahdollista raskauden aikana, mutta harvinainen,
 Älä pelkää kolonoskopiaa
Älä pelkää kolonoskopiaa
 Ihmisillä, joilla on IBS -oireita, on todennäköisesti alhainen D -vitamiinipitoisuus,
Ihmisillä, joilla on IBS -oireita, on todennäköisesti alhainen D -vitamiinipitoisuus,
 Närästyksen ymmärtäminen
Närästyksen ymmärtäminen
 E. coli -bakteerin leviäminen huonon wc -hygienian vuoksi,
ei ruoan kautta Uusi tutkimus julkaistiin vuonna Lancetin tartuntataudit lokakuuta 22, 2019, sanoo, että yksi yleinen superbug, joka aiheuttaa yli 5, Englannissa vuosittain 000 ruokamyrkytystapausta
E. coli -bakteerin leviäminen huonon wc -hygienian vuoksi,
ei ruoan kautta Uusi tutkimus julkaistiin vuonna Lancetin tartuntataudit lokakuuta 22, 2019, sanoo, että yksi yleinen superbug, joka aiheuttaa yli 5, Englannissa vuosittain 000 ruokamyrkytystapausta
 Genetiikka voi vaikuttaa mikrobiomin koostumukseen enemmän kuin ympäristötekijät
Tutkijat, jotka tutkivat hiiriä Technion-Israel Institute of Technologyssä, ovat havainneet, että mikrobiomiin vaikuttaa paljon enemmän genetiikka kuin äidin syntymäympäristö. Kateryna Kon
Genetiikka voi vaikuttaa mikrobiomin koostumukseen enemmän kuin ympäristötekijät
Tutkijat, jotka tutkivat hiiriä Technion-Israel Institute of Technologyssä, ovat havainneet, että mikrobiomiin vaikuttaa paljon enemmän genetiikka kuin äidin syntymäympäristö. Kateryna Kon
 Suoliston mikrobiota voi ennustaa COVID-19:n vakavuuden
COVID-19-pandemia leviää kaikkialle maailmaan. Kaikki eivät kuitenkaan sairastu yhtä nopeasti. Uusi tutkimus julkaistiin esipainopalvelimella medRxiv huhtikuussa 2020 ehdottaa, että suoliston mikrob
Suoliston mikrobiota voi ennustaa COVID-19:n vakavuuden
COVID-19-pandemia leviää kaikkialle maailmaan. Kaikki eivät kuitenkaan sairastu yhtä nopeasti. Uusi tutkimus julkaistiin esipainopalvelimella medRxiv huhtikuussa 2020 ehdottaa, että suoliston mikrob