Un nouvel article dans la revue La vie présente une première revue des facteurs viraux impliqués dans l'initiation et l'exécution de l'apoptose dans les cellules infectées.
 Micrographie électronique à balayage colorisée d'une cellule apoptotique (bleu) infectée par des particules du virus SARS-COV-2 (rouge), isolé à partir d'un échantillon de patient. Image capturée au NIAID Integrated Research Facility (IRF) à Fort Detrick, Maryland. Crédit d'image :NIAID/Flickr
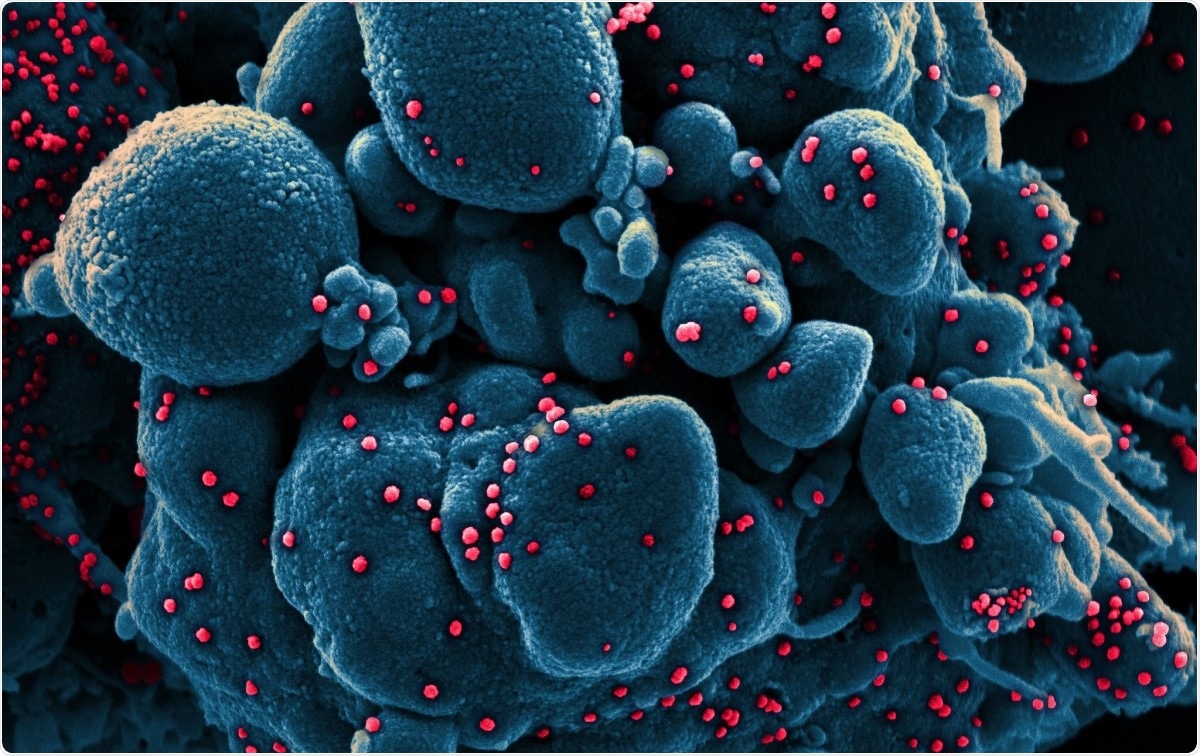
Micrographie électronique à balayage colorisée d'une cellule apoptotique (bleu) infectée par des particules du virus SARS-COV-2 (rouge), isolé à partir d'un échantillon de patient. Image capturée au NIAID Integrated Research Facility (IRF) à Fort Detrick, Maryland. Crédit d'image :NIAID/Flickr Les coronavirus sont parmi les plus gros virus à acide ribonucléique (ARN) identifiés à ce jour. Leur génome a une longueur d'environ 30 kb, avec quatre protéines structurales, et plusieurs protéines non structurelles et accessoires. Ils sont classés en alpha, bêta, coronavirus gamma et delta.
Plusieurs coronavirus animaux et humains ont été isolés jusqu'à présent et provoquent principalement des infections respiratoires ou gastro-intestinales. Comme d'autres virus, ils détournent la machinerie de la cellule hôte à toutes les étapes de leur réplication. Il s'agit de modifier l'expression de divers gènes de l'hôte, y compris ceux qui codent les défenses de l'hôte pour faciliter la réplication virale.
Récemment, Des études ont montré qu'au début de l'infection, les coronavirus modifient le métabolisme cellulaire et augmentent le taux de mort cellulaire. Cela se produit avant que l'immunité adaptative ne soit déclenchée, et cela pourrait indiquer son rôle dans l'infection virale productive.
Deux des processus les plus importants impliqués dans cette modulation sont l'apoptose et la modification du cycle cellulaire. L'apoptose est déclenchée par un certain nombre de voies de signalisation. L'apoptose peut réduire la propagation virale, mais l'effet inverse peut également se produire - la libération des particules virales infectieuses nouvellement produites au cours de l'infection lytique.
Les voies cellulaires qui activent l'apoptose peuvent être déclenchées directement par l'infection virale elle-même ou indirectement via d'autres cascades de signalisation. Ce dernier est déclenché par la présence du virus et recrute des cellules immunitaires sur le site de l'infection. L'événement final est l'apoptose, causant des dommages importants aux tissus dans l'infection lytique.
Les composants viraux à l'intérieur de la cellule sont appelés motifs moléculaires associés aux agents pathogènes (PAMP) et sont reconnus par les récepteurs de reconnaissance de motifs (PRR). Ceux-ci répondent en activant des cytokines et d'autres molécules de signalisation qui régulent positivement l'expression du gène de l'interféron.
Un autre mécanisme de défense implique la reconnaissance de l'acide nucléique viral par des protéines hôtes qui s'associent, comme les PRR, avec des protéines adaptatrices pour activer deux facteurs de transcription clés, à savoir, Facteur régulateur 3 du NFĸB et de l'IFN (IRF3). Ceux-ci sont transloqués vers le noyau et augmentent l'expression des interférons de type I (IFN).
Ceux-ci se lient au récepteur IFN-α/β (IFNAR), à son tour, déclencher un système de signaux impliquant la voie Janus kinase/transducteurs de signaux et activateurs de la transcription (JAK/STAT). Le résultat est la régulation à la hausse de plusieurs gènes stimulés par l'IFN (ISG).
Ces gènes inactivent le processus impliqué dans la synthèse des protéines cellulaires et induisent ainsi la mort cellulaire. Un autre ISG qui joue un rôle dans ce processus d'arrêt de la traduction est la combinaison de 2′, 5′-oligoadénylate synthétase (OAS) et RNase L.
L'apoptose est régulée par plusieurs protéines pro- et anti-apoptotiques dans la cellule hôte. Une telle famille de protéines est la famille Bcl-2 (lymphome à cellules B-2), y compris les facteurs qui provoquent la poration de la membrane mitochondriale et l'activation éventuelle des enzymes caspases, initier l'apoptose. D'autres protègent contre l'apoptose.
Une autre famille est celle des protéines kinases activées par les mitogènes (MAPK), qui comprennent la kinase régulée extracellulaire 1/2 (ERK1/2), ERK5, p38, et les kinases c-Jun N-terminales (JNK). Le premier est régulé à la hausse par les facteurs de croissance et les mitogènes, les deux derniers par le stress cellulaire. La voie JNK peut conduire à l'activation de gènes pro-apoptotiques ou peut interagir avec les gènes Bcl-2 pour ce faire, ou peut activer d'autres facteurs de transcription comme 53 et p73.
Deux voies de l'apoptose ont été identifiées, l'extrinsèque et l'intrinsèque. Le premier est médié par l'activation de ligands de mort (FasL, TNF) sur leur interaction avec leurs récepteurs de mort (DR) respectifs. La caspase-8 est un inducteur majeur de l'apoptose chez les coronavirus animaux qui agissent via les DR. Cette enzyme, lorsqu'il est activé, fend l'offre, une protéine Bcl2, conduisant à la libération du cytochrome mitochondrial c. Ce dernier est la clé de la formation de l'apotosome avec le clivage et l'activation de la caspase 9.
La voie intrinsèque est basée sur la perméabilisation des membranes externes mitochondriales et est principalement observée avec les coronavirus animaux. Les protéines Bcl2 comme Bax et Bak favorisent l'apoptose et sont nécessaires pour déclencher ce processus via la voie intrinsèque ou à médiation mitochondriale, avec la caspase-9.
De nombreux coronavirus animaux provoquent l'activation de voies extrinsèques et intrinsèques, montrant le réseau complexe de voies de signalisation impliquées dans l'apoptose.
Les génomes viraux codent souvent pour des gènes homologues à des protéines anti-apoptotiques hôtes. Cela leur permet de retarder l'apoptose dans les premiers stades de l'infection et ainsi de générer un rendement adéquat de nouveaux virions. D'autres protéines virales peuvent empêcher la transcription de certains gènes apoptotiques ou provoquer la modification de leurs produits protéiques, de supprimer leur activité.
L'induction de l'apoptose par des protéines virales peut impliquer l'arrêt de la traduction cap-dépendante dans les cellules hôtes, induire l'apoptose, comme on le voit avec le poliovirus. Dans le cas du virus de l'hépatite C, la protéine virale NS3 interagit avec la caspase-8, pour déclencher la mort cellulaire.
La revue actuelle se concentre sur l'identification des mécanismes pro-apoptotiques déclenchés par les coronavirus animaux. Par exemple, le virus de la diarrhée épidémique porcine (PEDV) déclenche des modifications de l'expression de 14 gènes impliqués dans l'apoptose indépendante des caspases pour favoriser sa réplication, ainsi que produire les traits caractéristiques de la maladie.
L'apoptose est également impliquée dans la réplication virale en activant la caspase, qui est nécessaire pour le clivage de la protéine virale de la nucléocapside (N) au cours de ce processus. C'est le cas du virus de la gastro-entérite transmissible (TGEV), qui active la famille MAPK, ainsi que l'apoptose induite par FasL et les mitochondries. Ce processus comprend également la régulation négative des microARN de l'hôte qui suppriment la voie apoptotique mitochondriale.
Bêtacoronavirus, comme le virus de l'hépatite murine (MHV), provoque l'apoptose. Ce virus présente une apoptose induite par la protéine d'enveloppe (E), à nouveau via l'activation de la caspase. Dans ce cas, l'apoptose semble protéger contre la production de virions.
Avec le virus de l'encéphalomyélite hémagglutinante porcine (PHEV), la mort cellulaire est médiée par les DR et les voies à médiation mitochondriale, impliquant la caspase-8 et la caspase-9, comme initiateurs, et caspase-3, comme effecteur de l'apoptose.
De la même manière, les gamma- et delta-coronavirus présentent une induction complexe de voies de signalisation cellulaire dans la cellule hôte, conduisant à la modulation de l'apoptose. Ainsi, de nombreuses protéines virales modulent les voies des cellules hôtes pour favoriser la réplication virale et les caractéristiques de la maladie.
Le fait que l'apoptose se produise suite à l'infection de plusieurs hôtes par une gamme de coronavirus conduit à la conclusion qu'il s'agit d'une caractéristique commune de l'infection par les coronavirus humains et animaux et vise à favoriser la propagation.
Avec le précédent coronavirus du syndrome respiratoire aigu sévère (SRAS-CoV), la protéine 7a forme un complexe avec la protéine Bcl-XL ou d'autres facteurs pro-survie, les inactivant et permettant ainsi à l'apoptose de se dérouler via l'activation de la caspase-3. La protéase de type 3CL (3CLpro) active également à la fois la caspase-3 et la caspase-9 pour induire l'apoptose en culture cellulaire.
Le SRAS-CoV et les virus SARS-CoV-2 actuellement en circulation possèdent la protéine ORF3a qui déclenche la mort cellulaire via l'activation de la caspase dans la voie extrinsèque via les DR.
Un rôle similaire n'a pas encore été démontré pour les protéines virales dans les infections à coronavirus animal. Cependant, avec PEDV, la sous-unité S1 de la protéine de pointe, et la protéine non structurale 1 (NSP1), a été suggéré pour être l'initiateur et l'effecteur de la mort cellulaire, respectivement, sur la base d'expériences récentes.
D'autres études pourraient aider à comprendre comment ces voies fonctionnent dans d'autres coronavirus. L'état actuel des connaissances peut indiquer l'utilité de cibler cette voie pour la gestion des infections à coronavirus.
 Les patients atteints du SII pourraient bénéficier de suppléments de vitamine D,
Les patients atteints du SII pourraient bénéficier de suppléments de vitamine D,
 Rectocolite hémorragique
Rectocolite hémorragique
 Le pH acide améliore l'infection par le SRAS-CoV-2 en régulant à la hausse le récepteur ACE2
Le pH acide améliore l'infection par le SRAS-CoV-2 en régulant à la hausse le récepteur ACE2
 Les aliments crus pour animaux de compagnie représentent un risque pour les humains et les animaux
Les aliments crus pour animaux de compagnie représentent un risque pour les humains et les animaux
 Des scientifiques extraient le génome humain complet d'un « chewing-gum » vieux de plusieurs milliers d'années
Des scientifiques extraient le génome humain complet d'un « chewing-gum » vieux de plusieurs milliers d'années
 La génétique peut influencer la composition du microbiome plus que les facteurs environnementaux
La génétique peut influencer la composition du microbiome plus que les facteurs environnementaux
 Risques croissants de biodéfense posés par la biologie synthétique
Une étude commandée par le département américain de la Défense a révélé quil existe plusieurs outils de génie génétique qui pourraient être utilisés pour concevoir des armes biologiques en peu de temp
Risques croissants de biodéfense posés par la biologie synthétique
Une étude commandée par le département américain de la Défense a révélé quil existe plusieurs outils de génie génétique qui pourraient être utilisés pour concevoir des armes biologiques en peu de temp
 Un scientifique prouve le rôle du microbiome dans l'obésité
Nouvelle recherche présentée par le Dr Christoph Thaiss dans son essai primé pour le Science et SciLifeLab Prize for Young Scientists » décrit plusieurs métabolites bactériens dans lintestin humain
Un scientifique prouve le rôle du microbiome dans l'obésité
Nouvelle recherche présentée par le Dr Christoph Thaiss dans son essai primé pour le Science et SciLifeLab Prize for Young Scientists » décrit plusieurs métabolites bactériens dans lintestin humain
 La boue dans les pommes de douche pourrait abriter des bactéries pulmonaires dangereuses selon une étude
Une étude a montré que les pommes de douche contiennent de la boue qui peut abriter des bactéries potentiellement dangereuses qui entraînent de graves maladies pulmonaires. Les bactéries mycobactérien
La boue dans les pommes de douche pourrait abriter des bactéries pulmonaires dangereuses selon une étude
Une étude a montré que les pommes de douche contiennent de la boue qui peut abriter des bactéries potentiellement dangereuses qui entraînent de graves maladies pulmonaires. Les bactéries mycobactérien