Gestion de la première étape et deux E lymphome à grandes cellules B gastrique: la chimiothérapie seule ou la chirurgie suivie d'une chimiothérapie
Résumé
Gestion de localisée primaire gastrique B lymphome (PGL) reste controversée. Le but de cette étude est de comparer deux traitements:. La chimiothérapie seule et la chirurgie plus chimiothérapie Matériaux
dossiers de tous les patients ayant un diagnostic de lymphome gastrique et qui ont été traités à l'Institut national d'oncologie, entre 1999 et 2006 , ont été examinés et les patients remplissant les critères suivants ont été inclus dans cette étude: histologiquement prouvée à grandes cellules B lymphome de l'estomac; maladie complète l'information clinique de stade I /II en fonction de la mise en scène Musshoff; Résultats des patients qui ont reçu la chirurgie suivie d'une chimiothérapie (groupe I) ou la chimiothérapie seule (groupe II).
Cette étude a porté sur 82 patients qui ont été traités pour le cancer dans notre Institut. Toutes les caractéristiques cliniques et pathologiques étaient similaires entre les deux groupes, à l'exception que les patients du groupe I était significativement plus maladie de stade II (P = 0,023) que celle du groupe II. Parmi les 52 patients qui pourraient être évalués pour la réponse à la chimiothérapie, il y avait 45 qui avait une réponse complète au traitement, 3 eu une réponse partielle au traitement et 4 avaient une maladie progressive. La survie prévue de 5 ans sans récidive (RFS) et la survie globale (OS) du groupe I étaient 86,69% (IC à 95%, de 57,9 à 97,7%) et 90,0% (IC à 95%, de 58,0 à 97,8%), respectivement. Et la survie à 5 ans RFS projetée sans rechute et OS du groupe II étaient 86,67% (IC à 95%, de 57,0 à 88,2%) et 93,33% (IC à 95%, de 73,3 à 98,7%), respectivement. Il n'y avait pas de différences statistiquement significatives dans RFS (P = 0,485) et OS (P = 0,551) entre les deux groupes.
Conclusion
Nos données suggèrent que la chimiothérapie seule peut être un traitement alternatif raisonnable pour la phase I /II gastrique Chirurgie Présentation
lymphome à grandes cellules, mais ce résultat doit être confirmé par des essais cliniques randomisés prospectifs. a été le traitement conventionnel pour les patients ayant localisé le lymphome gastrique [1, 2]. chimiothérapie ou radiothérapie adjuvante a été souvent utilisés pour des patients présentant une atteinte régionale des ganglions lymphatiques. La chimiothérapie systémique a été le traitement de choix pour la plupart des lymphomes nodaux nodaux et supplémentaires comme indiqué dans les données publiées qui soutiennent l'innocuité et l'efficacité des traitements conservateurs dans le cas de la phase I /II lymphome à grandes cellules B gastrique primaire (PGDLCL). Comme le traitement de chimiothérapie primaire a été administré seul ou suivi par un traitement par rayonnement, le rôle de la résection chirurgicale de la tumeur primaire doit être clairement défini et justifié [3-5]. Cette étude rétrospective a enquêté sur le résultat clinique du lymphome gastrique localisé traité par chimiothérapie seule ou la chirurgie suivie d'une chimiothérapie.
Méthodes
Patients
Tous les dossiers des patients qui ont été diagnostiqués comme ayant un lymphome gastrique pendant la période 1999 et 2006, ont été examinées et les patients remplissant les critères suivants ont été inclus dans cette étude: histologiques éprouvée à grandes cellules B lymphome de l'estomac; information clinique complète pour la phase I /II de la maladie (Musshoff de modification du système Ann Arbor); les patients qui ont reçu une chirurgie curative suivie d'une chimiothérapie à base d'anthracycline adjuvant (groupe I) ou à la chimiothérapie seule avec anthracycline-contenant des schémas (groupe II), la gestion primaire et suivent dans notre institution. Les patients atteints de la muqueuse tissu lymphoïde associé (MALT) lymphome ont été exclus.
Évaluation clinique
procédures Staging inclus examens complets physiques, l'inspection de l'anneau de Waldeyer, numération globulaire complète et leucocytaire, la chimie du sang, endoscopie digestive haute, la poitrine et tomodensitométrie abdominale, l'aspiration de la moelle osseuse et une biopsie. La mise en scène a été déterminée en fonction de la modification Musshoff du système Ann Arbor [6] qui a divisé la maladie de stade II dans l'étape IIE1 et le stade IIE2. Dans l'étape IE la tumeur reste confinée dans l'estomac; au stade IIE1 l'envahissement ganglionnaire périgastrique était positif; dans l'étape IIE2 plus éloignée ganglionnaire a été trouvé jusque dans la région au-dessous du diaphragme. Le classement de la toxicité du traitement, ainsi que la réponse tumorale a été évaluée selon les critères définis par l'Organisation mondiale de la santé [7]. Réponse à la chimiothérapie a été évaluée par un examen physique, l'endoscopie, et les études d'image tous les 3 cycles de chimiothérapie. réponse complète (RC) a été définie comme étant la disparition de toute trace de tumeur (s) pendant une durée d'au moins 4 semaines. Une réponse partielle (PR) est défini comme > réduction de 50% de la somme des produits des diamètres perpendiculaires les plus longs de toutes les lésions mesurables dans les images radiographiques, avec la réduction d'au moins 4 semaines. Stable maladie (SD) a été définie comme < 50% de réduction ou < augmentation de 25% de la somme des produits des diamètres perpendiculaires les plus longs de toutes les lésions mesurables, durable > 4 semaines. Les patients présentant des lésions progressives ne sont pas classés comme ayant PR ou SD. maladie progressive (PD) a été définie comme l'apparition de nouvelles lésions ou > augmentation de 25% dans la zone (s) de maladie mesurable d'origine.
Analyse statistique (de SPSS16.0) Les comparaisons de entre les caractéristiques cliniques et pathologiques ont été faites par Pearson test du chi-carré. La survie globale a été calculée à partir de la date du diagnostic à la date du dernier suivi ou de décès de toute cause. la survie sans rechute a été calculée à partir de la date de la chirurgie pour le groupe I ou la rémission complète pour le groupe II à la date de rechute tumorale définie par les résultats des études d'imagerie ou la biopsie endoscopique. Répartition de survie de la survie sans récidive et la survie globale ont été tracées par la méthode d'estimation de Kaplan et Meier [8]. Les courbes de survie différentes ont été comparés avec le test du log-rank. Tous les p
valeurs étaient deux à queue et une valeur p <
; 0,05 a été considérée comme statistiquement significative. SPSS, version 16.0 a été utilisé pour toutes les analyses statistiques.
Consentement et déclaration d'approbation éthique
Comme le traitement de chaque patient a été décidé par le personnel médical du centre, le consentement oral a été obtenu à partir des sujets et a été approuvé par le patients caractéristiques des résultats
caractéristiques «patients de commissions d'examen institutionnels de l'Institut national d'oncologie, Centre du cancer à Rabat
Cette étude a été approuvée par les conseils d'examen institutionnels de l'Institut national d'oncologie, à Rabat. sont résumées dans le tableau 1. Quatre-vingt-deux patients qui répondaient aux critères de diagnostic à large spectre pour PGL, l'exclusion de ceux avec un lymphome de MALT, ont été identifiés. Parmi 82 patients, 52 qui ont reçu la chimiothérapie seule ont été classés dans le groupe II et les 30 autres qui ont reçu une gastrectomie totale suivie d'une chimiothérapie ont été classés en groupes caractéristiques I. clinico-pathologiques des patients sont énumérés dans le tableau 1. Aucune différence significative n'a été notée pour toutes les autres caractéristiques majeures entre ces deux groupes. Groupe II avait une maladie beaucoup plus localisée avec moins de patients au stade II-2 (p = 0,023). Tous les patients ont reçu un traitement anti-ulcère au cours chemotherapy.Table 1 Caractéristiques des patients atteints de lymphome gastrique primaire localisé et avancé traités par chirurgie suivie d'une chimiothérapie ou une chimiothérapie seule
Paramètres
Chirurgie plus chimiothérapie
Groupe I
(n = 30) (%) Groupe II
chimiothérapie
(n = 52) (%)
P valeur
52
53
Range
Age ans
19-79
19-81
25 (83%
Sexe Masculin )
33 (64%)
P
= 0,057
Femme
5 (17%)
19 (36%)
Musshoff
Staging
I
26 (86%)
32 (61%)
P
= 0,023
II-1
3 (10%)
6 (12%)
II-2
1 (4%)
14 (27%)
réponse au traitement
Tous les patients ont reçu CHOP (cyclophosphamide, doxorubicine, vincristine, prednisone) chimiothérapie qui consistait en une injection intraveineuse de cyclophosphamide 750 mg /m², doxorubicine 50 mg /m², et vincristine 1,4 mg /m² (maximum 2 mg) le jour 1, et prednisone 60 mg /m2 par voie orale les jours 1-5. Le nombre médian de cycles de chimiothérapie était de 4 (plage: de 1 à 6) pour le groupe I, et 5 (plage: de 3 à 8) pour le groupe II. Pour le groupe I, treize patients ont subi une gastrectomie totale à visée curative avant la chimiothérapie. Parmi ces patients, nous avons évalué la réponse à la chimiothérapie seule dans le groupe II dans lequel une réponse complète a été obtenue chez 87% (45/52), des réponses partielles à 6% et de la maladie de progression de 7%. Salvage gastrectomie a subi cinq patients: trois avaient perforation gastrique et deux avaient des saignements gastro-intestinal supérieur
Résultat des patients
Seule une rechute locale a eu lieu dans le groupe de la chimiothérapie II et les autres rechutes dans les 2 groupes ont été diffusés.. La RFS 5 ans projetée et OS du groupe I étaient 86,69% (IC à 95%, 57,9 - 97. 7%) et 90,0% (IC à 95%, de 58,0 à 97,8%), respectivement. La survie prévue de 5 ans sans récidive (RFS) et la survie globale (OS) étaient 86,67% (IC à 95%, de 57,0 à 88,2%) et 93,33% (IC à 95%, 73,3 à 98,7%), respectivement dans le groupe II. Il n'y avait pas de différences statistiquement significatives dans RFS (P = 0,485) et OS (P = 0,551) entre les deux groupes (figure 1 et 2). Toxicités traitements liés de la figure 1 sans rechute localisée survie primaire lymphome gastrique.
Figure 2 Globalement survie localisée primaire lymphome gastrique.
Les toxicités liées au traitement sont résumés dans le tableau 2. Il n'y avait pas de traitement décès. la PI Grade 3/4 leucopénie était les effets les plus indésirables pour le groupe II. La chimiothérapie adjuvante pour le groupe I résulte de l'incidence similaire de toxicité hématologique. Après l'administration de la chimiothérapie dans le groupe II, trois patients (un patient après premier cycle et deux après deux cycles) ont développé une perforation gastrique et deux patients (après premier cycle) de saignements gastro-intestinaux. Ces deux complications ont été gérées avec succès par la réparation chirurgicale d'urgence. Tous ces patients ont présenté à la phase II-2 de la maladie, avec le statut de performance (PS) 2/3, et plus l'âge de 72 ans (extrêmes: 67-81 ans). Ils sont morts de la progression de la maladie de la distance au bout de 6, 13 et 18 mois après le diagnostic, respectivement. fuite de l'anastomose a été noté chez deux patients dans le groupe I. Ils avaient une mauvaise PS (3/4), la perte de poids (20%) et l'état nutritionnel lamentable. Ils sont morts après des complications septiques choc.Table 2 liés au traitement du lymphome gastrique primaire
Groupe I
Groupe II
Toxicité
Nb
%
Nb
%
Leucopoeniae (G3 /4)
5
15
10
18
Thrombocytopeniae (G3 /4) 1
0,3
0
0
Fever 2
0,6 3
0.5
UGI Bleeding
NA NA 2
0.3
fuites d'anastomose 2
0,03
NA NA
obstruction gastrique
NA NA 1
1,9%
perforation
NA NA 3
5,7%
abréviations. G: grade; UGI: gastro-intestinal supérieur; NA: non applicable
Discussion
Cette étude rétrospective suggère que le résultat clinique de PGL localisée traités par chimiothérapie seule est comparable à celui traité par la chirurgie associée à la chimiothérapie en termes de survie sans maladie et la survie globale, de sorte que la chirurgie est non requis. Revue de la littérature a montré que la plupart des études pertinentes de traitement et les résultats de PGL, considérés comme un petit nombre de patients et ont été menées de façon rétrospective [9, 10]. Le traitement optimal localisée PGL reste à établir. Des études antérieures ont affirmé que la chirurgie était le traitement de première ligne de choix pour les patients atteints d'un lymphome localisé gastrique [11, 12]. Les partisans de la chirurgie primaire inclus que les patients ayant subi une chirurgie avaient une meilleure survie que ceux qui ne l'a pas, et la chirurgie peut réduire le risque de saignement ou de perforation lors de la chimiothérapie ou de la radiothérapie. Cependant, en raison du succès de la gestion chirurgicale de PGL dépend de la taille de la tumeur, la profondeur de sa pénétration dans le tissu gastrique, et l'implication des ganglions lymphatiques régionaux [13-15] certains chercheurs ont commencé à utiliser la chimiothérapie, la plupart du temps CHOP et ses protocoles connexes pour contrôler des tumeurs et de prévenir la morbidité postopératoire gastrectomie [9, 16, 17]. Récemment, les rôles des thérapies de l'estomac-conservation pour localisée PGL ont été soulignés. Relativement peu de données existent cependant pour la chimiothérapie comme seule modalité de traitement dans DLBCL gastrique localisée, qui sont pourtant très prometteurs et suggèrent que la thérapie de combinaison peut plus traiter une proportion substantielle de patients [3, 5]. Maor et al ont montré que la survie globale des patients traités par chimiothérapie de 6 ans seulement était de 76% [17]. Cependant, pour les tumeurs volumineuses, l'avantage de la chimiothérapie est éclipsé par le potentiel de saignement de la tumeur et la perforation gastrique. La plupart des études ont montré une assez faible incidence d'hémorragie sévère ou d'une perforation, ce qui représente 2,1% et 1,7%, respectivement, de ces individus traités avec une chimiothérapie seule, et 2,2% et 0,9%, respectivement, des individus chirurgicalement traités [17, 18 ]. Cette preuve suggère que le rôle de la chirurgie dans le traitement de PGL peut être moins importante que précédemment considéré. Dans notre étude, la perforation gastrique et gastrique saignements développés respectivement chez 3 patients et 2 patients recevant une chimiothérapie primaire et donc cela reste une complication réelle et remarquable. Pour éviter de telles complications graves, nous vous recommandons de réévaluer les patients par endoscopie après deux cycles de chimiothérapie. Dans le même temps, les patients doivent être avertis que des complications telles que la perforation gastrique et des saignements sont possibles, et des programmes de sensibilisation liées à l'éducation globale devraient faire partie du processus de traitement [19]. Notre étude a fourni de bonnes preuves à l'appui de la chimiothérapie seule. La meilleure gestion des PGL n'a pas été établie et le choix de la modalité de traitement est principalement dépendante de l'expertise des spécialistes responsables primaires. Oncologues préfère une chimiothérapie systémique seul et réservés chirurgie comme traitement de sauvetage, tandis que les chirurgiens résection curative préférée suivie d'une chimiothérapie adjuvante [20]. Une telle variation dans la sélection des patients a fait la comparaison entre les différentes études difficiles. Des études prospectives sont nécessaires pour évaluer chaque stratégie en termes de survie et les complications liées au traitement. Nos données suggèrent que la chimiothérapie systémique seule peut être un traitement alternatif raisonnable pour la phase I II lymphome /grandes cellules de l'estomac. Nous pouvons supposer, cependant, que la fonction d'organe est mieux préservée par la chimiothérapie seule que la chirurgie. La résection de la tumeur primaire avant la chimiothérapie systémique ne semble pas améliorer le taux de ce groupe de patients de guérison et pourrait être réservé à ceux avec complication grave (hémorragie sévère ou perforation) après la chimiothérapie, mais ce résultat doit être confirmé dans l'essai clinique randomisé prospectif, y compris Déclarations d'anticorps monoclonal
Remerciements
les auteurs tiennent à remercier: Pr Abouqal et le Dr Ahid samir pour leur aimable assistance à l'analyse statistique des données; Pr Nourredine Benjaafar et Pr Brahim El Gueddari Elkhalil pour. leur aimable assistance pour recueillir des données et Pr Mohammed Ismaili pour leur aimable assistance aux Anglais Ecrit. de fichiers soumis originaux pour les images
Voici les liens vers les auteurs
auteurs originaux soumis fichiers pour les images. 13045_2010_107_MOESM1_ESM.png de fichier d'origine pour la figure 1 13045_2010_107_MOESM2_ESM.png Auteurs Auteurs fichier d'origine pour la figure 2 Intérêts concurrents
Les auteurs déclarent qu'ils ont aucun conflit d'intérêts.
|  La thérapie biologique peut réduire le risque de COVID-19 sévère
La thérapie biologique peut réduire le risque de COVID-19 sévère
 Une étude met en lumière les causes des douleurs intestinales débilitantes
Une étude met en lumière les causes des douleurs intestinales débilitantes
 Le rotavirus joue un rôle dans le développement du diabète de type 1
Le rotavirus joue un rôle dans le développement du diabète de type 1
 Les scientifiques transforment le sang de type A en type O universel,
Les scientifiques transforment le sang de type A en type O universel,
 Les probiotiques peuvent aider à lutter contre la malnutrition au cours des deux prochaines décennies,
Les probiotiques peuvent aider à lutter contre la malnutrition au cours des deux prochaines décennies,
 Selon une étude, les aliments affectent sélectivement les microbes intestinaux
Selon une étude, les aliments affectent sélectivement les microbes intestinaux
 Les enfants sont immunisés contre le SRAS-CoV-2
Au moins 30 nouvelles maladies sont apparues au cours des 20 dernières années et menacent désormais ensemble la santé de centaines de millions de personnes. Pour beaucoup de ces maladies, il ny a pas
Les enfants sont immunisés contre le SRAS-CoV-2
Au moins 30 nouvelles maladies sont apparues au cours des 20 dernières années et menacent désormais ensemble la santé de centaines de millions de personnes. Pour beaucoup de ces maladies, il ny a pas
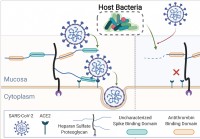 Le microbiome humain coupe les glycanes muqueux,
influençant linfection par le SRAS-CoV-2 Une équipe internationale de chercheurs a mené une étude montrant que les différences dans le microbiome humain peuvent influencer la capacité du coronavirus 2
Le microbiome humain coupe les glycanes muqueux,
influençant linfection par le SRAS-CoV-2 Une équipe internationale de chercheurs a mené une étude montrant que les différences dans le microbiome humain peuvent influencer la capacité du coronavirus 2
 Faits saillants et principaux points à retenir du Boston Bacterial Meeting (BBM) 2019
Le Boston Bacterial Meeting (BBM) est une conférence annuelle qui rassemble des experts en bactériologie de la région de Boston et du monde entier. Ses 25 e itération a eu lieu entre le 6 juin e e
Faits saillants et principaux points à retenir du Boston Bacterial Meeting (BBM) 2019
Le Boston Bacterial Meeting (BBM) est une conférence annuelle qui rassemble des experts en bactériologie de la région de Boston et du monde entier. Ses 25 e itération a eu lieu entre le 6 juin e e