Un nuovo articolo sulla rivista Vita presenta una prima revisione dei fattori virali coinvolti nell'iniziare e nell'effettuare l'apoptosi all'interno delle cellule infette.
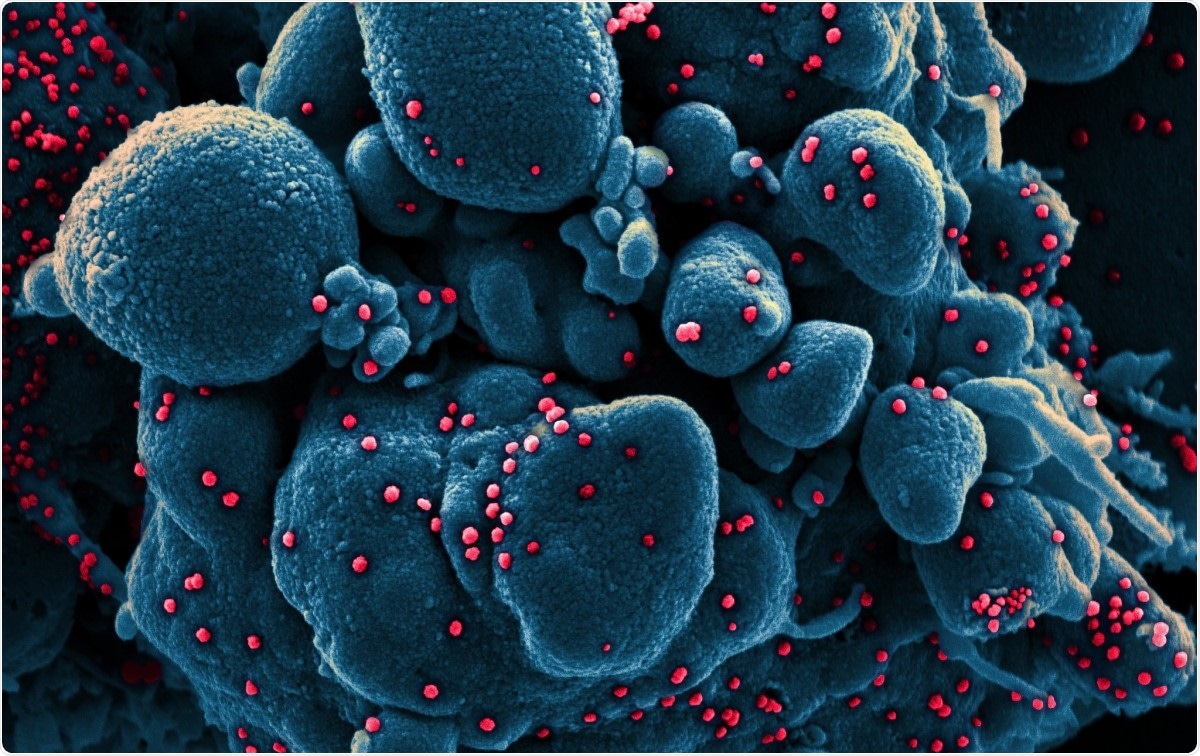 Micrografia elettronica a scansione colorata di una cellula apoptotica (blu) infettata da particelle di virus SARS-COV-2 (rosso), isolato da un campione di paziente. Immagine acquisita presso il NIAID Integrated Research Facility (IRF) a Fort Detrick, Maryland. Credito immagine:NIAID / Flickr
Micrografia elettronica a scansione colorata di una cellula apoptotica (blu) infettata da particelle di virus SARS-COV-2 (rosso), isolato da un campione di paziente. Immagine acquisita presso il NIAID Integrated Research Facility (IRF) a Fort Detrick, Maryland. Credito immagine:NIAID / Flickr I coronavirus sono tra i più grandi virus dell'acido ribonucleico (RNA) identificati finora. Il loro genoma è lungo circa 30 kb, con quattro proteine strutturali, e diverse proteine non strutturali e accessorie. Sono classificati in alfa, beta, gamma e delta coronavirus.
Diversi coronavirus animali e umani sono stati isolati finora e causano principalmente infezioni respiratorie o gastrointestinali. Come altri virus, dirottano il macchinario della cellula ospite in tutte le fasi della loro replicazione. Ciò comporta la modifica dell'espressione di vari geni ospiti, compresi quelli che codificano le difese dell'ospite per facilitare la replicazione virale.
Recentemente, studi hanno dimostrato che nelle prime fasi dell'infezione, I coronavirus alterano il metabolismo cellulare e aumentano il tasso di morte cellulare. Ciò si verifica prima che venga attivata l'immunità adattativa, e questo potrebbe indicare il suo ruolo nell'infezione virale produttiva.
Due dei processi più importanti coinvolti in questa modulazione sono l'apoptosi e la modifica del ciclo cellulare. L'apoptosi è innescata da una serie di vie di segnalazione. L'apoptosi può ridurre la propagazione virale, ma può verificarsi anche l'effetto opposto:il rilascio delle particelle virali infettive appena prodotte durante l'infezione litica.
Le vie cellulari che attivano l'apoptosi possono essere attivate direttamente dall'infezione virale stessa o indirettamente tramite altre cascate di segnalazione. Quest'ultimo è innescato dalla presenza del virus e recluta cellule immunitarie nel sito di infezione. L'evento finale è l'apoptosi, causando danni significativi ai tessuti nell'infezione litica.
I componenti virali all'interno della cellula sono chiamati pattern molecolari associati ai patogeni (PAMP) e sono riconosciuti dai recettori di riconoscimento del pattern (PRR). Questi rispondono attivando citochine e altre molecole di segnalazione che sovraregolano l'espressione genica dell'interferone.
Un altro meccanismo di difesa prevede il riconoscimento dell'acido nucleico virale da parte delle proteine dell'ospite che associano, come i PRR, con proteine adattatrici per attivare due fattori di trascrizione chiave, vale a dire, Fattore regolatorio 3 di NFĸB e IFN (IRF3). Questi vengono traslocati nel nucleo e aumentano l'espressione degli interferoni di tipo I (IFN).
Questi si legano al recettore IFN-α/β (IFNAR), a sua volta, innescare un sistema di segnali che coinvolgono la via Janus chinasi/trasduttori di segnale e attivatori della trascrizione (JAK/STAT). Il risultato è la sovraregolazione di più geni stimolati da IFN (ISG).
Questi geni inattivano il processo coinvolto nella sintesi delle proteine cellulari e quindi inducono la morte cellulare. Un altro ISG che è un giocatore in questo processo di chiusura della traduzione è la combinazione di 2′, 5′-oligoadenilato sintetasi (OAS) e RNasi L.
L'apoptosi è regolata da diverse proteine pro e anti-apoptotiche nella cellula ospite. Una di queste famiglie di proteine è la famiglia Bcl-2 (linfoma a cellule B-2), compresi i fattori che causano la porosità della membrana mitocondriale e l'eventuale attivazione degli enzimi della caspasi, iniziando l'apoptosi. Altri proteggono dall'apoptosi.
Un'altra famiglia è quella delle protein chinasi attivate da mitogeni (MAPK), che includono la chinasi extracellulare regolata 1/2 (ERK1/2), ERK5, p38, e c-Jun chinasi N-terminale (JNK). Il primo è sovraregolato da fattori di crescita e mitogeni, gli ultimi due dallo stress cellulare. La via JNK può portare all'attivazione di geni pro-apoptotici o può interagire con i geni Bcl-2 per farlo, o può attivare altri fattori di trascrizione come 53 e p73.
Sono state identificate due vie di apoptosi, l'estrinseco e l'intrinseco. Il primo è mediato dall'attivazione di ligandi della morte (FasL, TNF) sulla loro interazione con i rispettivi recettori di morte (DR). La caspasi-8 è un importante induttore di apoptosi nei coronavirus animali che agiscono tramite DR. Questo enzima, quando attivato, fende un'offerta, una proteina Bcl2, che porta al rilascio di citocromo mitocondriale c. Quest'ultimo è la chiave per la formazione dell'apoptosoma con la scissione e l'attivazione della caspasi 9.
La via intrinseca si basa sulla permeabilizzazione delle membrane esterne mitocondriali ed è osservata principalmente con i coronavirus animali. Le proteine Bcl2 come Bax e Bak favoriscono l'apoptosi e sono necessarie per innescare questo processo attraverso la via intrinseca o mediata dai mitocondri, insieme a caspasi-9.
Molti coronavirus animali causano l'attivazione di percorsi sia estrinseci che intrinseci, mostrando l'intricata rete di vie di segnalazione coinvolte nell'apoptosi.
I genomi virali spesso codificano per geni che sono omologhi per ospitare proteine anti-apoptotiche. Ciò consente loro di ritardare l'apoptosi nelle prime fasi dell'infezione e quindi di generare un'adeguata resa di nuovi virioni. Altre proteine virali possono impedire la trascrizione di alcuni geni apoptotici o causare la modifica dei loro prodotti proteici, per sopprimere la loro attività.
L'induzione dell'apoptosi da parte delle proteine virali può comportare la cessazione della traduzione dipendente dal cappuccio nelle cellule ospiti, inducendo l'apoptosi, come visto con il poliovirus. Nel caso del virus dell'epatite C, la proteina virale NS3 interagisce con la caspasi-8, per innescare la morte cellulare.
L'attuale revisione si concentra sull'identificazione dei meccanismi pro-apoptotici innescati dai coronavirus animali. Ad esempio, il virus della diarrea epidemica suina (PEDV) innesca cambiamenti nell'espressione di 14 geni coinvolti nell'apoptosi indipendente dalla caspasi per promuoverne la replicazione, oltre a produrre i tratti caratteristici della malattia.
Un altro modo in cui l'apoptosi è coinvolta nella replicazione virale è l'attivazione della caspasi, che è necessaria per la scissione della proteina nucleocapside virale (N) durante questo processo. È il caso del virus della gastroenterite trasmissibile (TGEV), che attiva la famiglia MAPK, così come l'apoptosi indotta da FasL e mitocondri. Questo processo include anche la sottoregolazione dei microRNA dell'ospite che sopprimono la via apoptotica mitocondriale.
Betacoronavirus, come il virus dell'epatite murina (MHV), induce l'apoptosi. Questo virus mostra l'apoptosi indotta dalla proteina dell'involucro (E), di nuovo tramite l'attivazione della caspasi. In questo caso, l'apoptosi sembra essere protettiva contro la produzione di virioni.
Con il virus dell'encefalomielite emoagglutinante suina (PHEV), la morte cellulare è mediata dai DR e dalle vie mediate dai mitocondri, coinvolgendo caspasi-8 e caspasi-9, come iniziatori, e caspasi-3, come effettore dell'apoptosi.
Allo stesso modo, i gamma- e delta-coronavirus mostrano una complessa induzione di vie di segnalazione cellulare nella cellula ospite, che porta alla modulazione dell'apoptosi. Così, molte proteine virali modulano i percorsi delle cellule ospiti per promuovere la replicazione virale e le caratteristiche della malattia.
Il fatto che l'apoptosi si verifichi in seguito all'infezione di più ospiti da parte di una serie di coronavirus porta alla conclusione che è una caratteristica comune dell'infezione da coronavirus umani e animali e mira a favorire la propagazione.
Con la precedente sindrome respiratoria acuta grave coronavirus (SARS-CoV), la proteina 7a forma un complesso con la proteina Bcl-XL o altri fattori pro-sopravvivenza, inattivandoli e quindi consentendo all'apoptosi di procedere tramite l'attivazione della caspasi-3. La proteasi simile a 3CL (3CLpro) attiva anche sia la caspasi-3 che la caspasi-9 per indurre l'apoptosi nella coltura cellulare.
Sia i virus SARS-CoV che i virus SARS-CoV-2 attualmente in circolazione hanno la proteina ORF3a che innesca la morte cellulare tramite l'attivazione della caspasi nella via estrinseca attraverso i DR.
Un ruolo simile non è stato ancora dimostrato per le proteine virali nelle infezioni animali da coronavirus. Però, con PEDV, la subunità S1 della proteina spike, e la proteina non strutturale 1 (NSP1), è stato suggerito di essere l'iniziatore e l'effettore della morte cellulare, rispettivamente, sulla base di recenti esperimenti.
Ulteriori studi possono aiutare a capire come operano questi percorsi in altri coronavirus. Lo stato attuale delle conoscenze potrebbe indicare l'utilità di prendere di mira questo percorso per la gestione delle infezioni da coronavirus.
 Il modello matematico rivela il rischio di infezione da SARS-CoV-2 dopo il trapianto di microbiota fecale
Il modello matematico rivela il rischio di infezione da SARS-CoV-2 dopo il trapianto di microbiota fecale
 Il modello di topo appena nato fornisce indizi sulla causa di una devastante malattia intestinale nei prematuri anemici
Il modello di topo appena nato fornisce indizi sulla causa di una devastante malattia intestinale nei prematuri anemici
 La ricerca collega la prevalenza di SARS-CoV-2,
La ricerca collega la prevalenza di SARS-CoV-2,
 La malattia di Parkinson potrebbe essere prevenuta dai microbi intestinali
La malattia di Parkinson potrebbe essere prevenuta dai microbi intestinali
 La trasmissione di SARS-CoV-2 da madre a figlio in gravidanza è possibile ma rara,
La trasmissione di SARS-CoV-2 da madre a figlio in gravidanza è possibile ma rara,
 Aumentano i rischi per la biodifesa posti dalla biologia sintetica
Aumentano i rischi per la biodifesa posti dalla biologia sintetica
 Gli scienziati trasformano il sangue di tipo A in tipo universale O,
potenzialmente raddoppiando le scorte di trasfusione di sangue I ricercatori dellUniversità della British Columbia hanno trovato un modo potenziale per trasformare il sangue di tipo A in sangue unive
Gli scienziati trasformano il sangue di tipo A in tipo universale O,
potenzialmente raddoppiando le scorte di trasfusione di sangue I ricercatori dellUniversità della British Columbia hanno trovato un modo potenziale per trasformare il sangue di tipo A in sangue unive
 I ricercatori usano la terapia fagica per trattare con successo la malattia epatica alcolica
Per la prima volta, i ricercatori hanno utilizzato con successo la terapia con batteriofagi (fagi) per eliminare la malattia epatica correlata allalcol in un modello animale. Credito di imm
I ricercatori usano la terapia fagica per trattare con successo la malattia epatica alcolica
Per la prima volta, i ricercatori hanno utilizzato con successo la terapia con batteriofagi (fagi) per eliminare la malattia epatica correlata allalcol in un modello animale. Credito di imm
 Le diete a base vegetale migliorano la salute del cuore attraverso il microbioma intestinale
Un nuovo studio pubblicato nel febbraio 2020 su Giornale dellAmerican College of Cardiology riporta che una ridotta assunzione di alimenti di origine animale e una dieta a base di piante possono com
Le diete a base vegetale migliorano la salute del cuore attraverso il microbioma intestinale
Un nuovo studio pubblicato nel febbraio 2020 su Giornale dellAmerican College of Cardiology riporta che una ridotta assunzione di alimenti di origine animale e una dieta a base di piante possono com