Makrofager er immunforsvarsceller, som er en del av det medfødte immunsystemet som ser etter infeksjoner. Derimot, deres respons på patogener av noe slag kan også utløse kronisk eller overdreven betennelse. Denne typen unormal makrofagaktivering ses ved revmatoid artritt (RA) og andre autoimmune tilstander. Et mål med RA -behandling er å modulere makrofagaktiveringstilstander og redusere makrofaginfiltrasjon i det betente vevet.
I lungene, også, infeksjon kan forårsake makrofagindusert betennelse, som resulterer i ødeleggelse av lungevev. Det kan også sette i gang en cytokinstorm, sett ved akutt respiratorisk nødsyndrom (ARDS). Makrofagaktivering er avhengig av reseptorer, som igjen reagerer på en rekke eksterne signaler. De fleste av disse medieres av cytokiner og antigener som finnes på mikrober.
Et av de mest kjente og viktigste makrofagaktivatormolekylene er interferon-γ (IFN-γ). Makrofager primet ved IFN-γ-eksponering reagerer kraftigere på påfølgende stimulering. En annen lignende aktivatorklasse inneholder Toll-like reseptor (TLR) agonister, som primer makrofager slik at de skiller ut molekyler som danner den inflammatoriske kroppen som kalles inflammasomet. Aktivering av inflammasome komponenter får cellen til å dø av pyroptose sammen med frigjøring av interleukin -1β (IL -1β).
Med forskernes ord, “ En viktig komponent i makrofagresponsen til et primærsignal er oppregulering av en sekundær superaktivatorreseptor som deretter kan transformere disse primede makrofager til et eksplosiv, potensielt patogen inflammatorisk tilstand . ”
Forskerne utforsket flere inflammatoriske tilstander som RA, Crohns sykdom og alvorlig COVID-19, å finne en ny sekundær superaktiverende makrofagreseptor kalt SLAMF7. Dette, de sier, er nøkkelen til patogenesen av disse tilstandene.
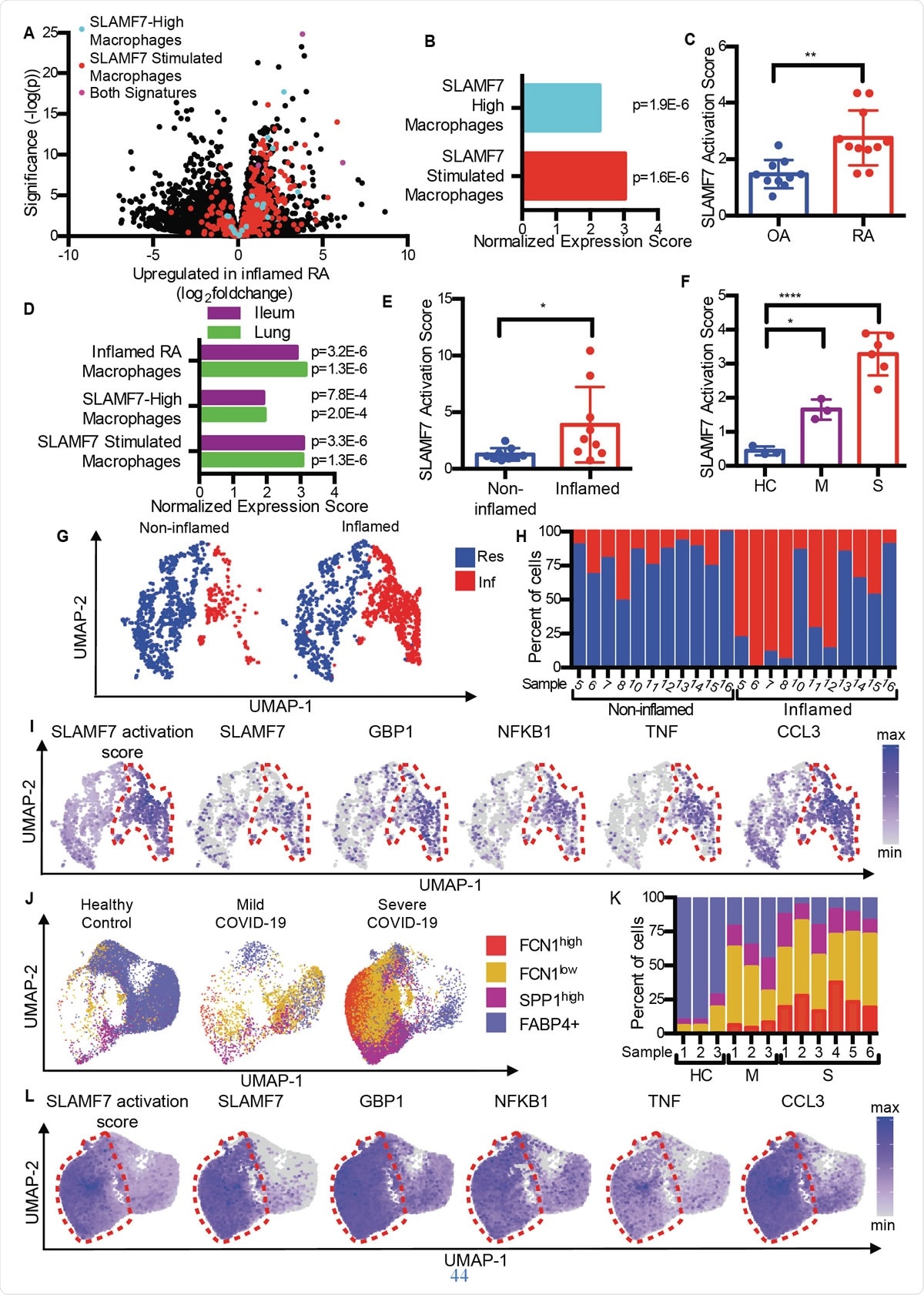 SLAMF7 superaktiverte makrofager driver betennelse ved autoimmun og smittsom sykdom. A) Vulkanplott fra figur 1A som fremhever gener fra "SLAMF7-High Macrophage Signature, "Macrophage SLAMF7 stimuleringssignatur, ”Og gener inkludert i begge signaturene. B) Berikningsanalyse av gensett som sammenligner differensialgenuttrykk i RA versus OA med "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringspoeng for bulk-RNA-seq-data om synoviale makrofager fra pasienter med OA (n =10) eller RA (n =11). Data representerer gjennomsnitt ± SD. D) Berikningsanalyse av genet som sammenligner genuttrykk fra makrofager fra betent ilealvev hos pasienter med Crohns sykdom eller lunger hos pasienter med COVID-19 med "Inflamed RA Macrophage Signature", "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7 -aktiveringspoeng for makrofager fra ikke -betent (n =9) og betent ilealvev (n =9). F) SLAMF7 -aktiveringspoeng for bronkoalveolære skyllemakrofager fra friske kontroller (n =3), eller personer med mild (n =3) eller alvorlig COVID-19 (n =6). Data i E-F representerer gjennomsnitt ± SD. G) UMAP -plott av makrofagklynger fra involverte og ikke -involverte ilealvev. H) Prosent av makrofager fra hver donor tildelt hver klynge. I) UMAP -plott som viser genuttrykk av ileal makrofagpopulasjoner. J) UMAP -plott av bronkoalveolære skyllemakrofagpopulasjoner. K) Prosent av makrofager fra hver donor tildelt hver populasjon. L) UMAP -tomter som viser genuttrykk for bronkoalveolære skyllemakrofagpopulasjoner. Den sammenkoblede t-testen ble brukt til toveis statistiske sammenligninger, og enveis ANOVA med Dunnetts multiple sammenligningstest ble brukt til å sammenligne mild og alvorlig COVID-19 med friske kontrollpersoner.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Resident makrofag klynge; Inf, Inflammatorisk makrofagklynge; HC, sunn kontroll; M, mild COVID-19; S, alvorlig COVID-19.
SLAMF7 superaktiverte makrofager driver betennelse ved autoimmun og smittsom sykdom. A) Vulkanplott fra figur 1A som fremhever gener fra "SLAMF7-High Macrophage Signature, "Macrophage SLAMF7 stimuleringssignatur, ”Og gener inkludert i begge signaturene. B) Berikningsanalyse av gensett som sammenligner differensialgenuttrykk i RA versus OA med "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringspoeng for bulk-RNA-seq-data om synoviale makrofager fra pasienter med OA (n =10) eller RA (n =11). Data representerer gjennomsnitt ± SD. D) Berikningsanalyse av genet som sammenligner genuttrykk fra makrofager fra betent ilealvev hos pasienter med Crohns sykdom eller lunger hos pasienter med COVID-19 med "Inflamed RA Macrophage Signature", "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7 -aktiveringspoeng for makrofager fra ikke -betent (n =9) og betent ilealvev (n =9). F) SLAMF7 -aktiveringspoeng for bronkoalveolære skyllemakrofager fra friske kontroller (n =3), eller personer med mild (n =3) eller alvorlig COVID-19 (n =6). Data i E-F representerer gjennomsnitt ± SD. G) UMAP -plott av makrofagklynger fra involverte og ikke -involverte ilealvev. H) Prosent av makrofager fra hver donor tildelt hver klynge. I) UMAP -plott som viser genuttrykk av ileal makrofagpopulasjoner. J) UMAP -plott av bronkoalveolære skyllemakrofagpopulasjoner. K) Prosent av makrofager fra hver donor tildelt hver populasjon. L) UMAP -tomter som viser genuttrykk for bronkoalveolære skyllemakrofagpopulasjoner. Den sammenkoblede t-testen ble brukt til toveis statistiske sammenligninger, og enveis ANOVA med Dunnetts multiple sammenligningstest ble brukt til å sammenligne mild og alvorlig COVID-19 med friske kontrollpersoner.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Resident makrofag klynge; Inf, Inflammatorisk makrofagklynge; HC, sunn kontroll; M, mild COVID-19; S, alvorlig COVID-19. Sammenligning av artrose (OA) med revmatoid artritt, forskerne fant at RA -vev inneholder makrofager med betennelsessignatur, inkludert oppregulering av gener som induseres av interferon, så vel som gener som koder for inflammatoriske kjemikalier i kroppen. Genet med den høyeste ekspresjonsøkningen blant disse var SLAMF7.
Dette ble funnet i lave nivåer i leddvev fra ledd betent av OA, men på høye nivåer hos RA -pasienter. Det var tilstede i 55% av makrofager i sistnevnte, men <6% av pasientene med OA. Det var tilstede på to ganger høyere nivåer i makrofager fra synovialvæske fra RA -gruppen sammenlignet med OA -gruppen, og på omtrent en halv og en fjerdedel av makrofager i hver gruppe, henholdsvis. Derimot, dette var ikke sant for en annen SLAM -reseptor, peker på SLAMF7 som spesifikk for inflammatoriske makrofager i RA.
IFN-γ ble funnet å være den primære induktoren til denne reseptoren på makrofager, sammen med IFN-β, IL-1β og TNF-α ved lavere nivåer. Derimot, det proinflammatoriske cytokinet IL-6 klarte ikke å indusere SLAMF7-ekspresjon. En gang til, de tidligere cytokinene reduserte nivåene av en annen SLAM -reseptor, CD84, til halvparten.
Forskerne bekreftet også at JAK-banen spilte en viktig rolle i SLAMF7-mediert makrofagaktivering. JAK -hemmeren ruxolitinib undertrykte det effektivt. Faktisk, dette stoffet brukes til å behandle myelofibrose, hvor, en gang til, aktiverte SLAMF7-uttrykkende makrofager er funnet. Det dobler også CD84 -nivåene, noe som kan bety at IFN-γ har motsatte og gjensidige effekter på disse to SLAM-reseptorene.
I neste trinn, SLAMF7 -ekspresjon ble indusert ved høye nivåer på makrofager, av IFN-γ. I ettertid, aktiverende monoklonalt antistoff eller rekombinant SLAMF7 -protein ble tilsatt for å binde til reseptorene. Forskerne fant at denne bindende hendelsen utløste dramatiske endringer i genuttrykk.
Nesten 600 gener ble oppregulert - Macrophage SLAMF7 Stimulation Signature - sammen med en økning i flere inflammatoriske cytokiner og kjemokiner, selv utover økningen forårsaket av IFN-γ alene. For eksempel, TNF-α og IL-6 nivåer øker fra picomolar til nanomolar nivåer på dette tidspunktet. Videre, uttrykket av SLAMF7 i seg selv økte ytterligere, foreslår en positiv tilbakemeldingssløyfe.
Binding av makrofager til SLAMF7 setter også en myeloid inflammatorisk syklus i bevegelse, i tillegg til å starte inflammasomet for å reagere sterkt på mikrobielle TLR-bindende antigener, eller til cytokiner, med en massiv frigjøring av IL-1β. På den andre siden, når en kombinasjon av IFN-γ + LPS (et potent bakteriemolekyl) ble brukt til å aktivere makrofager, cytokinprofilen som er karakteristisk for SLAMF7 -binding ble ikke observert. Derimot, det var en delvis likhet mellom cytokinresponsen og genuttrykksprofilen som oppstod da IFN-γ ble brukt første gang, etterfulgt av LPS -eksponering.
Forskerne sa, “ Dette SLAMF7-aktiveringsprogrammet hviler på og er et eget trinn etter primær stimulering av makrofager ved IFN-γ eller andre M1-differensierings- og aktiveringsfaktorer . ” Den karakteristiske tilstanden til dette aktiveringsprogrammet-den superaktiverte makrofaginflammatoriske tilstanden indusert av SLAMF7-engasjement (SAM7)-er en første potensering av makrofager av IFN-γ, hvorved SLAMF7 blir dramatisk oppregulert. Bindende hendelser ved denne reseptoren fullfører nå aktiveringen av de primede makrofager for å produsere en hyperinflammatorisk tilstand av makrofagaktivering.
Denne veien ser ut til å bli opprettholdt og ytterligere forsterket av en autokrin tilbakemeldingssløyfe, som involverer TNF-α, som raskt induseres (innen to timer) etter SLAMF7 -engasjement og deretter fortsetter å bygge seg opp over tid. Bevis for dette inkluderer halvering av TNF-α-ekspresjon med anti-TNF-antistoff, eller ved å dempe TNF -reseptorer med siRNA.
De fant at gjennomsnittlig SLAMF7 -aktiveringspoeng ved RA var nesten det dobbelte av personer med OA, indikerer at denne reseptoren er tett involvert i betennelse hos de med RA.
På samme måte, overlappende makrofagaktiveringsgenprofiler ble generert både ved inflammatorisk tarmsykdom (IBD) og i COVID-19, sammenlignet med RA. Faktisk, bronkoalveolære skyllevæskeceller og celler fra betent tarmvev i COVID-19 og IBD viste de samme makrofagaktiveringssignaturene. De bemerket også en todelt SLAMF7 -aktiveringsscore i betent tarm i forhold til normalt tarmvev. Og ved alvorlig COVID-19, poengsummen var seks ganger høyere sammenlignet med mild COVID-19. Alt dette antyder dominansen til SAM7 -programmet for makrofagaktivering under inflammatoriske tilstander, spesielt siden SLAMF7 -reseptoren ikke finnes på bosatte makrofager i normalt vev.
Utforske forskjellige makrofagundergrupper, de fant at inflammatoriske makrofager hadde ekstremt høye aktiveringspoeng sammenlignet med bosatte makrofager. En gang til, tre forskjellige undergrupper av makrofager hos COVID-19-pasienter ble markant økt i andel, med to av disse gruppene som viser ekspansjon i alvorlig sykdom. Interessant, disse hadde de høyeste aktiveringspoengene, og makrofager fra alvorlig syke COVID-19-pasienter hadde ekstremt høye SLAMF7-ekspresjonsnivåer, sammen med svært høye nivåer av mange andre inflammatoriske og interferon-induserbare markører og reseptorer.
Kort oppsummert, SAM7-tilstanden kan være en hovedkomponent i den hyperinflammatoriske responsen sett ved COVID-19 lungebetennelse, så vel som i RA, og IBD. Derimot, den sekvensielle måten slik aktivering oppnås, tillater også bruk av flere forskjellige terapeutiske mottiltak. Disse inkluderer JAK -hemmere som ruxolitinib, TNF-α-hemmere, eller SLAMF7 -blokkering av Elotuzumab. Den siste kategorien er spesielt nyttig ved at den kan tillate at SAM7 -programmet blir hemmet selektivt, samtidig som makrofager fortsatt kan utføre sine normale essensielle immunfunksjoner.
bioRxiv publiserer foreløpige vitenskapelige rapporter som ikke er fagfellevurdert og, derfor, skal ikke betraktes som avgjørende, veilede klinisk praksis/helserelatert atferd, eller behandles som etablert informasjon.
 Å håndtere cøliaki
Å håndtere cøliaki
 Lite bevis for mRNA COVID-19 vaksineassosiert trombocytopeni,
Lite bevis for mRNA COVID-19 vaksineassosiert trombocytopeni,
 Fiskeslim kan være en potensiell kilde til antibiotika, finner studier
Fiskeslim kan være en potensiell kilde til antibiotika, finner studier
 Husholdningsdesinfeksjonsmidler kan bidra til fedme hos barn
Husholdningsdesinfeksjonsmidler kan bidra til fedme hos barn
 Vanlig genetisk variant forklarer hvorfor immunterapi ofte mislykkes ved Crohns sykdom
Vanlig genetisk variant forklarer hvorfor immunterapi ofte mislykkes ved Crohns sykdom
 Lungemikrobiom forutsier alvorlighetsgraden av COVID-19 sykdom
Lungemikrobiom forutsier alvorlighetsgraden av COVID-19 sykdom
 Mikrober knyttet til hjerteinfarkt finner studier
En studie avslørt på ESC -kongressen 2019 i Paris sist helg avslører at unormal mikrobepopulasjon i kroppen kan føre til svekkelse av de stabile koronarplakkene og føre til at de løsnes og fører til h
Mikrober knyttet til hjerteinfarkt finner studier
En studie avslørt på ESC -kongressen 2019 i Paris sist helg avslører at unormal mikrobepopulasjon i kroppen kan føre til svekkelse av de stabile koronarplakkene og føre til at de løsnes og fører til h
 Land med eldre befolkninger har høyere SARS-CoV-2 infeksjoner og dødsfall,
sier studie Mer enn et år inn i coronavirus-sykdommen 2019 (COVID-19), forårsaket av alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2), forskjellen i alvorlighetsgraden av det kliniske s
Land med eldre befolkninger har høyere SARS-CoV-2 infeksjoner og dødsfall,
sier studie Mer enn et år inn i coronavirus-sykdommen 2019 (COVID-19), forårsaket av alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2), forskjellen i alvorlighetsgraden av det kliniske s
 Tarmbakterier knyttet til sterkere muskler hos eldre mennesker
En dristig ny studie antyder at muskelstyrke hos eldre voksne kan være høyere på grunn av, delvis, mekanismer som involverer tarmbakterier. Tarmbakteriene er relatert til muskelmasse og fysisk funks
Tarmbakterier knyttet til sterkere muskler hos eldre mennesker
En dristig ny studie antyder at muskelstyrke hos eldre voksne kan være høyere på grunn av, delvis, mekanismer som involverer tarmbakterier. Tarmbakteriene er relatert til muskelmasse og fysisk funks