Effektiv utvikling av legemidler må effektivisere antallet kandidatmedisiner som kommer inn i syklusen, å få ned kostnaden og tidspunktet for prosessen. Nyere studier anbefaler å integrere en rekke teknikker for å utvikle rørledninger for forskning og utvikling (FoU), samt bruk av genetiske data for å identifisere de mest sannsynlige vellykkede nye stoffene. Proteomikk og transkriptomikk er blant de mest verdifulle feltene mot dette målet.
Akkurat nå, Det er over 150 kliniske studier som tester legemidler som antas å være muligens effektive for å øke overlevelsen og forbedre utvinningen av COVID-19 pasienter. Disse inkluderer hydroksyklorokin, klorokin, og baricitinib.
En annen måte å samle bevis på potensielt nyttige legemidler mot COVID-19 er ved å finne vertsproteinene som letter virusinnføring og infeksjon, og ved å undersøke muligheten for å gjenbruke tidligere legemiddelmål i SARS-CoV for å bekjempe det nåværende viruset, alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2).
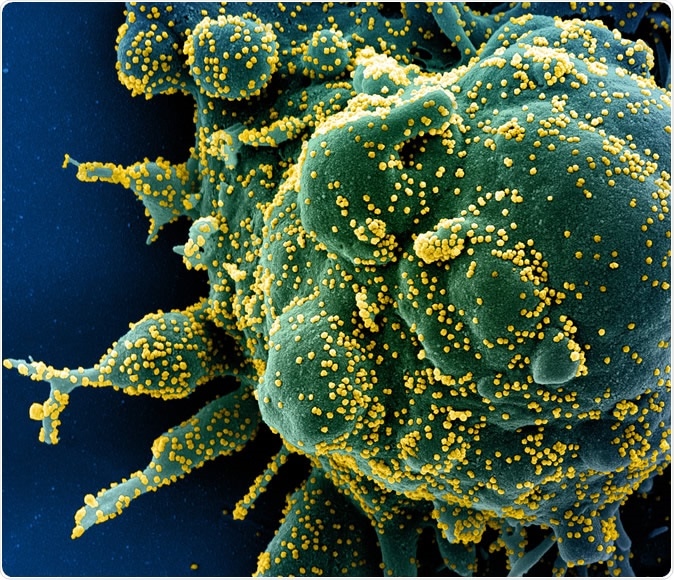 Ny koronavirus SARS-CoV-2 farget skanningelektronmikrofotografi av en apoptotisk celle (grønn) sterkt infisert med SARS-COV-2-viruspartikler (gul), isolert fra en pasientprøve. Bilde tatt på NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Kreditt:NIAID
Ny koronavirus SARS-CoV-2 farget skanningelektronmikrofotografi av en apoptotisk celle (grønn) sterkt infisert med SARS-COV-2-viruspartikler (gul), isolert fra en pasientprøve. Bilde tatt på NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Kreditt:NIAID En nylig studie fant over 330 humane vertsproteiner som er nødvendige for at viruset skal infisere mennesker. Disse samhandler med 26 virale proteiner. Dette kan bidra til å fremme FoU langs den første ruten.
Den andre metoden har blitt brukt av noen få studier, som har gitt 59 musegener som er knyttet til den tidligere SARS-CoV-infeksjonen. Blant disse, Det er 44 som har ekvivalenter i det menneskelige genomet. Ved å blokkere virus-humant protein-interaksjon, det kan være mulig å målrette virusinfeksjonsmekanismer mer effektivt med lavere sjanse for medikamentresistens, sammenlignet med direkte målretting av viruset.
Et hovedproblem med denne tilnærmingen er faren for å utilsiktet produsere andre effekter som kan forverre komplekse sykdomstilstander - eller til og med komme dem til gode. Den nåværende studien er rettet mot å evaluere hvordan disse legemiddelmålene kan påvirke menneskekroppens funksjon, basert på en forståelse av den underliggende genetikken.
Forskerne brukte protokollen for prioritering av medisiner, som de med hell utviklet tidligere, for å teste 353 legemiddelmål som muligens interagerer med viruset. De ønsket å observere hvordan disse stoffene forårsaket andre ytre merkbare effekter av infeksjonen, så vel som hvordan de oppnådde både tilsiktede og utilsiktede effekter på komplekse sykdommer.
De konstruerte først et sykdomsatlas som viser menneskelige proteiner og gener som deltar i virusinnføring. Dette var via mendelsk randomiseringsstudier, gir over 372, 000 unike spådommer om hvordan stoffet påvirker en sykdom. Dette var basert på plasmaproteomikk så vel som vevsspesifikk transkriptomikk.
Som et resultat, de var i stand til å evaluere hvordan disse 353 potensielle legemidlene kan virke i 49 fenotyper av virusinfeksjon, hvordan de kan påvirke over 500 komplekse sykdommer, og endre 72 fenotyper av sykdom. Disse resultatene ble vurdert med hensyn til data fra legemiddelforsøk, så vel som det arvelige genomet, å identifisere de beste stoffene med størst mulighet for gjenbruk, og minst bivirkninger.
De har opprettet en online åpen tilgangsplattform som inneholder resultatene av alle testene, slik at alle kan undersøke resultatene for noen av stoffene raskt.
Atlaset for interaksjoner mellom legemiddelmål og sykdom gir over 370, 000 målsykdomsforeninger i 11 vev som er relevante i COVID-19-scenariet. Av dem, 833 hadde sterke bevis fra MR -avbildning av de 11 vevene. 726 av disse viste også robust kolokalisering, for en kolokaliseringssannsynlighet på over 70%. Dette var studiens mest robuste funn.
Viktigheten av å oppdage slike assosiasjoner er evnen til å utføre analyser av hvordan uttrykk for bestemte mål påvirker spesifikke sykdommer, avhengig av vev. For eksempel, virkningen av legemiddelmålene på Crohns sykdom, hypertensjon, atopiske lidelser, og diabetes kan vurderes. Hvor som helst fra 11-17 av målgenene hadde assosiasjoner til disse fire sykdommene, basert på hvilket vev som ble studert.
For det andre, legemiddelmålene ble analysert for assosiasjon med 49 virusinfeksjonsfenotyper. Det var to sterke assosiasjoner, nemlig, NEU1 -genet med kronisk hepatitt og DPY19L1 -genet med viral enteritt. Det var også tre mindre sterke, men antydende assosiasjoner, som JAK2 -genet med kronisk hepatitt.
For det tredje, studien viste 45 potensielle måter proteiner kan påvirke sykdomstrekk og 430 lignende assosiasjoner til mRNA -uttrykk. Blant disse, det var 95 mål assosiert med 105 sykdommer eller sykdomsuttrykk. JAK2 -genet, for eksempel, er forbundet med ni sykdomsfenotyper, alt fra atopi til fedme, som antyder potensielt pleiotropiske handlinger for dette genet.
Endelig, de fant 249 assosiasjoner der legemiddelmålet påvirket en sykdomsfenotype ulikt avhengig av vevet som ble analysert. Blant disse var 52 unike gener uttrykt i 7 vev for å påvirke 47 unike sykdommer.
Det var 29 sterkt assosierte vevsavhengige effekter av legemiddelmålet på sykdommen i mer enn et enkelt vev, blant dem var det bare to som ikke viste den samme virkningsretningen når de ble uttrykt i blod, så vel som en rekke andre vev.
For eksempel, DHODH-genet påvirker lipoproteinkolesterol med lav tetthet (LDL). Et legemiddel som markedsføres mot høyt LDL, kalt Leflunomide, virker ved å hemme dette genet. Leflunomide blir også vurdert som en COVID-19-behandling.
Analysen viste at dette stoffet bare uttrykkes i forhold til LDL uten mange andre forskjellige handlinger, over et bredt spekter av vev fra lunge til tykktarm.
Forskerne scoret de 726 assosiasjonene funnet av MR mellom mål og sykdom, ved å bruke data fra kliniske studier samt antatt bevis på at de forårsaket forskjellige fenotypiske effekter på tvers av en rekke vev, å komme med de mest dopbare assosiasjonene. 499 av dem var unike sammenhenger av mål og sykdom, med de andre som blir observert i mer enn ett vev.
De satte opp fire poengklasser, for eksempel omics score, prøvescore, dopbarhetspoeng, og infeksjonspoengsummen. Hver poengsum ble skalert fra 1 til 100. Det var høy score for 2 av de 499 foreningene i 3 av 4 klasser, som gjorde dem til målene med høyest utviklingsprioritet. 77 scoret høyt i to klasser og 97 i en. De resterende 323 hadde universelt lave score og regnes derfor som de lavest prioriterte legemiddelmålene.
Noen mål inkluderer ITGB5 -genet som er rettet mot stoffet Cilengitide, som var beregnet på glioblastomer og lignende svulster. Dens høye score og den genetiske profilen antyder at det har potensial til å redusere høyt blodtrykk. Blant de 5 beste, alle manglet sterke assosiasjoner til tilstander som hjertearytmier, som kan påvirke bruken av dem i COVID-19.
På den andre siden, TLR9 -genet, som er målrettet av stoffet hydroksyklorokin har høye poengsummer i to kategorier, men lav score for de to andre. Det er ennå ingen kliniske bevis for antiviral eller klinisk fordel av en kombinasjon av dette legemidlet med azitromycin. Videre, dette genet kan øke sjansen for embolisk slag, astma, og visse immunforhold.
Studien var i stand til å fremme prioriteringen av legemiddelmål på tre måter:å undersøke sikkerhetsspørsmålene som kan oppstå ved gjenbruk av medisiner for behandling av COVID-19; identifisering av lovende legemiddelmål; og finne hvordan legemiddelmålet påvirker det menneskelige fenomet i forskjellige vev.
Ved å bruke denne tilnærmingen, et potensielt stoff, Baricitinib, testes for effektivitet i COVID-19. Det antas å hemme JAK2 -proteinet, og dermed redusere systemisk betennelse. Derimot, den nåværende studien foreslo at den også kan forårsake kronisk hepatitt. Faktisk, litteraturen antyder at hepatitt B reaktiveres etter behandling med JAK 2 -hemmer ruxolitinib.
De tre potensialene med høy potensial fra denne studien inkluderer immunsuppressivt stoff Leflunomide, brukes ved revmatoid artritt, blant andre forhold, og Cilengitide. Førstnevnte har antiviral aktivitet mot flere virus, og den nåværende studien antyder også at den har lipidsenkende egenskaper, mens sistnevnte har antihypertensiv aktivitet, muligens.
Endelig, noen av disse målene uttrykkes i flere vev for å produsere den samme fenotypen, men andre viser endring av uttrykk som er spesifikt for vevet.
Selv om det er noen begrensninger, studien gir en pipeline for statistisk genetisk undersøkelse og en åpen tilgangsplattform for å arrangere legemiddelmål mot COVID-19 i prioritert rekkefølge. Genome-wide association studies (GWAS) kan ytterligere forbedre kvaliteten på dataene, gjør det enda mer nyttig for å finne lovende legemiddelmål blant potensielt repurposed medisiner.
medRxiv publiserer foreløpige vitenskapelige rapporter som ikke er fagfellevurdert og, derfor, skal ikke betraktes som avgjørende, veilede klinisk praksis/helserelatert atferd, eller behandles som etablert informasjon.
 DeNovix kunngjør vinner av Platinum DS11 FX+ spektrofotometer / fluorometer
DeNovix kunngjør vinner av Platinum DS11 FX+ spektrofotometer / fluorometer
 Lungemikrobiom forutsier alvorlighetsgraden av COVID-19 sykdom
Lungemikrobiom forutsier alvorlighetsgraden av COVID-19 sykdom
 Pankreatitt
Pankreatitt
 Mikrobiotamodulering og reetablering av eubiose kan bidra til å dempe COVID-19-komplikasjoner
Mikrobiotamodulering og reetablering av eubiose kan bidra til å dempe COVID-19-komplikasjoner
 Studie antyder en sammenheng mellom bruk av probiotika og "tåkete hjernen"
Studie antyder en sammenheng mellom bruk av probiotika og "tåkete hjernen"
 Nyoppdagede store fag utvisker grensen mellom liv og skade
Nyoppdagede store fag utvisker grensen mellom liv og skade
 Bakterier i fødselskanalen er knyttet til lavere risiko for eggstokkreft
En ny studie viser at noe så enkelt som en livmorhalspinne kan ha potensial til å hjelpe hundrevis av kvinner som har ekstremt høy risiko for eggstokkreft fordi de har en mutasjon i BRCA1 -genet. Di
Bakterier i fødselskanalen er knyttet til lavere risiko for eggstokkreft
En ny studie viser at noe så enkelt som en livmorhalspinne kan ha potensial til å hjelpe hundrevis av kvinner som har ekstremt høy risiko for eggstokkreft fordi de har en mutasjon i BRCA1 -genet. Di
 Crohns sykdom
Crohns sykdom forårsaker betennelse i mage -tarmkanalen. Det kan forveksles med ulcerøs kolitt og irritabel tarm, men Crohns sykdom er unik for seg selv. På Ogden Clinic GI på McKay, vi kan diagnostis
Crohns sykdom
Crohns sykdom forårsaker betennelse i mage -tarmkanalen. Det kan forveksles med ulcerøs kolitt og irritabel tarm, men Crohns sykdom er unik for seg selv. På Ogden Clinic GI på McKay, vi kan diagnostis
 Dysbiose i tarmmikrobiota kan forårsake alvorlig sekundær infeksjon hos COVID-19-pasienter
En interessant studie ledet av forskere i USA har nylig avslørt at det mikrobielle samfunnet i tarmen er direkte påvirket av alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2) og at virus
Dysbiose i tarmmikrobiota kan forårsake alvorlig sekundær infeksjon hos COVID-19-pasienter
En interessant studie ledet av forskere i USA har nylig avslørt at det mikrobielle samfunnet i tarmen er direkte påvirket av alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2) og at virus