Črevná mikroflóra ovplyvňuje fungovanie mnohých telesných procesov, ako je imunitná funkcia, normálny metabolizmus, a vývoj organizmu. Ovplyvňuje to aj správanie hostiteľa, vrátane sociálnych aktivít a reakcií na stres, ktoré sú spojené s mnohými rôznymi poruchami mozgu a/alebo mysle. Avšak, nie je veľa znalostí o základných mechanizmoch, ktorými môžu črevné baktérie meniť spôsob fungovania mozgových buniek, alebo správanie väčšieho organizmu.
Skorší výskum poskytuje silné náznaky prepojenia medzi zdravím čriev a radom chorôb, ktoré sa líšia od ASD a posttraumatickej stresovej poruchy. Mnoho štúdií ukázalo, že autoimunitné ochorenia sú spojené s abnormálnym črevným mikrobiómom, a tiež na niekoľko psychiatrických a neurologických stavov. Napríklad zápalové ochorenie čriev, roztrúsená skleróza a psoriáza sú všetky poruchy autoimunity, a títo jedinci majú vyššie riziko nižšieho počtu rôznych črevných baktérií, ako aj väčšiu pravdepodobnosť úzkosti, poruchy nálady a depresia. Zdá sa, že bežné gény sú prítomné v psychiatrických aj autoimunitných stavoch.
V tejto štúdii vedci sa pozreli na mozgy dvoch typov myší s abnormálnou črevnou mikroflórou:myší, ktoré dostali antibiotiká na zníženie rastu baktérií v čreve, alebo myši, ktoré boli chované v úplne sterilnom prostredí tak, aby boli bez zárodkov (GF). Tieto myšie populácie najskôr vystavili nebezpečenstvu, a potom ho odstránil. Pri štúdiu reakcií na vzdelávanie v týchto populáciách myší, zistili, že obaja vykazujú zníženú schopnosť naučiť sa, že nebezpečenstvu, ktoré ich ohrozuje, sa už nemožno báť (nazýva sa učenie o zániku strachu). Inými slovami, u normálnych myší sa vyvinie reflexná reakcia strachu na hroziace nebezpečenstvo, ale postupom času, keď stimul nepriniesol žiadne poškodenie po expozícii, ich podmienené reakcie na strach klesajú. Toto učenie nebolo zrejmé u myší liečených GF alebo antibiotikami, ktoré v priebehu času naďalej vykazovali podmienené reakcie na strach.
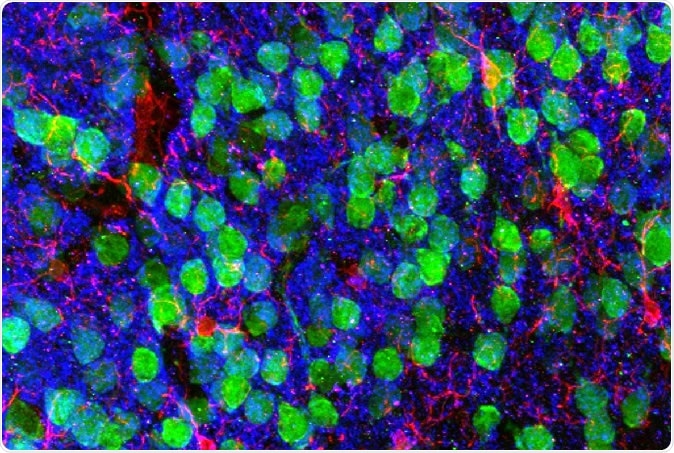 Zobrazovanie mozgu. Stredná prefrontálna kôra demonštrujúca kortikálne neuróny (zelená), mikroglie (červená), a postsynaptický marker PSD95 (modrý). Obrázok so súhlasom Drs. Christopher Parkhurst a David Artis (WCM).
Zobrazovanie mozgu. Stredná prefrontálna kôra demonštrujúca kortikálne neuróny (zelená), mikroglie (červená), a postsynaptický marker PSD95 (modrý). Obrázok so súhlasom Drs. Christopher Parkhurst a David Artis (WCM). Ak chcete zistiť prečo, vedci sekvenovali RNA v mikrogliách, imunitné bunky mozgu. RNA je intermediárna molekula medzi genetickým plánom v jadre a konečným proteínom v cytoplazme, produkované z kódovaného génu. Sekvencia RNA teda ukazuje gén exprimovaný v tejto konkrétnej bunke.
Sekvenovanie RNA ukázalo iný vzor génovej expresie v mozgových bunkách týchto myších populácií, čo zasa ovplyvnilo normálnu prestavbu, ku ktorej dochádza v rámci učenia. Mozgové bunky vytvárajú spojenia alebo synapsie na prenos informácií medzi sebou. Avšak, ako učenie pokračuje, niektoré synapsie sú odstránené a iné pridané, podľa pohybu impulzov po tejto ceste. Toto sa nazýva prerezávanie synapsií a je to dôležitý proces pri učení.
Pri skúmaní rozdielov v génovej expresii v mediálnej prefrontálnej kôre myšieho mozgu vedci zistili, že na rozdiel od mikroglie u zdravých myší, tieto mikroglie nevykazovali normálne zmeny prerezávania, a to zase znížilo počet nových synapsií, ktoré boli vytvorené počas vzdelávacieho zážitku. Táto zmena negatívne ovplyvnila ich schopnosť učiť sa.
Postsynaptické dendritické chrbtice tiež neboli normálne prestavané, a neuróny kódujúce tágo v tejto časti mozgu nedokázali vykazovať normálne hladiny aktivity. Spolu s mikrogliou, excitačné neuróny a iné typy mozgových buniek vykazovali podobné zmeny.
Navyše, vedci zistili, že došlo k zmenám v hladinách štyroch chemikálií v mozgu myší GF. Tieto chemikálie sú typicky spojené s neuropsychiatrickými ochoreniami, ako je schizofrénia a porucha autistického spektra. Zmeny v týchto chemikáliách sú preto úzko späté so zmenami vo fungovaní mozgu, čo zase rozhoduje o tom, ako vnímame svoje okolie a ako naň reagujeme. Skutočnosť, že zmenený črevný mikrobióm je spojený s niečím tak zásadným, ako je chémia mozgu, je preto významná pri odhaľovaní základného vzorca. Ako hovorí výskumník Frank Schroeder, "Chémia mozgu v zásade určuje, ako sa cítime a ako reagujeme na svoje prostredie, a dokazujú sa, že chemikálie pochádzajúce z črevných mikróbov hrajú hlavnú úlohu. "
Na fázu 3 - vedci sa teraz pokúsili obnoviť normálnu schopnosť učenia sa myší vrátením črevných organizmov, ktoré nahradia tie, ktoré boli stratené, v prvej skupine, alebo transplantáciou bežných mikrobiómov, v populácii GF. Podarilo sa to, ak sa črevný mikrobióm ihneď po narodení obnovil do normálu, pričom ošetrené myši vykazovali normálne vzorce učenia. Na druhej strane, nedostatok zlepšenia neskoršími intervenciami naznačuje zásadnú potrebu signálov zo zdravého črevného mikrobiómu do vyvíjajúceho sa mozgu hneď po narodení dieťaťa.
Výskumník Conor Liston poznamenáva, "Toto bolo zaujímavé zistenie, vzhľadom na to, že mnohé psychiatrické stavy, ktoré sú spojené s autoimunitnými ochoreniami, sú spojené s problémami počas raného vývoja mozgu. “
Výskumník David Artis hovorí:"Os čreva a mozgu ovplyvňuje každý jednotlivý človek každý deň jeho života." Nikto zatiaľ nepochopil, ako IBD a ďalšie chronické gastrointestinálne stavy ovplyvňujú správanie a duševné zdravie. Naša štúdia poskytuje nové porozumenie tomu, ako mechanizmy fungujú. “
Objasnenie spôsobu, akým črevná dysbióza ovplyvňuje fungovanie mozgu na molekulárnej a bunkovej úrovni, dúfajme, urýchliť identifikáciu cieľových molekúl alebo ciest na liečbu postihnutých ľudí v budúcnosti.
 Netesné črevo a vesmírny let - mechanizmus odhalený
Netesné črevo a vesmírny let - mechanizmus odhalený
 Infliximab môže brániť účinnosti niektorých vakcín proti COVID-19
Infliximab môže brániť účinnosti niektorých vakcín proti COVID-19
 Riziko ochorenia ďasien a rakoviny pažeráka a žalúdka
Riziko ochorenia ďasien a rakoviny pažeráka a žalúdka
 Pľúcne mikróby by mohli pomôcť predpovedať výsledky u vážne chorých
Pľúcne mikróby by mohli pomôcť predpovedať výsledky u vážne chorých
 Peptid z jedu pavúka by mohol pomôcť zastaviť bolesť pri syndróme dráždivého čreva
Peptid z jedu pavúka by mohol pomôcť zastaviť bolesť pri syndróme dráždivého čreva
 Stredomorská strava podporuje zdravé starnutie so zdravším črevným mikrobiómom
Stredomorská strava podporuje zdravé starnutie so zdravším črevným mikrobiómom
 Dezinfekčné prostriedky pre domácnosť by mohli prispieť k riziku obezity u detí
Kanadskí vedci dokázali, že bežne používané čistiace prostriedky pre domácnosť môžu spôsobiť nadváhu detí tým, že spôsobia zmeny v ich črevnej mikroflóre. Sergej Mironov | Shutterstock V
Dezinfekčné prostriedky pre domácnosť by mohli prispieť k riziku obezity u detí
Kanadskí vedci dokázali, že bežne používané čistiace prostriedky pre domácnosť môžu spôsobiť nadváhu detí tým, že spôsobia zmeny v ich črevnej mikroflóre. Sergej Mironov | Shutterstock V
 Črevný mikrobióm spojený s problémami správania u detí
Deti s problémami so správaním môžu mať v črevnom mikrobióme rôzne zloženie, pričom rodičia hrajú hlavnú úlohu v tom, aké výrazné boli rozdiely, okrem jedla, ktoré poskytujú, naznačuje nová štúdia.
Črevný mikrobióm spojený s problémami správania u detí
Deti s problémami so správaním môžu mať v črevnom mikrobióme rôzne zloženie, pričom rodičia hrajú hlavnú úlohu v tom, aké výrazné boli rozdiely, okrem jedla, ktoré poskytujú, naznačuje nová štúdia.
 Mikrobiotická modulácia a obnovenie eubiózy by mohli pomôcť obmedziť komplikácie súvisiace s COVID-19
Koronavírusová choroba (COVID-19), spôsobená závažným akútnym respiračným syndrómom koronavírusom 2 (SARS-CoV-2), postihuje mnoho orgánov v tele. Okrem toho, že ide o ochorenie dýchacích ciest, môže t
Mikrobiotická modulácia a obnovenie eubiózy by mohli pomôcť obmedziť komplikácie súvisiace s COVID-19
Koronavírusová choroba (COVID-19), spôsobená závažným akútnym respiračným syndrómom koronavírusom 2 (SARS-CoV-2), postihuje mnoho orgánov v tele. Okrem toho, že ide o ochorenie dýchacích ciest, môže t