 10 % bolnikov z GERB razvije Barrettov požiralnik, dejavnik tveganja za raka na požiralniku.
10 % bolnikov z GERB razvije Barrettov požiralnik, dejavnik tveganja za raka na požiralniku.

Barrettov požiralnik nima edinstvenih simptomov. Bolniki z Barrettovo boleznijo imajo simptome GERB ali refluksa kisline, ki vključujejo naslednje:
Barrettov požiralnik je zaplet kronične gastroezofagealne refluksne bolezni (GERB), predvsem pri belih moških. GERB je bolezen, pri kateri pride do refluksa kisle tekočine iz želodca v požiralnik (požiralno cev). GERB najpogosteje povzroča zgago.
Obstajata dve zahtevi za diagnozo Barrettovega požiralnika. Zahteve zahtevajo endoskopijo požiralnika. Med endoskopijo se skozi usta in navzdol v požiralnik vstavi dolga fleksibilna cev z lučko in kamero na koncu (endoskop) za ogled in biopsijo (vzorec tkiva iz) sluznice požiralnika. Dve zahtevi sta:
Barrettov požiralnik je uradno kodiran s strani Kongresne knjižnice za elektronsko iskanje literature kot Barrettov požiralnik, vendar je Barrettov požiralnik (z apostrofom "s") ime, ki se uporablja univerzalno. Stanje je poimenovano po kirurgu Normanu Barrettu, ki je opisal stanje. Vendar se je izkazalo, da njegova interpretacija ugotovitev ni bila pravilna. Leta 1953 sta zdravnika Allison in Johnstone dejansko opisala to stanje, kot ga zdaj razumemo, in sicer, da se je pojavila metaplazija. (Metaplazija, ki je obravnavana v nadaljevanju, je izraz, ki se uporablja, ko eno odraslo tkivo nadomesti drugo.) Kljub temu je bilo stanje ovekovečeno z Barrettovim imenom.
Sprva so mislili, da je Barrettov požiralnik sestavljen iz želodčnega (želodčnega) tkiva, ki nadomešča običajno skvamozno tkivo, ki obdaja požiralnik. Vendar so sredi 70. let prejšnjega stoletja dr. Paull s sodelavci objavili članek, v katerem so podrobneje opisali sluznico (notranjo oblogo) Barrettovega požiralnika, kot je bilo storjeno prej. Poudarili so, da je Barrettov požiralnik sestavljen iz metaplazije, pri kateri so normalne celice, ki obdajajo požiralnik, zamenjane z mešanico celic želodčne in črevesne sluznice. Celice črevesnega tipa se imenujejo tudi specializirane stebričaste celice, ki vključujejo vrčaste celice. Nekaj let so nekateri znanstveniki menili, da obstajata dve vrsti Barrettove bolezni; ena, pri kateri je bila normalna sluznica zamenjana samo s celicami želodčnega (želodčnega) tipa, in druga, v kateri so bile prisotne črevesne celice. Vendar je trenutno prepričanje, da le prisotnost vrčastih celic črevesnega tipa vzpostavi diagnozo Barrettovega požiralnika, ne glede na to, katere druge vrste celic so prisotne.
Razlog za veliko zanimanje za Barrettov požiralnik je, da je povezan s povečanim tveganjem za raka na požiralniku. Vrsta raka, ki se pojavi pri bolnikih z Barrettovo boleznijo, je adenokarcinom, ki nastane iz metaplastičnega črevesnega tkiva. Običajni rak požiralnika, ki ni povezan z Barrettovim, je skvamozni karcinom, ki nastane iz ploščatocelične sluznice, ki je običajno prisotna v požiralniku. Povezava med adenokarcinomom požiralnika in Barrettovim požiralnikom je zdaj jasna, adenokarcinom požiralnika pa postaja vse pogostejši v večini držav na zahodni polobli.
Dobra novica pa je, da se rak pojavi pri relativno malo bolnikih z Barrettovim požiralnikom. Kljub temu je glavni izziv v tem stanju paziti na zgodnje opozorilne znake raka z jemanjem biopsij v rednih intervalih med endoskopijo. Ta praksa se imenuje nadzor in je načeloma podobna nadzoru pri ženskah zaradi raka materničnega vratu, pri katerem se bris PAP odvzame v rednih časovnih presledkih.
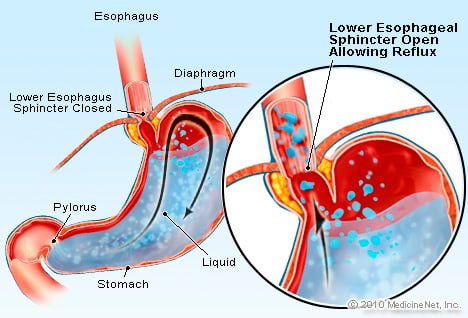
 GERB je stanje, pri katerem se prekomerna tekočina, ki vsebuje kislino, refluksira (teče) nazaj v požiralnik, deloma zaradi spodnji ezofagealni sfinkter je šibek.
GERB je stanje, pri katerem se prekomerna tekočina, ki vsebuje kislino, refluksira (teče) nazaj v požiralnik, deloma zaradi spodnji ezofagealni sfinkter je šibek. GERB povzroča Barrettov požiralnik. Požiralnik je mišična cev, ki se nahaja v prsnem košu in služi za prenos hrane iz ust v želodec. Spodnji ezofagealni sfinkter (LES) je ventil, ki se nahaja na stičišču želodca s požiralnikom. Njegova funkcija je preprečiti vrnitev kisline in druge želodčne vsebine v požiralnik. GERB je stanje, pri katerem se prekomerna tekočina, ki vsebuje kislino, refluksira (teče) nazaj v požiralnik, deloma zato, ker je spodnji ezofagealni sfinkter šibek. Slabost LES je lahko delno povezana z dejstvom, da imajo skoraj vsi bolniki z GERB hiatalno kilo. Pri bolnikih s hiatalno kilo zgornjih nekaj centimetrov želodca drsi naprej in nazaj med trebuhom in prsnim košem skozi diafragmo. To drsenje lahko moti delovanje sfinkterja kot ovire za refluks iz želodca v požiralnik.
Prej se je namesto izraza GERB uporabljal izraz hernija, ko so bolnikom razlagali osnovo njihovih simptomov (običajno zgaga), ker imajo skoraj vsi bolniki z GERB hiatalno kilo. GERB pa je bolj natančen izraz. Medtem ko so hiatalne kile izredno pogoste v populaciji, le majhno število ljudi s hiatalno kilo razvije GERB. Z drugimi besedami, prisotnost hiatalne kile ne pomeni, da bo oseba razvila GERB. Na drugi strani pa, če ima oseba GERB, je hiatalna kila skoraj vedno prisotna.
Tako je Barrettov požiralnik posledica kroničnega (večletnega trajanja) in običajno hudega refluksa kisline. Pri nekaterih bolnikih z GERB se požiralnik odzove na ponavljajočo se poškodbo kisle tekočine tako, da spremeni vrsto celic, ki ga obdajajo, iz skvamoznih (normalne celice) v stebraste (celice črevesnega tipa). Verjame se, da je ta transformacija, imenovana metaplazija, zaščitni odziv, ker je specializirani stebrični epitelij (epitelij pomeni obloga) v Barrettovem požiralniku bolj odporen na poškodbe zaradi kisline kot ploščati epitelij.
Tekočina v želodcu vsebuje kislino, ki jo proizvaja želodec. Poleg tega lahko tekočina vsebuje žolčne kisline (iz žolča, ki ga proizvajajo jetra) in encime (ki jih proizvaja trebušna slinavka), ki so se refluksirali iz dvanajstnika v želodec. (Dvanajstnik je prvi del tankega črevesa tik za želodcem.) Kislina, ki refluksira iz želodca v požiralnik, je škodljiva za požiralnik. Vendar pa obstajajo nekateri dokazi, da so žolč in encimi trebušne slinavke v kombinaciji s kislino lahko bolj škodljivi kot sama kislina.
Znaten odstotek posameznikov s kroničnimi simptomi GERB razvije Barrettov požiralnik, najpogostejši pa je pri moških belcev. Vendar pa vsi z GERB nimajo simptomov GERB. Zato se nekateri ljudje z Barrettovo boleznijo ne zavedajo, da imajo Barrettovo bolezen, ker imajo GERB brez kakršnih koli simptomov ali pa imajo zelo blage in redke simptome.
Ni jasno, zakaj je Barrettov požiralnik tako večinoma pogostejši pri belih moških kot pri kateri koli drugi skupini. Na primer, čeprav se zdi, da ženske in Afroameričani niso zaščiteni pred razvojem GERB, so v veliki meri zaščiteni (zlasti Afroameričani) pred razvojem Barrettovega požiralnika in Barrettovega raka (adenokarcinoma). Obstajajo dokazi, da se na zahodni polobli pogosteje pojavljata rak požiralnika in rak gastroezofagealnega stika (imenovan kardialni rak), morda bolj kot kateri koli drug rak prebavil. (Vendar je rak debelega črevesa še vedno veliko bolj pogost kot rak požiralnika.)
Barrettov požiralnik se lahko pojavi v nekaterih družinah in je genetsko določen. V teku so študije, da bi ugotovili, ali je v teh družinah mogoče najti kakšne gene ali markerje, ki bi napovedali razvoj Barrettovega požiralnika v splošni populaciji. V teh družinah z Barrettovo, pa tudi z Barrettovo v splošni populaciji, je GERB skupni imenovalec. Vendar je vprašanje, zakaj se Barrettova bolezen pogosteje pojavlja v teh družinah kot v drugih s primerljivo hudo GERB, vendar brez družinske zveze.
Naj ponovim, prvi kriterij za diagnozo Barrettovega požiralnika je ugotovitev pri endoskopiji rožnate sluznice v požiralniku, kjer je običajno ne vidimo. Ta nenormalna obloga se lahko pojavi po obodu kot trak, podobna jeziku ali kot otoki. Drugo merilo je, da biopsije rožnate sluznice razkrijejo značilno črevesno sluznico (oblogo, ki jo običajno vidimo v črevesju) s tipičnimi vrčastimi celicami. Biopsijo požiralnika dobimo med endoskopijo. Endoskopija zgornjega dela prebavil je postopek, pri katerem zdravnik vstavi dolgo fleksibilno cev (endoskop) skozi usta in navzdol v požiralnik, da neposredno vizualizira sluznico požiralnika. Med istim endoskopskim pregledom je mogoče vizualizirati tudi želodec in dvanajstnik. Z endoskopom je mogoče dobiti več majhnih vzorcev (biopsij) epitelnega tkiva sluznice.
Kot smo že omenili, se proces zamenjave ene vrste tkivne obloge z drugo imenuje metaplazija. V želodcu in črevesju je metaplazija pogost odziv na nekatere vrste poškodb. Kot je dejal patolog Henry Appelman:"Ko je črevesje pod stresom, želi biti nekaj drugega." Drugi primeri metaplazije, pri kateri ena sluznica nadomesti drugo, so:(1) v želodcu, kjer lahko kronično vnetje (gastritis) povzroči črevesno sluznico, ki nadomešča dele normalne želodčne sluznice; in (2) v dvanajstniku (tik za želodcem v črevesju), kjer se pojavijo peptične razjede in se črevesna sluznica, ki obdaja razjedo, spremeni v želodčno sluznico.
Menimo, da je proces metaplazije zaščitni ali prilagodljivi odziv na poškodbo sluznice. Vendar pa je slaba stran metaplazije, da v Barrettovem požiralniku prinaša majhno, a zagotovo povečanje tveganja za nastanek raka. Vse metaplazije nimajo povečanega tveganja za raka. Na primer, od dveh metaplazij, omenjenih v prejšnjem odstavku, lahko črevesna metaplazija v želodcu povzroči raka, črevesna metaplazija v dvanajstniku pa ne.
Proces razvoja Barrettove bolezni se začne na stičišču želodčne in požiralne sluznice. Požiralnik je običajno obložen s skvamoznim epitelijem ali plastjo sluznice. Ta ploščati epitelij ima biserno bel videz, medtem ko ima sluznica v želodcu in črevesju bolj lososovo rožnato barvo, ker gre za stebrast epitelij in ne za ploščati epitelij. Ploščati epitelij je sestavljen iz ploščatih skvamoznih celic, ki so podobne kožnim celicam. Želodčna ali želodčna sluznica je sestavljena iz višjih stebričastih celic, kot jih vidimo pod mikroskopom. Stičišče skvamoznega epitelija požiralnika in želodčnega stebričnega epitelija se pojavi na stičišču požiralnika in želodca, kjer se, kot se spomnite, nahaja spodnji požiralni sfinkter. Skupna meja (vmesnik) teh dveh oblog se pogosto imenuje črta Z, ker je pri pregledu med endoskopijo videti cik cak.
S progresivno poškodbo požiralnika se pojavi metaplazija in metaplastično tkivo se premakne navzgor po požiralniku za razdaljo, ki se razlikuje od osebe do osebe, običajno od približno 0,5 do 2,5 palca (približno 1 do 6 centimetrov). Vrsta celice, ki povzroča metaplastično tkivo, ni znana.
Barrettov požiralnik je pogosto razvrščen v Barrettov požiralnik s kratkimi ali dolgimi segmenti, glede na dolžino prizadetega požiralnika. Kratki segment Barrettov na splošno se nanaša na prizadetost 3 centimetre ali manj, medtem ko dolg segment pomeni prizadetost več kot 3 centimetre požiralnika. Zanimivo je, da ko se pri bolniku diagnosticira Barrettov požiralnik, se zdi, da metaplastična obloga ne napreduje naprej v požiralnik, če se bolnik zdravi zaradi GERB. Tako sčasoma trajanje sodelovanja pri Barrettovem na splošno ostane enako.
Če se biopsije vzamejo pri bolnikih z GERB, ki imajo normalno pojavljajočo se črto Z (ni vidnih dokazov o Barrettovem požiralniku), bo do 30 % pokazalo enako metaplazijo črevesnega tipa s vrčastimi celicami kot tiste, ki jih vidimo v Barrettovem požiralniku. Vendar ne izvajamo rutinske biopsije normalnih pojavnih črt Z, da bi poiskali to spremembo, niti ne izvajamo nadzora, ko jo tam najdemo. Razlog je v tem, da se zdi, da se omejena črevesna metaplazija regije gastroezofagealnega stičišča pri GERB pojavlja s podobno pogostostjo pri ženskah in Afroameričanih kot pri belih moških, vendar je tveganje za očiten Barrettov požiralnik veliko manjše kot pri belih moških.
Zato prisotnost metaplazije na rutinski biopsiji normalne linije Z pri GERB ne bi smela povzročiti nobenih sprememb v upravljanju. Še več, najdbe vrčastih celic v tem kontekstu ne bi smeli označiti, kot so nekateri predlagali, kot Barrettov ultra kratki segment. Glavni razlog, da ga ne označimo za Barrettovega, je ta, da izraz Barrettov pomeni povečano tveganje za raka, in ni dokazov, da je ta ugotovitev povezana s povečanim tveganjem za raka.
Vrsta raka, ki se pojavi pri Barrettovem požiralniku, je adenokarcinom. Rak, ki nastane iz skvamozne sluznice požiralnika, se imenuje skvamozni rak ali karcinom. Med belci se stopnja (pogostost skozi čas) skvamoznega raka zmanjšuje v primerjavi z Barrettovim adenokarcinomom. Druge rasne skupine (na primer Afroameričani) pa niso doživele enake stopnje upada skvamoznega raka v primerjavi z adenokarcinomom.
Kajenje in prekomerno uživanje alkohola sta zagotovo dejavnika tveganja za skvamoznega raka. Prav tako so dejavniki tveganja za adenokarcinom, ki ga opazimo v Barrettovem požiralniku. V tej situaciji pa ni jasno, ali kajenje in alkohol povečata tveganje za adenokarcinom, tako da poslabšata GERB, ali ali imata kajenje in alkohol bolj neposreden učinek na raka, kot se dogaja pri skvamoznem raku. Ploščatocelični rak je vse manj pogost, medtem ko se je število diagnoz adenokarcinoma povečalo. Incidenca adenokarcinoma pri belih moških je narasla bolj strmo kot pri drugih etničnih skupinah.
V preostalem delu tega razdelka se bo izraz rak požiralnika nanašal na adenokarcinom, ki izhaja iz Barrettovega požiralnika.
Rak gastroezofagealnega stika se imenuje tudi kardialni rak, ker se območje, kjer se požiralnik sreča z želodcem, imenuje kardija. Ta rak, tako kot adenokarcinom, povezan z Barrettom, najdemo pretežno pri belih moških, očitno se pogosteje povečuje z enako hitrostjo kot rak požiralnika in je povezan s kronično GERB. Zato se domneva, da se rak kardije začne s kratkimi segmenti (na primer 1-2 cm) Barrettovega. Vendar pa se lahko do postavitve diagnoze raka tumor razširi preko kratkega Barrettovega segmenta in se zdi, da je v kardiju. To ugibanje o izvoru raka kardije pa je treba še dokazati.
Povečanje pogostnosti adenokarcinoma požiralnika je bilo opaženo že vsaj 20 let, predvsem pri belih moških. Eden od namigov za razlog za ta trend je lahko povezan z zmanjšanjem pogostosti H. pylori okužba želodca. Z drugimi besedami, zdi se, da imajo ljudje z Barrettovim rakom, vključno z rakom kardije, nižjo stopnjo H. pylori okužbe kot drugi iste starosti in spola v isti populaciji.
H. pylori je vrsta bakterij, ki je glavni vzrok za razjede. Je zelo pogosta okužba po vsem svetu in pri veliki večini prizadetih ljudi ne povzroča nobenih simptomov. Vendar pa nekateri ljudje z H. pylori razvoj peptične razjede na želodcu in dvanajstniku. Te razjede zdravimo z odstranitvijo bakterij, kar pa preprečuje ponovitev razjed.
Če H. pylori če se ne zdravi, povzroči progresivno vnetje želodca (gastritis), ki je povezano z zmanjšanjem izločanja kisline in morda manjšim refluksom kisline v požiralnik. Na mnogih območjih sveta se pogostnost te okužbe zmanjšuje, verjetno zaradi boljših ukrepov javnega zdravja. Zato je možno, da zaščitni učinek (kot je zmanjšana proizvodnja kisline) kroničnega H. pylori okužba se je zmanjšala. Z drugimi besedami, z manj H. pylori gastritis, želodec proizvaja več kisline in je več kisline za refluks v požiralnik. Hkrati smo v višjih letih bolj nagnjeni k refluksu. Čeprav to ni rešeno vprašanje, se zmanjševanje pogostosti H. pylori Okužba je lahko eden od razlogov za naraščajočo pogostost Barrettovega adenokarcinoma.
Displazija je sprememba v celicah, ki obdajajo požiralnik, pri kateri celice dejansko kažejo nenormalne spremembe v svoji strukturi in videzu. Ko te spremembe postanejo dovolj hude (od displazije nizke do visoke stopnje), se celice začnejo pojavljati maligne (kot rakave celice). Vendar za razliko od raka te celice ostanejo na mestu in ne vdrejo v tkiva zunaj sluznice. Displazija se pojavi kot vrsta celičnih sprememb, ko Barrettov požiralnik napreduje v Barrettov rak. Bolnike z Barrettovo boleznijo spremljajo z endoskopijo in biopsijami (nadzor), da se odkrijejo te celične spremembe (displazija) ali v najslabšem primeru zgodnji rak, da se lahko zdravijo. Trenutno ni mogoče predvideti, kateri bolniki z Barrettovim požiralnikom bodo razvili displazijo.
Displazijo so odkrili tudi poleg tumorjev gastrointestinalnega trakta, razen adenokarcinoma požiralnika. Na primer, displazijo najdemo v polovici primerov raka na želodcu in pri raku debelega črevesa, pri katerem je displazija vidna kot tako imenovani adenomatozni polipi. Poleg tega je displazija enaka zgodnja opozorilna sprememba celic, ki jo patologi iščejo v brisih PAP materničnega vratu, ki napovedujejo raka materničnega vratu.
Displazija velja za premaligno. To pomeni, da če je bila displazija večkrat dokazana, se domneva, da bo bolnik zbolel za rakom, če bo dovolj dolgo živel. Displazija je kategorizirana kot visoka ali nizka stopnja. Ko je diagnosticirana displazija visoke stopnje, je lahko rak že prisoten, in če ne, je tveganje za nastanek raka prej večje kot pri nižjih stopnjah displazije.
Pri nadaljnjih biopsijah bolnikov z displazijo stanje morda ne bo več odkrito pri nekaterih bolnikih, medtem ko pri drugih najdemo nizke stopnje displazije. Ta odsotnost ali zmanjšanje displazije je lahko posledica dejavnikov, kot so razlike v vzorčenju, odstranitev drobnih žarišč (skupin celic) displazije z začetno biopsijo ali dejanski biološki preobrat. Natančni razlogi niso znani.
Z uporabo molekularnih tehnik je mogoče nekatere spremembe, imenovane biomarkerji, odkriti v vzorcih biopsije, preden se razvije displazija. Te spremembe so podobne tistim, ki jih opazimo pri drugih vrstah raka. Biomarkerji vključujejo spremembe v vsebnosti DNK v celicah, v genih in kromosomih ter v rastnih faktorjih. Za številne od teh biomarkerjev se lahko pokaže, da se pojavijo pred in med pojavom displazije. Končni cilj je najti čarobni marker, ki nam lahko pove, pri katerih bolnikih med tistimi, ki nimajo displazije ali displazije nizke stopnje, je večja verjetnost za razvoj displazije visoke stopnje ali raka. Takšne bolnike lahko nato spremlja bolj natančno kot druge.
Trenutno so vsi bolniki z Barrettovim požiralnikom z vidika nadzora obravnavani na enak način. Razpoložljivost biomarkerjev bi ločila (razslojila) Barrettove bolnike glede na njihovo tveganje za raka. Takšna stratifikacija bi zdravnikom omogočila pogostejše izvajanje nadzorne endoskopije in biopsije pri manjšini bolnikov, ki imajo večje tveganje za raka, in redkeje pri tistih, za katere se predvideva, da bodo imeli manjše tveganje za raka.
Druga uporaba dokazanih biomarkerjev bi bila pomoč pri potrditvi patologove razlage displazije na biopsijah.
Ko bolnike z Barrettovim požiralnikom ocenimo kot skupino, je bilo ugotovljeno, da je tveganje za raka le eden od 300 bolnikov letno. To pomeni, da če bi letno pregledali 300 bolnikov, bi vsako leto odkrili enega bolnika z rakom. Kar res moramo vedeti, je tveganje za raka, če po enem ali dveh letih nadzora ne odkrijemo displazije. Prepričani smo, da bi bilo to tveganje veliko manjše od prej navedenih številk o enem od 300 bolnikov letno.
Pri bolnikih z visoko stopnjo displazije se lahko pogosto odkrije rak. Zato je prvi način zdravljenja, ko se odkrije displazija visoke stopnje, izključiti prisotnost adenokarcinoma.
Displazija nizke stopnje je veliko manj nevarna kot displazija visoke stopnje, vendar ne vemo, koliko manj. Pravzaprav nimamo natančnih podatkov, ki bi pokazali, kakšno je tveganje za raka pri bolnikih z Barrettovo in nizko stopnjo displazije.
Diagnoza displazije mora biti čim bolj natančna, saj lahko ta diagnoza spodbudi spremembo zdravljenja ali intenzivnost spremljanja bolnikov z Barrettovim požiralnikom. Za natančno diagnozo prisotnosti in stopnje displazije je potrebno veliko izkušenj. Zato je običajna in koristna praksa, da prosite drugega patologa (ali celo tretjega, če je potrebno), da pregleda biopsije. Ideja je videti, ali obstaja dogovor med patologi in/ali pridobiti bolj izkušeno mnenje o prisotnosti in stopnji displazije.
Če ima oseba Barrettov daljši segment, bi lahko ugibali, da je tveganje za nastanek raka večje kot pri krajšem Barrettovem segmentu. Podatki pa so glede tega sporni. Zaradi tega je trenutna praksa, da se endoskopski biopsijski nadzor izvaja s podobno pogostostjo pri bolnikih s kratkim in dolgim segmentom Barrettovega požiralnika.
Barrettov požiralnik nima edinstvenih simptomov. Bolniki z Barrettovo boleznijo imajo simptome GERB (na primer zgaga, regurgitacija, slabost itd.). Splošni trend je, da imajo Barrettovi bolniki hujšo GERB. Vendar pa nimajo vsi Barrettovi izrazitih simptomov GERB in nekateri bolniki so odkriti po naključju z minimalnimi simptomi GERB ali brez njih.
Zgaga je pekoč občutek za prsnico, običajno v spodnji polovici, vendar se lahko razširi vse do grla. Včasih ga spremlja pekoč občutek ali bolečina v želodčni jami tik pod koncem prsnice. Drugi najpogostejši simptom je regurgitacija (regurgitacija) grenke tekočine. Simptomi GERB so pogosto slabši po obroku in med ležanjem.
Refluksirana, regurgitirana tekočina lahko občasno pride v pljuča ali glasnico (grlo), kar povzroči tako imenovane ekstraezofagealne (zunaj požiralnika) simptome (manifestacije) GERB. Ti simptomi vključujejo:
Iz razlogov, ki niso popolnoma razumljeni, imajo nekateri bolniki z GERB minimalno zgago, vendar imajo druge simptome GERB, na primer ekstraezofagealne simptome.
GERB lahko povzroči strikture in razjede požiralnika. Striktura ali zožitev je posledica brazgotinjenja (fibroze) požiralnika, ki lahko povzroči težave pri požiranju (disfagija). Disfagijo zaznamo kot zastajanje (ustavljanje) trdne hrane v prsnem košu (v požiralniku) in tekočine, ko je zožitev močna. Strikture lahko zdravimo tako, da jih med endoskopijo raztegnemo z dilatatorji. Nezdravljene lahko strikture spodbudijo več razlitja hrane in/ali želodčne tekočine v pljuča. Občasno se lahko pojavijo obsežne krvavitve iz prebavil (GI), ki jih povzroči vnetje požiralnika. Takšna krvavitev povzroči bruhanje krvi ali odvajanje črnega ali rjavega blata. Pogosteje pa lahko vnet požiralnik povzroči počasno krvavitev, ki se odkrije, ko se odkrije anemija (nizko število rdečih krvnih celic) in/ali se blato testira za kri.
Zdravstveno zdravljenje simptomov Barrettovega požiralnika je enako kot pri GERB.
Zatiranje kisline je hrbtenica zdravljenja GERB. Za blage simptome refluksa se običajno uporabljajo zdravila brez recepta, od antacidov do nizkih odmerkov zdravil, imenovanih antagonisti receptorjev H-2 ali zaviralci H2. Primera zaviralcev H2 brez recepta sta cimetidin (Tagamet) in famotidin (Pepcid, Zantac 360). Za trajnejše simptome se lahko uporabijo višji odmerki antagonistov receptorjev H-2 (na recept, na primer:
Vendar pa se pri trajnih simptomih, ki zahtevajo vzdrževalno (trajno) zdravljenje ali pri zapleteni GERB s strikturami ali krvavitvami, uporabljajo zaviralci protonske črpalke (PPI). Primeri PPI so:
Nekateri bolniki morajo vzeti samo eno tableto na dan, drugi pa potrebujejo dve tableti (dvojni odmerek) za nadzor simptomov. Dvojni odmerek lahko vzamete kot eno tableto dvakrat na dan ali 2 tableti enkrat na dan.
PPI so močni zaviralci izločanja kisline iz želodca. Učinkoviti so pri lajšanju zgage in pri zdravljenju vnetja požiralnika (ezofagitis) in razjed požiralnika, ki jih povzroča refluks kisline. PPI se dobro prenašajo z malo stranskimi učinki. Po prenehanju jemanja teh zdravil se simptomi refluksa kisline običajno ponovijo, včasih s povečano intenzivnostjo. To povečanje simptomov je deloma posledica ponovnega izločanja kisline (hipersekrecija kisline), ki je odziv, ki ga spodbudi okrevanje od zaviranja izločanja kisline s PPI.
Dolgoročna varnost PPI je pomemben dejavnik. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Ti vključujejo:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Anatomija in delovanje jeter
Definicija jeter in dejstva Jetra so velik, mesnati organ, ki se nahaja na desni strani trebuha. Jetra imajo dva velika dela, imenovana desni in levi reženj. Jetra so bistven organ, ki opravlja
Anatomija in delovanje jeter
Definicija jeter in dejstva Jetra so velik, mesnati organ, ki se nahaja na desni strani trebuha. Jetra imajo dva velika dela, imenovana desni in levi reženj. Jetra so bistven organ, ki opravlja
 Kaj pomeni, če imate bolečine v jetrih po pitju alkohola?
Delovanje jeter Presežek alkohola lahko povzroči bolečine v jetrih, poškodbe in vodi do bolezni jeter ali ciroze. Dolgotrajna uporaba alkohola je povezana z možnostjo razvoja raka na jetrih. Jet
Kaj pomeni, če imate bolečine v jetrih po pitju alkohola?
Delovanje jeter Presežek alkohola lahko povzroči bolečine v jetrih, poškodbe in vodi do bolezni jeter ali ciroze. Dolgotrajna uporaba alkohola je povezana z možnostjo razvoja raka na jetrih. Jet
 Pacienti, ki naj bodo pozorni na težave po operaciji debelega črevesa
Zadnje novice o raku Ni vam treba biti kadilec, da zbolite za pljučnim rakom Napredek pri pljučnem raku vodi do splošnega upada Zdravila na imunski osnovi se borijo proti raku endometrija Pravila Med
Pacienti, ki naj bodo pozorni na težave po operaciji debelega črevesa
Zadnje novice o raku Ni vam treba biti kadilec, da zbolite za pljučnim rakom Napredek pri pljučnem raku vodi do splošnega upada Zdravila na imunski osnovi se borijo proti raku endometrija Pravila Med