Förutom de ofta omtalade BRCA-genmutationerna finns det ett betydande antal andra ärftliga genmutationer som ökar risken för att utveckla bröstcancer. Faktum är att man tror att mutationer i över 100 gener bidrar till risken, och antalet icke-BRCA-genmutationer som ökar risken för bröstcancer förväntas växa i takt med att vår kunskap om cancerns genetik ökar.
Förutom BRCA1- och BRCA2-genmutationer inkluderar några av dessa mutationer i ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 och mer. Låt oss titta på hur viktiga dessa icke-BRCA1/BRCA2-mutationer är i familjär bröstcancer, och några av egenskaperna hos de som är vanligare.
Man tror för närvarande att 5 % till 10 % av bröstcancer är genetiska eller familjär ( även om detta antal kan ändras när vi lär oss mer), men inte alla dessa cancerformer beror på BRCA-mutationer.
Som mest testar 29 % (och troligen mycket färre) ärftliga bröstcancerfall positivt för BRCA1- eller BRCA2-genmutationer, och många människor fortsätter att testa för andra kända genetiska förändringar.
Eftersom vetenskapen bakom ärftlig cancer är mycket ångestframkallande, för att inte tala om förvirrande och ofullständig, är det bra att börja med att prata om genmutationers biologi och hur dessa förändringar i DNA spelar en roll i utvecklingen av cancer.
När man talar om mutationer är det viktigt att skilja mellan ärvda och förvärvade genmutationer.
Förvärvade eller somatiska genmutationer har fått mycket uppmärksamhet de senaste åren, eftersom dessa mutationer orsakar förändringar som driver tillväxten av cancer. Riktade terapier, läkemedel som riktar sig mot specifika vägar relaterade till dessa förändringar, har avsevärt förbättrat behandlingen av vissa cancerformer som lungcancer.
Förvärvade mutationer är dock inte närvarande från födseln, utan bildas snarare tid efter födseln i processen att en cell blir en cancercell. Dessa mutationer påverkar endast vissa celler i kroppen. De ärvs inte från en förälder, utan snarare "förvärvade" eftersom DNA i celler utsätts för skador från miljön eller som ett resultat av kroppens normala metaboliska processer.
Äftliga mutationer eller könslinjemutationer är däremot genetiska förändringar som människor är föds med, och som går i arv från en eller båda föräldrarna. Dessa mutationer påverkar alla kroppens celler. Det är dessa ärftliga mutationer (och andra genetiska förändringar) som kan öka chansen att en person kommer att utveckla cancer och förklarar vad som kallas ärftlig eller familjär bröstcancer.
Ärftliga (germline) vs. förvärvade (somatiska) genmutationerMånga undrar hur exakt en onormal gen eller kombinationer av gener kan leda till bröstcancer , och en kort diskussion om biologin är till hjälp för att förstå många av frågorna, som varför inte alla som har dessa mutationer utvecklar cancer.
Vårt DNA är en ritning eller kod som används för att tillverka proteiner. När kartan eller koden är fel (som "bokstäverna" i en viss gen), ger den fel anvisningar för att syntetisera ett protein. Det onormala proteinet kan då inte utföra sitt vanliga jobb. Alla genmutationer ökar inte risken för cancer, och de flesta gör det faktiskt inte. Mutationer i gener som ansvarar för tillväxt och delning av celler, eller "drivrutiner" är det som driver tillväxten av cancer. Det finns två huvudtyper av gener som, när de muteras, kan leda till okontrollerad tillväxt som kallas cancer:onkogener och tumörsuppressorgener.
Flera av generna associerade med en högre risk för bröstcancer är tumörsuppressorgener. Dessa gener kodar för proteiner som fungerar för att reparera skador på DNA i celler (skador från toxiner i miljön eller de normala metaboliska processerna i celler), tjänar till att eliminera celler som inte kan repareras eller reglera tillväxten på andra sätt. Generna BRCA1 och BRCA2 är tumörsuppressorgener.
Många av dessa gener är autosomalt recessiva, vilket innebär att varje person ärver en kopia av gen från varje förälder, och båda kopiorna måste muteras för att öka cancerrisken. Förenklat innebär detta att en kombination av genetiska och miljömässiga faktorer (en förvärvad mutation i den andra genen) behöver agera tillsammans för att resultera i att cancer utvecklas. Utöver detta måste vanligtvis flera mutationer inträffa för att en cell ska bli en cancercell.
Vad det innebär att ha en genetisk predisposition för cancerAlla genmutationer eller genetiska förändringar ökar inte risken för bröstcancer i samma grad , och detta är ett viktigt koncept för alla som överväger genetiska tester, särskilt eftersom många människor har hört talas om den mycket höga risken för BRCA-mutationer. Genpenetrans definieras som andelen personer med en mutation som kommer att uppleva tillståndet (i detta fall utveckla bröstcancer).
För vissa mutationer är risken för bröstcancer mycket hög. För andra kan risken bara öka med en faktor 1,5. Detta är viktigt att förstå när man talar om möjliga förebyggande alternativ.
Ett annat viktigt koncept som är viktigt för att förstå genetik och cancer, även om det är för komplicerat att utforska i detalj här, är epigenetik. Vi har lärt oss att förändringar i DNA som inte involverar förändringar i basparen (nukleotider) eller "bokstäverna" som kodar för ett protein, kan vara lika viktiga i utvecklingen av cancer. Med andra ord, istället för strukturella förändringar i DNA:s ryggrad, kan det finnas molekylära förändringar som förändrar hur meddelandet läses eller uttrycks.
BRCA-genmutationer är den mest välkända genetiska abnormiteten förknippad med bröstcancer, men det är varit tydligt att det finns kvinnor som är predisponerade för bröstcancer baserat på sin familjehistoria, som testar negativt.
En studie från 2017 visade att BRCA-mutationer endast stod för 9 % till 29 % av de ärftliga bröstcancer. Även när testning gjordes för ytterligare 20 till 40 kända mutationer, testade dock endast 4% till 11% av kvinnorna positivt. Med andra ord testade 64 % till 86 % av kvinnorna som misstänktes ha ärftlig bröstcancer negativa för både BRCA-mutationer och 20 till 40 andra.
Vår kunskap om genmutationer som ökar risken för bröstcancer är fortfarande ofullständig, men vi har nu vet att det finns minst 72 genmutationer kopplade till ärftlig bröstcancer. Dessa mutationer (och andra ännu oupptäckta) tros vara ansvariga för de 70 % till 90 % av ärftliga bröstcancersjukdomar som testar negativa för BRCA-genmutationer. Akronymen BRCAX har myntats för att beskriva dessa andra mutationer, vilket står för icke-BRCA1- eller BRCA2-relaterad familjär bröstcancer.
72 genetiska mutationer kopplade till ärftlig bröstcancerDe genetiska avvikelserna nedan skiljer sig i sin frekvens, mängden risk förknippad, vilken typ av bröstcancer de är kopplade till och andra cancerformer som är förknippade med mutationerna.
De flesta av dessa bröstcancer är lika i egenskaper (såsom cancertyp, östrogen- receptorstatus och HER2-status) till icke-ärftliga eller sporadiska bröstcancer, men det finns undantag. Till exempel är vissa mutationer starkare förknippade med trippelnegativ bröstcancer, inklusive mutationer iBARD1 , BRCA1 , BRCA2 , PALB2 , och RAD51D .
Inte alla människor som har följande genmutationer är desamma. I allmänhet kan det finnas hundratals sätt på vilka dessa gener muteras. I vissa fall kommer genen att producera proteiner som hämmar tumörtillväxt, men proteinerna kommer inte att fungera lika bra som det normala proteinet. Med andra mutationer kanske proteinet inte produceras alls.
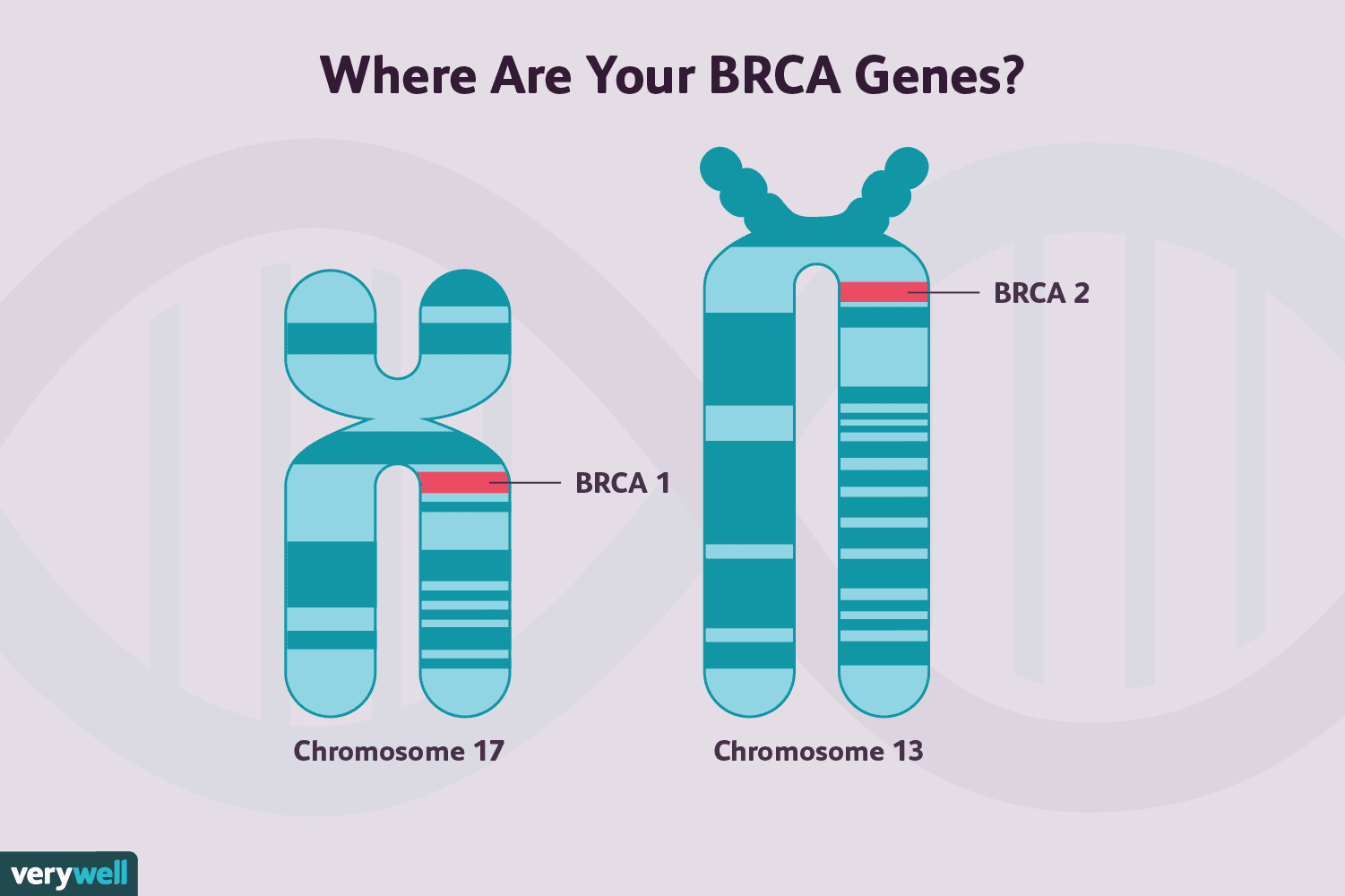
BRCA 1-genmutationer och BRCA2-genmutationer är båda förknippade med en ökad risk att utveckla bröstcancer, liksom vissa andra cancerformer, även om de två skiljer sig något åt i den risken.
I genomsnitt kommer 72 % av kvinnorna som har BRCA1-mutationer och 69 % som har muterade BRCA2-gener att utveckla bröstcancer vid 80 års ålder.
Dessutom kan bröstcancer associerade med dessa mutationer skilja sig åt. Bröstcancer hos kvinnor som har BRCA1-mutationer är mer benägna att vara trippelnegativa. Cirka 75% är östrogenreceptornegativa, och de är också mindre benägna att vara HER2-positiva. De är också mer benägna att ha en högre tumörgrad. Bröstcancer hos kvinnor med BRCA2-mutationer liknar däremot cancer hos kvinnor som inte är bärare av BRCA-genmutationer.
ATM-genen kodar för proteiner som hjälper till att kontrollera celltillväxthastigheten. De hjälper också till med reparationen av skadade celler (celler som har fått DNA-skador från toxiner) genom att aktivera enzymer som reparerar denna skada.
De som har två kopior av den muterade genen har ett ovanligt autosomalt recessivt syndrom som kallas ataxi-telangiektasi. Med ataxi-telangiectasia ökar de defekta proteinerna inte bara risken för cancer, utan leder till att vissa celler i hjärnan dör ut för tidigt, vilket resulterar i en progressiv neurodegenerativ störning.
Människor som bara har en muterad kopia av genen (ungefär 1 % av befolkningen) har 20 % till 60 % risk för att utveckla bröstcancer under hela livet.
Människor som har denna mutation tros vara predisponerade för bröstcancer i tidig ålder , samt att utveckla bilateral bröstcancer.
Bröstcancerscreening med bröst-MRI rekommenderas från och med 40 års ålder, och kvinnor kan önska att överväga förebyggande mastektomier. Personer med en muterad ATM-gen verkar också vara predisponerade för cancer i sköldkörteln och bukspottkörteln och är mer känsliga för strålning.
Mutationer i PALB2-genen är också en viktig orsak till ärftlig bröstcancer. Genen PALB2 kodar för ett protein som arbetar tillsammans med BRCA2-proteinet för att reparera skadat DNA i celler. Totalt sett är livstidsrisken för bröstcancer med en PALB2-mutation så hög som 58 % även om den kan variera beroende på ålder. Risken är 8 gånger till 9 gånger genomsnittet för kvinnor under 40 år, men runt 5 gånger genomsnittet för kvinnor över 60 år.
Bland dem som bär en kopia av genen kommer 14 % att utveckla bröstcancer vid 50 års ålder och 35 % vid 70 års ålder (mindre än med BRCA-mutationer).
Människor som har en PALB2-mutation och utvecklar bröstcancer kan ha en högre risk att dö från sjukdomen.
Människor som ärver 2 kopior av den muterade PALB2-genen har en typ av Fanconi-anemi som karakteriseras av mycket låga antal röda blodkroppar, vita blodkroppar och blodplättar.
CHEK2-genen kodar för ett protein som aktiveras när skada uppstår på DNA. Det aktiverar också andra gener som är involverade i cellreparation.
Livstidsriskerna för bärare av CHEK2 trunkerande mutationer är 20 % för en kvinna utan drabbad släkting, 28 % för en kvinna med en andra gradens släkting drabbad, 34 % för en kvinna med en första gradens släkting påverkad och 44 % för en kvinna med både en första och andra gradens släkting drabbad.
För både män och kvinnor ökar genen också risken för tjocktarmscancer och icke -Hodgkins lymfom.
Mutationer i CDH1 orsakar ett tillstånd som kallas ärftligt magcancersyndrom.
Människor som ärver denna gen har en livstidsrisk på upp till 80 % för att utveckla magcancer och upp till 52 % för att utveckla lobulär bröstcancer.
Genen kodar för ett protein (epitelial cadherin) som hjälper celler att hålla fast vid varandra (en av skillnaderna mellan cancerceller och normala celler är att cancerceller saknar dessa vidhäftningskemikalier som gör att de fastnar). Cancer hos personer som ärver denna mutation är mer benägna att metastasera.
Mutationer i PTEN-genen är en av de vanligaste tumörsuppressorgenmutationerna. Genen kodar för proteiner som reglerar cellernas tillväxt och hjälper även cellerna att hålla ihop.
Mutationer i genen verkar öka risken för att cancerceller bryts av från en tumör och metastaserande. PTEN är associerat med ett syndrom som kallas PTEN hamartoma tumörsyndrom samt Cowdens syndrom.
Kvinnor som bär på en PTEN-mutation har en livstidsrisk att utveckla bröstcancer upp till 85 %, och har även en ökad risk för godartade bröstförändringar som fibrocystisk sjukdom, adenos och intraduktal papillomatos.
Mutationerna är också kopplade till en ökad risk för livmodercancer (och benigna myom ), sköldkörtelcancer, tjocktarmscancer, melanom och prostatacancer.
Icke-cancerrelaterade symtom inkluderar stort huvud (makrocefali) och tendensen att bildas godartade tumörer som kallas hamartom.
Mutationer i STK11 är associerade med ett genetiskt tillstånd som kallas Peutz-Jeghers syndrom. STK11 är en tumörsuppressorgen involverad i celltillväxt.
Förutom en ökad risk för bröstcancer (med en livstidsrisk på upp till 50%), medför syndromet en ökad risk för många cancerformer, av vilka några inkluderar tjocktarmscancer, bukspottkörtelcancer, magcancer, äggstockscancer, lungcancer, livmodercancer och mer.
Icke-cancerrelaterade tillstånd associerade med mutationen inkluderar icke-cancerösa polyper i matsmältningskanalen och urinvägar, fräknar i ansiktet och insidan av munnen med mera. Bröstcancerscreening rekommenderas ofta för kvinnor som börjar i 20-årsåldern och ofta med MRT med eller utan mammografi.
TP53-genen kodar för proteiner som stoppar tillväxten av onormala celler.
Dessa mutationer är extremt vanliga vid cancer, medförvärvade mutationer i p53-genen som finns i cirka 50 % av cancerfallen.
Äftliga mutationer är mindre vanliga och förknippas med tillstånd som kallas Li-Fraumenis syndrom, eller Li-Fraumeni-liknande syndrom (som har en lägre cancerrisk). Majoriteten av människor som ärver mutationen utvecklar cancer vid 60 års ålder och är, förutom bröstcancer, benägna att utveckla skelettcancer, binjurecancer, bukspottkörtelcancer, tjocktarmscancer, levercancer, hjärntumörer, leukemi med mera. Det är inte ovanligt att personer med mutationen utvecklar mer än en primär cancer.
Äftliga mutationer i p53-genen tros stå för omkring 1 % av fallen av ärftlig bröstcancer. Bröstcancer associerade med mutationen är ofta HER2-positiva och har en hög tumörgrad.
Lynch syndrom eller ärftlig icke-polypos kolorektal cancer är associerad med mutationer i flera olika gener inklusive PMS2, MLH1, MSH2, MSH6 och EPCAM.
Särskilt PMS2 har associerats med dubbel risk för bröstcancer. Genen fungerar som en tumörsuppressorgen som kodar för ett protein som reparerar skadat DNA.
Förutom bröstcancer medför dessa mutationer en hög risk för cancer i tjocktarmen , äggstock, livmoder, mage, lever, gallblåsa, tunntarm, njure och hjärna.
Det finns flera andra genmutationer associerade med en ökad risk att utveckla bröstcancer, och det förväntas att mer kommer att upptäckas inom en snar framtid. Några av dessa inkluderar:
För närvarande är testning tillgänglig för BRCA-genmutationer, såväl som mutationer ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B och TP53, med detta område som förväntas expandera dramatiskt inom en snar framtid.
Att ha dessa test tillgängliga väcker dock många frågor. Vem kan till exempel ha ärftlig bröstcancer och vem ska testas? Vad ska du göra om du testar positivt för en av dessa gener?
I idealfallet bör alla tester endast göras med vägledning och hjälp av en genetisk rådgivare . Det finns två anledningar till detta.
En är att det kan vara förödande att lära sig att du bär på en mutation som kan öka din risk, och vägledningen från någon som är medveten om rekommenderad hantering och screening är ovärderlig.
Som nämnts tidigare ger vissa mutationer en hög risk och andra en mycket lägre risk. Vissa mutationer kan vara mer bekymmersamma tidigare i livet (säg i 20-årsåldern), medan andra kanske inte kräver tidig screening. En genetisk rådgivare kan hjälpa dig att lära dig om vad som för närvarande rekommenderas när det gäller screening för just din mutation samtidigt som du tar hänsyn till eventuella andra riskfaktorer du kan ha.
Den andra anledningen till att genetisk rådgivning är så viktig är att du kan ha en betydande risk för utvecklar bröstcancer även om dina tester är negativa. Det finns mycket kvar att lära, och en genetisk rådgivare kan hjälpa dig att titta på din familjehistoria för att se om du kan ha en hög risk trots negativa tester, och planera screening därefter.
Gentestning för bröstcancerPrecis som människor som har diagnostiserats med bröstcancer behöver stöd, de som bär gener som ökar risken behöver stöd. Lyckligtvis finns det organisationer som fokuserar specifikt på att stödja människor i den här situationen.
En organisation, FORCE, som är en akronym för Facing Our Risk of Cancer Empowered, erbjuder en hjälplinje, anslagstavla och information för dem som lider av ärftlig cancer.
Andra organisationer och stödgrupper finns tillgängliga för att hjälpa människor att hantera beslut som är relaterade till en diagnos av ärftlig bröstcancer.
Begreppet "previvor" myntades av FORCE för att beskriva människor som överlever en predisposition till bröstcancer. Om det är den här situationen du står inför är du inte ensam, och med hashtaggen #previvor kan du hitta många andra på Twitter och andra sociala medier.
Det kan vara överväldigande att lära sig om de många olika genmutationer som ökar risken för bröstcancer utöver BRCA-mutationer, men dessa "andra" mutationer är av betydande betydelse med vetskapen om att BRCA-mutationer står för en relativ minoritet av familjär bröstcancer. Samtidigt är vetenskapen som tittar på ärftlig bröstcancer fortfarande i sin linda och det finns mycket att lära. Om du är orolig att du kan ha en mutation eller har lärt dig att du har det, är det bra att lära dig så mycket du kan. Ärftliga cancerorganisationer som FORCE kan inte bara ge dig ytterligare information utan kan hjälpa dig att få kontakt med andra som står inför en resa med liknande frågor och bekymmer.
 Kopplingen mellan bäckenbottendysfunktion och IBS-symtom
Kopplingen mellan bäckenbottendysfunktion och IBS-symtom
 SIBO Coaching Program Intresseanmälan
SIBO Coaching Program Intresseanmälan
 Nya tarmsjukdomsbehandlingar behövs, säger FDA
Nya tarmsjukdomsbehandlingar behövs, säger FDA
 Proteinbud från mänsklig mikrobiom belyser människors hälsa
Proteinbud från mänsklig mikrobiom belyser människors hälsa
 Speler vårt immunsystem en roll vid IBS?
Speler vårt immunsystem en roll vid IBS?
 Bästa gastroenterolog (GI) läkare i FL Uppdaterad [sep’19]
Bästa gastroenterolog (GI) läkare i FL Uppdaterad [sep’19]
 Varför bra kost hjälper ditt immunförsvar
Varför är det viktigt att ha ett hälsosamt immunförsvar? Ditt immunsystems primära funktion är att övervaka tecken på invasion eller fara och skydda dig från skadliga bakterier eller virus. Samtidig
Varför bra kost hjälper ditt immunförsvar
Varför är det viktigt att ha ett hälsosamt immunförsvar? Ditt immunsystems primära funktion är att övervaka tecken på invasion eller fara och skydda dig från skadliga bakterier eller virus. Samtidig
 Vridning av cystor på äggstockarna - Diagnos av akut buk
De överlindade cystor på äggstockar är, som vi vet, observeras ofta, och inte bara i praktiken av särskilt gynekologiska medicinska institutioner, utan också i varje helkirurgisk medicinsk institution
Vridning av cystor på äggstockarna - Diagnos av akut buk
De överlindade cystor på äggstockar är, som vi vet, observeras ofta, och inte bara i praktiken av särskilt gynekologiska medicinska institutioner, utan också i varje helkirurgisk medicinsk institution
 Migration påverkar tarmmikrobioter som i sin tur påverkar hälsofyndforskare
Människans tarm innehåller biljoner hjälpsamma och vänliga bakterier som utgör mikrobiomet. Dessa mikrober har visat sig ha stor inflytande på mänskliga förhållanden inklusive allmän hälsa till mental
Migration påverkar tarmmikrobioter som i sin tur påverkar hälsofyndforskare
Människans tarm innehåller biljoner hjälpsamma och vänliga bakterier som utgör mikrobiomet. Dessa mikrober har visat sig ha stor inflytande på mänskliga förhållanden inklusive allmän hälsa till mental