Ett nytt papper i tidningen Liv presenterar en tidig översyn av de virala faktorerna som är inblandade i initiering och verkan av apoptos i infekterade celler.
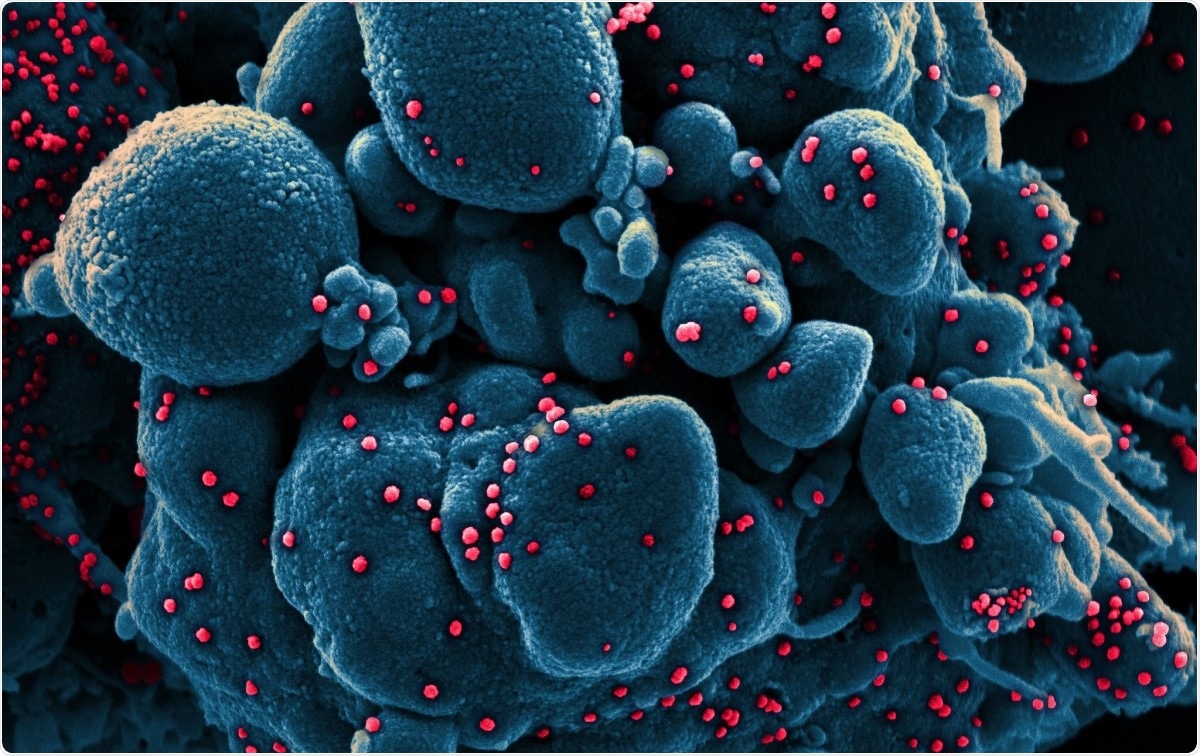 Färgad skanningselektronmikrograf av en apoptotisk cell (blå) infekterad med SARS-COV-2-viruspartiklar (röd), isolerat från ett patientprov. Bilden togs vid NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Bildkredit:NIAID / Flickr
Färgad skanningselektronmikrograf av en apoptotisk cell (blå) infekterad med SARS-COV-2-viruspartiklar (röd), isolerat från ett patientprov. Bilden togs vid NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Bildkredit:NIAID / Flickr Coronavirus är ett av de största ribonukleinsyravirus (RNA) som hittills har identifierats. Deras genom är cirka 30 kb långt, med fyra strukturproteiner, och flera icke-strukturella och tillbehörsproteiner. De klassificeras i alfa, beta, gamma- och delta -coronavirus.
Flera djur- och mänskliga coronavirus har hittills isolerats och orsakar mestadels luftvägs- eller mag -tarminfektioner. Liksom andra virus, de kapar värdcellsmaskineriet i alla skeden av deras replikering. Detta innebär att modifiera uttrycket av olika värdgener, inklusive de som kodar värdförsvar för att underlätta viral replikation.
Nyligen, studier har visat att tidigt i infektionen, coronavirus förändrar cellmetabolismen och ökar graden av celldöd. Detta inträffar innan adaptiv immunitet utlöses, och detta kan indikera dess roll i produktiv virusinfektion.
Två av de viktigaste processerna som är involverade i denna modulering är apoptos och cellcykelmodifiering. Apoptos utlöses av ett antal signalvägar. Apoptos kan minska virusutbredning, men den motsatta effekten kan också inträffa - frisläppandet av de infektiösa nyproducerade viruspartiklarna under lytisk infektion.
Cellvägarna som aktiverar apoptos kan triggas direkt av själva virusinfektionen eller indirekt via andra signalkaskader. Det senare motverkas av närvaron av viruset och rekryterar immunceller till infektionsstället. Sluthändelsen är apoptos, orsakar betydande skador på vävnaderna vid lytisk infektion.
De virala komponenterna i cellen kallas patogenassocierade molekylära mönster (PAMP) och känns igen av mönsterigenkänningsreceptorer (PRR). Dessa svarar genom att aktivera cytokiner och andra signalmolekyler som uppreglerar interferongenexpression.
En annan försvarsmekanism innefattar igenkänning av viral nukleinsyra av värdproteiner som associerar, som PRR, med adapterproteiner för att aktivera två viktiga transkriptionsfaktorer, nämligen, NFĸB och IFN reglerande faktor 3 (IRF3). Dessa translokeras till kärnan och ökar uttrycket av typ I -interferoner (IFN).
Dessa binder till IFN-α/β-receptor (IFNAR), i tur och ordning, starta ett system av signaler som involverar Janus kinas/signalomvandlare och aktiverare av transkriptionsvägen (JAK/STAT). Resultatet är uppreglering av flera IFN-stimulerade gener (ISG).
Dessa gener inaktiverar processen som är involverad i syntesen av cellproteiner och inducerar därmed celldöd. En annan ISG som är en spelare i denna process för att stänga av översättning är kombinationen av 2 ′, 5′-oligoadenylatsyntetas (OAS) och RNas L.
Apoptos regleras av flera pro- och anti-apoptotiska proteiner i värdcellen. En sådan proteinfamilj är familjen Bcl-2 (B-celllymfom-2), inklusive faktorer som orsakar poring av mitokondriemembranet och eventuell aktivering av caspasenzymer, initierar apoptos. Andra skyddar mot apoptos.
En annan familj är mitogenaktiverade proteinkinaser (MAPK), som inkluderar extracellulärt reglerat kinas 1/2 (ERK1/2), ERK5, p38, och c-Jun N-terminal kinaser (JNK). Den första uppregleras av tillväxtfaktorer och mitogener, de två sista genom cellstress. JNK-vägen kan leda till aktivering av pro-apoptotiska gener eller kan interagera med Bcl-2-gener för att göra det, eller kan aktivera andra transkriptionsfaktorer som 53 och p73.
Två vägar för apoptos har identifierats, det yttre och det inre. Den förra förmedlas genom aktivering av dödligander (FasL, TNF) om deras interaktion med sina respektive dödsreceptorer (DR). Caspase-8 är en viktig inducerare av apoptos i animaliska coronavirus som verkar via DR. Detta enzym, när den är aktiverad, klyver bud, ett Bcl2 -protein, vilket leder till frisläppande av mitokondriellt cytokrom c. Det senare är nyckeln till bildandet av apoptosomen med klyvning och aktivering av caspas 9.
Den inneboende vägen är baserad på permeabilisering av mitokondriella yttre membran och ses främst med djurkoronavirus. Bcl2-proteiner som Bax och Bak gynnar apoptos och krävs för att utlösa denna process via den inneboende eller mitokondriemedierade vägen, tillsammans med caspase-9.
Många djurcoronavirus orsakar aktivering av både yttre och inre vägar, visar det invecklade nätverket av signalvägar som är involverade i apoptos.
Virala genomer kodar ofta för gener som är homologa för att vara värd för anti-apoptotiska proteiner. Detta gör att de kan fördröja apoptos i de tidiga stadierna av infektionen och därmed generera ett adekvat utbyte av nya virioner. Andra virala proteiner kan förhindra transkription av vissa apoptotiska gener eller orsaka modifiering av deras proteinprodukter, att undertrycka deras aktivitet.
Induktion av apoptos av virala proteiner kan innebära avslutning av cap-beroende translation i värdceller, inducerar apoptos, som sett med poliovirus. När det gäller hepatit C -virus, det virala NS3-proteinet interagerar med caspase-8, för att utlösa celldöd.
Den aktuella översynen är inriktad på att identifiera pro-apoptotiska mekanismer som utlöses av djurkoronavirus. Till exempel, Porcine Epidemic Diarrhea Virus (PEDV) utlöser förändringar i uttrycket av 14 gener som är involverade i kaspasoberoende apoptos för att främja dess replikation, liksom att producera de karakteristiska egenskaperna hos sjukdom.
Ett annat sätt på vilket apoptos är involverad i viral replikation är genom att aktivera caspas, som krävs för klyvningen av det virala nukleokapsid (N) -proteinet under denna process. Detta är fallet med det överförbara gastroenteritviruset (TGEV), som aktiverar MAPK -familjen, samt FasL- och mitokondrierinducerad apoptos. Denna process inkluderar också nedreglering av värdmikroRNA som undertrycker den mitokondriella apoptotiska vägen.
Betacoronavirus, såsom murint hepatitvirus (MHV), inducerar apoptos. Detta virus visar kuvertprotein (E) -inducerad apoptos, igen via caspase -aktivering. I detta fall, apoptos verkar vara skyddande mot virionproduktion.
Med svinhemagglutinerande encefalomyelitvirus (PHEV), celldöd medieras av DRs och de mitokondriemedierade vägarna, som involverar caspase-8 och caspase-9, som initiativtagare, och caspase-3, som en effektor av apoptos.
Liknande, gamma- och delta-coronaviruses visar komplex induktion av cellulära signalvägar i värdcellen, vilket leder till modulering av apoptos. Således, många virala proteiner modulerar värdcellsvägar för att främja viral replikation och sjukdomsfunktioner.
Det faktum att apoptos inträffar efter infektion av flera värdar av en rad koronavirus leder till slutsatsen att det är ett vanligt inslag i infektion av mänskliga och animaliska koronavirus och syftar till att gynna förökning.
Med det tidigare allvarliga akuta respiratoriska syndromet coronavirus (SARS-CoV), 7a-proteinet bildar ett komplex med Bcl-XL-protein eller andra överlevnadsfaktorer, inaktivera dem och därmed tillåta apoptos att fortsätta via caspase-3-aktivering. Det 3CL-liknande proteaset (3CLpro) aktiverar också både caspas-3 och caspas-9 för att inducera apoptos i cellodling.
Både SARS-CoV och de för närvarande cirkulerande SARS-CoV-2-virusen har ORF3a-proteinet som utlöser celldöd via kaspasaktivering i den yttre vägen genom DR.
En liknande roll har ännu inte visats för virala proteiner i djurinfektioner med coronavirus. Dock, med PEDV, S1 -subenheten av spikproteinet, och det icke-strukturella proteinet 1 (NSP1), har föreslagits vara initiativtagare och effektor av celldöd, respektive, baserat på senaste experiment.
Fler studier kan hjälpa till att förstå hur dessa vägar fungerar i andra coronavirus. Det nuvarande kunskapsläget kan indikera nyttan av att rikta in denna väg för att hantera coronavirusinfektioner.
 Studie tyder på koppling mellan probiotisk användning och "hjärntimmighet"
Studie tyder på koppling mellan probiotisk användning och "hjärntimmighet"
 Svampar och bakterier i tarmen kan också påverka människors hälsa och sjukdomens svårighetsgrad
Svampar och bakterier i tarmen kan också påverka människors hälsa och sjukdomens svårighetsgrad
 Ny strategi kan stärka tarm-hjärnkommunikation
Ny strategi kan stärka tarm-hjärnkommunikation
 Bakterier i födelsekanalen kopplade till lägre risk för äggstockscancer
Bakterier i födelsekanalen kopplade till lägre risk för äggstockscancer
 Länder med äldre befolkningar har högre SARS-CoV-2-infektioner och dödsfall,
Länder med äldre befolkningar har högre SARS-CoV-2-infektioner och dödsfall,
 Genetisk risk för autoimmunitet kan vara kopplad till skillnader i tarmmikrobiom
Genetisk risk för autoimmunitet kan vara kopplad till skillnader i tarmmikrobiom
 Organchips -teknik förbättrar studier av tarmen för personlig medicin
Forskare har utvecklat tekniken för orgelchips med hjälp av donatorhärledda tarmceller som ger fördelar jämfört med organoider och ger nya möjligheter för personlig medicin. Inuti tarmen
Organchips -teknik förbättrar studier av tarmen för personlig medicin
Forskare har utvecklat tekniken för orgelchips med hjälp av donatorhärledda tarmceller som ger fördelar jämfört med organoider och ger nya möjligheter för personlig medicin. Inuti tarmen
 Forskare utvecklar 3D -tryckt piller som provar bakterier som finns i tarmen
Tarmmikrobiomet består av biljoner levande mikrober, och mer än tusen bakteriearter. Det har varit känt att tarmen spelar en viktig roll för kroppens hälsa. Ett team av universitetsingenjörer kan ha u
Forskare utvecklar 3D -tryckt piller som provar bakterier som finns i tarmen
Tarmmikrobiomet består av biljoner levande mikrober, och mer än tusen bakteriearter. Det har varit känt att tarmen spelar en viktig roll för kroppens hälsa. Ett team av universitetsingenjörer kan ha u
 Läckande tarm och mikrobiell dysbios kan bidra till cytokinstorm i allvarligt sjuka COVID-19-fall
När världen närmar sig den dystra milstolpen med tre miljoner dödsfall av covid-19-sjukdom, ett nytt förtryck forskningspapper publicerat på bioRxiv * servern visar att förekomsten av tarmbakterier
Läckande tarm och mikrobiell dysbios kan bidra till cytokinstorm i allvarligt sjuka COVID-19-fall
När världen närmar sig den dystra milstolpen med tre miljoner dödsfall av covid-19-sjukdom, ett nytt förtryck forskningspapper publicerat på bioRxiv * servern visar att förekomsten av tarmbakterier