Ændringer af E-cadherin og β-catenin i gastrisk cancer
Abstract
Baggrund
E-cadherin-cateninkomplekset spiller en afgørende rolle i epitelcelle-celleadhæsion og i opretholdelsen af væv arkitektur. Forstyrrelse i udtrykket eller funktionen af denne komplekse resultater i tab af intercellulære vedhæftning, med mulig deraf følgende celletransformation og tumor progression.
Metoder
Vi studerede de ændringer af E-cadherin og β-catenin i et sæt af 50 primære gastriske tumorer ved hjælp af tab af heterozygositet (LOH) analyse, genmutation screening, detektion af afvigende udskrifter og immunhistokemi (IHC). Search Results
En høj frekvens (75%) af LOH blev påvist ved 16q22.1 indeholdende E -cadherin locus. Tre sager (6%) viste identiske missense mutation, A592T. Denne mutation er ikke forventes at bidrage stærkt til carcinogenese af gastrisk kræft, fordi en lav frekvens (1,6%) i denne mutation også blev fundet i 187 normale individer. Vi har registreret også en lav frekvens (0,36%, 0%) af denne mutation i 280 brysttumorer og 444 andre tumorer, herunder colon og rectum, lunge, endometrium, ovarie, testikel, nyre, thyroid carcinomer og sarcomer hhv. Vi analyserede også de afvigende E-cadherin mRNA'er i det gastriske tumorer og fandt, at 7 tumorer (18%) havde afvigende mRNA'er ud over den normale mRNA. Disse afvigende mRNA'er kan producere unormale E-cadherin molekyler, hvilket resulterer i svag celle-celle-adhæsion og invasive opførsel af carcinomceller. Reduceret ekspression af E-cadherin og β-catenin blev identificeret ved frekvensen 42% og 28%, hhv. Specielt, 11 tumorer (22%) udviste positiv cytoplasmatisk farvning for β-catenin IHC. En association blev fundet mellem reduceret ekspression af E-cadherin og β-catenin. Desuden blev en associering detekteret mellem reduceret ekspression af E-cadherin og diffus histotype.
Konklusion
Vores resultater understøtter den hypotese, at ændringer af E-cadherin og β-catenin spille en rolle i initiering og progression af mavekræft .
Baggrund
E-cadherin (120 kDa; kromosom 16q) er et klassisk cadherin og danner nøglen funktionelle komponent af compliance forbindelser mellem epithelceller [1]. Det er bundet via en række underulds proteiner, de catenins (α, p og y) til actincytoskelettet [1]. Denne kobling mellem transmembrane cadheriner og actinfilamenter i cytoskelettet er nødvendig for at danne en stærk celle-celle-adhæsion. Et intakt E-cadherin - cateninkomplekset er nødvendig for opretholdelse af normal intercellulær adhæsion. I lyset af dette har adskillige grupper foreslået, at i carcinomer, E-cadherin fungerer som en invasion suppressor-molekyle, således at dets tab tillader eller forstærker invasionen af tilgrænsende normale væv. Immunohistokemiske undersøgelser i humane kræftformer, herunder gastrisk kræft, ofte har vist, at en del af de invasive karcinomer og karcinomer in situ
vise afvigende niveauer af E-cadherin og /eller catenin udtryk i forhold til deres relaterede normale væv [2-4] . Generelt E-cadherin og catenin farvning er stærk i godt differentierede kræftformer, der opretholder deres celle klæbeevne og er mindre invasive, men er reduceret i dårligt-opdelte tumorer, der har mistet deres celle-celle-adhæsion og vise stærk invasiv adfærd [2, 3].
E-cadherin er involveret i kontakt inhibering af cellevækst ved at inducere cellecyklusstandsning [5]. Det har evnen til at inhibere celleproliferation med opregulering af p27 er involveret i cellecyklusregulering [5], selv om den mekanisme, hvormed E-cadherin regulerer p27 er stadig uklar. Derfor, E-cadherin, generelt beskrives som en invasion suppressor [6], kan optræde som en stor vækst /proliferation lyddæmper.
En vigtig funktion af β-catenin i cellesignalering, er blevet klarlagt [7]. I mangel af en mitotisk signal fra uden for cellen, er β-catenin afsondret i et kompleks med adenomatøs polypose coli (APC) -gen produkt, en serin threonin glycogensyntetase kinase (GSK-3β) og en adapter protein axin (eller en homolog conductin), muliggør phosphorylering og nedbrydning af fri β-catenin ved ubiquitin-proteasom systemet [8]. Når en mitotisk signal leveres af Wnt-vejen, ved association af Wg /Wnt familie af udskilte glycoproteiner og deres membranreceptor Frizzled, fører det til aktivering af pjusket (Dsh) protein, der rekrutteres til cellemembranen. Den aktiverede Dsh nedregulerer proteinkomplekset, således at den ikke længere kan phosphorylere β-catenin, som derefter ikke nedbrydes. Frigivelsen af β-catenin fra phosphorylering og nedbrydning kompleks fremmer stabilisering β-catenin og signalering. Dette resulterer i en forøgelse af frit cystolic β-catenin som translokerer til kernen og binder direkte transskriptionsfaktorerne Lef og Tcf, der fører til aktivering af genekspression. Derfor β-catenin udfører særskilte funktioner i E-cadherin-medieret celle-celle-adhæsion og i Wnt signalering [8].
Tab af E-cadherin locus på den lange arm af kromosom 16 (16q22) forekommer i gastrisk (24 %), hepatocellulære (50%), luftrør bryst (50-100%) og øsofageal (66%) carcinomer [4, 9-12]. Der har været adskillige rapporter om E-cadherin genmutationer i humane cancere [13]. I dårligt-opdelte tumorer, såsom luftrør brystkræft og diffus type mavekræft, E-cadherin mutationer spiller en vigtig rolle i tumor udvikling [14, 15]. Flere undersøgelser har rapporteret kimlinie mutationer i E-cadherin gen i familier med en nedarvet diffus type mavekræft [16, 17]. Kun kan forklares et mindretal af gastrisk kræft for via e-cadherin mutationer. Hyppige somatiske mutationer af β-catenin-genet er blevet fundet i små kolorektale adenomer og intestinal type, gastrisk cancer [18, 19]. De fleste af mutationerne involverede tabet af seriner eller threoniner fra GSK-3β phosphorylering region. Genetiske ændringer i β-catenin afskaffelse celle-celle klæbeevne er blevet observeret i to gastriske cancer cellelinjer, HSC39 og 40A; både skyldes samme signetring cellecarcinom i maven og viser en diffus vækstmønster [20, 21]. Denne mutation resulterer i en afkortet β-catenin, der mangler regionen for interaktion med β-catenin. Transfektion af disse cellelinjer med vildtype-β-catenin genskaber cellulære klæbeevne [21].
Her udførte vi E-cadherin og beta-catenin genmutation og ekspressionsanalyse i en serie af 50 primære gastriske tumorer for at forstå bedre inddragelse af ændringer af E-cadherin og β-catenin i carcinogenese af mavekræft.
Materialer og metoder
prøver
Inkluderet i undersøgelsen var 50 tumorer og tilsvarende normale prøver, hvoraf to tumorer (17 og 23) var fra samme familie, resten sporadiske (tabel 1). Disse sager blev diagnosticeret ved Patologisk Institut, University Hospital of Iceland. Væv blev opnået frisk på dagen for kirurgi eller fra paraffinindlejret materiale. Oplysninger om tumor scenen, histotype og kvalitet blev også erhvervet fra den samme afdeling. DNA for PCR blev isoleret ved proteinase K-behandling [22]. RNA til RT-PCR blev ekstraheret ved anvendelse Tri Reagent (Molecular Research Center, INC., USA). For A592T mutationen, screenede vi 187 normale individer, 280 bryst og 444 andre cancerpatienter med colon og rectum, lunge, endometrium, ovarie, testikel, nyre, thyroid carcinomer og sarkomer. Alle individuelle id'er blev fjernet fra kontrolprøverne før analyse, og efterforskerne blev således blindet til identifikation af prøver, der ikke længere kan spores til bestemte personer. Samtykke blev formodet til patientprøver. For sager 294 og 728 med A592T mutationen, vi analyserede deres stamtavler og fandt, at der ikke var andre kræfttilfælde i stamtavle tilfælde 294, men der var andre 5 kræfttilfælde i stamtavlen af sagen 728, herunder 2 prostatakræft, en hud cancer, 1 lungekræft og 1 cancer uklar origin.Table 1 Resumé af ændringer af E-cadherin og β-catenin i en serie af 50 gastriske tumorer.
Tumour
Stage
Type
Grade
LOH
E-cad genmutationer
Aberrant mRNA
E-cad
β-cat
Sample
|
| dele på 16q22.1
og polymorfier
af E-cad
IHC
IHC
1
T3N3
diff
+
IVS1+6T→C
-
+/-
++/-∇
3
T3N1
squ
G1
+
IVS4+10C→G
ND
-
+/-
17
T3N1
diff
ND
GTG (Val) → GTC (Val) ved cd832
ND -
-
23
opfyldt
+
GCC (Ala) → ACC (Thr ) ved cd592 *
ND
+++ /-
+++ /-
43
T3N2
diff
+ -
-
-
+++ /-
50
T3N1
diff
-
IVS1+6T→C
-
++/-
++/-
165
T3N1
int
G3
ND
-
-
+++/-
+++/-∇
174
T3N2
int
G3
-
-
ND
+++/-
++/-
193
T3N2
int
G3
+
-
ND
-/+++
-/++
200
T3N1
int
G2
-
IVS4+10C→G
-
++/-
+++/-
231
T3N0
mi
G3
+
-
-
++/-
++/-∇
283
T3N0
int
G3
ND
-
ND
++/-
++/-
287
T3N1
int
G2
+
-
-
-/+
++/-
294
T3N1M1
mi
G4
+
GCC(Ala)→ACC(Thr) på cd592♦
-
++/-
++/-∇
304
T3N3
int
G2
-
-
-
-/+++
+/-
308
T3N1
int
G2
+
-
-
+++/-
++/-
314
T3N1
diff
-
CAC (His) → CAT (His) ved cd632 -
+++ /-
++ /- ∇
GGC (Gly) → GGT (Gly) på cd865
360
T2N1
int
G3
+
IVS4 + 10C → G
+ ♣
++ /-
+/-
369
mødte
+
-
+♣
+++/-
++/-
433
T3N1
mi
G3
-
IVS4+10C→G
-
-/++
-/+
435
T2N0
int
G3
+
-
-
-/+++
-/++
443
T2N0
int
G4
-
-
-
+++/-
+++/-
451
T4N0
int
G2
ND
-
ND
+++/-
++/-
474
T3N1
int
G3
ND
-
ND
-
+/-
493
T3N1
int
G3
+
-
-
-/+++
+/-
503
T3N1
int
G3
ND
-
-
-
+++/-
556
T3N2
int
G2
-
IVS1+6T→C
ND
++/-
+/-
5'UTR-71C → G
568
T3N2
mi
G3
+
-
+♣
++/-
++/-
612
T3N0
int
G2
ND
IVS4+10C→G
-
+++/-
+/-
AAC (Asn) → AAT (Asn) ved cd751
636
T3N1
diff
+
IVS4+10C→G
ND
+++/-
+++/-∇
650
T2N0M1
int
G2
+
-
ND
-/+
++/-
675
T2N0
mi
G3
+
IVS4+10C→G
-
+/-
++/-∇
676
T3N1
int
G2
+
-
-
+++/-
-∇
680
T3N1
mi
G3
+
IVS1+6T→C
-
++/-
++/-
AAC (Asn) → AAT (Asn) ved cd751
694
T3N1
int
G1
+
-
-
+++/-
+++/-
717
T3N1
int
G3
+
-
+♣
-/+++
+++/-
726
T2N1
int
G2
+
IVS4+10C→G
-
-/+++
++/-
728
T3N0
int
G2
+
GCC(Ala)→ACC(Thr) på cd592♦
-
-/+++
++/-
729
T3N1
int
G1
-
IVS1+6T→C
-
-/+++
+++/-
732
T2N1
int
G3
+
-
-
-/+++
+++/-
735
T4N3
diff
ND
AAC (Asn) → AAT (Asn) ved cd751 -
+++ /-
+++ /- ∇
738
T3N2
diff
+ -
- -
-∇
750
mødtes
ND
AAC (Asn) → AAT (Asn) ved cd751
+♣
++/-
+++/-
755
T2N1
int
G2
ND
-
+♥
+++/-
++/-
808
T3N0
int
G1
+
ACG(Thr)→ACA(Thr) på cd251
+♠
+++/-
++/-
811
T2N1
int
G2
+
-
-
+++/-
-/+
832
T3N2
int
G2
+
-
-
+++/-
+++/-∇
855
T3N2
int
G2
+
-
-
+++/-
+++/-
875
T3N2
int
G2
-
IVS4+10C→G
ND
+++/-
+++/-
904
T2N0
int
G3
+
IVS4+10C→G
-
-/+++
++/-
Useful
30
3
7
21
14
Total
40
50
38
50
50
%
75
6
18
42
28
T, tumor (størrelse og invasivitet); N, knudepunkt (grad af metastase); M, metastaser; G1, godt differentieret; G2, moderat differentieret; G3, dårligt differentieret; G4, ikke differentieret; diff, diffus (grad af differentiering = G4); mi, blandet; int, tarm; opfyldt, metastatisk tumor sandsynligvis fra mave tumor; SQU, squamous epithelial; LOH, tab af heterozygositet; E-cad, E-cadherin; β-kat, β-catenin; IHC, immunhistokemi; cd, codon; UTR, utranslateret region; +, Positive LOH, afvigende E-cad-mRNA, E-cad og β-cat IHC -, negativ LOH, E-cadherin genmutation, afvigende E-cad-mRNA, E-cad og β-cat IHC; ND, ikke bestemt eller ikke gjort; +/-, ++ /- Og +++ /-, mere end 50% celler positive; - /+, - /++ Og - /+++, mere end 50% celler negativ; *, Somatisk mutation; ♦, kimcellelinje mutation; ♣, insertion af intron 7 mellem exonerne 7 og 8, stop codon 374; ♥, sletning af sidste 72 baser af exon 7, exon 8 og de første 124 baser af exon 9, stop codon 322; ♠, sletning af exon 8 og 9; sletning af sidste 84 baser i exon 8, stop codon 358; ∇, disse prøver viste også cytoplasmatisk farvning for β-catenin IHC
LOH bestemmelse
mikrosatellitmarkører anvendes til LOH analyse af kromosom 16q var:. D16S503, D16S496, D16S421, D16S545 og D16S512 for regionen 16q22.1 indeholder E -cadherin locus (Genome Database). De polymerasekædereaktion (PCR) produkter blev separeret i en acrylamid sekventering-gel og overført til en positivt ladet nylonmembran, Hybond-N + (Amersham, Aylesbury, UK) og bages i mindst 2 timer ved 80 ° C. Den ikke-radioaktive påvisning metode anvendt til at visualisere PCR-produkterne har tidligere [23] blevet beskrevet. Autoradiogrammer blev inspiceret visuelt med mindst to korrekturlæsere, der sammenligner intensiteten af alleler fra normale og tumor-DNA. Fraværet eller et signifikant fald i én allel i tumoren sammenlignet med den normale referenceprøve blev betragtet som LOH.
Mutation screening
Alle 16 exoner af E-cadherin genet og exon 3 af β-catenin-genet blev screenet for inaktivering mutationer med PCR-SSCP (enkelt konformationspolymorfisme) analyse på genomiske DNA-templates. Primerne til E-cadherin og β-catenin, der anvendes i SSCP-analyse blev beskrevet i vores tidligere artikel [4] og Park et al. [1999] henholdsvis og bestilt fra Pharmacia Biotech eller TAG Copenhagen A /S. Genomisk DNA blev anvendt ved 30 ng pr 25 pi reaktionsblanding indeholdende 5 pmol fremad- og revers-primere, 2,5 nmol af hver dNTP, 0,5 enheder af DyNAzyme polymerase. Prøverne blev amplificeret i 35 cykler bestående af 30 s denaturering ved 94 ° C, 30 s annealing ved 55-70 ° C, og endelig 60 sekunders forlængelse ved 72 ° C. En varm start blev anvendt ved at tilsætte enzymet i første cyklus på omkring 70 ° C, efter en præinkubation på 5 min ved 94 ° C. En 4 pi alikvot af PCR-produkter blev blandet med 7 pi formamid farvestof (95% formamid, 0,05% bromphenolblåt og 0,05% xylencyanol), denatureret ved 94 ° C i 10 minutter og snapcooled på is. Alikvoter på 2 pi blev analyseret samtidigt på to ikke-denaturerende polyacrylamidgeler (5% acrylamid med 2% tværbinding), enten indeholdende 5% glycerol eller mangler glycerol. Elektroforese blev udført i 1 x TBE om vertikale geler på 6w natten over eller i 6 timer ved stuetemperatur. PCR-produkterne blev visualiseret som mikrosatellitmarkører. Prøver med unormale mobilitet bånd blev amplificeret igen i 35 cykler som beskrevet ovenfor. En 5 pi alikvot af PCR-produkter blev derefter inkuberet med 10 U exonulease I og 2 U reje-alkalisk phosphatase til fjernelse af for store primere og dNTP'er (US70995, Amersham). Sekvenser af begge strenge blev bestemt ved termo Sequenase DNA-polymerase (Thermo Sequenase Radiomærket Terminator Cycle Sequencing Kit, Amersham) ved anvendelse af de to oprindelige PCR-primere. Vi udførte A592T mutationen analyse på de kræftformer, undtagen cancer uklar oprindelse, i familien af sag 728 under anvendelse direkte sekventering.
Aberrant mRNA screening
1-5 ug af det totale RNA blev omvendt transkriberet til cDNA under anvendelse af første streng cDNA syntesekit (Amersham Pharmacia Biotech). Alle prøver blev undersøgt for E-cadherin cDNA deletioner og insertioner. E-cadherin cDNA blev amplificeret under anvendelse af primerparrene EX7-REX10 /2 og Ex9 /2a-rEx11 for regionen exonerne 7-10 koder calcium bindingssteder [24]. PCR-produkter blev visualiseret ved agarosegelelektroforese. Unormale fragmenter blev skåret ud og sekventeret ved hjælp frem og bak primere til at bestemme grænserne for de sletninger og indsættelser. Her anvendte vi BigDye Terminator Cycle Sequencing Ready Reaction Kit (Perkin-Elmer, Foster City, CA) og automatisk sekventeringsapparat ABI PRISM ™ 3100 (Perkin-Elmer) til sekventering
Immunohistokemisk farvning
Immunhistokemi for E-cadherin og β catenin blev udført på 5-um snit fra paraffinindlejrede tumor- vævsblokke med monoklonale antistoffer E-cadherin 5H9 og gede-anti-catenin Beta (Research Diagnostic, Inc. NJ, USA), henholdsvis anvendelse af antigenet hentning protokollen beskrevet af Hazelbag et al. [1995]. Tumorer blev gradueret af intensiteten af farvning som negativ (-), svagt positive (+), moderat positiv (++) og stærkt positive (+++)
Statistisk analyse
A Χ 2 test eller. Fishers eksakte test blev anvendt til at vurdere forholdet mellem de ovennævnte parametre.
Resultater
hyppigheden af LOH på 16q22.1 regionen var 75% (tabel 1).
Tre tumorer (6%) viste den samme missense mutation A592T af exon 12, hvoraf 2 sager havde kimcellelinje mutation, og ét tilfælde havde somatiske mutation. Information til detekterede polymorfier blev inkluderet i tabel 1. Tre af 187 (1,6%) normale individer og 1 ud af 280 (0,36%) brysttumorer viste denne kimcellelinje mutation. Mutationen blev ikke fundet i 444 andre tumorer (tabel 2) .table 2 Hyppigheden af A592T missense mutation i gastrisk kræft, andet kræft og normale individer
Variabler
A592T /total
%
mavekræft
3/50
6
Brystkræft
1/280
0,36
Andre kræft *
0/444
0
Normal befolkning
3/187
1,6
* herunder tyktarm og endetarm, lunger, endometrium, ovarie, testikel, nyre, thyreoidea carcinomer og sarkomer.
Derudover 3 af 280 brysttumorer viste endnu missense mutation GCC (Ala) → TCC (Ser) på identisk codon 592, hvoraf 2 tilfælde var kimcellelinje mutation; den tredje var uklart, fordi det normale væv var ikke tilgængelig. Den histologiske type af de 4 brysttumorer var duktal.
I familien af sagen 728, fandt vi, at patienten med hudkræft og en af patienter med prostatacancer viste den samme kimcellelinje mutation som case 728. Interessant, ingen mutationer blev påvist i tumoren prøver af disse to tilfælde. Sandsynligvis blev de muterede alleler tabt under tumorudvikling. Starten aldre for de tilfælde med germlinie mutationer i stamtavlen var 78 år for tilfælde 728, 73 år for hudkræft og 76 år for prostatakræft.
Vi har ikke afsløre mutation ved SSCP og DNA-sekventering i exon 3 den β-catenin-genet i 50 gastriske tumorer.
Syv gastriske tumorer viste afvigende transkripter af E-cadherin. Tumorer 360, 369, 568, 717 og 750 viste indsættelse af intron 7 mellem exon 7 og 8. Tumor 755 viste sletning af sidste 72 baser af exon 7, exon 8 og de første 124 baser af exon 9. Tumor 808 vises to afvigende mRNA, hvoraf en havde deletion af exon 8 og 9, og et tilfælde med deletion af sidste 84 baser af exon 8 (tabel 1).
Endelig udførte vi immunhistokemisk farvning af E-cadherin og β-catenin. En regional variation af farvning blev detekteret tværs tumorerne. De scoringer +/-, ++ /- og +++ /- se mere end 50% celler positive og scoringer - /+, - /++ og - /+++ angiver mere end 50% celler negative. Negativ (-) eller reduceres (- /+, - /++ - /+++ og +/-) ekspression af E-cadherin og β-catenin blev detekteret i 21/50 (42%) og 14/50 ( 28%) tilfælde, hhv. Desuden er der for β-catenin IHC, 11 tumorer viste også positiv cytoplasmatisk farvning (tabel 1). En signifikant sammenhæng blev fundet mellem negativ eller nedsat ekspression af E-cadherin og β-catenin (p = 0,048, Χ 2 test). Også vi fundet en sammenhæng mellem reduceret ekspression af E-cadherin og diffus histotype (p = 0,04, Fishers eksakte test).
Diskussion
høje frekvens af LOH på 16q22.1 regionen tyder stærkt på, at der er en eller flere tumorsuppressorgener i denne region, hvis tab kan udløse carcinogenese af gastrisk cancer. E-cadherin-genet er blevet kortlagt til kromosom 16q22.1 [26]. De reducerede ekspression og genmutationer ved E-cadherin i flere typer cancer, herunder mave- og luftrør brystcancer er blevet identificeret, hvilket viser, at E-cadherin genet er et tumorsuppressorgen [2-4], [13-17, 27] . I denne undersøgelse 3 tilfælde (6%) viste identiske missense mutation A592T. Calcium-bindende motiver beliggende i de ekstracellulære domæner 1-5 betragtes som det centrale element for funktionen af E-cadherin, da et syntetisk molekyle med en enkelt aminosyresubstitution i en calcium-bindende motiv viste ingen klæbeevne [28] . Også i human cellelinie MKN45 fra gastrisk cancer, som manglede stram celle-celle-adhæsion, blev en 4-amino-syre deletion findes på grænsen mellem exonerne 6 og 7, som blev anset for at ændre konformationen omkring den centrale calcium-bindende motiver og at afskaffe den klæbende egenskab af E-cadherin molekyler [29]. Den enkelt aminosyresubstitution i den foreliggende undersøgelse er beliggende inden for det femte ekstracellulære domæne af E-cadherin, hvor en calcium-bindende motiv kunne eksistere. Det er tænkeligt, derfor, at mutationerne i de tre tilfælde også ødelagt funktion af E-cadherin. Interessant, de tre tilfælde viste også LOH ved 16q22.1 indeholdende E-cadherin locus. Så det kan antages, at to genetiske hændelser resulterer i inaktivering af genet forekom i de to alleller af E-cadherin-genet hhv. Resultaterne ovenfor viste, at E-cadherin gen er et tumor-suppressor-gen, fordi det er i overensstemmelse med den klassiske to-hit teori for tumorsuppressorgener [30]. Tidligere undersøgelser i luftrør brystkræft støtter også denne udtalelse [4, 14]. I cellelinie nævnte MKN45 ovenfor (dårligt differentieret adenocarcinom) med svag celle-celle-adhæsion, blev påvist en 12 bp i ramme deletion af E-cadherin gen og tab af vildtype allelen [29]. Men denne cellelinie viste stadig stærk ekspression af mRNA'er og proteiner, hvilket antyder, at ikke kun reduceret ekspression, men også strukturelle abnormaliteter kan selv resultere i inaktivering af E-cadherin-medieret celleadhæsion-systemet [29]. Derfor kan en enkelt aminosyresubstitution fundet i denne undersøgelse forårsage strukturelle ændringer af E-cadherin og resultere i begrænset celle-celle-adhæsion, selv om to af tilfældene (23 og 294) viste tilstrækkelig proteinekspression.
Interessant samme sekvens variant af somatiske og kimlinie mutation blev fundet samtidigt i forskellige gastriske patienter. Case 23 med somatisk mutation havde en debut alder af 56 år, men sager 294 og 728 med germlinie mutation havde debut alderen 71 og 78 år, hhv. En forklaring på dette fænomen kunne være, at tab af anden allel af E-cadherin i tilfælde 23 indtraf meget tidligt, hvorved triggerring carcinogenese relativt tidligt i tilfælde 23. Men der er en anden mulighed, at denne mutation i tilfælde 23 spillede kun en rolle i udviklingen af tumoren, men ikke i indledningen, hvor andre genetiske begivenheder sandsynligvis kunne være ansvarlig for indledningen af mavekræft. Men sager 294 og 728 med kimcellelinje mutationer havde sen begyndelse alder. Dette kan skyldes, at inaktivering af en anden allel forekom meget sent. En artikel rapporterede, at de obligatoriske luftfartsselskaber med afstumpede mutationer i E-cadherin gen i deres 80'erne og 90'erne forblev upåvirket [31]. Derfor bør yderligere identifikation af genetiske og /eller miljømæssige modifikatorer, som kan forklare den variable alder debut udføres. Specielt, hvis 294 havde tre tumorer i maven, hvilket er i overensstemmelse med genetiske tumorer normalt er flere [30].
Frekvens (6%) af mutation A592T i 50 gastriske tumorer er næsten fire gange, at i normale befolkning , hvilket tyder igen at denne mutation faktisk bidraget til tumorigenese i en undergruppe af gastriske tumorer. Futhermore, 0,36% af brysttumorer, og ingen andre tumorer, viste identisk germlinie mutation, hvilket viser, at der kunne være en histologisk forskel for denne mutation i gastrisk cancer og andre cancer.
Kun to andre tilfælde udviste A592T mutationen i familien af tilfælde 728. Specielt blev denne mutation påvises kun i tilsvarende normale væv, men ikke i tumorvævet, hvilket antyder, at de muterede alleler blev tabt under tumorudvikling. Fra disse kan vi konkludere, at denne mutation ikke kan spille en rolle i tumorigenese af prostata og hudkræft, men det kunne være gastrisk cancer specifik.
Vi konkluderer, at A592T mutationen kan forøge levetiden risiko for at udvikle gastrisk cancer, men er klart en sekvens variant af lav penetrans. Vores resultater i to forskellige sekvens varianter i codon 592 (A592T og A592S), som germlinie og somatiske mutationer, tyder på, at denne codon er et hotspot for mutationer i tumor patogenese.
Den breakpoints for indsættelser af intron 7 og sletning af exons 8 og 9 er i splejsning sites, i overensstemmelse med "GU-AG" regel for mRNA splejsning. Det kan spekuleres, at disse ændringer ikke blev frembragt ved alternativ splejsning, eftersom ingen beviser for alternativ splejsning blev fundet inden for muse E-cadherin-genet [32] og ingen afvigende mRNA'er blev fundet i noncancerous væv. De mutationer ved splejsningssteder burde være ansvarlig for de ændringer af E-cadherin mRNA'er, selvom ingen mutationer blev fundet på DNA-niveau i denne undersøgelse, formentlig fordi SSCP anvendes til mutation screening har en lav effektivitet. Yderligere 2 sletninger viste breakpoints på ikke-splejsningssteder, hvis splejsning er ikke i overensstemmelse med "GU-AG" -reglen, hvilket muligvis indikerer, at en omlægning i genomisk niveau kan forårsage afvigende mRNA. Tidligere undersøgelser har vist at springe i exon 8 eller 9 i gastrisk cancer [24, 33]. Disse afvigelser kan resultere i E-cadheriner miste calcium-bindende motiver grund af mangel på exon 8 og 9, og trunkerede molekyler på grund af læserammeforskydningsmutationer forårsaget af insertioner og deletioner endelig letter spredning af carcinomceller.
Reduceret ekspression af E- cadherin og β-catenin er blevet fundet i nogle kræftformer herunder gastrisk cancer [8]. Heterogen eller ustabil udtryk for både E-cadherin og β-catenin tværs tumorerne blev fundet. Det er blevet påvist, at i 40% af adenocarcinomer E-cadherin niveauer blev rejst i deres intravaskulære tumor komponenter i forhold til deres ekstravaskulære rum [34]. En forklaring kan være, at indgangen til en carcinom i et intravaskulært rum er forbundet med en opregulering af E-cadherin ekspression, og at efterfølgende udkørsel ind ekstravaskulære væv er forbundet med nedregulering [35]. Da E-cadherin og β-catenin er de afgørende komponenter til dannelse celle-celleadhæsion kompleks, kan tab af dem resultere i afbrydelse af funktionen af komplekset, hvilket kan forårsage svag celle-celle-adhæsion og bibringe invasive egenskaber på en tumor . Endvidere reduceres celle-celle-adhæsion forbundet med tab af kontaktinhibering af proliferation, hvorved flygte fra vækstregulering signal endelig udløser carcinogenese af human cancer [8]. I denne undersøgelse blev en associering mellem abnorm ekspression af E-cadherin og β-catenin fundet, tyder på, at tabet af E-cadherin binding kan forårsage en omfordeling af β-catenin fra cellemembranen til cytoplasmaet. Den øgede frie β-catenin i cytoplasmaet kunne translokere til kernen og føre til aktivering af genekspression. Dette understøttes af resultaterne, at to tilfælde (676 og 738) viste negativ farvning i den indre overflade af membranen og positiv farvning i cytoplasmaet, samtidigt. Men andre 9 tumorer (tabel 1) viser moderat eller stærk farvning i membran udviste også positiv farvning i cytoplasmaet, hvilket antyder, at den normale nedbrydning af den frie β-catenin i cytoplasmaet inhiberes. Vi fandt også, en associering mellem abnorm ekspression af E-cadherin og diffus histotype, hvilket indikerer, at ændringer af E-cadherin kan spille en rolle i dårligt differentierede gastriske tumorer. Interessant nok har afvigende ekspression af E-cadherin og /eller de catenins blevet vist at være en uafhængig prognostisk markør for korte overlevelse i mavecancerpatienter [8]. Af særlig interesse er den konstatering, at E-cadherin er en uafhængig prædiktor for okkult lymfeknude og mikrometastase i knuder klassificeret som Ingen ved rutinemæssige histopatologiske metoder [8].
Konklusioner
Vores resultater understøtter, at ændringer af E-cadherin og β-catenin spille en rolle i initiering og progression af mavekræft. Ekspression af begge gener er reduceret i gastrisk cancer, men mekanismen for nedregulering er ikke klart. LOH, mutationer og ændringer i RNA splejsning kan forklare en del af nedregulering af E-cadherin i mavekræft.
Erklæringer
Tak
Dette arbejde blev støttet af Forskningsrådet islandsk, Islands Universitet Science Fund og den islandske Cancer Society.
konkurrerende interesser
Ingen erklæret
|  Gastroparese
Gastroparese definition og fakta Ved gastroparese holder musklerne i maven op med at virke. Gastroparese er en sygdom i mavemusklerne eller nerverne, der styrer musklerne, og som får musklerne til at
Gastroparese
Gastroparese definition og fakta Ved gastroparese holder musklerne i maven op med at virke. Gastroparese er en sygdom i mavemusklerne eller nerverne, der styrer musklerne, og som får musklerne til at
 resultater:8 ugers blodsukkerdiæt
Resultaterne er klar og de er spændende! Det er 8 uger siden jeg begyndte på 8-ugers blodsukkerdiæt af Dr Michael Mosley og jeg er begejstret for, hvad jeg har været i stand til at opnå på så kort en
resultater:8 ugers blodsukkerdiæt
Resultaterne er klar og de er spændende! Det er 8 uger siden jeg begyndte på 8-ugers blodsukkerdiæt af Dr Michael Mosley og jeg er begejstret for, hvad jeg har været i stand til at opnå på så kort en
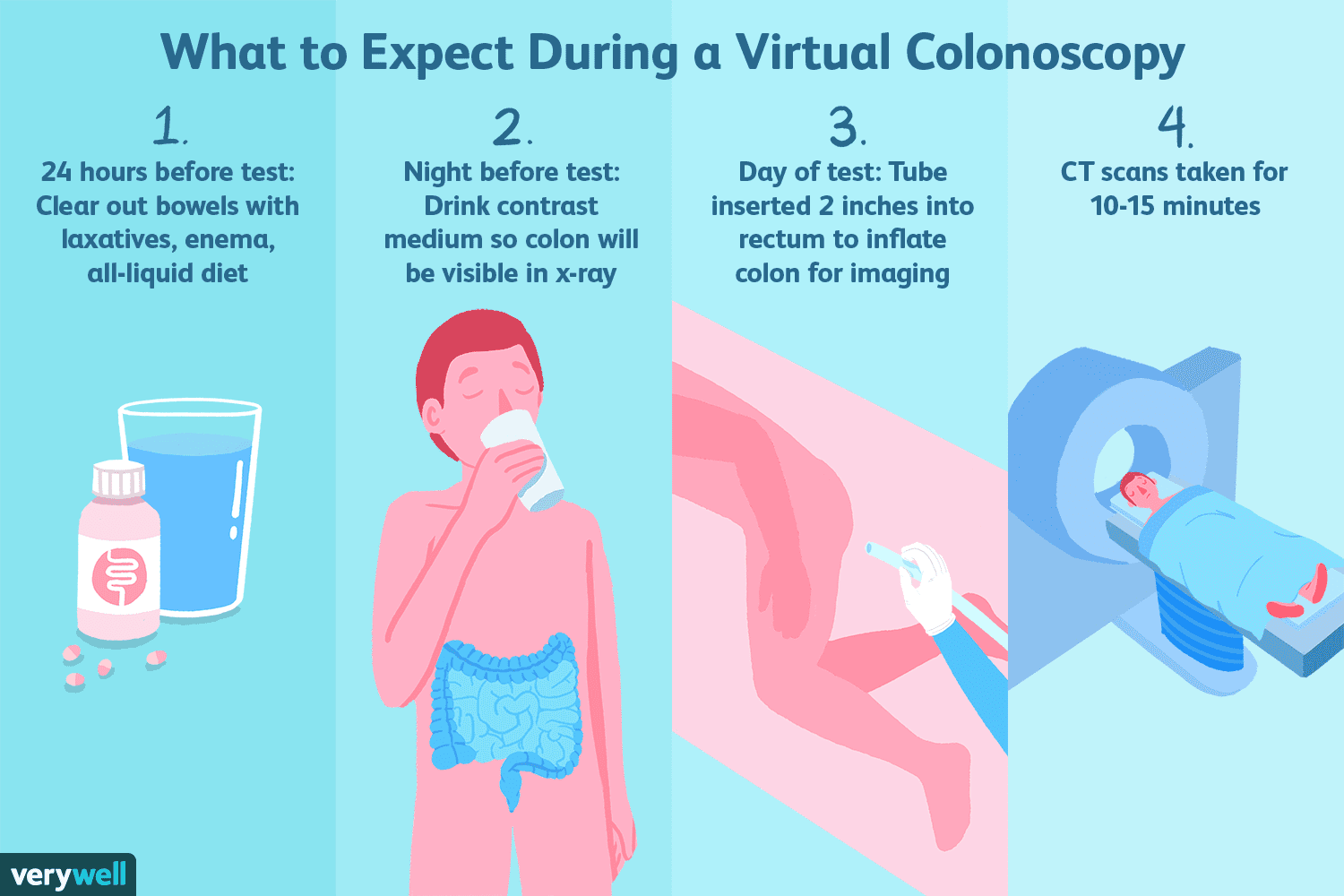 Hvad er en virtuel koloskopi?
En virtuel koloskopi, også kaldet CT-kolonografi, er en speciel type computertomografiskanning, der tilbydes som et alternativ til en konventionel koloskopi. Som en screeningstest for tyktarmskræft fo
Hvad er en virtuel koloskopi?
En virtuel koloskopi, også kaldet CT-kolonografi, er en speciel type computertomografiskanning, der tilbydes som et alternativ til en konventionel koloskopi. Som en screeningstest for tyktarmskræft fo