Opaganib ist ein Roman, Host-gezielt, duale antivirale und entzündungshemmende Prüfpille in fortgeschrittener klinischer Entwicklung zur Behandlung von schwerem COVID-19. Opaganib hat vor kurzem eine starke In-vitro-Hemmung der Beta- (südafrikanisch) und Gamma-(Brasilien)-Varianten gezeigt und basiert auf seinem einzigartigen, auf den Wirt gerichteten Mechanismus und den vorläufigen Ergebnissen dieser Studie, wir gehen davon aus, dass Opaganib seine Aktivität auch gegen neu auftretende Varianten beibehalten wird, einschließlich Delta und Delta Plus. Zuvor wurden auch positive Phase-2-Wirksamkeitsdaten aus den USA bekannt gegeben.
Neue Daten zeigen, dass Varianten in der Lage sind, die Wirkung von Impfstoffen zu umgehen. Dies bedroht nicht nur die Bemühungen zur Eindämmung der Pandemie, aber es rückt auch den dringenden Bedarf an wirksamen oralen COVID-19-Therapien, die trotz des Aufkommens von Varianten wirksam sind, in den Fokus. Dies macht den Abschluss dieser Studie noch bedeutsamer, angesichts seines Potenzials, die Behandlung von COVID-19 zu verändern. Wir können uns jetzt darauf konzentrieren, alle gesammelten Daten zu sammeln, bereinigt und in der Datenbank für die Analyse und das anschließende Reporting zusammengestellt. Das bedeutet, dass wir noch Wochen davon entfernt sind zu wissen, ob wir einer paradigmenwechselnden oralen Therapie für hospitalisierte COVID-19-Patienten einen großen Schritt näher gekommen sind."
Mark L. Levitt, MD, Ph.D., Medizinischer Leiter, RedHill Biopharma
Der primäre Endpunkt der globalen Phase 2/3 Studie, in 10 Ländern zugelassen, ist der Anteil der Patienten, die an Tag 14 Raumluft ohne Sauerstoffunterstützung atmen. Die Studie hat auch weitere wichtige Ergebnisparameter erfasst, wie die Zeit bis zur Entlassung aus dem Krankenhaus, Verbesserung gemäß der Weltgesundheitsorganisation Ordinal Scale for Clinical Improvement und Intubationsinzidenz und Mortalität.
Die Auswertungen der verblindeten Intubations- und Mortalitätsraten aus der Phase 2/3-Studie waren ermutigend im Vergleich zu den berichteten Mortalitätsraten aus großen Plattformstudien wie RECOVERY, und andere Studien an ähnlichen Patientenpopulationen. Außerdem, Vier unabhängige DSMB-Empfehlungen zur Fortsetzung der Studie wurden nach drei nicht verblindeten Sicherheitsüberprüfungen und einer nicht verblindeten Nutzbarkeitsanalyse erhalten. Zusätzlich, In Israel und in der Schweiz wurden Erfahrungen mit der Förderung der Anwendung von Opaganib im Rahmen der Ausnahmeregelung für den „Compassionate-Use“ gemacht.
Das Unternehmen unterhält laufende Gespräche mit der FDA, EMA und andere Aufsichtsbehörden, über mögliche Zulassungswege, mit den nächsten Schritten, die sich an den Studienergebnissen orientieren. Darüber hinaus laufen Gespräche mit potenziellen Partnern, die an den Rechten an Opaganib in verschiedenen Ländern interessiert sind.
 Entwickeln Frauen häufiger langes COVID?
Entwickeln Frauen häufiger langes COVID?
 Spezifische Kohlenhydrat-Diät im Rampenlicht:Susan „The SCD Girl“
Spezifische Kohlenhydrat-Diät im Rampenlicht:Susan „The SCD Girl“
 Gesunde Ernährung, gesunder Darm
Gesunde Ernährung, gesunder Darm
 Schwächt Morbus Crohn Ihr Immunsystem?
Schwächt Morbus Crohn Ihr Immunsystem?
 Was ist ein perianaler Abszess?
Was ist ein perianaler Abszess?
 Leistungsstarke neue Forschungsergebnisse, dass die spezifische Kohlenhydratdiät funktioniert
Leistungsstarke neue Forschungsergebnisse, dass die spezifische Kohlenhydratdiät funktioniert
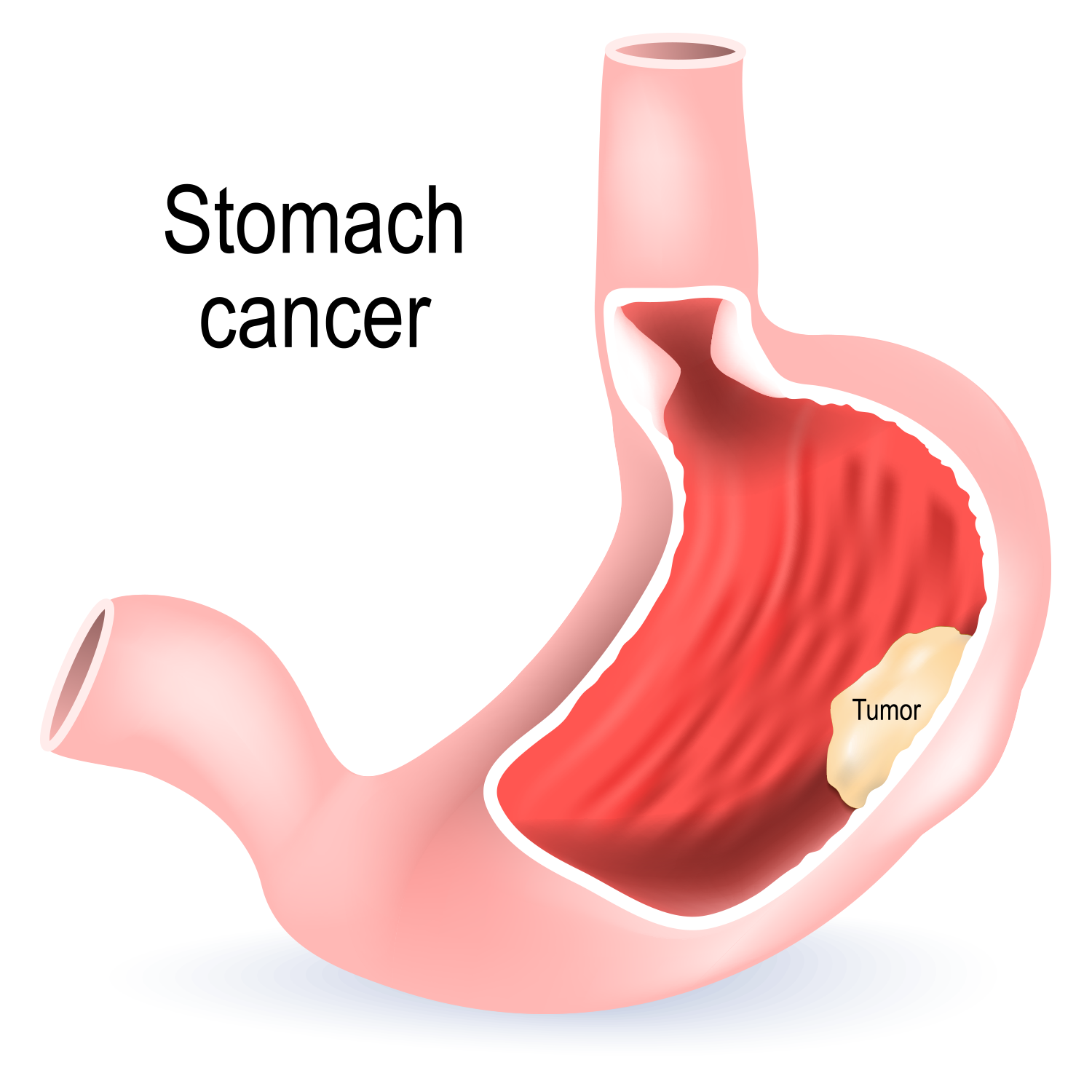 Schützen Sie Ihre Familie vor Magenkrebs
Für viele Amerikaner bringt der Anfang November Gedanken an Thanksgiving mit sich. Im Mittelpunkt unseres Nationalfeiertags steht die Dankbarkeit für Familie, Freunde und reichlich Essen. Aus diesem G
Schützen Sie Ihre Familie vor Magenkrebs
Für viele Amerikaner bringt der Anfang November Gedanken an Thanksgiving mit sich. Im Mittelpunkt unseres Nationalfeiertags steht die Dankbarkeit für Familie, Freunde und reichlich Essen. Aus diesem G
 Einnahme ätherischer Öle für Ihr IBS
Vielleicht haben Sie einiges von dem Gerede um ätherische Öle gehört. Sind sie genau das, was Sie brauchen, oder ist das alles nur ein Hype? Werfen wir einen Blick darauf, was ätherische Öle sind, was
Einnahme ätherischer Öle für Ihr IBS
Vielleicht haben Sie einiges von dem Gerede um ätherische Öle gehört. Sind sie genau das, was Sie brauchen, oder ist das alles nur ein Hype? Werfen wir einen Blick darauf, was ätherische Öle sind, was
 COVID-19-Beschränkungen haben in den USA zu einem Rückgang der Norovirus-Infektionen um 86 Prozent geführt.
findet Studie Der Ausbruch der COVID-19-Pandemie führte zur Verhängung mehrerer nicht-pharmazeutischer Interventionen (NPIs) auf der ganzen Welt. Während sich die Bürger in den USA über den Rat geärge
COVID-19-Beschränkungen haben in den USA zu einem Rückgang der Norovirus-Infektionen um 86 Prozent geführt.
findet Studie Der Ausbruch der COVID-19-Pandemie führte zur Verhängung mehrerer nicht-pharmazeutischer Interventionen (NPIs) auf der ganzen Welt. Während sich die Bürger in den USA über den Rat geärge