Als Pionier der Enteric Dialysis®-Plattformtechnologie Die Mission von Kibow® Biotech war immer in Verbindung mit der Standardbehandlung der Therapie. Das Nahrungsergänzungsmittel für die Nieren des Unternehmens wurde entwickelt, um die normale Nierenfunktion zu unterstützen, was dazu beitragen kann, das Fortschreiten der Nierenfunktion in allen Stadien der chronischen Nierenerkrankung (CKD) zu verlangsamen und möglicherweise zu einem besseren Ergebnis für Dialysepatienten weltweit zu beitragen.
Kibow® Biotech Inc ist stolz darauf, Ihnen mitteilen zu können, dass während seiner 22-jährigen Betriebszeit Der Fokus auf die Unterstützung und Aufrechterhaltung einer gesunden Nierenfunktion mit Probiotika/Präbiotika, um möglicherweise den Übergang zur Dialyse zu verzögern, basiert auf seiner Plattformtechnologie zur Reduzierung von enterischen Toxinen, die als „Enteric Dialysis®“ bezeichnet wird. Seit 2005, Kibow® ist ein Pionier und Marktführer bei den derzeit vermarkteten Nahrungsergänzungsmitteln für die Nieren. Renadyl™*.
Kibow® hat an verschiedenen Jahrestagungen der Nephrologie und medizinischen Fachkreise teilgenommen und ausgestellt. wie die American Society of Nephrology (ASN), Nationale Nierenstiftung (NKF), Amerikanische Vereinigung von Nierenpatienten (AAKP), World Congress of Nephrology (WCN) und mehrere andere medizinische Fachkonferenzen seit 2005.
Die Teilnahme von Kibow®Biotech an diesen Veranstaltungen soll die Nephrologie und alle anderen medizinischen Fachkräfte über die zunehmende Bedeutung und entscheidende Rolle von Probiotika/Präbiotika aufklären. Darm-Nieren-Verbindung, Dysbiose, und Modulation des Darmmikrobioms mit seiner innovativen Plattformtechnologie "Enteric Dialysis®".
Kibow® setzt sich für die Verbesserung der Nierengesundheit bei Patienten mit Nierenproblemen ein. nicht nur für Amerikaner, sondern in allen Ländern weltweit. Obwohl als Nahrungsergänzungsmittel vermarktet und verkauft, Renadyl™ ist das erste und einzige Nahrungsergänzungsmittel für die Nieren, das auf der Grundlage klinischer Ergebnisse entwickelt und formuliert wurde und die patentierte und revolutionäre "Enteric Dialysis®"-Technologie von Kibow® Biotech verwendet.
Schon vor der Ankündigung von Präsident Trump Kibow® Biotech hat Schritte unternommen, um das Leben von mehr Patienten zu erreichen und zu verbessern, indem es Renadyl™ von einem Nahrungsergänzungsmittel zu einem neuartigen lebenden biotherapeutischen Arzneimittel (Mikroorganismen) diversifiziert und die Zulassung als neues Arzneimittel erhält. Als von der FDA zugelassenes Humanarzneimittel Renadyl™ kann auf der Grundlage spezifischer gesundheitsbezogener Angaben vermarktet werden, was zu einer größeren Akzeptanz durch medizinisches Fachpersonal führen dürfte.
Es wird auch den Weg für die medizinische Kostenerstattung ebnen und könnte zu niedrigeren Zuzahlungskosten führen – sowohl von privaten Versicherern als auch von Bundesbehörden für Medicare/Medicaid. Neben der Aufrechterhaltung der normalen Nierenfunktion und der Verlangsamung des Fortschreitens der Nierenerkrankung, Ziel wäre es, den Bedarf an teuren, physisch und psychisch belastende Dialysetherapie.
Als LBP-Arzneimittel, Renadyl™ kann auch potenziell nützlich sein, um die Dauer oder Häufigkeit der Dialyse mit einer deutlich verbesserten Lebensqualität zu reduzieren und mehrere Milliarden Dollar zu sparen, die nicht nur in den USA, sondern weltweit ausgegeben werden.
Kibow® hat bereits den Pre-Investigational New Drug (IND)-Antrag eingeleitet und wird anschließend das IND-Antragsverfahren beim Center for Biological Evaluation Research (CBER) der US-amerikanischen FDA für seine verbesserte Renadyl™-Probiotika/Präbiotika-Formulierung als LBP-Arzneimittel fortsetzen.
Um die Arzneimittelzulassung zu erhalten, Kibow wird benötigt, um gut kontrollierte, randomisierte klinische Wirksamkeits- und Sicherheitstests. Kibow® hat die "Kibow® Hope Study" geplant, eine Multisite, Randomisierte kontrollierte Studie (RCT) bei CKD-Patienten in den Stadien III und IV.
An der geplanten Kibow® Hope RCT-Studie werden etwa 600 Patienten in 20 bis 25 Krankenhäusern/Kliniken teilnehmen. Das Unternehmen beabsichtigt, diese Multi-Site-RCT in Zusammenarbeit mit hochqualifizierten Prüfärzten für klinische Studien in den USA in ihren jeweiligen Kliniken/Institutionen/Krankenhäusern durchzuführen. Ähnliche klinische Studien werden auch in mehreren anderen Ländern vorgeschlagen und durchgeführt.
Außerdem, es ist bekannt, dass 40 % der CKD-Patienten aufgrund eines erhöhten Harnsäurespiegels auch an Gicht leiden. Kibow® hat ein Nahrungsergänzungsmittel entwickelt, das einen normalen Harnsäurespiegel im Blut aufrechterhält. Tierversuche haben gezeigt, dass das Produkt die Harnsäurekonzentration senkt und auch den Blutdruck stabilisiert.
Das Unternehmen führt derzeit offene klinische Studien durch, die vom Institutional Review Board (IRB) genehmigt wurden, um ähnliche Endpunkte bei Menschen zu überwachen. Anschließend, Kibow® plant, das Potenzial eines weiteren IND-Verfahrens mit der US-amerikanischen FDA/CBER zu untersuchen und die FDA-Zulassung für Gicht-/Hyperurikämie-Anwendungen zu beantragen. Alle Kibow®-Produkte wurden basierend auf der Auswahl spezifischer probiotischer Stämme für CNI- bzw. Gichtanwendungen entwickelt.
Dr. Ranganathan, der Gründer und wichtigste F&E-Wissenschaftler der Kibow®-Staaten,
Die Verwendung verschiedener probiotischer und präbiotischer (Faser-)Produkte als Nahrungsergänzungsmittel gewinnt bei Kindern und Erwachsenen für Verdauungs-, immun, und Darmgesundheit. Sie sind allgemein als sicher (GRAS) von der US-amerikanischen FDA anerkannt. Renadyl™ wurde 2010 als Nahrungsergänzungsmittel für die Nieren in den USA eingeführt und anschließend in verschiedene Überseeländer exportiert.
„Nach der Anwendung von Renadyl™ am Menschen wurden in den letzten neun Jahren weder dem Unternehmen noch der US-amerikanischen FDA schwerwiegende unerwünschte Ereignisse gemeldet. Diese Markterfahrungen unterstützen die Sicherheit von Renadyl™ für Anwendungen im Bereich der Nierengesundheit.
Kibow® hat mit seinem Flaggschiff-Produkt Renadyl™ das Konzept der „ENTERIC DIALYSIS®“ entwickelt und wissenschaftlich validiert. Medizinisches Fachpersonal und eine große Basis an gebildeten Kunden sind immer auf der Suche und bereit, sich an eine gut recherchierte, Wissenschaftlich fundierte natürliche Behandlung."
Dr. Ranganathans eingeladener Kommentar mit dem Titel Reality of "Enteric Dialysis®" with Probiotics and Prebiotics to Delay the Need of Conventional Dialysis, der 2018 im Journal of Nephrology &Therapeutics veröffentlicht wurde, kann hier abgerufen werden.
Weitere Aktualisierungen werden während des bevorstehenden Nierenwochentreffens der American Society of Nephrology (5.-10. November, 2019) in Washington DC, wo Kibow® seit 15 Jahren als Aussteller teilnimmt
 Histoplasmose (Höhlenkrankheit)
Histoplasmose (Höhlenkrankheit)
 7 Anzeichen dafür, dass Ihr IBS SIBO sein könnte
7 Anzeichen dafür, dass Ihr IBS SIBO sein könnte
 Was Sie von einer Stuhltransplantation erwarten können
Was Sie von einer Stuhltransplantation erwarten können
 Lupus:Wie man den Autoimmunprozess ausschaltet und auf natürliche Weise heilt
Lupus:Wie man den Autoimmunprozess ausschaltet und auf natürliche Weise heilt
 L-Glutamin:7 Gebote und Verbote für Menschen mit Leaky Gut &Autoimmunität
L-Glutamin:7 Gebote und Verbote für Menschen mit Leaky Gut &Autoimmunität
 Wie Sie sich um Ihre Darmmikrobiota kümmern
Wie Sie sich um Ihre Darmmikrobiota kümmern
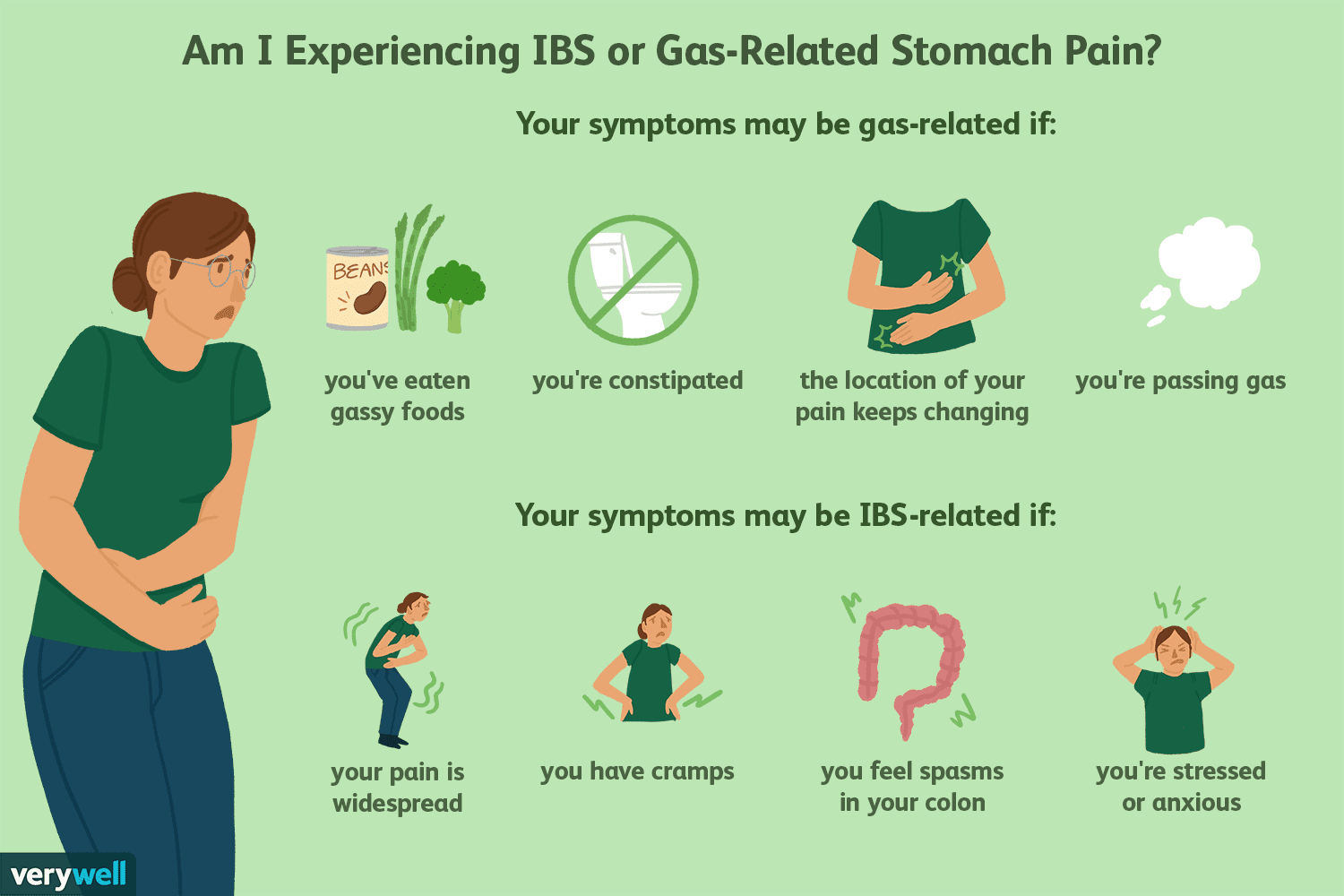 Eingeschlossener Gasschmerz und andere IBS-Bauchschmerzquellen
Wenn Sie ein Reizdarmsyndrom (IBS) haben, denken Sie vielleicht, dass Ihre Bauchschmerzen von eingeschlossenen Darmgasen herrühren. Einiges davon kann jedoch aus anderen Quellen stammen. Darmgas entst
Eingeschlossener Gasschmerz und andere IBS-Bauchschmerzquellen
Wenn Sie ein Reizdarmsyndrom (IBS) haben, denken Sie vielleicht, dass Ihre Bauchschmerzen von eingeschlossenen Darmgasen herrühren. Einiges davon kann jedoch aus anderen Quellen stammen. Darmgas entst
 Warum ich erneut auf SIBO teste
Im Januar 2015 wurde bei mir SIBO diagnostiziert. Bis Juli 2015 hatte ich meine Entwarnung erhalten. In den letzten 3 Jahren habe ich mich mit allen Dingen der Darmgesundheit beschäftigt, mit besonder
Warum ich erneut auf SIBO teste
Im Januar 2015 wurde bei mir SIBO diagnostiziert. Bis Juli 2015 hatte ich meine Entwarnung erhalten. In den letzten 3 Jahren habe ich mich mit allen Dingen der Darmgesundheit beschäftigt, mit besonder
 So reinigen Sie Ihr Haus mit Probiotika
Die Fünf-Sekunden-Regel ist eine Lüge. Es stellt sich heraus, wenn Sie etwas auf den Boden fallen lassen, egal wie schnell Sie es aufheben es ist immer noch dreckig. Dies wurde durch eine kürzlich vo
So reinigen Sie Ihr Haus mit Probiotika
Die Fünf-Sekunden-Regel ist eine Lüge. Es stellt sich heraus, wenn Sie etwas auf den Boden fallen lassen, egal wie schnell Sie es aufheben es ist immer noch dreckig. Dies wurde durch eine kürzlich vo