La expresión de la tirosina quinasa del receptor de RON y su asociación con el carcinoma gástrico en comparación con tejidos normales gástricas
Abstract
Antecedentes
Recepteur d'origine nantais (RON) es un receptor tirosina quinasa que se activa por un derivado del suero, macrófagos estimulante de proteína (MSP) factor de crecimiento y se expresa en muchos tumores malignos. El objetivo del presente estudio fue revelar el perfil de expresión de proteínas de RON y su relación con las características clínico-patológicas del carcinoma gástrico y el pronóstico.
Métodos
tejido de carcinoma gástrico en 98 pacientes, junto con 29 muestras de tejido paraneoplásico y 10 especímenes de mucosa gástrica normal, se examinaron por inmunohistoquímica (IHC). El análisis de transferencia Western de 19 muestras de tejido de carcinoma gástrico y el correspondiente tejido paraneoplásico, 8 muestras de mucosa gástrica normal, y 2 especímenes de muestras normales de los ganglios linfáticos también detectó la expresión de una variante de empalme de RON, RONΔ165. Todas las muestras obtenidas se acompañaron del paciente los datos de seguimiento que osciló entre 3 a 89 meses (mediana: 22 meses).
Resultados
La tasa de expresión RON positiva varían considerablemente entre los tejidos de carcinoma gástrico [56,1%, ( 55/98)] y los tejidos paraneoplásicos [25,6%, (8/29)] (p = 0,007). En contraste, la expresión RON estaba ausente en las muestras de mucosa gástrica normal. RON expresión correlacionada positivamente con la profundidad invasiva del tumor (p = 0,019), la linfa perigástrica linfáticos metástasis (p = 0,019), y el estadio TNM (p = 0,001). Sin embargo, la expresión RON era independiente del patrón de crecimiento del tumor de acuerdo con criterios de Bormann (p = 0,209), grado histopatológico (p = 0,196), y la incidencia de metástasis a distancia (p = 0,400). RON expresión no estaba relacionada con la tasa de supervivencia de un paciente (p = 0,195). RONΔ165 se expresa fuertemente en el tejido carcinoma gástrico fresca, tejido paraneoplásico, y los ganglios linfáticos perigástricos con carcinoma metastásico correspondiente. En contraste, la expresión de RONΔ165 no se observó en la mucosa gástrica normal y muestras de tejido de los ganglios linfáticos normales.
Conclusión
expresión RON es significativa en tejido de carcinoma gástrico y el tejido paraneoplásico correspondiente, pero no se expresa en la mucosa gástrica normal. Expresión de RONΔ165 se observó de manera similar en tejido de carcinoma gástrico y en las metástasis presentes en los tejidos de ganglios linfáticos. Se postula que el RON y su variante de empalme juegan un papel importante en la aparición, progresión y metástasis de carcinoma gástrico, y por lo tanto pueden representar un marcador útil para evaluar la actividad biológica de carcinoma gástrico.
Antecedentes
morbilidad por gástrico el carcinoma está aumentando cada año, mientras que la edad de inicio está disminuyendo. En China, el carcinoma gástrico es el tumor maligno superior en ambas categorías de morbilidad y mortalidad [1]. Recepteur nantais d'origine (RON) es un receptor tirosina quinasa (RTK) que pertenece a la familia proto-oncogen MET. Estudios recientes de un modelo de ratón knockout RON muestra que la interrupción completa del gen RON es embriones letal [2], lo que demuestra que RON es esencial en el desarrollo embrionario. RON es activado por un factor de crecimiento derivado del suero, proteína de macrófagos estimulante (MSP), y los estudios han demostrado que el RON se expresa en muchos tumores malignos y juega un papel en su aparición y progresión.
Zhou et al. [3] encontró que el RON se expresa fuertemente en los carcinomas colorrectales, y se identificaron tres variantes de corte y empalme de RON (RONΔ160, RONΔ165, y RONΔ155). La expresión de RON y sus variantes se asoció con la progresión del carcinoma colorrectal. Otros estudios han demostrado que la expresión de RON y sus variantes de empalme puede precipitar la formación de colonias de células epiteliales de colon y aumentar su viabilidad. Cuando la expresión de RON y sus variantes de empalme fueron objeto de siRNA en cepas de células tumorales rectales, la proliferación y metatasis se inhibieron significativamente, concomitante con el aumento de la apoptosis. Basándose en estos datos, RON y sus variantes de empalme son la hipótesis de tener un papel importante en la aparición, progresión y metástasis de cáncer rectal [4]. Del mismo modo, los estudios de expresión RON en ambos tejidos de cáncer de mama y de vejiga ha demostrado aumento de los niveles de expresión RON y una correlación con el grado histológico [5, 6].
A nuestro conocimiento, el papel de RON en el cáncer gástrico sólo se ha estudiado por Collesi et al [7]. En este estudio la variante de empalme de RON, RONΔ165, se detectó en la cepa de células de carcinoma gástrico, KATO-III. RONΔ165 fue mostrado para mejorar la invasión de células de cáncer gástrico, indicando un papel para la variante de empalme de RON en la transformación maligna de las células gástricas a un carcinoma. En este estudio, se analiza la expresión de RON en el tejido carcinoma gástrico de 98 pacientes utilizando el método Envision inmunohistoquímica (IHC). Para examinar la expresión de RONΔ165, se realizó la transferencia Western de tejido de carcinoma gástrico fresco. Los pacientes incluidos en nuestro estudio fueron controlados entre los 3 y 89 meses después de la operación para investigar la asociación de la expresión RON, incluyendo su variante de empalme, con las características clínico-patológicas del carcinoma gástrico y el pronóstico. Debido a la compleja patogénesis de carcinoma gástrico, la eficacia terapéutica no ha demostrado ser muy eficaz. Por lo tanto, es importante investigar la patogénesis del carcinoma gástrico para encontrar nuevas dianas terapéuticas.
Métodos
muestras de pacientes
embebidos en parafina muestras de tejido de 98 pacientes que se sometieron a cirugía para el confirmado patológicamente carcinoma gástrico en el Primer Hospital Afiliado de la Facultad de Medicina de la Universidad de Zhejiang entre 1998 y 2003 se obtuvieron. muestras gástricas se utilizaron con el consentimiento de los pacientes y el permiso de los Comités de Ética de los hospitales. Setenta hombres y 28 mujeres, de edades comprendidas entre 21 y 76 años (edad media 58 años), se incluyeron en este estudio. diagnóstico de los pacientes incluyó 78 casos de carcinoma ventriculi sinusal, 16 casos de carcinoma de cardias gástrico, y 4 casos de carcinoma gástrico total. informes patológicos-post cirugía diagnostican 2 adenocarcinomas bien diferenciados, moderadamente diferenciados 21 adenocarcinomas, 69 adenocarcinomas pobremente diferenciados, 1 carcinoma de células en anillo de sello, 2 adenocarcinomas mucinosos, y 3 displasia severa con cancerización. Según UICCTNM (1998), se determinó el grado histológico de las muestras para incluir 26 etapa casos I, 14 en estadio II de los casos, 30 en estadio III casos, y 28 en estadio IV casos. La tasa de seguimiento de nuestros pacientes fue del 92%, con 8 pacientes no disponible para completar el seguimiento. El período de seguimiento fue de entre 3 y 89 meses (mediana de 22 meses) después de la cirugía. Diez muestras de mucosa gástrica normal se examinaron como controles. Se recogieron Diecinueve muestras de tejido fresco gástrico carcinoma, tejido paraneoplásico, y el tejido de ganglio linfático perigástrica positivo para el análisis de transferencia Western. Diez muestras de mucosa gástrica normal también se incluyeron como controles.
Inmunohistoquímica
muestras de parafina se seccionaron en 4 micras rodajas gruesas que fueron desparafinados, hidratados y se incubaron durante 20 min en 0,3% H
2O 2 para inhibir la actividad de la peroxidasa endógena. Para la recuperación de antígenos, las muestras se incubaron con tampón de citrato 0,1 M (pH 6,0) y se calentó en una olla a presión durante 8 min. Después de aclarar en TBS, los portaobjetos se incubaron con 3% de suero normal de burro (NDS) en TBS durante 20 min para evitar la unión no específica del primer anticuerpo. anticuerpo monoclonal de conejo anti-ron ron β (C-20) (Santa Cruz biotecnologías, EE.UU.) se utilizó a 1: 400. El kit Envision (DAKO) se utilizó de acuerdo con las instrucciones del fabricante, y se detectó anticuerpo unido usando DAB. Las muestras fueron también co-teñidas con hematoxilina. Las muestras fueron observadas bajo un microscopio de luz y se utilizó una muestra de sólo PBS como control tinción de fondo. Los criterios de evaluación para la detección
RON por inmunohistoquímica
La evaluación del grado de tinción se determinó usando un procedimiento de evaluación cegada por experiencia patólogos. campos de alta potencia (400 ×) mediante microscopía de luz estándar fueron divididos en diez secciones que se anotó al azar. Las células tumorales con partículas buffy en la intracytoplasm se calificaron como positivo, y se registró el porcentaje de células tumorales positivas y la intensidad de tinción para cada muestra. Las células tumorales que no manchan para la expresión RON se anotó como negativa, las células que débilmente teñidas se anotó como 1, tinción moderada fue marcado con un 2, y las muestras fuertemente de tinción se puntuó como 3. de las células tumorales positivas detectadas, < 5% fueron negativos, entre el 5 y el 24% se calificaron como 1, 25-49% se obtuvo con un 2, y > 50% se obtuvo con un 3. La puntuación acumulada de las células tumorales identificados en una muestra determinada puntuación final de una muestra. Sobre la base de la puntuación final, se determinó el tejido tumoral a ser negativa (puntuación de 0-2), o positivos (puntuación de 3-6) para la expresión RON.
Inmunotransferencia de proteínas
Cincuenta microgramos de proteína total para cada muestra se separaron por electroforesis en un gel de poliacrilamida al 10% y se transfirieron a una membrana de PVDF (Millipore). La detección de proteína RON se realizó utilizando un anti-RON anticuerpo monoclonal de conejo Ron β (C-20) (Santa Cruz biotecnologías, EE.UU.) (1: 400). Unión de los anticuerpos se visualizó usando un anticuerpo anti-conejo conjugado con peroxidasa de rábano picante y un kit mejorado de quimioluminiscencia (ECL) (Biological Industries, Inc. Israel). β-actina se utilizó como control de carga.
El análisis estadístico se utilizó el programa SPSS
13,0 software estadístico para identificar la significación estadística de los datos usando tablas de cuatro veces o el R × C mesa de χ 2 test. Las curvas de supervivencia se evaluaron utilizando el método de Kaplan-Meier y las comparaciones de las tasas de supervivencia fueron evaluados mediante una prueba de log-rank.
Resultados
expresión RON en tejido gástrico y el tejido paraneoplásico
proteína se observó en el RON cytolymph, pero no en el nucleolo, de células de carcinoma gástrico y típicamente apareció como buffy granulo-tinción (Fig. 1). se registró el porcentaje de células tumorales positivas y la intensidad de tinción para cada muestra. Para las 98 muestras de pacientes evaluados, se observó expresión RON en 56,1% de los tejidos de carcinoma gástrico (55/98), pero no en muestras de mucosa gástrica normal. En el carcinoma gástrico tejido paraneoplásico, que se recogió a partir de la capa mucosa gástrica de 0,5 cm de las muestras de carcinoma gástrico, se observó proteína RON en 25,6% de las muestras (8/29). Estos datos representan una diferencia estadística significativa en la expresión de la proteína RON entre el tejido de carcinoma gástrico y su tejido paraneoplásica asociada (χ 2 = 7.290, p = 0,007). Figura 1 Detección de la expresión de RON por immunhistochemistry. A, H) Detección de RON en una muestra de adenocarcinoma gástrico pobremente diferenciado. 200 × 400 × magnificación y. B, E) Vista ampliada del RON detección en una muestra de adenocarcinoma gástrico pobremente diferenciado. 400 × 200 × magnificación y. C) Detección de RON en una muestra de carcinoma de células en anillo de sello. 400 × magnificación. D) Detección de RON en una muestra de adenocarcinoma gástrico moderadamente diferenciado. 400 × magnificación. F) La detección de RON en una muestra de adenocarcinoma gástrico moderadamente diferenciado. 200 × magnificación. G) La detección de RON en una muestra de carcinoma de células en anillo de sello. no se encontró 400 × magnificación
expresión de la proteína RON en relación a la patología de carcinoma gástrico
expresión de la proteína RON estar asociado con el género, la edad, o región enferma (p
> 0,05).. Sin embargo, en los tejidos de carcinoma gástrico, más profunda es una célula de carcinoma infiltrado, se expresó la proteína RON más fuertemente (p = 0,019
). También se encontró expresión de la proteína RON correlacionar positivamente con perigástrica la metástasis de los ganglios linfáticos y la etapa de patología clínica con significación estadística (p = 0,019
, p = 0,001
) (Tabla 1). En contraste, no hubo diferencias estadísticamente significativas en la expresión de Ron con la clasificación de la patología, tipo Borrmann, o la presencia de metástasis. Sin embargo, se observó que la expresión de RON era más fuerte en el grupo Borrmann III /IV (63,6%) que en el grupo Borrmann I /II (53,8%), más fuerte en el grupo de metástasis a distancia (68,2%) que en la no distante grupo metástasis (52,6%), y más fuerte en el grupo histológicamente inferior diferenciada (52,4%) que en el grupo histología moderadamente diferenciado y altamente (39,1%). No hubo diferencias estadísticas significativas para estas comparaciones (p = 0,209; p = 0,400; p = 0,196), respectivamente (Tabla 1) .Tabla 1 Relación de expresión RON a la patología parámetros
RON RON
Χ2
p gratis (+) (%) gratis ( cáncer gástrico precoz) Profundidad
invasiva
5 (29,4) página 12
se infiltró a la capa muscular de
15 (51,7) página 14
7.795
p - = 0,019
se infiltró a la membrana serosa
35 (67,3) 17
estadio TNM
Etapa página 14 (35,0) 26
12.245
p = 0,001
Etapa
41 (70,7) 17
metástasis a los ganglios linfáticos
N0 página 11 (37,9) 18
N1-3
44 (63,8)
25
5.535
p = 0,019
Borrmann Grado
grupo I /II página 14 (53,8): perfil 12
III /IV
grupo de 35 (63,6 )
20
0,708
p = 0.400
Otros página 6 página 11
Histología Grado
Moderadamente & altamente diferenciada página 9 (39,1) página 14
1.577
p = 0,209
menos diferenciado *
39 (54,2) 33
Otros ** 0
página 3
metástasis distante M0
40 (52,6) 36
1.675
p = 0,196
M1
15 (68,2) página 7
* Incluye adenocarcinoma pobremente diferenciado, carcinoma de células en anillo de sello, adenocarcinoma mucinoso; ** La displasia severa con cancerización.
RON de expresión y las tasas de supervivencia Opiniones de los 90 pacientes incluidos en este estudio que se dio seguimiento post-operativa, no se encontraron diferencias estadísticamente significativas en las tasas de supervivencia entre los pacientes con carcinoma gástrico RON-positivo muestras en comparación con las muestras de carcinoma gástrico RON-negativos (Fig. 2). Figura 2 Curva de supervivencia de RON + frente a Ron-pacientes.
La detección de la variante de empalme RONΔ165
En las 19 muestras de tejidos de carcinoma gástrico frescas recogió, junto con los tejidos paraneoplásicos correspondiente, y patológicamente confirmó ganglios linfáticos perigástricos con carcinoma metastásico, la variante de empalme de RON, RONΔ165, se expresó. En contraste, no se observó expresión de la proteína RON en mucosa gástrica normal o normal de tejido de ganglios linfáticos (Fig. 3, 4). Figura 3 Análisis de transferencia Western de la expresión RON en tejido gástrico carcinoma, el tejido paraneoplásico, y los ganglios linfáticos perigástricos. Las muestras duplicadas de tejido gástrico carcinoma (T), tejido paraneoplásico (P), y los tejidos de ganglios linfáticos metastásico (L) se analizaron para la expresión de RONΔ 165 (165 kDa). se compararon mucosa gástrica normal (N) y muestras de tejido de ganglio linfático normal (NL). β-actina (44 kDa) se utilizó como control de carga.
Figura 4 análisis de transferencia Western de la expresión RON en el tejido gástrico carcinoma, tejido paraneoplásico, y la mucosa gástrica normal. Las muestras duplicadas de tejido gástrico carcinoma (T) y el tejido paraneoplásico (P) fueron analizados para la expresión de RONΔ165 (165 kDa) y se compararon con muestras de tejido normal de la mucosa gástrica (N). Marcador (M) y el control positivo (CP) (160 kDa) fueron incluidos.
Discusión En el presente estudio, mostramos tanto por IHC y Western blot, que la expresión RON no es detectable en la mucosa gástrica normal. Estas observaciones son consistentes con los resultados de Okino et al [8]. Sin embargo, la tinción de RON en tejidos de carcinoma y los tejidos correspondientes paraneoplásicos por IHC mostraron expresión significativa de RON relativa a las muestras de mucosa gástrica normales. Western blot proporciona información más específica sobre la expresión RON con detección de RONΔ165 en tejidos de carcinoma gástrico, tejidos paraneoplásicos correspondiente, y los ganglios linfáticos con metástasis de carcinoma. Estos datos indican que la expresión de larga duración RON, así como una variante de RON, se expresan durante el proceso de transformación maligna de las células epiteliales gástricas. Sobre la base de estos datos y trabajar en otros estudios sobre el papel de RON en fenotipos tumorigénicos, que postula que el RON puede actuar como un oncogén promover la aparición, progresión, invasión y metástasis de cáncer gástrico.
Estudios previos han demostrado que expresión de RON se correlaciona con la invasión de células tumorales. Maggiora et al [9] informó de que Ron se expresó en el 55% de los tejidos de cáncer de ovario. Además, si una línea celular de cáncer de ovario que expresa fuertemente RON es inducida por MSP, el crecimiento tumoral y la invasión se ha mejorado de manera significativa. Basándose en estos datos, se planteó la hipótesis de que RON juega un papel en la progresión del cáncer de ovario. Del mismo modo, Chan et al [10] mostró que la expresión de RON promovió el crecimiento y la transformación maligna de papilomas de piel, y Cheng et al [6] mostró que la fuerte expresión de RON en líneas celulares de cáncer de vejiga correlaciona con aumento de la proliferación e inhibición de la apoptosis. Este último estudio también demostró que la expresión de RON en el carcinoma gástrico correlacionó positivamente con la profundidad invasiva de la célula de cáncer gástrico y los ganglios linfáticos de metástasis, y el nivel de expresión aumentó significativamente con patologías clínicas más altas de cáncer gástrico. Por lo tanto, la fuerte expresión de RON en tejidos de cáncer gástrico puede servir como un marcador para indicar una conversión de las células normales a un fenotipo maligno, que asocia con una mayor invasión de células tumorales y la metástasis, se asocia con un mal pronóstico para la supervivencia a largo plazo. La proximidad de tejido de cáncer gástrico a la displasia epitelial de los resultados del estómago en la susceptibilidad de la displasia epitelial del estómago para lesiones precancerosas. Por lo tanto, por informar de la expresión de RON en el tejido paraneoplásico, que se recogió ~ 0.5 cm de las muestras de carcinoma gástrico, estamos proporcionando datos para apoyar nuestra hipótesis de que RON juega un papel importante en la promoción de cáncer gástrico y puede servir como un marcador para la conversión de los tejidos a un fenotipo maligno.
en estudios previos se observa la relación entre Ron de expresión y las tasas de supervivencia, Lee et al [11] encontró que el MET y Ron fueron factores pronósticos independientes de recurrencia a largo plazo de cáncer de mama, y que las muestras positivas para MET y expresión RON tenía una tasa de supervivencia libre de enfermedad de 10 años significativamente menor. Del mismo modo, Cheng et al [6] informó de una menor tasa de supervivencia de los cánceres de vejiga positivos tanto para MET y RON. En contraste, se encontró que la tasa de supervivencia de los pacientes positivos para la expresión RON no era más baja que la tasa de supervivencia para el grupo de pacientes RON-negativo. Es posible que la tasa de supervivencia de los pacientes con cáncer gástrico puede verse afectada por muchos factores, y nuestros datos de seguimiento no fue suficiente para proporcionar información adicional sobre los factores que podrían ser importantes.
Conclusión
Los resultados de este estudio muestran que RON se expresa en el cáncer gástrico, pero no en la mucosa gástrica normal. Además, la tasa de expresión de RON en el cáncer gástrico se correlaciona positivamente con la profundidad invasiva, el estadio patológico clínico, y la extensión de la metástasis de los ganglios linfáticos. Se postula que el RON juega un papel importante en la aparición, progresión, invasión y metástasis de cáncer gástrico, y por lo tanto podría ser un marcador importante para evaluar el comportamiento biológico del cáncer gástrico. Los resultados de nuestros estudios proporcionan una base desde la cual identificar aún más los detalles de la mecánica del papel de RON en el cáncer gástrico con el fin de identificar RON como diana terapéutica en el cáncer gástrico.
Declaraciones
Agradecimientos Este trabajo
fue financiado por la Beca de Investigación Científica de la Oficina de Salud de la provincia de Zhejiang (Nº 491010-W10380) (núm 2006B039) y la Fundación de Ciencias Naturales de la provincia de Zhejiang, china (Nº Y2080168).
Autores "original expediente sometido a imágenes
a continuación se presentan los enlaces a los archivos originales presentados los autores de las imágenes. 'archivo original para la figura 1 12885_2008_1291_MOESM2_ESM.jpeg autores 12885_2008_1291_MOESM1_ESM.jpeg Autores archivo original para la figura 2 12885_2008_1291_MOESM3_ESM.jpeg autores archivo original para la figura 3 12885_2008_1291_MOESM4_ESM.jpeg autores archivo original de la figura 4 Conflicto de intereses
Los autores declaran que tienen intereses en competencia.
Investigaciones sobre el Estómago
Investigaciones sobre el Estómago
|  Revisión de la cumbre SIBO 2016:Dra. Allison Siebecker (parte 1)
Revisión de la cumbre SIBO 2016:Dra. Allison Siebecker (parte 1)
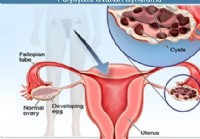 Quistes ováricos:síntomas, causas, tipos y tratamiento
Quistes ováricos:síntomas, causas, tipos y tratamiento
 Síntomas de una perforación de la úlcera - Diagnóstico de abdomen agudo
Síntomas de una perforación de la úlcera - Diagnóstico de abdomen agudo
 Endoscopia frente a colonoscopia
Endoscopia frente a colonoscopia
 Elegir la enfermedad con tanto por dar
Elegir la enfermedad con tanto por dar
 Fenoles y salicilatos:qué son y por qué son importantes
Fenoles y salicilatos:qué son y por qué son importantes
 Cómo mantener el intestino sano durante las vacaciones
¡Esta semana en #AskADietitian Facebook Live hablamos sobre cómo mantener el intestino sano y feliz durante las fiestas! Repaso mis 5 consejos para reducir los síntomas del SII durante las fiestas:¡pa
Cómo mantener el intestino sano durante las vacaciones
¡Esta semana en #AskADietitian Facebook Live hablamos sobre cómo mantener el intestino sano y feliz durante las fiestas! Repaso mis 5 consejos para reducir los síntomas del SII durante las fiestas:¡pa
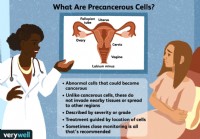 Qué significa si tiene células precancerosas
El término células precancerosas puede dar miedo. Lo primero que hay que aclarar es que no todas las células precancerosas se convierten en cáncer. De hecho, la mayoría no lo hace. Pero estas son célu
Qué significa si tiene células precancerosas
El término células precancerosas puede dar miedo. Lo primero que hay que aclarar es que no todas las células precancerosas se convierten en cáncer. De hecho, la mayoría no lo hace. Pero estas son célu
 Consejos para adoptar un enfoque saludable para el Año Nuevo
Resumen:Mejore su salud digestiva este Año Nuevo estableciendo hábitos saludables, como dejar de fumar, hacer ejercicio regularmente y comer más fibra. Una tradición común de celebrar el Año Nuevo e
Consejos para adoptar un enfoque saludable para el Año Nuevo
Resumen:Mejore su salud digestiva este Año Nuevo estableciendo hábitos saludables, como dejar de fumar, hacer ejercicio regularmente y comer más fibra. Una tradición común de celebrar el Año Nuevo e