gástrica disminución de la expresión de prenil difosfato sintasa subunidad 2 se correlaciona con una menor supervivencia de los pacientes con cáncer gástrico
Resumen Antecedentes
Identificación de nuevos biomarcadores moleculares mejorará el tratamiento de pacientes con cáncer gástrico (CG). Se requiere prenil difosfato sintasa subunidad 2 (PDSS2) para la biosíntesis de la coenzima Q10 y actúa como un supresor de tumores; Sin embargo, los mecanismos de regulación de conducta y de PDSS2 Hoteles en GC no se entienden. El objetivo de este estudio fue determinar el estado de expresión y mecanismos de regulación de PDSS2
en GC.
Métodos
asociaciones entre la expresión y la metilación de PDSS2
fueron evaluados utilizando líneas celulares GC. La importancia clínica de PDSS2
expresión se evaluó utilizando 238 pares de tejidos gástricos resecado quirúrgicamente con el análisis de subgrupos basado en subtipos GC.
Resultados
la expresión de ARNm PDSS2
se redujo en el 73% de las células GC líneas en comparación con la célula de control no cancerosa. El PDSS2
promotor se hypermethylated en células con disminución PDSS2
expresión, y el tratamiento de estas células con un inhibidor de la metilación reactivado PDSS2
expresión. GC tejidos expresan significativamente más bajos niveles medios de PDSS2
ARNm en comparación con los tejidos normales adyacentes (P Hotel < 0,001). El patrón de expresión de la proteína PDSS2 fue consistente con el de su ARNm. La disminución de la expresión de ARNm PDSS2
en los tejidos GC (menos de la mitad el nivel de expresión detectado en los tejidos adyacentes normales correspondientes) se correlacionó significativamente con los niveles elevados de antígeno 19-9 de hidratos de carbono (P
= 0,015), los ganglios linfáticos metástasis (P = 0,022
), y la supervivencia libre de recidiva después de la resección curativa más corta (P = 0,022
). Además, el análisis multivariado identificó PDSS2
la expresión del ARNm como un factor pronóstico independiente (razón de riesgo 1,95, IC del 95% 1.22 a 3.9, P = 0,005
), y su patrón de expresión y la importancia pronóstica fueron similares entre los tres subtipos de GC .
Conclusiones
PDSS2
codifica un gen supresor tumoral putativo, y se muestra aquí que su expresión estaba regulada por la hipermetilación de su promotor en las células de GC. La inhibición de la expresión de ARNm de PDSS2
puede servir como un nuevo biomarcador de todos los tipos de GC.
Palabras clave
gástrico cáncer Prenyl difosfato sintasa subunidad 2 Expresión de fondo Subtipo de metilación
Aunque la incidencia de cáncer gástrico (GC) está disminuyendo en los países más desarrollados, sigue siendo una de las causas más comunes de muerte relacionada con el cáncer en todo el mundo [1] - [3]. adecuada estratificación de los pacientes es un aspecto fundamental del tratamiento individualizado, lo que lleva a la reducción de la mortalidad por este cáncer [4], [5].
De acuerdo con su epidemiología, patología, y la ubicación en el cuerpo, GC se reconoce como tres distintas neoplasias malignas que surge en el mismo órgano [6] - [8]. Shah et al. [9] propuesto una clasificación convincente de GC de acuerdo con criterios histopatológicos y anatómicas de la siguiente manera: (1) proximal nondiffuse GC donde se encuentra el tumor, principalmente en el cardias gástrico con evidencia de precursor displasia glandular o carcinoma in situ en la presencia de inflamación crónica , por lo general sin atrofia; (2) GC difusa, que puede estar situado en cualquier lugar en el estómago sin gastritis evidente que presenta un patrón totalmente difusa de la infiltración de células con un fenotipo pobremente diferenciado; y (3) GC nondiffuse distal, que se encuentra principalmente en el estómago distal con evidencia de gastritis crónica que es predominantemente diferenciado o exhibe un fenotipo intestinal. En este estudio, demostraron que los tres subtipos de GC se distinguen por sus perfiles de expresión génica. Por lo tanto, la diversidad genética de los subtipos de GC se debe considerar en los estudios de alteraciones genéticas y epigenéticas relacionados con la carcinogénesis gástrica y la progresión.
Prenyl difosfato sintasa subunidad 2 (PDSS2
) fue identificado en 2005 [10], y la evidencia indica que actúa como un supresor de tumores [11], [12]. PDSS2
se requiere para la síntesis de la coenzima Q10 (CoQ10) [13], [14], que se sintetiza en la membrana interna mitocondrial y juega un papel vital en la cadena respiratoria mitocondrial, la biosíntesis de nucleósido de pirimidina, y la modulación de la apoptosis [15]. PDSS2
reside dentro del locus cromosómico 6q16.3-21, un sitio de frecuente inestabilidad de microsatélites de ADN y pérdida de heterocigosidad (LOH) en GC [16], [17], el apoyo a su papel como un supresor tumoral en las células epiteliales gástricas . Por otra parte, PDSS2
puede suprimir el desarrollo de melanomas malignos y cánceres de pulmón [11], [12]. Por otra parte, Chen et al. informó de que la sobreexpresión de cumplir PDSS2
conduce a la apoptosis en una línea celular GC al causar la detención del ciclo celular en la fase G0 /G1 [18]. Estos informes nos llevó a hacer una hipótesis de que PDSS2
puede suponer un gen relacionado con la GC-y un candidato de la novela marcador pronóstico clínicamente relevante de GC.
En este estudio, la expresión y el estado de metilación de Hoteles en PDSS2 GC se determinaron para evaluar la significación clínica y los mecanismos de regulación de la expresión en PDSS2
GC. Nuestros resultados indican que la expresión PDSS2
ofrece un potencial biomarcador clínico de la progresión y recurrencia de GC.
Material y métodos
Ética
Este estudio se ajusta a las directrices éticas de la Declaración de la Asociación Médica Mundial de Helsinki Principios -Ethical para las investigaciones médicas en seres humanos y ha sido aprobado por la Junta de Revisión Institucional de la Universidad de Nagoya, Japón. Consentimiento informado por escrito para el uso de muestras clínicas y datos, como es requerido por la junta de revisión institucional, se obtuvo de todos los pacientes [4].
De recogida de muestra
líneas celulares Once GC (H111, KATOIII, MKN1, MKN28, MKN45 , MKN74, NUGC2, NUGC3, NUGC4, línea (no canceroso celular derivada de intestino delgado) SC-2-NU y SC-6-LCK) y CCL-241 se obtuvieron de la American Type Culture Collection (Manassas, VA, EE.UU.) o la Universidad de Tohoku, Japón. Las líneas celulares de GC se cultivaron a 37 ° C en medio RPMI-1640 (Sigma-Aldrich, St. Louis, MO, EE.UU.) suplementado con suero bovino fetal al 10% en una atmósfera que contiene 5% de CO
2. Para CCL-241, se añadieron 30 ng /ml de factor de crecimiento epidérmico (Sigma-Aldrich) en el medio. GC tejidos primarios y los correspondientes tejidos adyacentes normales se obtuvieron de 238 pacientes que fueron sometidos a resección gástrica para GC en el Hospital de la Universidad de Nagoya entre 2001 y 2012. Los pacientes que recibieron terapia neoadyuvante fueron excluidos debido a que era difícil obtener células de cáncer de los tejidos cicatrizados. Las muestras se clasificaron histológicamente usando la 7ª edición de la Unión Internacional para la clasificación de Control del Cáncer (UICC) [19]. clinicopathological parámetros relevantes fueron compradas a los registros médicos. Para evaluar si el nivel de expresión de PDSS2
correlacionado con el fenotipo del tumor, los pacientes se clasificaron en tres grupos de acuerdo a la definición de los subtipos de GC de acuerdo con los criterios de Shah et al. [9] como sigue: nondiffuse proximal, difuso, y el tipo nondiffuse distal. Desde 2006, el uso de la quimioterapia adyuvante S-1 (una pirimidina fluorada oral) es administrado a todos UICC etapa II-III pacientes con GC menos que esté contraindicado por la condición del paciente [20]. Los pacientes fueron seguidos al menos una vez cada 3 meses durante 2 años después de la cirugía y luego cada 6 meses durante 5 años o hasta la muerte. El examen físico, pruebas de laboratorio, y la tomografía computarizada mejorada (pecho y la cavidad abdominal) se realizaron en cada visita. La quimioterapia para pacientes con metástasis a distancia o después del retorno se determinó mediante la discreción del médico.
Muestras de tejido fueron inmediatamente congeladas en nitrógeno líquido y se almacenan a -80 ° C. Las muestras tumorales sin áreas necróticas (aproximadamente 5 mm 2) fueron extraídos por observación grosera y sólo las muestras confirmadas a comprender más de un 80% de componentes tumorales de H & E tinción fueron incluidos en este estudio. Correspondiente normales adyacentes muestras de mucosa gástrica > 5 ° cm del borde de los tumores se obtuvieron del mismo paciente [21]
reacción cuantitativa en tiempo real de transcripción inversa en cadena de polimerasa (QRT-PCR)
los ARN totales. (10 mg por muestra) fueron aisladas de líneas celulares GC 11, CCL-241, 238 tejidos GC primaria y los correspondientes tejidos normales adyacentes fueron utilizados para generar ADNc, que se amplifica usando cebadores específicos de PCR (archivo adicional 1: Tabla S1). la detección en tiempo real de la intensidad de la fluorescencia verde SYBR se llevó a cabo utilizando un sistema ABI StepOnePlus Real-Time PCR (Applied Biosystems, Foster City, CA, EE.UU.). La expresión de GAPDH se cuantificó
ARNm en cada muestra para la estandarización. Las reacciones de QRT-PCR en cada muestra se realizaron por triplicado. El nivel de expresión de cada muestra se presenta como el valor de la PDSS2
amplicón dividido por el de GAPDH
[22]. PDSS2
la expresión de ARNm se definió como una disminución en los tejidos GC cuando su nivel fue de menos de la mitad que la del tejido adyacente normal correspondiente.
Análisis de la región promotora del PDSS2 México La secuencia de nucleótidos del PDSS2
se analizó la región del promotor para determinar la presencia o ausencia de las islas CpG definen como sigue: al menos una región de 200 pb de ADN con un alto contenido de GC (> 50%) y un observó una relación de CpG /esperada CpG ≥0.6 [23] . Se utilizó el software CpG Island Buscador (http:.. //Cpgislands USC edu /) para determinar la ubicación de las islas CpG [24]
PCR específica de metilación (MSP) y la secuencia de bisulfito de análisis
. PDSS2
posee una isla CpG cerca de su región promotora, y la hipótesis de que la metilación aberrante es responsable de regular la transcripción de PDSS2 Hoteles en GC. muestras de ADN de líneas celulares 11 GC tratadas con bisulfito se sometieron a MSP y análisis de la secuencia de nucleótidos [25]. Las secuencias de los cebadores utilizados para el MSP y la secuenciación de bisulfito se enumeran en el archivo adicional 1: Tabla S1
5-aza-2'- desoxicitidina tratamiento (5-aza-DC)
Para evaluar la relación entre la hipermetilación del promotor de PDSS2.
la transcripción, las células GC (1,5 × 10 6) fueron tratados con 5-aza-dC (Sigma-Aldrich) para inhibir la metilación del ADN y se cultivaron durante 6 días con cambios de medio en los días 1, 3 y 5. se extrajo el ARN y RT-PCR se realizó como se describe [7].
la inmunohistoquímica (IHC)
IHC análisis de la localización de PDSS2 se realizó usando un anticuerpo monoclonal de ratón contra PDSS2 (ab119768, Abcam, Cambridge, Reino Unido ) diluido 1: 150 en diluyente de anticuerpo (Dako, Glostrup, Dinamarca) a la sonda 30 secciones fijadas en formalina y embebidas en parafina de tejido representativas GC bien conservada descrito previamente [3]. patrones de tinción se compararon entre los GC y los tejidos adyacentes normales correspondientes. Para evitar la subjetividad, los especímenes fueron aleatorizados y codificados antes del análisis por dos observadores independientes que no tenían conocimiento de la situación de las muestras. Todos los observadores evaluaron todas las muestras de al menos dos veces para minimizar la variación intra-observador [7].
Evaluación de la importancia clínica de expresión PDSS2
Las correlaciones entre el patrón de expresión de ARNm PDSS2
y clinicopathological parámetros fueron evaluados de acuerdo a las diferencias entre los tres subtipos de GC. Se realizó un análisis de subgrupos de la supervivencia según el subtipo de GC para determinar la influencia de PDSS2
expresión en los resultados de los pacientes.
El análisis estadístico
niveles relativos de expresión de ARNm (PDSS2 /GAPDH
) entre GC y adyacentes tejidos normales fueron analizados utilizando la Red de Mann-Whitney. Se utilizó la χ
2 de prueba para analizar la importancia de la asociación entre la expresión y la metilación del estado de PDSS2 Opiniones y parámetros clínico. Específica de la enfermedad y las tasas de supervivencia libre de enfermedad se calcularon utilizando el método de Kaplan-Meier, y la diferencia en las curvas de supervivencia se analizaron mediante la prueba de log-rank. Se realizó un análisis de regresión multivariante para detectar los factores de pronóstico utilizando el modelo de riesgos proporcionales de Cox, y variables con P Hotel < 0.05 se introdujeron en el modelo final. Todos los análisis estadísticos se realizaron utilizando el software JMP 10 (SAS Institute Inc, Cary, NC, EE.UU.). Un valor de P Hotel < 0,05 fue considerado estadísticamente significativo.
Resultados
Identificación de una isla CpG en el promotor PDSS2
Una isla CpG se identificó en la región promotora PDSS2
utilizando la isla CpG buscador. Las propiedades de la isla CpG son las siguientes: 1.655 pb, 55,9% GC, y 0.70 relación observada CpG /Esperada CpG (Figura 1A). Por lo tanto, la hipótesis de que la hipermetilación de las islas CpG regula la expresión de PDSS2 Hoteles en GC. Figura 1 La metilación análisis de PDSS2 en líneas celulares de GC. (A) La isla CpG indicado por la línea azul se centra en el PDSS2
sitio de iniciación de la transcripción que se extiende aguas arriba en la región promotora. gráficos (B) indican Bar PDSS2
los niveles de expresión de ARNm en CCL-241 (control de células no cancerosas) y líneas celulares GC antes o después del tratamiento con 5-aza-DC. El estado de metilación del promotor PDSS2
se evaluó utilizando MSP, y los resultados se incluye en la caja. M, metilada; pM, parcialmente metilado; U, no metilado. (C) Los resultados representativos de análisis de la secuencia de bisulfito. Todos los sitios CpG en células KATOIII se mantienen como CG y los de MKN74 se convirtieron a TG.
Expresión de ARNm y PDSS2 estado de metilación en líneas celulares de GC
disminuciones significativas en los niveles de mRNA PDSS2
fueron detectados en siete (73 %) de 11 líneas celulares de GC en comparación con el nivel de expresión de la célula CCL-241 (los datos para los tejidos de GC se describen a continuación). No había ninguna diferencia aparente en los niveles de expresión entre las líneas celulares derivadas de selectiva y no selectiva GCs (Figura 1B). se detectó hipermetilación del promotor PDSS2
en MKN1, SC-2-NU, KATOIII, MKN45, y las células NUGC3 (Figura 1B). Para determinar si la hipermetilación del promotor PDSS2
inhibió la transcripción, los niveles de expresión de ARNm se compararon antes y después de tratamiento de las células con el inhibidor de la metilación 5-aza-dC. PDSS2
niveles de mRNA fueron restaurados en células con PDSS2 reguladas por
expresión que acompaña a la hipermetilación después de tratamiento con 5-aza-DC (Figura 1B), lo que indica que la hipermetilación del promotor inhibe la transcripción en PDSS2
GC. cromatogramas representativos del análisis de la secuencia de la región promotora PDSS2
en MKN28 (metilación completa) y NUGC4 (ausencia de metilación) las células se muestran en la Figura 1C.
Características de los pacientes México La población de pacientes incluyeron 179 varones y 59 las mujeres con edades comprendidas entre 20 y 84 años (65,3 × 11,7 años, con una media × desviación estándar). Patológicamente, 139 y 99 pacientes fueron diagnosticados con GC indiferenciadas y diferenciadas, respectivamente. Los pacientes se clasificaron en los tres fenotipos de GC como sigue: nondiffuse, 54; difusa, 48; y nondiffuse distal, 136. De acuerdo con la 7ª edición de la clasificación de la UICC, 58, 40, 71 y 69 pacientes se encontraban en estadios I, II, III y IV, respectivamente. Ciento sesenta y cuatro pacientes en estadios I-III fueron sometidos a resección R0. Sesenta de los 69 pacientes en estadio IV UICC fueron diagnosticados en estadio IV, debido a la citología peritoneal positiva lavado, metástasis peritoneal localizada o distante metástasis en los ganglios linfáticos. Ocho de los pacientes en estadio IV tenían metástasis hepáticas sincrónicas, uno tenía metástasis de pulmón, y se sometieron a gastrectomía destinado a controlar la hemorragia u obstrucción al paso de los alimentos.
Niveles de expresión de ARNm y proteínas PDSS2 en los tejidos extirpados quirúrgicamente Francia El significa nivel de expresión de mRNA PDSS2
fue menor en los tejidos de GC en comparación con la de los tejidos adyacentes normales (P
< 0,001); Sin embargo, no hubo diferencia significativa en PDSS2
los niveles de expresión de ARNm entre los pacientes con GC indiferenciada o diferenciado (Figura 2A). El patrón de expresión de PDSS2 se evaluó usando IHC. Casos representativos con reducida tinción de los tejidos PDSS2 GC se muestran en la Figura 2B. En general, los patrones de tinción de PDSS2 fueron consistentes con los datos de QRT-PCR. Figura 2 Expresión análisis de PDSS2 en muestras clínicas. (A) El nivel medio de PDSS2
mRNA en tejidos GC en comparación con los tejidos adyacentes normales correspondientes y en los tejidos de GC entre los pacientes con GC y GC indiferenciada diferenciada. datos (B) Representante IHC comparar la expresión PDSS2 en el tumor y el tejido adyacente normal adyacente (magnificada 100 × 400 × y). N, tejido normal adyacente; T, tumor de tejido.
Implicaciones pronósticas de los niveles de expresión de ARNm PDSS2 comentario El PDSS2 expresión de mRNA en tejidos
GC se redujo en 76 (32%) de los 238 pacientes (menos de la mitad del nivel de expresión detectado los tejidos adyacentes normales correspondientes). La tasa de supervivencia específica de la enfermedad de los pacientes con disminución de los niveles de mRNA en PDSS2
GC fue significativamente menor en comparación con los que no tienen (tasas de supervivencia a 5 años, 36% y 64%, respectivamente, P Hotel < 0,001, figura 3A). Disminución de los niveles de mRNA en PDSS2
GC se asociaron significativamente con el antígeno carbohidrato (CA) 19-9 > 37 IU /ml metástasis en los ganglios linfáticos y (Tabla 1). El análisis univariante de la supervivencia específica de la enfermedad mostró que el subtipo GC (nondiffuse proximal o difuso), CA 19-9 > 37 IU /ml, tamaño de tumor (≥50 mm), pT4, tumores indiferenciados, afectación linfática, invasión de vasos, de crecimiento invasivo, la metástasis de los ganglios linfáticos, la citología de lavado peritoneal positivo, y la disminución de la expresión de ARNm PDSS2
en los tejidos de GC fueron significativas pronóstico factores de resultados adversos. El análisis multivariado identificó disminuyó PDSS2
la expresión del ARNm como un factor pronóstico independiente (cociente de riesgos instantáneos 1,95, intervalo de confianza del 95% 1.22 a 3.9, P = 0,005
, Tabla 2). La asunción de riesgos proporcionales de Cox en el modelo se evaluó con modelos incluyendo el tiempo-por-covarianza interacciones y no hay violaciónes significativos fueron encontrados en el modelo. Figura 3 implicaciones pronósticas de la expresión de ARNm PDSS2 en pacientes con GC. la supervivencia (A) específica de la enfermedad de los pacientes con disminución de PDSS2
ARNm en el tejido GC. (B) (C) específico de la Enfermedad (B) y libre de recidiva (C) la supervivencia de los 168 pacientes que fueron sometidos a resección R0.
Tabla 1 Asociación entre el nivel de expresión de ARNm y PDSS2 parámetros clínico de 238 pacientes
Variables
DecreasedPDSS2
mRNA en tejidos GC (n) guía empresas Otros (n)
P
valor
Edad
0,408
< 65 años
29
71
≥ 65 años
47
91
Sexo Masculino
0.551
59
120
Mujer
17
42
Subtipo
0,298
proximal nondiffuse
22
32
difuso página 14
33
nondiffuse distal
40
96
El antígeno carcinoembrionario (ng /ml)
0.490
≤ 5
59
132 Hotel > 5
17
30
antígeno carbohidrato 19-9 (UI /ml)
0,015 *
≤ 37
55
139 Hotel > 37
21
23
El tamaño del tumor (mm) 0,104
Hotel < 50
29
80
≤ 50
47
82
tumor profundidad (UICC)
0,419
pT1 página 14
32
pT2 página 6
24
pT3 página 19
33
pT4
37
73
Diferenciación
0,217
diferenciada
36
63
indiferenciado
40
99
afectación linfática
0,201
Ausente página 8
27
Presente
68
135
invasión de vasos
0,535
Ausente
31
73
Presente
45
89
tipo de crecimiento infiltrante
0,443
crecimiento invasivo
24
59
crecimiento expansivo
52
102
metástasis de ganglios linfáticos (UICC)
0,022 *
pN0 página 19
70
pN1 página 8 página 19 página 12
pN2
24
pN3
37
49
peritoneal citología de lavado
0,306
negativo
57
131
positiva página 19
31
metástasis a distancia (UICC)
0,228
M0
50
119
M1
26
43
* estadísticamente significativa (P
< 0,05). GC, cáncer gástrico; UICC, Unión Internacional contra el Cáncer.
Tabla 2 Factores pronósticos de la supervivencia específica de la enfermedad de 238 pacientes
variables
n (%) guía empresas univariante
multivariable
cociente de riesgos
95% IC
P
valor
cociente de riesgos
IC del 95%
P
valor
Edad (≥65)
138 (58%): perfil del 1,04
0,67-1,61
0,843
género (femenino)
59 (25%)
1,29
0,79-2,05
0,301
Subtipo (nondiffuse distal)
136 (57%)
0,43
0,28 - 0,67 Hotel < 0,001 0,64
0.40 - 1.01
0,056
antígeno carcinoembrionario (> 5 ng /ml)
47 (20%)
1,48
0,86-2,42 0,149
antígeno carbohidrato 19-9 (> 37 IU /ml): perfil 44 (18%)
1,98
01.17 a 03.20
0,012
1,23
0,71 - 2,06
0,445
El tamaño del tumor (≥50 mm)
129 (54%)
2,86
1,78-4,80 Hotel < 0,001
1,40
0,83-2,42 0,211
la profundidad del tumor (pT4, UICC)
110 (46%): perfil del 4,17
2,61-6,88 Hotel < 0,001
1,38
0,78-2,50
0,273
diferenciación tumoral (indiferenciado)
139 (58%)
2,03
1,28-3,32
0,002
1,45
0,83-2,60
0.197
linfático participación
203 (85%)
6,31
2,36-25,8 Hotel < 0,001
1,45
0,45-6,50
0,559
invasión de vasos
134 (56%)
2.65
1,66-4,37 Hotel < 0,001
1.75
1,07-2,97
0,026 *
invasiva crecimiento
83 (35%)
3,03 1,97
- 4.70 Hotel < 0,001
1,19
0,70 - 2.05
0.520
metástasis de ganglios linfáticos
149 (63%)
7,02
3.70 - 15.1 Hotel < 0,001
1,38
0,56 - 3,81
0,503
peritoneal citología de lavado (positivo)
50 (21%)
4.33
2,76-6,74 Hotel < 0,001
1,87
1.14 a 3.6
0,014 *
UICC etapa (III-IV)
140 (59%)
9,68
4,97 - 21,8 Hotel < 0,001
2,63
0,94 - 7,83
0.065
Disminución PDSS2
mRNA en los GC
76 (32%)
2,18
1,40-3,37 Hotel < 0,001
1.91
01.19 a 03.04
0,008 *
* estadísticamente significativo en el análisis multivariante. GC, cáncer gástrico; IC: intervalo de confianza; UICC, Unión Internacional contra el Cáncer.
De los 168 pacientes que fueron sometidos a resección R0, la tasa de supervivencia específica de la enfermedad fue significativamente menor para aquellos con una disminución de la expresión de ARNm PDSS2
en GC (n = 50) en comparación con aquellos sin (n = 118) (tasas de supervivencia a 5 años, 50% y 77%, respectivamente; p = 0,006
, Figura 3B). Los pacientes con disminución de la expresión de ARNm PDSS2
en GC experimentó recurrencias significativamente más temprano después de la cirugía en comparación con aquellos sin (tasas de 2 años de supervivencia libre de recidiva, 64% y 84%, respectivamente; p = 0,022
, Figura 3C). sitios de recidiva inicial de 43 pacientes que recaen con disminución de la expresión de ARNm PDSS2
en los GC fueron peritoneal en 21 (49%), el hígado en 6 (14%), los ganglios linfáticos en 13 (30%) y otros (por ejemplo, de pulmón y hueso) en 3 pacientes. Por otro lado, las de 61 pacientes con recaídas sin disminución PDSS2
eran peritoneal en 35 (57%), el hígado en 10 (16%), los ganglios linfáticos en 8 (13%) y otros en 8 pacientes. Los pacientes con disminución de la expresión de ARNm PDSS2
en GC eran propensos a tener una recaída nodo, aunque no alcanzó la significación estadística.
El análisis de subgrupos de expresión PDSS2 de acuerdo con GC subtipo
Mean PDSS2
la expresión del ARNm los niveles fueron equivalentes en GC y tejidos adyacentes normales (Figura 4A). Del mismo modo, el valor pronóstico de la disminución de la expresión de ARNm PDSS2
en GC fue comparable entre los tres subtipos de GC (Figura 4B). Figura 4 El análisis de subgrupos de los subtipos de GC. (A) PDSS2
niveles de mRNA expresión entre los tres subtipos de GC, tanto en GC y tejidos adyacentes normales. (B) Comparación de la supervivencia específica de la enfermedad de los pacientes con y sin disminución de la expresión de ARNm PDSS2
en GC de cada subtipo GC.
Discusión
PDSSs son enzimas heterotetrameric que comprenden subunidades codificadas por PDSS1 gratis (10p12. 1) y PDSS2
[10], [12]. PDSS actividad requiere que ambas subunidades [10], [14], [15]. La asociación de PDSS2
con GC se consideró debido a su localización cromosómica (6q21), y debido a su inactivación o pérdida de ciertos tumores malignos [16], [26]. Aquí mostramos que PDSS2
mRNA se expresó de forma heterogénea en líneas celulares de GC, y su expresión se inhibió en 73% y 32% de líneas celulares de GC y los tejidos tumorales, respectivamente. Detectamos hipermetilación del promotor PDSS2
en cinco (45%) de las líneas celulares 11 GC con una disminución significativamente los niveles de PDSS2
expresión. Además, PDSS2
transcripción se reactivó después las células se trataron con un inhibidor de la metilación del ADN. Estos resultados son los primeros en nuestro conocimiento para demostrar que la hipermetilación del promotor regula PDSS2
transcripción. Sin embargo, PDSS2
expresión se redujo en algunas células GC sin hipermetilación. Debido a que el cromosoma 6q es un sitio frecuente de LOH en GC [17], [26], [27], LOH puede regular PDSS2
expresión también.
Ha habido un informe que demuestra que PDSS2
se expresó en disminución o indetectable expresión en un pequeño número de muestras de biopsia de GC [18]. En el presente estudio, se analizaron 238 muestras quirúrgicas de tumores y el tejido no afectado correspondiente a ganar una mayor comprensión de la importancia clínica de PDSS2
expresión en GC. En consonancia con el análisis de melanoma maligno y cáncer de pulmón [11], [12], la mayoría de los pacientes con GC albergaba un nivel disminuido de PDSS2
mRNA en tejidos GC, y la media PDSS2
nivel de expresión fue significativamente menor en comparación GC con los tejidos adyacentes normales. IHC se realizó para determinar si el nivel de mRNA refleja PDSS2
expresión de la proteína. Debido a los resultados de IHC indicaron que los datos de mRNA fueron consistentes con el nivel de proteína, los análisis posteriores se realizaron de acuerdo con los datos de ARNm, que son más susceptibles al análisis cuantitativo [7], [23].
Disminución PDSS2
la expresión de ARNm en los GC se asoció significativamente con los niveles preoperatorios elevados de CA19-9 y metástasis en los ganglios linfáticos y se identificó como un factor pronóstico independiente. Por otra parte, los pacientes con disminución de la PDSS2
la expresión del ARNm en el tejido GC con experiencia significativa con anterioridad a la recurrencia después de la resección R0. Recientemente, Chen et al. investigado la actividad supresora de tumor de PDSS2
en el cáncer de pulmón [28]. Se informó de que la sobreexpresión forzada de PDSS2
causó la muerte masiva de células a través de las vías de apoptosis y la formación de colonias inhibió significativamente y no había una correlación inversa entre PDSS2
expresión y gelsolina expresión, que se sabe que inhibe la apoptosis y mejorar la invasión de células y metástasis [29], aunque PDSS2 no influyó en la sensibilidad de las células cancerosas a los fármacos quimioterapéuticos [28]. Este mecanismo supresor tumoral de PDSS2
podría aplicarse a GC, así. México La patrón de expresión de ARNm PDSS2
y su impacto pronóstico fueron similares entre los tres subtipos de GC (nondiffuse proximal, difusa y distal nondiffuse) , lo que indica que PDSS2
expresión influye en la patogénesis de todos los tipos de GC. Shah et al. informó de que un tercio de los genes amplificados, posiblemente incluyendo PDSS2
, mostró patrón de expresión equivalente entre los tres subtipos de GC [9]
. GC es uno de los tumores con una alta frecuencia de metilación aberrante, y frecuentemente exhibe la isla CpG methylator fenotipo [30], [31]. La expresión de un gran número de genes es suprimida por la isla CpG hipermetilación en las células de GC, incluyendo los supresores de codificación tumorales, reguladores del ciclo celular, inductores y ejecutores de la apoptosis, proteínas que promueven el fenotipo invasivo, y enzimas de reparación del mal emparejamiento del DNA [32]. Estas alteraciones epigenéticas pueden servir como marcadores biológicos que iluminan un mayor fenotipo metastásico potencial y agresivo tumor [33], así como dianas terapéuticas [34]. Por lo tanto, la identificación de otros genes que son regulados por la metilación en las células de GC es probable que mejorar la gestión de GC Francia El supresor tumoral de la función PDSS2
son compatibles con los actuales resultados de la siguiente manera:. (1) disminución de la expresión de PDSS2
fue detectado con frecuencia en los tejidos GC, (2) el nivel medio de PDSS2
expresión fue significativamente menor en los tejidos de GC, y (3) disminución de la expresión de PDSS2
se asoció con recurrencia temprana y posterior mal pronóstico. PDSS2
niveles de expresión en tejido de biopsia obtenidas a partir de muestras de vigilancia endoscópica o en especímenes quirúrgicos pueden ser útiles para predecir la recurrencia temprana y de mal pronóstico, que es probable que los esfuerzos de ayuda para diseñar estrategias terapéuticas más eficaces.
Este estudio estuvo limitado por su falta de análisis funcional suficiente de PDSS2
, que atempera la conclusión de que actúa como un supresor tumoral en el GC. Se espera que los nuevos estudios que incluyen análisis de la vía en la carcinogénesis gástrica y el análisis funcional para aclarar los mecanismos moleculares que subyacen a las actividades biológicas de PDSS2
en GC.
Conclusión
En conclusión, nuestros resultados apoyan la conclusión de que la expresión de la putativo gen supresor de tumores PDSS2
está regulada por el promotor hipermetilación en las células de GC e indique. Nuestros resultados indican además que la disminución de la expresión de ARNm PDSS2
puede representar un nuevo biomarcador para la progresión y recurrencia de todos los tipos de GC.
Contribuciones de los autores
MK, HO, FS, DS, HT, RH y KM experimentos y los datos se realiza el análisis. DK, CT, SY, TF, GN, SA, MK, MF y YK recogen casos y los datos clínicos. MK y SN concebido y diseñado el estudio, y preparó el manuscrito inicial. YK supervisó el proyecto. Todos los autores contribuyeron al manuscrito final.
 Ensalada de pollo con cítricos
Me encanta el sabor cítrico cuando se mezcla con carnes blancas como el pollo... ¡y esta ensalada es increíble! Además, puedes hacerlo en menos de 20 minutos... Ensalada de pollo con cítricos Lechug
Ensalada de pollo con cítricos
Me encanta el sabor cítrico cuando se mezcla con carnes blancas como el pollo... ¡y esta ensalada es increíble! Además, puedes hacerlo en menos de 20 minutos... Ensalada de pollo con cítricos Lechug
 9 causas del estreñimiento y fuentes del estreñimiento a largo plazo
Cuando tiene estreñimiento a largo plazo, su instinto le dice que algo debe cambiar. Descubra nueve causas comunes de estreñimiento y cuándo preguntarle a un médico. Índice 1. Deshidratación y estre
9 causas del estreñimiento y fuentes del estreñimiento a largo plazo
Cuando tiene estreñimiento a largo plazo, su instinto le dice que algo debe cambiar. Descubra nueve causas comunes de estreñimiento y cuándo preguntarle a un médico. Índice 1. Deshidratación y estre
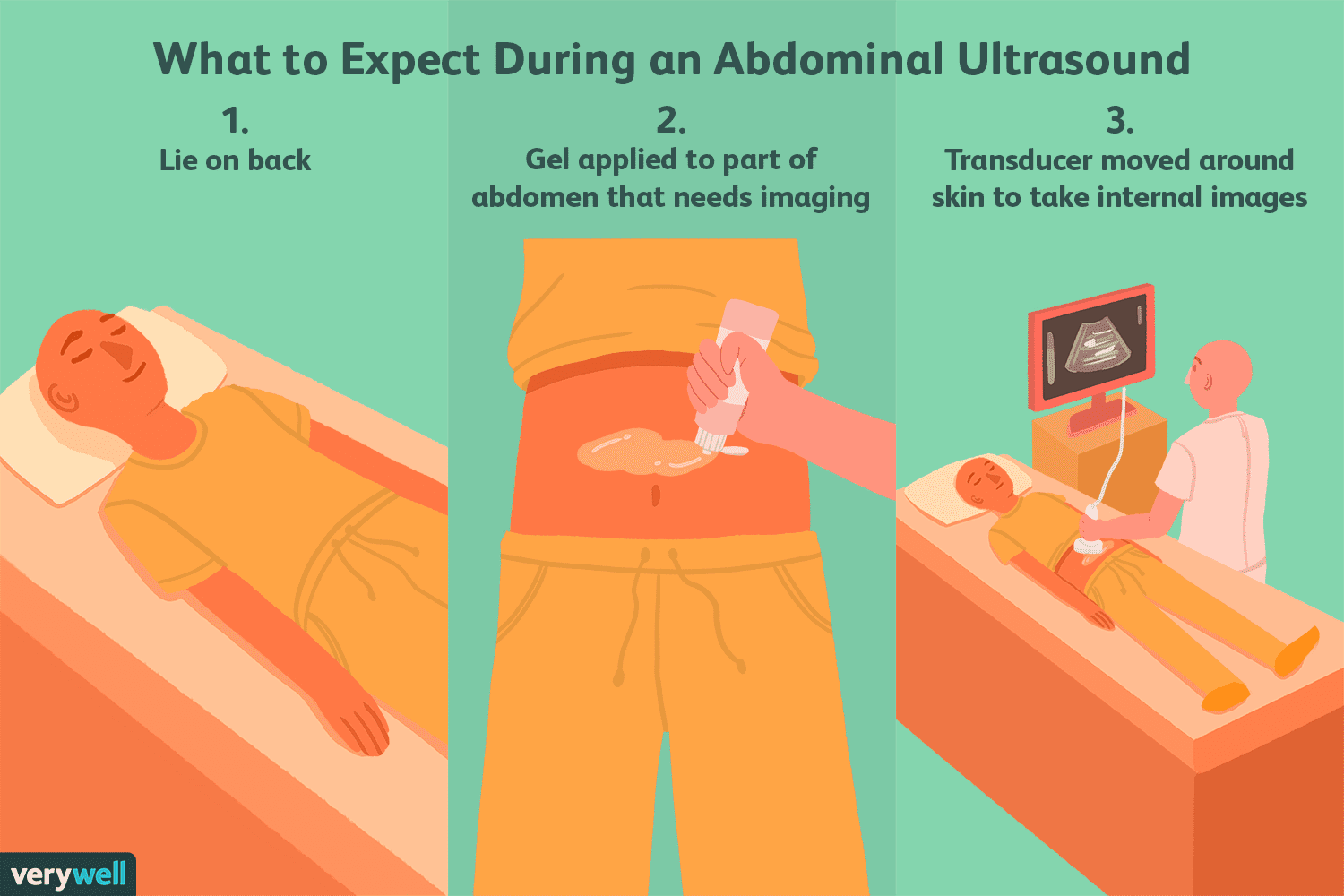 ¿Qué es una ecografía abdominal?
Un ultrasonido abdominal (o ecografía) es una forma no invasiva de ver los órganos en la cavidad abdominal. A diferencia de otros tipos de pruebas médicas por imágenes, los ultrasonidos no usan radiac
¿Qué es una ecografía abdominal?
Un ultrasonido abdominal (o ecografía) es una forma no invasiva de ver los órganos en la cavidad abdominal. A diferencia de otros tipos de pruebas médicas por imágenes, los ultrasonidos no usan radiac