clinicopathological características y funciones de pronóstico de las mutaciones KRAS, BRAF, y PIK3CA ANR de cáncer gástrico avanzado
Resumen Antecedentes
RAS-RAF-MEK-ERK y PI3K-AKT forman una cascada significativa para la terapia blanco molecular potencial en el cáncer avanzado. El significado clínico de las mutaciones en estos genes en el cáncer gástrico avanzado (AGC) es incierto.
Métodos
recogimos fijado en formol, las muestras congeladas de tumores incluidas en parafina y frescas de pacientes AGC y analizó el KRAS, las ANR, BRAF Opiniones y PIK3CA
mutaciones por secuenciación directa. Se investigaron de forma retrospectiva las características clínico-patológicas de estas mutaciones en pacientes de AGC, y los pacientes seleccionados con cáncer gástrico metastásico.
Resultados Estar entre 167 pacientes de AGC, las mutaciones de KRAS
codones 12/13 (N = 8
/164, 4,9%), PIK3CA gratis (N
= 9/163, 5,5%), y las ANR
ha codón 12/13 (N
= 3/159, 1.9%) fueron detectados. La comparación de las características clínico-patológicas de los mutadas del gen KRAS, PIK3CA, las ANR
genes con un tipo todo-natural de estos genes mostró que la frecuencia del tipo intestinal fue significativamente mayor en los pacientes cuyo tejido tumoral contenida KRAS mutaciones
(P
= 0,014). Entre 125 pacientes con cáncer gástrico metastásico, los pacientes con ANR
codón 12/13 mutaciones en sus tumores tenían menor supervivencia global en comparación con las ANR
pacientes de tipo salvaje (MST: 14,7 vs 8,8 meses, P = 0,011
). Por análisis multivariado, las ANR
codón 12/13 mutación es un indicador de mal pronóstico en pacientes con cáncer gástrico metastásico (HR ajustada 5.607, IC del 95%: 1,637 a 19,203).
Conclusiones
Nuestro estudio indica que mutaciones de KRAS, PIK3CA
y las ANR
eran raros en AGC. NRAS
mutaciones eran propensos a asociarse con mal pronóstico en el estado metastásico de pacientes AGC, pero se requiere una validación adicional de otras investigaciones.
Antecedentes
El cáncer gástrico es la segunda causa principal de muerte por cáncer en todo el mundo, con aproximadamente 989.600 nuevos casos y 738.000 muertes por año, lo que representa aproximadamente el 8 por ciento de los nuevos casos de cáncer [1]. Las tasas de incidencia más altas se encuentran en Asia oriental, las regiones andinas de América del Sur y Europa del Este, mientras que las tasas más bajas se encuentran en América del Norte, Europa del Norte, y la mayoría de los países de África y el sudeste de Asia.
Debido al desarrollo de la sistémica quimioterapia, el tiempo de supervivencia para el cáncer gástrico avanzado (AGC) se ha mejorado en la última década. Un régimen de fluoropirimidina y el platino es una quimioterapia estándar de primera línea en pacientes HER2-negativos de cáncer gástrico metastásico (mGC), y trastuzumab añadido a XP es una quimioterapia estándar en pacientes mGC HER2 positivos en Japón [2-5]. Aunque algunos pacientes AGC obtienen beneficio clínico de quimioterapia sistémica, la mayoría de los pacientes no alcanzaron un resultado clínicamente satisfactorio. Se requiere un tratamiento novedoso de mGC con regímenes más efectivos y menos tóxicos de la quimioterapia.
ensayos de fase III de la terapia molecular con inhibidor de mTOR, anticuerpo anti-VEGF, se informó de anticuerpos anti-EGFR en cáncer de AGC o gastro-esofágico, pero estos fármacos no pudo ser demostrado tener eficacia significativa [6, 7]. Recientemente, ramcirumab, anticuerpo monoclonal anti-VEGFR objetivo, se informó a mejorar la supervivencia en pacientes refractarios a la quimioterapia mGC. Sería una ventaja terapéutica significativa para identificar biomarcadores eficaces con el fin de que coincida con las células de cáncer de respuesta con el fármaco diana molecular apropiada y dilucidar mecanismos asociados con la resistencia a la quimioterapia. México La proteína quinasa activada por mitógenos (MAPK) es parte de una vía de señalización intracelular importante que regula diversas funciones celulares incluyendo la proliferación celular, la regulación del ciclo celular, la supervivencia celular, la angiogénesis y la migración celular [8]. Las proteínas Ras se identificaron inicialmente como los componentes de transformación de los virus oncogénicos, mientras que NRAS
fue identificado como el componente de transformación de un neuroblastoma. mutaciones de Ras se encuentran en hasta 30% de todos los cánceres y son particularmente comunes en los cánceres de páncreas y de colon. Raf es reclutado a la membrana celular mediante la unión a Ras y se activa en un proceso complejo que implica la fosforilación y múltiples cofactores. BRAF
mutaciones tienen una distribución estrecha, pero son frecuentes en algunos tumores malignos específicos, tales como melanoma, cáncer de tiroides papilar, cáncer de ovario y de bajo grado [9-11]. La importancia de la fosfoinosítido 3-quinasa (PI3K) en el cáncer fue confirmada por el descubrimiento de que el gen PIK3CA
, que codifica la subunidad catalítica de PI3K p110α, se muta con frecuencia en algunos de los tumores humanos más comunes [12]. Estas alteraciones genéticas de PIK3CA
compuestas exclusivamente por mutaciones sin sentido somáticas agrupados en dos "punto caliente" regiones en los exones 9 y 20, que corresponden a los dominios helicoidales y quinasa de p110α, respectivamente [13].
Recientemente, el uso de KRAS
, BRAF
, PIK3CA
y las ANR
como biomarcadores para la terapia blanco molecular en tumores sólidos ha sido ampliamente discutido. Varios biomarcador pequeña escala análisis del KRAS
, BRAF Opiniones y PIK3CA mutaciones
se había informado anteriormente en AGC [14-16]. La importancia clínica de estas mutaciones en pacientes AGC no está aclarado, y se necesitan más investigaciones de estos cambios moleculares intracelulares.
En el presente estudio, se realizó un análisis genómico de KRAS
, BRAF
, PIK3CA Opiniones y ANR
mutaciones con el fin de investigar las características clínico-patológicos y papel pronóstico de las mutaciones genéticas en pacientes AGC.
Métodos pacientes y muestras
colección
Todos los datos fueron extraídos de la base de datos de nuestra departamento, y el gráfico de revisión se realizó para cada paciente con el fin de obtener información importante. Recogimos muestras de tejido para el análisis del estado de la mutación del gen KRAS de, BRAF, PIK3CA
y las ANR
. Las muestras de tejido consistieron en muestras utilizadas en la investigación de biomarcadores anterior en nuestra institución [2, 17] y de muestras de tejido fresco congelado, que se obtuvieron de las resecciones quirúrgicas previas de AGC en nuestra institución. muestras de tejido tumoral de 173 pacientes AGC se reunieron, pero se excluyeron las muestras suficientes de los 6 pacientes. Finalmente, se utilizaron 167 muestras de tejido de pacientes AGC y se investigaron las mutaciones del gen KRAS de
, BRAF
, PIK3CA
y las ANR fotos: por el método de secuenciación directa (cohorte entera). Entre 167 pacientes AGC, 42 pacientes fueron sometidos a resección quirúrgica sin quimioterapia sistémica (cohorte no metastásico como el grupo A) y 125 pacientes con cáncer gástrico metastásico recibido quimioterapia sistémica (cohorte metastásico como grupo B). Un diagrama de este estudio se muestra en la Figura 1. El consentimiento informado de la utilización de tejidos tumorales de pacientes se confirmó de todos los pacientes que participaron en el estudio, que se llevó a cabo con la aprobación de la Junta de Revisión Ética Institucional del Centro Nacional del Cáncer en conformidad con la Declaración de Helsinki de 1975 (revisada en 1983). Figura 1 Diagrama de este estudio.
Genómica análisis del KRAS, BRAF, PIK3CA y las ANR
muestras de ADN fueron extraídos de secciones de tejido tumoral fijado en formol e incluidos en parafina (FFPE) y frescas congeladas. áreas rica en células tumorales en la sección de hematoxilina y eosina fueron marcados con un microscopio, y el tejido fue retirado de la zona de otra sección sin teñir deparaffinized. Se aisló el ADN a partir de piezas de la muestra de tejido rayado usando el kit de ADN de tejidos FFPE QIAamp (QIAGEN KK, Tokyo, Japón). Exon 2 (codón 12, 13), el exón 3 (codón 61), el exón 4 (codón 146) de KRAS
gen y el exón 15 (codón 600) de BRAF
gen y el exón 9 (codón 542, 545) , el exón 20 (codón 1047) de PIK3CA
gen y el exón 2 (codón 12, 13), el exón 3 (codón 61) de NRAS
gen se amplificó por PCR (el GeneAmp PCR System 9700 termociclador). Los productos de PCR se visualizaron mediante electroforesis en gel de agarosa con tinción de bromuro de etidio y secuenciados directamente utilizando un ABI 3130X /Genetic Analyzer (Life Technologies Japón (Applied Biosystems), Tokio, Japón) de acuerdo con las instrucciones del fabricante.
Tratamiento
A total de 125 pacientes en el grupo B recibió quimioterapia sistémica. Los regímenes de quimioterapia de primera línea consistieron en CP (n = 42, 33,6%), S-1 (n = 39, 31,2%), 5-FU (n = 10, 24,0%), una combinación de 5-FU y metotrexato (n = 10, 8.0%), paclitaxel (n = 3, 2,4%) y XP y /o bevacizumab (n = 1, 0,8%). Clave fármacos contra el cáncer de AGC en Japón son fluoropirimidina (5-FU, S-1, capecitabina), cisplatino, irinotecan y taxano. Durante todo el curso de la quimioterapia sistémica en el grupo B, la proporción de pacientes que recibieron 5-FU, cisplatino, irinotecan y taxanos eran el 85,6% (n = 107/125), el 52,8% (n = 66/125), 60,8% (n = 76/125), 36,0% (n = 45/125), respectivamente. Además, 22 pacientes (17,6%) recibieron todos los medicamentos clave contra el cáncer, 37 pacientes (29,6%) recibieron 3 de los medicamentos clave, 30 pacientes (24,0%) recibieron 2 de los medicamentos clave, y 36 pacientes (28,8%) recibieron solo uno de los principales medicamentos contra el cáncer. Los horarios y dosis de CP, S-1 y 5-FU se basaron en los informes anteriores [17]. Paclitaxel como monoterapia se repitió tres veces por semana durante 4 semanas y el docetaxel en monoterapia se administra por infusión intravenosa analiza una vez cada 3 semanas.
Estadístico
Se evaluó la proporción de cada uno de KRAS
, BRAF
, PIK3CA
y las ANR
mutación en el valor pronóstico de estas mutaciones, que se ajustaron las variables de características de los pacientes en términos de supervivencia global (SG) en el grupo B. metastásico OS cohorte entera y se define como el intervalo entre el inicio de quimioterapia de primera línea hasta la muerte o el último seguimiento.
Se realizaron análisis estadísticos mediante el software estadístico SPSS, versión 19 (IBM, Tokio, Japón). Las diferencias en la distribución de las variables se evaluaron mediante la prueba exacta de Fisher o la prueba de chi-cuadrado, según el caso. tiempo medio de supervivencia (MST) se estimó por el método y las curvas de supervivencia de Kaplan-Meier se compararon mediante la prueba de log-rank. Todas las pruebas fueron de dos caras y un valor de p < 0,05 se definió como estadísticamente significativo. Se estimó la razón de riesgo (HR) y el correspondiente intervalo de confianza del 95% (IC) para el sistema operativo utilizando análisis univariados y multivariados de los modelos de riesgo proporcional de Cox. Las variables en este análisis fueron: edad (≥median /< mediana), el género (hombre /mujer), ECOG (0 /1-2), el tipo histológico de la clasificación de Lauren (tipo intestinal /tipo difuso), el número de sitios metastásicos ( resultados individuales /múltiple).
la secuenciación directa de muestras de tejido en el grupo B determina la proporción de cada uno de KRAS
, BRAF
, PIK3CA
y las ANR gratis (Tabla 1). Las mutaciones de KRAS
codón 12 (3,7%, n = 6/164) y KRAS
codón 13 (1,2%, n = 2/164), PIK3CA
exón 9 (4,9%, n = 8 /163), PIK3CA
exón 20 (0,6%, n = 1/163) y las ANR
mutaciones (1,9%, se detectaron n = 3/159). Por otra parte, las mutaciones en KRAS
codón 61, KRAS
codón 146, BRAF V600E
, y las ANR
codón 146 no fueron detectados. KRAS
codón 12 mutaciones consistieron en G12D (35G > A, n = 4), G12S (34G > A; n = 1) y G12N (34 35GG > AA; n = 1), y el codón 13 mutaciones Consistió en G13S (37G > A; n = 1) y G13V (38 39GC > TT; n = 1). PIK3CA
exón 9 mutaciones consistieron en E542K (1624G > A; n = 2), E545K (1633G > A; n = 5), y E545D (1635G > C; n = 1), y el exón 20 mutaciones consistido en H1047R (3140A > G; n = 1). NRAS
mutaciones consistieron en G12S (34G > A; n = 1) y G13S (37G > A; n = 1). Había 70 pacientes cuyo tejido tumoral contenida tipo todo-silvestres de KRAS gratis (exon2, 3, 4), BRAF gratis (exón 15), PIK3CA gratis (exon9, 20) y las ANR gratis (exon2 , 3). Entre los pacientes cuyo tumor de tejido AGC contenida mutaciones genéticas, mutaciones de KRAS múltiples
codón 13, PIK3CA
codón 545 y las ANR
codón 12 se detectaron en sólo uno case.Table 1 Resultados de las mutaciones del gen KRAS de, BRAF, y PIK3CA ANR de AGC pacientes
Las mutaciones génicas
Proporción (%)
muestras de ADN insuficiente
KRAS codón 12
6/164 (3,7)
3/167
KRAS codón 13
2/164 (1,2)
3/167
KRAS codón 61
0/131 (0.0)
36/167
KRAS codón 146
0/137 (0.0)
30/167
BRAF V600E
0/136 (0.0)
31/167
PIK3CA exón 9 página 8 /163 (4.9)
4/167
PIK3CA exón 20
1/163 (0,6)
4/167
ANR codón 12
1/159 (0,6) página 8 /167
ANR codón 13
2/159 (1,3)
8/167
ANR codón 61
0/135 (0.0)
32/167
Las características clinicopatológicas de cada mutación genética en comparación con el tipo salvaje todo se resumen en la Tabla 2. la edad media de los pacientes cuyo tejido tumoral contenida mutaciones de KRAS
, PIK3CA
y las ANR gratis (54,5, 58,0 y 56,0 años, respectivamente) fueron inferiores a la de los pacientes que contienen todos los tipos silvestres de KRAS, BRAF, PIK3CA
y las ANR gratis (edad media, 64,0 años).
Hay hubo diferencias significativas, excepto para el tipo histológico, entre variables de características clínico como el género, la edad, el PS ECOG y el número de sitios metastásicos. En comparación con los pacientes de tipo todo-salvajes, las proporciones de tipo intestinal fueron mayores en los pacientes con KRAS codón
12/13 mutación (p = 0,014). El tipo histológico del tumor en todos los pacientes cuyo tejido tumoral contenía NRAS
mutaciones fue el tipo difuso de adenocarcinoma.Table 2 Comparación de las características clinocopathological por estado de mutaciones de genes en comparación con todo tipo salvaje en los pacientes con AGC pacientes
Todo tipo salvaje
KRAS codón
12/13
PIK3CA
exón 9/20
ANR
codon12 /13
KRAS, BRAF, las ANR, PIK3CA
tipo mutante
P-valor
tipo mutante
P CD - valor
tipo mutante
P-valor
Número de pacientes
70 página 8 página 9 página 3
mediana edad
64,0 54,5
58,0 56,0
Sexo (%)
Hombre
49 (70,0) página 7 (87,5) 0,429
página 8 (88.9)
0,432 página 2 (87,5) 1.000
Mujer
21 (30,0)
1 (12,5)
1 (11.1)
1 (12,5)
ECOG PS (%) 0
38 (54,3) página 3 (37,5) 0.466
página 4 (44,4) 0.727
1 (33,3)
0,476
1 ≦
32 (45,7) página 5 (62,5) página 5 (55,6) página 2 (66,7)
tipo histológico (%)
tipo intestinal
20 (28,6) página 6 (75,0) 0,014
página 4 (44,4) 0,443
0 (0,0) 0,556
tipo
difusa
50 (71,4) página 2 (25.0) página 5 (55,6) página 3 (100,0)
Nº de lugar de la metástasis (%)
1
 Lupus:cómo apagar el proceso autoinmune y curarse naturalmente
Lupus:cómo apagar el proceso autoinmune y curarse naturalmente
 ¿Es grave el esófago de Barrett?
¿Es grave el esófago de Barrett?
 Pan de plátano sin cereales, sin lácteos, sin frutos secos y bajo en carbohidratos
Pan de plátano sin cereales, sin lácteos, sin frutos secos y bajo en carbohidratos
 Registros de interés del Programa de Coaching SIBO
Registros de interés del Programa de Coaching SIBO
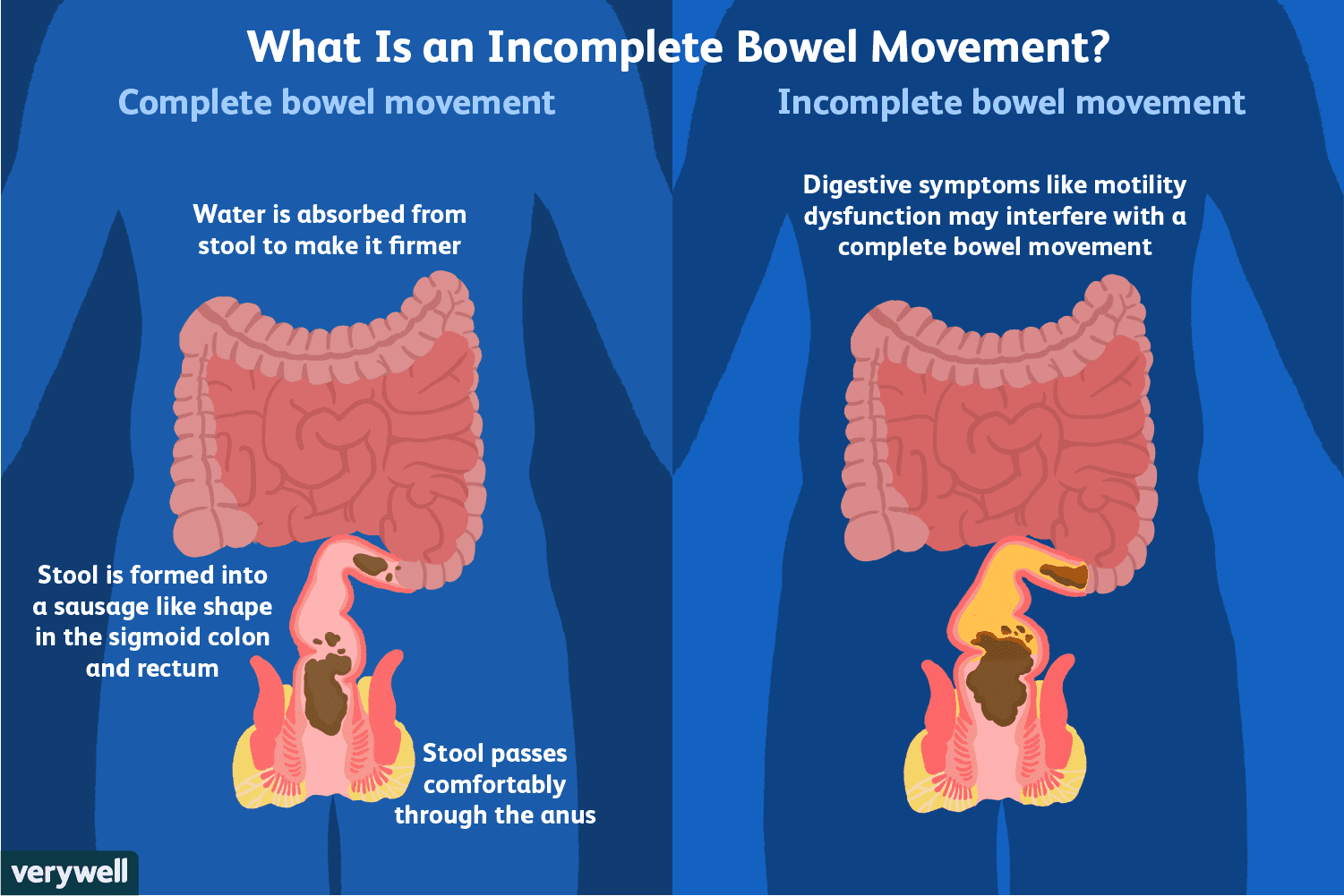 Lidiar con evacuaciones intestinales incompletas
Lidiar con evacuaciones intestinales incompletas
 La verdad:¿Cómo afecta el alcohol a su salud digestiva?
La verdad:¿Cómo afecta el alcohol a su salud digestiva?
 Microbioma de esperma revelado con secuenciación de ARN
Un nuevo estudio informa la primera descripción detallada del microbioma del esperma humano, utilizando técnicas de secuenciación de ARN más nuevas que son capaces de discriminar entre el ARN de esper
Microbioma de esperma revelado con secuenciación de ARN
Un nuevo estudio informa la primera descripción detallada del microbioma del esperma humano, utilizando técnicas de secuenciación de ARN más nuevas que son capaces de discriminar entre el ARN de esper
 El nuevo receptor de macrófagos súper activador podría explicar la hiperinflamación en el COVID-19 grave
La inmunidad es algo curioso. Si bien es esencial para proteger el cuerpo contra patógenos invasores y antígenos extraños, también puede volverse contra el cuerpo y desencadenar procesos inmunológicos
El nuevo receptor de macrófagos súper activador podría explicar la hiperinflamación en el COVID-19 grave
La inmunidad es algo curioso. Si bien es esencial para proteger el cuerpo contra patógenos invasores y antígenos extraños, también puede volverse contra el cuerpo y desencadenar procesos inmunológicos
 ¿Qué es la colangiopancreatografía retrógrada endoscópica (CPRE)?
Una colangiopancreatografía retrógrada endoscópica (ERCP, por sus siglas en inglés) es una prueba de imagen que usa endoscopia y rayos X para ver el interior de los conductos biliares y pancreáticos.
¿Qué es la colangiopancreatografía retrógrada endoscópica (CPRE)?
Una colangiopancreatografía retrógrada endoscópica (ERCP, por sus siglas en inglés) es una prueba de imagen que usa endoscopia y rayos X para ver el interior de los conductos biliares y pancreáticos.