arco doble terapia modulada volumétrica mejora la distribución de la dosis en comparación con IMRT pórtico estático y radioterapia conformada 3D para la terapia adyuvante del cáncer gástrico
Resumen Antecedentes
Francia El objetivo de este estudio fue comparar las distribuciones de dosis de RapidArc (RA ), pórtico estática de radioterapia de intensidad modulada (IMRT), y en tres dimensiones de radioterapia conformacional (3DCRT) como modalidades de radioterapia adyuvante para el tratamiento del cáncer gástrico.
Métodos
Quince pacientes con cáncer gástrico sometidos a linfadenectomía limitada de perigástrica ganglios linfáticos se incluyeron en este estudio. Los valores dosimétricos para una dosis total de 45 Gy (1,8 Gy /día) se calcularon para las modalidades RapidArc, IMRT, y 3DCRT. Se compararon los siguientes parámetros: D
99%, D 1%, V 95%, V 107%, y la conformidad y homogeneidad valores índice (IC y III, respectivamente) para el planeado volumen blanco (PTV). Dosis histograma de volumen (DVH) y distribución de la dosis de los órganos en riesgo (OAR), ya que la dosis máxima a la médula espinal, V 30 y V 40 del intestino delgado, y V 20, V también se evaluaron respectivamente 30 de hígado y riñón.
: resultados de la RA, IMRT, y 3DCRT toda logrado una cobertura PTV deseable. Sin embargo, la AR y la IMRT disminuyeron significativamente D 1% y V 107%, y siempre mejor IC y los valores de HI en comparación con 3DCRT (P Hotel < 0,05). Por otra parte, RA también logró una dosis máxima significativamente menor para la médula espinal, hígado V 30, y el riñón V 20 en comparación con IMRT y 3DCRT; mientras que la dosis media para estos tres tipos de órganos no difirió de los planes de la AR, IMRT, y 3DCRT.
Conclusiones
Tanto la AR y la IMRT lograron una cobertura favorable en comparación con PTV 3DCRT. Además, la AR logra mejor dosimetría de IMRT y 3DCRT, y proporciona una mejor protección de la médula espinal, hígado y riñones.
Palabras clave
doble arco volumétrica modulada terapia de arco radioterapia de intensidad modulada tridimensional radioterapia conformacional gástrico Antecedentes El cáncer de Francia El estudio reveló INT0116 los beneficios de supervivencia de la radioterapia postoperatoria para pacientes con cáncer gástrico [1, 2]. Por otra parte, tanto el de 3 años y 11 años de seguimiento los resultados confirmaron la supervivencia y libres de enfermedades beneficios de supervivencia global de la radioterapia [1, 2]. A pesar de estos resultados, sin embargo, la radioterapia del cáncer gástrico sigue siendo controvertido. En concreto, existen dudas acerca de la toxicidad inducida por la radiación. Los niveles de toxicidad reportados para el estudio INT0116 incluyen grado 3 (40%), grado 4 (32%), y la toxicidad gastrointestinal (33%), y tres casos involucrados muertes relacionadas con el tratamiento. En consecuencia, la toxicidad relacionada con el tratamiento sigue siendo un factor limitante para la aplicación de la radioterapia del cáncer gástrico [1].
En los últimos años, en tres dimensiones radioterapia conformacional (3DCRT) y la radioterapia de intensidad modulada (IMRT) han sido ampliamente utilizados para el tratamiento de cáncer. Estas técnicas frente a los inconvenientes de las técnicas anteroposterior-posteroanterior convencionales, tales como bajo-dosis de las regiones de destino y la radiación excesiva a las estructuras circundantes normales. Una ventaja de la tecnología de IMRT sobre 3DCRT para el tratamiento de carcinoma nasofaríngeo, cáncer de próstata, y cáncer de pulmón se ha mejorado la distribución de dosis dentro del área objetivo, un mejor control de punto de acceso de la dosis, y la reducción de la exposición de radiación a órganos de riesgo (OAR), incluyendo el cerebro tallo y la médula espinal [3-5]. Sin embargo, sigue siendo objeto de debate si la IMRT o 3DCRT es mejor para la radioterapia del cáncer gástrico [6, 7]. En nuestro estudio anterior, IMRT se ha encontrado que proporciona una mejor uniformidad de destino y conformalidad de cuatro campos 3DCRT. Sin embargo, IMRT no redujo la dosis aplicada a la OAR (por ejemplo, el hígado y los riñones) [8]. Por lo tanto, la disponibilidad de nuevas tecnologías es de gran interés.
RapidArc (RA) es un tipo de IMRT dinámico que implica la aplicación de un haz de rotación de acuerdo a la teoría de la rotación de Otto de la radioterapia de intensidad modulada. En pocas palabras, cambiando dinámicamente la velocidad de pórtico rotación, la forma de las hojas de varios colimador, y la tasa de dosis, RA puede lograr rápidamente y eficientemente la distribución de dosis de radiación superiores [9]. Como tal, la tecnología de RA tiene el potencial para acortar el tiempo de tratamiento y reducir la posibilidad de movimiento del blanco durante el tratamiento, lo que aumenta la precisión del tratamiento. Actualmente, la literatura disponible sobre RA se centra principalmente en el tratamiento de cáncer de mama, de próstata, y cáncer de pulmón [10-12]. Por el contrario, sólo unos pocos estudios han informado de las aplicaciones clínicas de la AR para el cáncer gástrico [13].
Hasta la fecha, ninguno de 3D-CRT IMRT ni han demostrado una clara ventaja en la radioterapia del cáncer gástrico. Esto se atribuye principalmente a la extensa región de la OAR que está involucrado. También queda por determinar si la tecnología RA sería mejorar el resultado de la radioterapia del cáncer gástrico. Por lo tanto, el objetivo de este estudio fue comparar la distribución de dosis de la AR, IMRT pórtico estático, y 3DCRT para el tratamiento de la radioterapia del cáncer gástrico mediante el análisis dosimétrico, y para evaluar la cual la tecnología de radiación externa es el mejor para el tratamiento postoperatorio de cáncer gástrico. Métodos Los pacientes
Entre octubre de 2010 y diciembre de 2011, 15 pacientes con cáncer gástrico que se sometieron a cirugía D1 en nuestro hospital se inscribieron en este estudio. De acuerdo con el manual de estadificación AJCC 2010 para el cáncer gástrico [14], hubo 6 pacientes en estadio T3 y T4 9 pacientes en etapa. Además, los ganglios linfáticos en 7/9 pacientes fueron negativos. Los tumores primarios se encuentran en el cardias (n
= 4), el píloro (n
= 6), o en el cuerpo gástrico (n
= 5). Para este estudio retrospectivo, todos los pacientes completaron el tratamiento 3D-CRT antes de diciembre de 2011. Sobre la base de las imágenes de TC que se recogieron, se generaron tres planes de tratamiento diferentes (3DCRT, IMRT, y RapidArc) con el fin de comparar las distribuciones de dosis de cada . Este estudio fue aprobado por el comité ético del hospital y el consentimiento informado se obtuvo de todos los pacientes.
La colocación del paciente
Cada paciente alcanzó una posición supina con sus manos sobre su pecho. A continuación, esta posición se fija mediante una máscara termoplástica. Los pacientes ayunaron 4 h antes de la simulación exploraciones de tomografía computarizada (TC), y se les administró iohexol en 200 ml de agua por vía oral 10 minutos antes de colocar. Las tomografías computarizadas mejoradas se realizaron con un grosor de corte de 3 mm. Las imágenes de TC fueron trasladados a la red Aria (sistema de Varian) y se reconstruyeron utilizando el sistema de planificación de tratamiento ECLIPSE (versión 11, Sistema de Varian Medical, Palo Alto, CA, EE.UU.) Objetivo y OAR.
delimitación
Según el Informe 62 [15] de la Comisión Internacional de Unidades y Medidas de la Radiación que se refiere a la TC y otros métodos de imagen, el volumen blanco clínico (CTV) incluía la anastomosis, lecho del tumor y los ganglios linfáticos regionales. El volumen blanco de planificación (PTV) se definió como una expansión uniforme mm 5 de la CTV. El hígado, el riñón izquierdo, riñón derecho, la médula espinal, el intestino delgado, el corazón y otros OAR se delinearon paso a paso como se describe anteriormente [16].
Planificación del tratamiento sobre Three planes de tratamiento de radioterapia se generaron utilizando la Varian Eclipse sistema de planificación de tratamiento (versión 11, Varian Medical System, Palo Alto, CA, EE.UU.) por un físico experimentado. Para cada uno de los planes, 6 MV haces de fotones de una máquina Trilogy (Varian Medical System) fueron utilizados y los cálculos de dosis se realizaron utilizando el algoritmo Acrous XB. Para 3DCRT 4-campo, el centro de la PTV fue designado el centro del campo de irradiación. Se encontró que la técnica de la caja en 3DCRT para proteger mejor la OAR en comparación con las técnicas de haz medio y el uso de cuñas. Por lo tanto, en este estudio, se seleccionó la técnica de la caja y los ángulos de incidencia utilizados fueron 0 °, 90 °, 180 °, y 270 °. La dosis aplicada en el centro del plano central también se establece como la referencia. Para de campo fijo deslizante IMRT ventana, el ángulo de pórtico se fijó en 0 °, 35 °, 90 °, 180 °, y 315 °. Para la AR, el doble arco coplanar incluyó 358 ° de la terapia de rotación, con 179 ° como el ángulo inicial y 330 ° como el ángulo final. Una tasa de dosis máxima de 600 unidades de monitor (MU) /se aplicó min. Para los tres planes, la dosis prescrita para el PTV fue 45 Gy /25 F. Esta dosis fue establecida para asegurar que > 95% de la PTV recibió 45 Gy, y 99% de la PTV recibido > 42,75 Gy. Para la OAR, a menos de 30% de todo el volumen del hígado se le permitió recibir > 30 Gy (V 30 ≤30%). Para el riñón contralateral, el volumen expuesto a más de 20 Gy también se limitó a < 30% (V 20 < 30%). La dosis media permitido (D media) para cada riñón era < 18,0 Gy, y la dosis máxima permitida para la médula espinal fue < 45 Gy. exposición a la radiación en el intestino delgado también se redujo al mínimo durante la generación de los planes de tratamiento de radioterapia. El V 40 y V 25 para el corazón eran < 30% y < 50%, respectivamente [16, 17]
Evaluación y comparación de los tres planes de tratamiento
distribuciones de dosis a. se evaluaron los órganos diana y la OAR para los quince pacientes. histogramas de volumen de dosis (DVH) también se generaron y se comparan, con los parámetros de dosimetría específicos evaluados como sigue:
Para evaluar la cobertura de objetivo, la dosis recibida por 99% y 1% del volumen (por ejemplo, D 99% y D 1%, respectivamente) se define como métrica para las dosis mínima y máxima [18]. Los volúmenes que reciben al menos el 95% y el 107% de la dosis prescrita (V 95% y V 107%, respectivamente), así como la homogeneidad del objetivo y del índice de conformación valores (HI y CI, respectivamente), fueron también en comparación. HI se calculó como: HI = (D2-D98) /D50. Cuanto mayor sea el valor HI, cuanto más pobre es la uniformidad de la distribución de la dosis [19]. IC se calculó como sigue: V T, ref /V T × V T, ref /V ref, donde V T, ref es el volumen de destino cubierto por el línea de referencia de isodosis, V T es el volumen blanco (PTV =), y V ref es el volumen de tejido cubierto por la línea de isodosis de referencia. El valor de CI varía entre 0 y 1, y un valor más cerca de uno indica una mayor conformidad de la dosis a la PTV [20, 21]. La dosis uniforme equivalente (DUE) para cada PTV se comparó.
Distribución de dosis a los órganos vitales, incluyendo los riñones, el hígado, el intestino delgado, y de la médula espinal, también fueron evaluados. Los parámetros que se compararon incluyen dosis media (D media) y V 20 para los riñones (V 20 es el porcentaje en volumen de los riñones que recibieron al menos 20 Gy), D significan y V 30 para el hígado, V 30 y V 40 para el intestino delgado, y la dosis máxima (D max) y D 1% de la médula espinal. Monitorear unidades (MU) también se compararon entre los tres planes.
El análisis estadístico
SPSS (versión 17.0, SPSS Inc., Chicago, IL, EE.UU.) se utilizó para el análisis de datos. Se realizaron pruebas de Wilcoxon no paramétrica o de dos colas t
: pruebas para comparar los grupos. Un
p-valor
inferior a 0,05 fue considerado estadísticamente significativo. Resultados
comparación PTV
Los tres planes cumplen el requisito de dosis, y no hubo diferencias significativas en el D 99% como mínimo la dosis y el volumen objetivo V 95% entre ellos. Sin embargo, el plan RA redujo significativamente la dosis máxima de destino y el volumen de dosis alta (por ejemplo, D 1% y V 107%, respectivamente) en comparación con los planes 3DCRT y IMRT, y la diferencia entre el 3DCRT y los planes de IMRT no fue significativa. Tanto la IMRT y RA redujeron significativamente la DUE del PTV en comparación con 3DCRT (P Hotel < 0,05). En cuanto a la uniformidad de destino, tanto IMRT y RA también ha mejorado la uniformidad PTV en comparación con 3DCRT (P Hotel < 0,05). Además, los valores de CI fueron 0,91 ± 0,02 para la AR, 0,89 ± 0,04 para IMRT, y 0,71 ± 0,01 para 3DCRT. El primero era mucho más cerca de un valor de 1 en comparación con el IMRT y planes 3DCRT (P
< 0,05) (Tablas 1 y 2;. Las figuras 1 y 2) .Tabla 1 Resumen de los parámetros DVH examinado
parámetros
3DCRT media ±
IMRT media ±
RA media ±
PTV
D1% (Gy)
49.9 ± 0,29 48,2 ± 0,17
48,4 ± 0,24%
D99 (Gy)
40,5 ± 0,43 40,3 ± 0,41
40,1 ± 0,37%
V95 (%)
96,6 ± 0,61 98,9 ± 0,33
98,5 ± 0,62%
V107 (%) 13,6 ± 3,7
1.02 ± 0.01 1.02 ± 0.01
EUD (Gy)
47,3 ± 0,09 46,8 ± 1,45
46,4 ± 0,06
HI
0,1 ± 0,01 0,05 ± 0,01
0,07 ± 0,01
CI
0,71 ± 0,02
0,89 ± 0,04 0,90 ± 0,02
hígado normal
dmean (Gy)
17,6 ± 0,82 14,2 ± 0,73
15.3 ± 1.1
V30 (%)
12.3 ± 1.6 12.7 ± 1.3
6,90 ± 1,4
riñón izquierdo
dmean (Gy)
13.2 ± 1.21
15,3 ± 0,63 14,1 ± 0,61
V20 (%) 29,9 ± 2,5
27,7 ± 1,8 22,4 ± 3,6
riñón derecho
dmean (Gy)
11.9 ± 1.4 13.5 ± 0.65
12,2 ± 0.90
V20 (%)
19,2 ± 1,1 16,2 ± 1,1
12.7 ± 1.3
intestino delgado
dmean (Gy): perfil del 13,1 ± 0,83 12,4 ± 0,39
13,1 ± 0,76
V30 (%)
17,2 ± 0,61 16,5 ± 0,67
15,6 ± 0,83
V40 (%)
11,0 ± 0,38 9,78 ± 0,93
9,15 ± 0,44
la médula espinal
D1% (Gy)
33,0 ± 0,74 31,0 ± 0,29
27.8 ± 0.75
MU
250 ± 3,4
694 ± 3,9 ± 6,8
399
Abreviaturas: 3DCRT: radioterapia conformada 3D; IMRT: la radioterapia de intensidad modulada; RA: RapidArc; PTV: volumen del tumor planificada; Dn%: dosis recibida por n% del volumen; Gy: Gray (unidad); Vx%: el volumen de recepción de ≥ x% de la dosis prescrita; EUD: dosis uniforme equivalente; HI: índice de homogeneidad; IC: índice de la conformidad; Dmean: la dosis media para el órgano; Vn: la dosis n volumen de recepción de la radiación (Gy); MU: unidades de monitor; EUD: dosis equivalente uniforme sobre Table 2 Las diferencias entre los tres métodos con respecto a los parámetros DVH
Parámetros
P-valores
general
3DCRT vs. IMRT
3DCRT vs RA
IMRT frente a la AR
PTV
% D1 (Gy)
0,003
3DCRT > IMRT **
3DCRT > ** RA -
D99% (Gy)
0,803
- - -
V95% (%)
0,533 -
- -
V107% (%)
0,005
3DCRT > IMRT *
3DCRT > AR * -
EUD (Gy)
0,012
3DCRT > IMRT *
3DCRT > AR *
_
HI
0,03
3DCRT > IMRT *
3DCRT > AR * -
CI
0,001
3DCRT < IMRT *
3DCRT < AR * -
hígado normal
dmean (Gy)
0,058
3DCRT > IMRT ** CD -
- V30 (%)
0,006 -
3DCRT > RA **
IMRT > RA **
riñón izquierdo
dmean (Gy)
0,335
- - -
V20 (%)
0,137 -
3DCRT > AR * -
derecho del riñón
dmean (Gy)
0,912
- - -
V20 (%)
0,005 CD -
3DCRT > ** RA -
intestino delgado
dmean (Gy)
0.657
- - -
V30 (%)
0,075 CD - CD -
- V40 (%)
0,453
- - -
la médula espinal
D1% (Gy)
0,011
-
3DCRT > AR *
IMRT > AR *
MU
0,001
IMRT > 3DCRT **
IMRT > RA **
Abreviaturas: 3DCRT: radioterapia conformada 3D; IMRT: la radioterapia de intensidad modulada; RA: RapidArc; PTV: volumen del tumor planificada; Dn%: dosis recibida por n% del volumen; Gy: Gray (unidad); Vx%: el volumen de recepción de ≥ x% de la dosis prescrita; EUD: dosis uniforme equivalente; HI: índice de homogeneidad; IC: índice de la conformidad; Dmean: la dosis media para el órgano; Vn: la dosis n volumen de recepción de la radiación (Gy); MU: Monitor de unidades
* P Hotel < 0,05; ** P Hotel < 0,01
Fig. 1 Comparación de las distribuciones de isodosis PTV logrados con 3DCRT, IMRT, y las modalidades de radioterapia adyuvante RapidArc
Fig. 2 La media de histogramas dosis volumen de PTV, CTV, OAR, y el tejido sano para el análisis global de acuerdo con el plan de tratamiento. 3DCRT: radioterapia conformada 3D (azul); IMRT: intensidad modulada radioterapia (rojo); RapidArc: doble arco RapidArc (verde)
Evaluación de la OAR
Investigaciones anteriores han demostrado que la D significa y V 30 para el hígado son importantes predictores de daño hepático inducido por la radiación [8] . En el presente estudio, V 30 para el hígado era (12,32 ± 1,61)% para 3DCRT, (12,73 ± 1,33)% para IMRT, y (6,90 ± 1,41)% para la AR. Este último fue significativamente menor que los otros dos métodos (P
< 0,05). Además, la D significa para el hígado fue 17,61 ± 0,82 Gy para 3DCRT, 14,22 ± 0,23 Gy para IMRT, y 15,31 ± 1,11 Gy para la AR. Tanto la IMRT y RA redujo la dosis de radiación media para el hígado, sin embargo, la diferencia no fue significativa (Tablas 1 y 2; Fig. 2). En un estudio anterior de Matzinger y Dawson [16, 17], las dosis de tolerancia recomendados para los riñones estaban V 20 < 30% y D media < 18 Gy. En el presente estudio, el V 20 para el riñón izquierdo o derecho con el plan de la AR fue inferior a la de la IMRT y planes 3DCRT. En concreto, el tratamiento de la AR disminuyó V 20 del riñón izquierdo por el 25,17%, y el riñón derecho por el 33,94%. Además, la dosis media para ambos riñones fue mayor tanto para el IMRT y planes con AR en comparación con 3DCRT, aunque la diferencia no fue significativa (P
> 0,05) (Tablas 1 y 2; Fig. 2).
< 40, así como la D O sea, se evaluó también la V sub> 30 y V para el intestino delgado. En comparación con 3DCRT, IMRT y RA sólo redujo moderadamente V 30 y V 40, y las diferencias no fueron significativas. En contraste, RA aumentó ligeramente la D significa del intestino delgado, aunque esta diferencia también no fue significativa (P
> 0,05) (Tablas 1 y 2; Fig. 2).
Para la médula espinal, los tres planes cumplen los requerimientos de la dosis. Las dosis máximas de radiación para D 1% fueron 32,98 ± 0,74 Gy para 3DCRT, 31,01 ± 0,29 Gy para IMRT y 27.80 ± 0.75 Gy para la AR. En comparación con 3DCRT, RA redujo significativamente la médula espinal D valor máximo de 15,71% (Tablas 1 y 2; Fig. 2).
Comparación de MU y parámetros de entrega de un comentario El MU para IMRT y RA fueron 694,25 ± 3.91 y 399.00 ± 6.81, respectivamente. Por lo tanto, RA redujo significativamente la dosis de radiación recibida por 42,5% en comparación con IMRT. Sin embargo, RA requiere un mayor número de MU que 3DCRT. Además, una cuña físico no fue utilizado para los tratamientos 3DCRT ya que esto podría aumentar el número de MU, y también podría aumentar el potencial de radiación de fuga (Tablas 1 y 2). La tasa de dosis para cada técnica fue de 400 MU /min para 3DCRT, 600 MU /min para IMRT, y casi 600 MU /min para ARC. Por lo tanto, los tiempos de tratamiento relativos para cada técnica fueron:. 3,2 ± 0,3 min para la AR, 6,6 ± 1,2 min para IM, y 4,2 ± 0,5 min para CRT
Discusión
Actualmente, quimiorradioterapia posoperatoria es uno de los principales tratamientos para los casos de cáncer gástrico con un mal pronóstico. Sin embargo, debido a la proximidad de esta región para muchos órganos vitales, sigue siendo un reto para cubrir eficazmente el área de destino y proteger órganos vitales vecinos. Para las modalidades de radioterapia adyuvante, ha sido difícil lograr una distribución de dosis ideal, con 3DCRT tradicional, mientras que la IMRT es capaz de optimizar simultáneamente dosis objetivo y reducir la exposición de la OAR. La IMRT también se ha demostrado para mejorar efectivamente el control local del tumor, para reducir la magnitud de los daños por radiación a los tejidos normales, y mejorar la calidad de vida del paciente [22]. Sin embargo, en nuestro estudio anterior de 3DCRT y IMRT para el tratamiento de cáncer gástrico, los datos de dosimetría de la radiación indicaron que IMRT no mostró una ventaja significativa sobre 3DCRT, con 3DCRT ser superior a IMRT para V 20 de los riñones izquierdo y derecho [8]. Por lo tanto, todavía se necesitan nuevas técnicas de radioterapia para el tratamiento del cáncer gástrico. Tecnología
RA tiene el potencial para acortar el tiempo de tratamiento y reducir la posibilidad de movimiento del blanco durante el tratamiento, que serviría para aumentar el tratamiento de precisión [18]. RA previamente se ha aplicado al tratamiento de muchos tipos de tumores [23, 24]. Por ejemplo, en el trabajo por Verbakel et al. [25], doce pacientes con cabeza y cuello cáncer avanzado recibieron IMRT frente a la terapia de radiación AR. El tratamiento con RA se ha encontrado para mejorar la uniformidad de la dosis objetivo y para reducir la exposición de la vecina OAR. Por otra parte, el doble arco de la AR proporciona ventajas adicionales en comparación con dosimétricos solo arco AR y la IMRT. Estas ventajas se confirmaron con el tratamiento de cáncer de pulmón y cáncer de próstata con doble arco de la AR [11, 12]. Sin embargo, para la radioterapia del cáncer gástrico, la forma del objetivo de radiación es irregular y los órganos circundantes, incluyendo el hígado y los riñones, tienen una baja tolerancia a la radiación. Por lo tanto, queda por determinar si una técnica IMRT volumétrica rotativa será ventajoso para la radioterapia del cáncer gástrico. México La cohorte estudiada incluyó a 15 pacientes con cáncer gástrico postoperatorio. Sobre la base de la ubicación de sus lesiones y de formación de imágenes CT, 3DCRT (4-campo), IMRT (5-campo), o planes de tratamiento con AR fueron aplicados. La dosis de prescripción incluye 45 Gy /25 F aplicada a la PTV, con > 95% de la PTV recibir 45 Gy y 99% de la PTV recibir 42,75 Gy. Los tres planes cumplen los requisitos de dosis y no hubo diferencias significativas entre ellos. Por otra parte, la IMRT y RA redujo la dosis máxima de destino y el rango de altas dosis (D 1%, V 107%) en comparación con 3DCRT. IMRT y RA también fueron superiores a 3DCRT para la uniformidad del volumen de destino. El valor de CI para la AR fue significativamente más cerca de uno de los valores de CI para IMRT y 3DCRT, lo que sugiere se logró una mejora conformalidad. Para objetivos con formas más grandes y complejas, la AR se ha encontrado para proporcionar una mejor distribución de la dosis, mejor PTV conformalidad objetivo, y una mejor distribución de la dosis objetivo, y estos resultados son consistentes con estudios anteriores [13]. Por lo tanto, la AR tiene el potencial de reducir los efectos secundarios relacionados con el tratamiento.
En los primeros estudios de tolerancia de órganos a la radiación ionizante, radiosensibilidad del hígado puede haber sido subestimado. las dosis de tolerancia eran limitadas en función del riesgo de enfermedad hepática inducida por la temperatura ambiente, y la dosis media y V30 para el hígado se consideraron importantes parámetros dosimétricos asociados con un mayor riesgo de toxicidad [26]. Mientras tanto, estudios más recientes han demostrado que las células normales del hígado son sensibles a la radiación, sobre todo cuando el hígado está infectado con virus de la hepatitis B [26]. En consecuencia, Dawson et al. [27] han sugerido que la dosis de tolerancia para el hígado debe ser inferior a 30% para V 30, y la D media debe ser inferior a 30 Gy. Para los casos de infección por hepatitis B, la D media debe ser inferior a 23 Gy. Además, según los análisis cuantitativos de los efectos de tejido normal en el esfuerzo Clinic (QUANTEC), la dosis media del hígado debe ser menor de 28 Gy en fracciones de 2-Gy para el cáncer primario de hígado, y debe ser inferior a 32 Gy en 2-Gy fracciones para las metástasis hepáticas [26]. En el presente estudio, el hígado V 30 fue (12,32 ± 1,61)% para 3DCRT, (12,73 ± 1,33)% para la IMRT, y (6,90 ± 1,41)% para la AR, siendo este último significativamente más bajos que los dos primeros valores (P Hotel < 0,05). Hígado D media fue de 17,61 ± 0,82 Gy para 3DCRT, 14,22 ± 0,23 Gy para IMRT, y 15,31 ± 1,11 Gy para la AR, y éstos no difirió significativamente. En comparación con 3DCRT y IMRT, RA redujo significativamente hígado V 30, sin embargo, no afectó a la dosis promedio de hígado. Por otra parte, a pesar de la reducción significativa en el hígado V 30, un análisis del volumen de la DVH mostró que V 10 aumentó. Estos resultados son consistentes con los reportados para un estudio de tratamiento de radiación del cáncer de hígado realizado por Kuo et al. [28]. Francia El riñón es otro órgano importante que se ve amenazada por la radioterapia del cáncer gástrico. tejido renal es sensible a la radiación, y las dosis de tolerancia de radiación recomendados son 23 Gy para todo el riñón, 30 Gy para 2/3 del riñón, y 50 Gy para 1/3 del riñón. Un estudio realizado por Jansen et al. además sugirió que la dosis renal medio fue menos importante que V 20. Por lo tanto, se recomienda que < 70% del volumen de riñón debe recibir 20 Gy (V 20 < 70%), mientras que el V 20 para el riñón contralateral debe ser < 30% [29] . En total, los tejidos renales expuestos a más de 20 Gy no debe superar el 50% de todo el riñón, de lo contrario, se puede producir el daño inducido por la radiación al riñón, tales como una disminución en la tasa de filtración glomerular y /o insuficiencia renal. Por lo tanto, un objetivo permanente es la reducción de la dosis de radiación a los riñones durante la radioterapia postoperatoria para el cáncer gástrico. Minn et al. [30] estudiaron la dosimetría, la eficacia y toxicidad de planificación de la radioterapia con 3DCRT e IMRT de 57 casos de cáncer gástrico, y la IMRT se ha encontrado para reducir los riñones V 20. En nuestro estudio anterior, no se observó ninguna diferencia obvia en el V 20 de riñón entre IMRT y 3D-CRT, aunque IMRT exhibió la cobertura del tumor favorable y la superioridad en la protección de la médula espinal y el hígado. Sin embargo, esta superioridad no se observó en el riñón en comparación con 3D-CRT. Por lo tanto, IMRT no parece representar un tratamiento superior para el cáncer gástrico [8]. Del mismo modo, en nuestro único arco posterior ensayo de artritis reumatoide, la dosis de radiación riñón fue no redujo significativamente, sin embargo, el doble arco de la AR disminuyó significativamente riñón V 20 en comparación con IMRT y 3DCRT de ambos riñones. Mientras tanto, no hubo una diferencia obvia en el D significa para ambos riñones entre los tratamientos 3D-CRT, IMRT, y RA. En conjunto, estos resultados sugieren que la RA puede proporcionar un efecto protector para los riñones en comparación con IMRT.
Toxicidad gastrointestinal es el principal factor limitante para la aplicación de la terapia de radiación para el cáncer gástrico. Correspondientemente, la clave para reducir la toxicidad debida a la radioterapia es el control de la exposición del tracto gastrointestinal a la radiación. En muchos estudios, IMRT y RA se ha demostrado para reducir la dosis de radiación en el tracto gastrointestinal durante la radioterapia abdominal. Por ejemplo, Minn et al. [30] demostraron que la IMRT reduce intestinal V 45 en comparación con 3DCRT. En otro estudio de 14 casos de metástasis abdominales tratados con radioterapia, Mario et al. [30] informó de que RA y IMRT reducirse la dosis media y dosis máxima para el estómago y el intestino delgado en comparación con 3DCRT. Sin embargo, la diferencia no fue significativa. En el presente estudio, la dosis media (D media) para el intestino delgado, así como V 30 y V 40, se examinaron. D significar para el intestino delgado no difirió significativamente entre los tres métodos de planificación, sin embargo, un análisis gráfico DVH mostró que la IMRT y RA aumentó V 10 y redujo V 30 y V 40 en comparación con 3DCRT. Por lo tanto, el volumen de la región de baja dosis aumentó concomitante con una disminución en el volumen de la región de alta dosis. Estos resultados son consistentes con la observación de que la dosis media no mostró una diferencia significativa.
La médula espinal es un haz de largo, delgado, tubular de tejido nervioso y es susceptible a la lesión de las altas dosis de radiación locales. Kirkpatrick et al. [31] informaron de que la tasa de incidencia de la radiación mielitis es 0,2, 6, y 50% de la dosis total de 50 Gy, 60 Gy, and_69 Gy, respectivamente, cuando se administra en la fracción convencional de 2-Gy por día. Además, según el Grupo de Oncología de Radiación de la Organización Europea para la Investigación y Tratamiento del Cáncer, la dosis de radiación máxima que se debe aplicar a la médula espinal es de 45 Gy, y no debe ser superior a 40 Gy si la quimioterapia se administre el oxaliplatino, así [dieciséis]. Por lo tanto, la dosis máxima para la médula espinal se fija generalmente a no más de 45 Gy. En el presente estudio, las dosis aplicadas a la médula espinal con cada una de las tres técnicas estaban todos dentro de la dosis tolerada. Por otra parte, en comparación con 3DCRT, la D max para la médula espinal con RA se redujo significativamente hasta en un 15,71%.
RA es una modalidad adyuvante radioterapia que recientemente se ha desarrollado y se ha utilizado para suministrar altas dosis de radiación a una variedad de tumores. Sin embargo, su papel en el tratamiento del cáncer gástrico sigue siendo controvertido debido a los volúmenes de destino irregulares involucrados y la tolerancia a la radiación baja de la que rodea los órganos críticos. En nuestro estudio anterior, RA proporciona homogeneidad dosis superior en comparación con 3DCRT e IMRT, pero no una mejor protección de la OAR. Por otra parte, mientras que la técnica de arco sola no tuvo éxito, la técnica de doble arco fue capaz de lograr la misma distribución de dosis como IMRT, sin afectar significativamente la OAR y el tejido sano proximal. Esta mejora de la protección de los tejidos de hígado y riñón en comparación con IMRT sugiere una dosis más alta podría aplicarse a un volumen de destino mediante doble RA arco. Sin embargo, es importante tener en cuenta las limitaciones de nuestro estudio también. En primer lugar, no se utilizó una técnica de gating respiratorio, y su influencia en la distribución de dosis no se investigó. Además, el presente estudio tuvo un pequeño tamaño de la muestra y no evaluó la eficacia clínica y toxicidad. Por lo tanto, se necesitan más estudios para confirmar la viabilidad técnica de la aplicación de RA doble arco para el tratamiento del cáncer gástrico, y éstos deben incluir un tamaño y las evaluaciones de la eficacia clínica y la toxicidad de la muestra más grande.
Conclusiones
En resumen, el doble arco RA redujo la dosis máxima aplicada a la zona de destino, se mejoró la conformalidad y la uniformidad de la radiación, y proporcionó suficiente cobertura de PTV. Todos los autores han leído y aprobado el manuscrito final.
 Medidas para prevenir la transmisión del SARS-CoV-2 a través de las aguas residuales en regiones pobres
Medidas para prevenir la transmisión del SARS-CoV-2 a través de las aguas residuales en regiones pobres
 Trastornos de eliminación en niños
Trastornos de eliminación en niños
 El extracto de semilla de xilitol y pomelo se muestra prometedor para prevenir la infección por SARS-CoV-2,
El extracto de semilla de xilitol y pomelo se muestra prometedor para prevenir la infección por SARS-CoV-2,
 ¿Qué es el SII? | Una dietista explica
¿Qué es el SII? | Una dietista explica
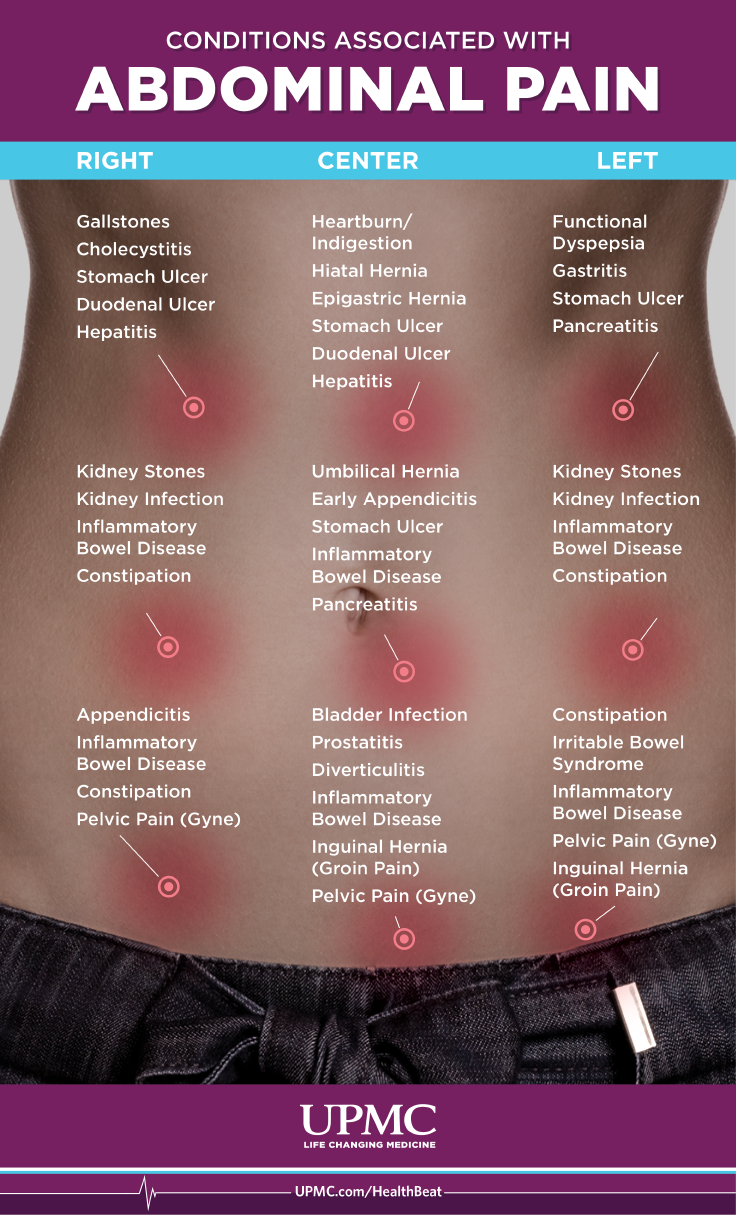 Dolor de estómago:cuándo preocuparse por el dolor de estómago
Dolor de estómago:cuándo preocuparse por el dolor de estómago
 Qué hacer para el estreñimiento recurrente
Qué hacer para el estreñimiento recurrente
 Suelo pélvico y SII | Entrevista con Renae Hunter
¡Hola! Estoy TAN emocionada de traerles una entrevista INCREÍBLE sobre el piso pélvico y el SII que tuve con Renae Hunter de Evidence Sport &Spinal. Se abrió una nueva clínica de fisioterapia en el su
Suelo pélvico y SII | Entrevista con Renae Hunter
¡Hola! Estoy TAN emocionada de traerles una entrevista INCREÍBLE sobre el piso pélvico y el SII que tuve con Renae Hunter de Evidence Sport &Spinal. Se abrió una nueva clínica de fisioterapia en el su
 Fuentes vegetarianas de proteínas en la dieta baja en FODMAP
Esta semana en #AskADietitian cubrimos las fuentes vegetarianas de proteínas en la dieta baja en FODMAP. A menudo, tengo pacientes que me llaman para preguntarme:¿Puedo consumir FODMAP bajo como vege
Fuentes vegetarianas de proteínas en la dieta baja en FODMAP
Esta semana en #AskADietitian cubrimos las fuentes vegetarianas de proteínas en la dieta baja en FODMAP. A menudo, tengo pacientes que me llaman para preguntarme:¿Puedo consumir FODMAP bajo como vege
 Semana 1 de la dieta elemental
Semana 1 de la Dieta Elemental No voy a mentir. La semana 1 de la Dieta Elemental ha sido un reto. Ha habido momentos en los que me he preguntado qué diablos estoy haciendo, que debo estar loco por d
Semana 1 de la dieta elemental
Semana 1 de la Dieta Elemental No voy a mentir. La semana 1 de la Dieta Elemental ha sido un reto. Ha habido momentos en los que me he preguntado qué diablos estoy haciendo, que debo estar loco por d