Contexte
L'étude actuelle a été réalisée pour examiner les effets gastroprotective de Parkia speciosa Constatations Méthodologie /principales de les rats Sprague Dawley ont été séparés en 7 groupes. Groupes 1-2 ont été contestées par voie orale avec carboxyméthylcellulose (CMC); le groupe 3 a reçu 20 mg /kg d'oméprazole et des groupes 4-7 ont reçu 50, 100, 200 et 400 mg /kg d'extrait éthanolique de feuilles, respectivement. Après 1 h, CMC ou l'éthanol absolu a été administré par voie orale à des groupes 2-7. Les rats ont été sacrifiés au bout de 1 h. Puis, les blessures de la muqueuse gastrique ont été estimés par l'évaluation de la glaire de paroi gastrique, l'aspect brut des zones d'ulcère, histologie, immunohistochimie et dosages enzymatiques. Groupe 2 présentait des blessures muqueuses importantes, avec une réduction du mucus de paroi gastrique et de graves dommages à la muqueuse gastrique, tandis que la réduction des lésions de la muqueuse ont été observées pour les groupes 4-7. Groupes 3-7 ont montré une inversion de la diminution de l'acide périodique de Schiff (PAS) coloration induite par l'éthanol. Aucun symptôme de toxicité ou de décès ont été observés au cours des essais de toxicité aiguë. Le traitement avec l'extrait a conduit à la surexpression de la protéine de choc thermique 70 (HSP70) et la régulation négative de la pro BAX -apoptotic protéique. Des augmentations significatives dans les niveaux de la défense anti-oxydant enzymes glutathion (GSH) et de la superoxyde dismutase (SOD) dans l'homogénat de la muqueuse gastrique a été observée, alors que celle d'un marqueur de la peroxydation lipidique (MDA) était significativement diminué. La signification a été définie comme p < 0,05 par rapport au groupe de contrôle de l'ulcère (Groupe 2) Citation:. Al Batran R, Al-Bayaty F, Jamil Al-Obaidi MM, Abdualkader AM, Hadi HA, Ali HM, et al. (2013) In Vivo activité antioxydante et Antiulcéreux de Parkia speciosa Editeur: Herbert B. Tanowitz, Albert Einstein College of Medicine, États-Unis d'Amérique Reçu 20 Janvier 2013; Accepté: 17 Avril 2013; Publié: 28 mai 2013 Droit d'auteur: © 2013 Al Batran et al. Ceci est un article en accès libre distribué sous les termes de la licence Creative Commons Attribution, qui permet une utilisation sans restriction, la distribution et la reproduction sur tout support, à condition que l'auteur et la source originelle sont crédités Financement:. Les auteurs exprimer ma gratitude à l'Université de Malaya pour le soutien financier de l'UM /MOHE Research Grant High impact (HIR Grant No. F000009-21001). Les bailleurs de fonds ont joué aucun rôle dans la conception de l'étude, la collecte et l'analyse des données, la décision de publier, ou de la préparation du manuscrit Intérêts concurrents:.. Les auteurs ont déclaré aucun conflit d'intérêts existent Introduction les ulcères peptiques, qui sont caractérisés par la présence de lésions de la muqueuse, sont principalement causés par une infection avec Helicobacter pylori Matériaux et réactifs Tous les matériaux et les réactifs ont été obtenus auprès de Sigma (Sigma Aldrich, Allemagne) et le MDA, SOD et kits de mesure de l'activité GSH ont été achetés auprès de Cayman Chemical Company (Cayman, USA). L'oméprazole a été utilisé comme référence et antiulcéreux médicament a été obtenu à partir de l'Université du Centre médical de Malaya (UMMC). Le médicament a été dissous dans 0,5% (p /v) de carboxyméthylcellulose (CMC) et administré oralement aux rats à une dose de 20 mg /kg de poids corporel (5 ml /kg) selon la Mahmood et al [17]. matériel végétal et préparation de l'extrait brut frais les feuilles de Parkia speciosa ont été obtenues à partir des ressources ethno (Selangor, Malaisie). L'identité de la plante a été confirmée au Rimba Ilmu Herbier, Institut des sciences biologiques, Université de Malaya à travers une comparaison avec les spécimens de référence. Les feuilles fraîches ont été accrochés à l'envers dans un endroit chaud et sec (à l'abri du soleil) avec une bonne circulation de l'air pendant deux semaines pour sécher. Puis, en utilisant un mélangeur électrique, les feuilles séchées ont été converties en une poudre fine. Une quantité de 100 g de la poudre a été trempée pendant 3 jours dans un ballon contenant 500 ml d'éthanol à 95%. Le mélange a été filtré à l'aide d'un papier mousseline et filtre fin (Whatman n ° 1). Le mélange filtré a été éliminé par distillation en utilisant un évaporateur rotatif (Eyela, USA) et a abouti à peu près 17,4% de masse sèche. L'extrait séché a été dilué dans du CMC et administrées par voie orale aux rats à une dose de 50, 100, 200 ou 400 mg /kg de poids corporel (dans 0,5% de CMC, 5 ml /kg de poids corporel), en accord avec des rapports antérieurs [18 ]. Toxicité aiguë mâle sain et des rats Sprague Dawley femelles (6-8 semaines) ont été obtenus à partir de la maison des animaux (Université de Malaya, éthique n ° PM /07/05 /2010/1111 /MAA /R). Les rats pesaient entre 180 à 200 g. Les animaux ont reçu des pastilles de rat standard et de l'eau du robinet ad libitum hôtels et ont été placés individuellement dans des cages séparées avec des fonds de fil métallique à larges mailles pour empêcher la coprophagie pendant l'expérience. Une étude de toxicité aiguë a été réalisée afin de déterminer une dose sans danger pour le P. speciosa adultes sains rats Sprague Dawley (6-8 semaines), pesant chacun entre 200-220 g, ont été obtenus à partir de la maison des animaux à l'Université de Malaya (No. Ethic PM /12/05/2010 /MAA /R). Les rats ont été divisés au hasard en 7 groupes de 6 rats chacun et ont reçu une alimentation de granulés standard et l'eau du robinet ad libitum. Ulcère gastrique induction par Ethanol les animaux ont été soumis à un jeûne pendant 24 heures avant l'expérience [17]. Les groupes 1 et 2 ont reçu le véhicule (0,5% de CMC) par voie orale. Groupe 3 a reçu une dose orale de 20 mg /kg oméprazole dans 0,5% de CMC (5 ml /kg), et les groupes 4-7 reçus extrait éthanolique de Parkia speciosa Les animaux ont été sacrifiés et leurs estomacs ont été enlevés. Le contenu de l'estomac ont été recueillies, mesurées, centrifugés et soumis à une analyse de l'acidité titrable contre NaOH 0,01 N à pH 7 [21]. La modification procédure de Piper et al. a été utilisé pour analyser le mucus de la paroi gastrique. Les segments glandulaires de l'estomac du contrôle et les rats traités ont été enlevés et pesés. Chaque segment a été transféré immédiatement à 1% de bleu alcian (dans une solution de saccharose tamponnée à l'acétate de sodium, pH 5) et le colorant en excès a été éliminé par rinçage avec une solution de saccharose. Le colorant dans un complexe avec le mucus gastrique de paroi a été extrait avec du chlorure de magnésium. Un échantillon de 4 ml de l'extrait bleu a été ensuite agité avec un volume égal d'éther diéthylique. L'émulsion résultante a été centrifugée et l'absorbance de la phase aqueuse a été mesurée à 580 nm. La quantité de bleu Alcian extraite par gramme (net) de tissu glandulaire a ensuite été calculée [22]. Les estomacs de rats ont été examinés sous un stéréomicroscope. La longueur et la largeur (mm) de chaque lésion hémorragique individuelle a été mesurée par un planimètre (10 x 10 mm 2 = surface de l'ulcère) sous un microscope à dissection (1,8 fois). La surface de l'ulcère (UA) a été calculée en utilisant la somme des surfaces de toutes les lésions pour chaque estomac selon un protocole publié antérieurement [23]. L'UA a été calculé selon la formule suivante: pourcentage d'inhibition (I%) a été calculé comme suit:. Préparation d'homogénat homogénat de tissu gastrique de 10% (p /v) a été préparée dans un tampon phosphate glacé 50 mM (pH 7,4) contenant un mammifère cocktail inhibiteur de protease, puis centrifugés à 4000 tpm pendant 10 minutes (4 ° C). mesure de la superoxyde dismutase (SOD). l'activité SOD a été mesurée selon le protocole de Sun et al [24]. L'activité enzymatique a été évaluée en mesurant la capacité de l'enzyme pour inhiber la réduction photochimique de nitro-bleu de tétrazolium (NBT). Dans cet essai, la réduction photochimique de riboflavine génère O 2-; ce qui réduit le NBT pour produire un sel de formazan qui absorbe la lumière à une longueur d'onde de 560 nm. En présence de SOD, la réduction du NBT est inhibée parce que l'enzyme convertit le radical superoxyde en peroxyde. Les résultats sont exprimés comme la quantité de SOD nécessaire pour inhiber le taux de réduction du NBT de 50% en nombre d'unités d'enzyme par gramme de protéine. Les surnageants des homogénats ont été centrifugés une deuxième fois (20 minutes, 12 000 tpm, 4 ° C) et le surnageant résultant a été analysée. Dans une chambre noire, 1 ml du réactif (50 mM de tampon phosphate 100 nM d'EDTA et 13 mM de méthionine, à pH 7,8) a été mélangé avec 30 ul de l'échantillon, 150 ul de 75 uM NBT et 300 ul de 2 pm riboflavine. La solution a ensuite été exposée à la lumière fluorescente (15 W) pendant 15 min et lu à l'aide d'un spectrophotomètre à 560 nm. malondialdéhyde tissulaire (MDA) ( mmol /l) a été déterminée en utilisant la méthode du double de chauffage de Draper et Hadley [25]. Un mélange réactionnel contenant 8,1% de dodécylsulfate de sodium, un tampon à 20% d'acétate (pH 3,5) et de l'acide thiobarbiturique à 0,8% (TBA) a été bien mélangée avec 0,2 ml d'estomac homogénat de tissu pendant 3 min, puis mis à incuber à 95 ° C pendant 60 min. Après refroidissement, la substance TBA-réactive (MDA) a été extrait avec 1 ml de H? 2O et 2,5 ml de n-butanol: pyridine mélange (15:01, v /v). La couche organique supérieure contenant le MDA, qui a été produit par la peroxydation des lipides a été mesurée à 532 nm. la muqueuse gastrique a été pesé, émincé avec des ciseaux et homogénéisés à 48 ° C dans une solution saline tamponnée au phosphate (PBS). L'homogénat a été immédiatement précipité avec de l'acide trichloroacétique à 0,1 ml de 25% et le précipité a été éliminé par centrifugation à 4200 rpm pendant 40 min à 4 ° C. Le surnageant a été utilisé dans un essai de 5,5'-dithiobis (2-nitrobenzoïque) pour déterminer le GSH. L'absorbance a été mesurée à 412 nm en utilisant un spectrophotomètre [26]. Les spécimens de la paroi gastrique ont été fixés dans 10% de formaline tamponnée pendant 24 h avant le traitement des tissus de paraffine (Leica, Allemagne). Les tissus de l'estomac ont été sectionnés à une épaisseur de 5 um et colorées avec de l'hématoxyline et de l'éosine pour évaluer la dégénérescence histologique [27]. Les sections de la partie glandulaire du rat l'estomac ont été colorées avec l'acide périodique de Schiff (PAS) comme décrit par McManus et al [28]. coloration immunohistochimique la coloration immunohistochimique pour les protéines HSP70 et BAX a été réalisée selon le protocole du fabricant ( DakoCytomation, États-Unis). Analyse statistique Toutes les valeurs sont rapportées comme la moyenne ± SEM et ont été analysées par une ANOVA suivie d'un test post-hoc de Tukey pour des comparaisons multiples utilisant le progiciel de statistiques pour le logiciel sciences sociales (SPSS 18). Les différences entre les moyennes ont été considérées comme statistiquement significatives lorsque la valeur de p était inférieure à 0,05. Les résultats de l'étude de toxicité aiguë Aucun décès ou une toxicité significative n'a été observée dans le contrôle ou groupes de traitement (doses d'extrait de 1, 3 ou 5 g /kg pendant 14 jours), évaluée sur la base des observations cliniques et histopathologiques. évaluation brute de lésions gastriques l'activité anti-ulcéreux de la Parkia speciosa Les effets de P. speciosa Évaluation histologique des lésions gastriques Les observations histologiques du groupe 1 a indiqué qu'il n'y avait pas de rupture de l'épithélium de surface, alors que l'examen histologique a révélé des dommages importants à la muqueuse gastrique dans le groupe 2, avec des lésions nécrotiques qui pénètrent profondément dans la muqueuse accompagnée d'oedème et leucocytaire une infiltration de la couche sous-muqueuse (fig 3). Le groupe 4 a présenté une perturbation modérée de l'épithélium de surface, d'un oedème et d'une infiltration de leucocytes de la couche sous-muqueuse, et le groupe 5 a montré une légère perturbation de l'épithélium de surface avec un œdème et une infiltration de leucocytes dans la couche sous-muqueuse. Le groupe 6 a montré une légère perturbation de l'épithélium de surface avec un œdème et une infiltration leucocytaire de la couche sous-muqueuse. Groupe 7 a montré un léger œdème et une infiltration leucocytaire de la couche sous-muqueuse, mais aucune perturbation de l'épithélium de surface. Groupe 3 a présenté une rupture légère de l'épithélium de surface, avec muqueux oedème et infiltration leucocytaire. Ces résultats démontrent que les extraits de plantes ont exercé des effets cytoprotecteurs d'une manière dose-dépendante (Figure 3). La muqueuse gastrique chez les animaux prétraités avec PAS intensité de la coloration par rapport aux rats du groupe 2 immunohistochimie l'expression de la protéine HSP70 dans la muqueuse gastrique a été downregulated dans le groupe 2, mais upregulated dans le groupe 3-7 (Figure 5) la coloration immunohistochimique de la muqueuse gastrique de rats prétraités avec Parkia speciosa Le test de toxicité aiguë n'a suggéré aucune toxicité ou de mortalité dans le P. speciosa Nos résultats ont révélé la protection de la muqueuse gastrique et l'inhibition de leucocytes infiltration dans la paroi gastrique chez des rats prétraités avec l'extrait La présente étude a établi que le prétraitement avec Parkia speciosa homogénat de tissu gastrique préparé à partir des groupes qui ont été prétraités avec un extrait de plante présentait une activité antioxydante importante, avec des niveaux de taux élevés de GSH et SOD, MDA et diminue en réponse au stress oxydant dû à un traitement à l'éthanol. SOD convertit superoxyde en peroxyde d'hydrogène (H 2 O 2), qui est transformé en eau par la catalase dans les lysosomes ou par glutathion peroxydase dans les mitochondries [34]. Le MDA est le produit final de la peroxydation lipidique et est utilisé pour déterminer les niveaux de peroxydation lipidique [35]. La peroxydation des lipides entraîne une perte de fluidité de la membrane, le transport d'ions avec facultés affaiblies et l'intégrité de la membrane et, finalement, une perte de la fonction cellulaire. Nos résultats expérimentaux indiquent que Parkia speciosa L'acide-Schiff (PAS), la méthode histochimique périodique produit une coloration au carmin caractéristique dans les régions de l'estomac qui sécrètent des mucopolysaccharides. Des sections de tissus provenant du groupe de rats a été traité avec 400 mg d'extrait /kg de plantes ont présenté une coloration intense qui reflète la sécrétion de mucus dans les glandes gastriques. La production de mucus est l'un des principaux mécanismes de la muqueuse gastrique défense locale [38]. BAX favorise l'apoptose [39], alors que BCL-2 inhibe ce processus. L'apoptose peut être provoqué par un déséquilibre dans l'expression de la famille Bcl-2 des protéines et des protéines anti-apoptotiques BAX apoptotiques dans les ulcères de stress [40]. HSP70 est une protéine de 70 kDa de la famille des HSP qui est exprimé dans des cellules de mammifères. Ces protéines sont responsables de la protection des processus homéostatiques cellulaires de blessures environnementales et physiologiques en préservant la structure des protéines normales et la réparation ou élimination des protéines endommagées [41], et l'étude de cette protéine peut ainsi fournir des données intéressantes pour l'élucidation des mécanismes d'action possibles . HSP70 défend les cellules du stress oxydatif ou de choc thermique. espèces réactives de l'oxygène éthanol généré (ROS) agissent normalement pour inhiber l'expression de HSP70 et d'augmenter l'expression de BAX. HSP70 empêche ces protéines partiellement dénaturées, de l'agrégation et leur permet de se replier. La surexpression de HSP70 qui a été observé dans cette étude suggère que l'extrait de Parkia speciosa protégeait les tissus gastriques par la surexpression de HSP70. En outre, HSP70 a été suggéré d'exercer son activité cytoprotectrice en protégeant les mitochondries et d'interférer avec le programme apoptotique induite par le stress. La coloration immunohistochimique a montré que BAX expression de la protéine a été downregulated chez des rats prétraités avec l'extrait Conclusion En conclusion, P. speciosa de l'extrait a été clairement démontré pour fonctionner comme un agent anti-ulcéreux. Les résultats suggèrent que P. speciosa de l'extrait peut agir en renforçant la protection de la muqueuse gastrique et /ou en inhibant la synthèse des leucotriènes. L'extrait végétal protégé les tissus gastriques par la surexpression de l'HSP70 et la régulation négative de la protéine BAX. Parkia speciosa Remerciements Les auteurs sont reconnaissants au personnel de la Faculté de médecine, et de la Chambre des animaux pour les soins et la fourniture de rats et d'autres qui ont participé à cette travail.
contre gastrique lésion de la muqueuse induite par l'éthanol chez le rat.
Conclusion
éthanolique Leaf Extract contre Ethanol-Induced Ulcère gastrique chez le rat. PLoS ONE 8 (5): e64751. doi: 10.1371 /journal.pone.0064751
, agents antiplaquettaires tels que l'acide acétylsalicylique [1], non-stéroïdiens anti-inflammatoire médicaments (AINS) tels que les bisphosphonates oraux, le chlorure de potassium, les médicaments immunosuppresseurs [2], les inhibiteurs de la recapture de la sérotonine [3], la consommation d'alcool et le tabagisme cigarette [4]. Ces facteurs peuvent causer l'érosion des muqueux et inhibent la cyclooxygénase, perturbant ainsi la protection de la couche muqueuse gastrique [5]. Anatomiquement, les ulcères peptiques se produisent principalement dans l'estomac et du duodénum proximal. Les ulcères peptiques sont provoqués par un déséquilibre entre la défensive (sécrétion de mucus, la barrière muqueuse, le débit sanguin, la régénération cellulaire et des agents de protection endogènes) et destructive (acide et la sécrétion de pepsine), les fonctions du système gastrique [6]. les lésions gastriques induites par l'alcool nuisent facteurs gastriques de défense tels que la sécrétion de mucus et de la muqueuse circulation [7]. L'éthanol provoque des lésions nécrotiques de la muqueuse gastrique par des voies multiples, produisant directement des lésions nécrotiques, ce qui réduit les facteurs défensifs, la sécrétion de bicarbonate et la production de mucus [8]. Le mucus de paroi gastrique est pensé pour jouer un rôle important en tant que barrière défensive contre les dommages gastro-intestinaux [9]. La sécrétion de mucus est considérée comme étant un facteur essentiel de défense qui protège la muqueuse gastrique des lésions [10]. Le niveau du mucus de la paroi gastrique a été évaluée précédemment et est utilisé comme un indicateur de la sécrétion gastrique du mucus [11]. Les chercheurs ont rapporté un grand nombre de plantes médicinales avec antiulcéreux propriétés [12] - [14]. médicaments à base de plantes représentent une vaste ressource inexploitée qui a montré un énorme potentiel thérapeutique. Parkia speciosa
est également connu comme le haricot puante ou "petai." Il porte de longues gousses de haricots plats avec des graines vertes. Ces fèves sont populaires en Asie du Sud-Est, y compris la Malaisie et du Nord-Est de l'Inde. Les fèves sont vendus dans les gousses ou les graines qui sont déjà séparés des gousses. Les grains peuvent être sont en pot en saumure et exportés. En outre, P. speciosa
est considéré par les habitants de la région à posséder des propriétés médicinales [15] et a été rapporté à exposer hypoglycémique, antibactérienne, anti-cancéreux et l'activité antioxydante [16]. La présente étude a été réalisée pour établir les propriétés antioxydantes et anti-ulcéreux activité de Parkia speciosa
extrait de feuilles d'éthanol contre les ulcères gastriques induits par l'éthanol chez le rat.
Matériel et méthodes
extrait. Un total de 48 rats (24 mâles et 24 femelles) ont été également divisé en 4 groupes qui ont reçu le véhicule (0,5% de CMC, 5 ml /kg) ou de 1, 3 ou 5 g /kg d'extrait de feuille (5 ml /kg) . Les animaux ont été soumis à un jeûne pendant une nuit (mais l'eau autorisés) avant le dosage. La nourriture a été retenu pendant encore 3 à 4 h après l'administration. Les animaux ont été observés pendant 48 heures après l'administration de la poudre pour l'apparition des symptômes cliniques ou toxicologiques. La mortalité, le cas échéant, a été observée sur une période de 2 semaines. Les animaux ont été sacrifiés par une surdose de xylazine et de kétamine le 15e jour. Histologique paramètres hématologiques et biochimiques du sérum ont été déterminées selon des méthodes standard [19]. Le comité d'éthique pour l'expérimentation animale de la Faculté de médecine, Université de Malaya, a approuvé l'expérience. Tout au long des expériences, tous les animaux ont été traités avec humanité en fonction des critères énoncés dans le «Guide pour le soin et l'utilisation des animaux de laboratoire" [20].
Animal Stock
Les rats ont été placés individuellement dans des cages séparées avec des fonds de fil à larges mailles pour empêcher la coprophagie pendant l'expérience .
à des doses de 50, 100, 200 ou 400 mg /kg en tant que prétraitement. A 1 h après le prétraitement, le véhicule ou l'éthanol absolu a été administré par voie orale à des groupes 2-7 [12]. Une heure plus tard, les rats ont été euthanasiés, et leurs estomacs ont été disséqués.
Mesure de Gastric Juice Acidité
Détermination du mur gastrique glaire (GWM)
macroscopique gastrique Lésion Évaluation
Antioxydant Activité
Mesure de la peroxydation lipidique (MDA).
Dosage du glutathion total (GSH).
L'examen histologique de la muqueuse gastrique
Etude de muqueux glycoprotéines
extrait de feuille dans le modèle de lésion gastrique induite par l'éthanol est présenté dans le tableau 1. les résultats ont démontré que les rats prétraités avec l'oméprazole ou Parkia speciosa
extraient avant le traitement avec l'éthanol absolu (groupes 3-7) ont présenté significativement plus petites zones de ulcères gastriques que fait le groupe 2 (figure 1). éthanol absolu a produit des lésions hémorragiques étendues et visibles dans la muqueuse gastrique. Parkia speciosa
extrait inhibe de manière significative la formation de l'ulcère induit par l'éthanol absolu et évidemment diminué les dommages de la muqueuse gastrique d'une manière dose-dépendante, soit le Parkia speciosa
extrait significativement supprimé la formation d'ulcères . Curieusement, un aplatissement des plis de la muqueuse gastrique a été observé dans le groupe 7. La protection de la muqueuse gastrique est aussi le plus important dans le groupe 7 (Tableau 1 et Figure 1). L'inhibition de la formation d'ulcère gastrique dans le groupe 6 est significative et comparable à celle observée dans le groupe traité par l'oméprazole (groupe 3) (Tableau 1 et Figure 1).
L'effet de Parkia speciosa sur GWM, SOD, MDA et GSH
sur le mucus de paroi gastrique dans les lésions de la muqueuse gastrique induites par l'éthanol chez le rat ont été examinés. Groupe 2 a montré une diminution significative de la capacité de liaison bleu Alcian du mucus de la paroi gastrique, tandis que les groupes 4-7 ont montré une amélioration significative de la capacité de liaison bleu Alcian de la muqueuse gastrique. De même, dans le groupe 2, l'éthanol a réduit l'activité de la SOD, tandis que les groupes 4-7 ont montré une augmentation significative de l'activité enzymatique SOD par rapport au groupe 2. L'activité MDA était significativement plus élevée dans le groupe 2 que dans le groupe 1, tandis que les groupes 4-7 ont démontré diminué de manière significative l'activité MDA. En outre, l'effet de la Parkia speciosa
extrait sur le total GSH dans les homogénats de la muqueuse gastrique a été évaluée. le traitement de l'éthanol a provoqué une diminution significative de GSH dans le groupe 2 par rapport au groupe 1. En revanche, les groupes 47 exposé contenu GSH significativement augmentée (Figure 2).
acide périodique Schiff (PAS)
.
extrait ou oméprazole a démontré une régulation négative de la protéine BAX (figure 6). En outre, les niveaux de protéine BAX dans le groupe 2 rats étaient plus élevés que ceux des groupes 3-7 (Figure 6).
Discussion
rats traités par. Ce test a révélé que l'usine est sûr et n'a aucune toxicité lorsqu'il est administré par voie orale jusqu'à 5 g /kg. Certains médicaments anti-ulcéreux ont été rapportés pour augmenter la quantité de mucus gastrique sécrétion dans la muqueuse gastrique [29]. Prétraitement avec Parkia speciosa
extraire augmenté de façon significative la teneur en mucus gastrique chez des rats souffrant d'ulcères induits par l'éthanol, ce qui indique que l'effet gastroprotective de Parkia speciosa
est médiée en partie par la préservation du mucus de la paroi gastrique. Ce mucus est composé de glycoprotéines de type mucine, qui peuvent être détectées par le bleu Alcian [30]; l'augmentation de la coloration au bleu Alcian démontre l'effet protecteur de administré par voie orale Parkia speciosa
, qui peut être médiée par la formation de complexes de protection entre Parkia speciosa
et le mucus qui agit comme une barrière contre agents nécrosantes introduits dans l'estomac [31]. Ici, extrait Parkia speciosa
a empêché la diminution de la concentration du mucus de la paroi gastrique, après traitement avec de l'éthanol. Ainsi, l'un des mécanismes possibles par lesquels la muqueuse gastrique est protégée par Parkia speciosa
implique le renforcement de la résistance de la barrière muqueuse, générée par un revêtement protecteur. Il est probable que l'effet protecteur de Parkia speciosa
est due au moins en partie à la préservation de la couche de mucus dans la muqueuse gastrique; Parkia speciosa
a été observée pour prévenir induite par l'éthanol paroi gastrique mucus épuisement. Les résultats de la présente étude a démontré que l'extrait de Parkia speciosa a une activité anti-ulcéreux efficace contre les blessures la muqueuse gastrique induite par l'éthanol. L'extrait de plante a augmenté la teneur en mucus de la paroi gastrique, ce qui est cohérent avec les résultats rapportés par Thirunavukkarasu et al. [32].
Parkia speciosa. L'activation et l'infiltration des neutrophiles semblent être impliqués dans les processus initiaux qui forment ces lésions. De même, Abdulla et al. [12] ont démontré que la réduction de l'infiltration des neutrophiles dans les tissus gastriques ulcérées aidé à prévenir les ulcères gastriques chez le rat. Wasman et al. [33] ont montré que l'administration orale d'un extrait végétal avant l'administration d'éthanol a diminué de manière significative l'infiltration des neutrophiles dans la muqueuse gastrique. L'éthanol provoque d'importants dommages à la muqueuse gastrique et entraîne une augmentation de l'infiltration de neutrophiles dans ce tissu.
réduit l'infiltration de neutrophiles dans le tissu ulcérée. Nous avons également observé un aplatissement des plis de la muqueuse, ce qui suggère que l'effet gastroprotective du Parkia speciosa
extrait de feuille peut être attribuée à une diminution de la motilité gastrique. Modifications de la motilité gastrique ont été impliqués dans le développement et la prévention des lésions gastriques expérimentales. La relaxation des muscles circulaires peut protéger la muqueuse gastrique par un aplatissement des plis. Cet aplatissement augmente la surface de la muqueuse exposée aux agents nécrosante et réduit le volume des irritants gastriques qui entrent en contact avec la crête Rugal [12], [33].
extrait éthanolique a inhibé de manière significative les effets négatifs de la éthanol sur les niveaux de GSH gastriques à toutes les doses utilisées. Le taux de GSH gastrique était la plus élevée pour la dose de 400 mg /kg et le plus bas pour la dose de 50 mg /kg, tandis que le taux de GSH a diminué dans le groupe de contrôle de l'ulcère. Les résultats actuels et des articles publiés précédemment indiquent qu'il existe une relation importante entre les niveaux de GSH gastriques et l'ulcère de gravité. des enzymes de GSH et GSH-apparentés sont connus comme des agents protecteurs du tissu important en raison de leurs propriétés antioxydantes [36], [37].
Parkia speciosa.
inversé la diminution de la coloration PAS induite par l'éthanol, augmenté de façon significative les activités du GSH et SOD, et une diminution du niveau de la peroxydation lipidique (MDA) dans le P. speciosa-
groupes prétraités.
 Carte détaillée du microbiome de la langue humaine
Carte détaillée du microbiome de la langue humaine
 Mois de sensibilisation au SII | L'histoire personnelle d'Andrea
Mois de sensibilisation au SII | L'histoire personnelle d'Andrea
 Comment voler à l'international avec SIBO
Comment voler à l'international avec SIBO
 La fonction hépatique peut être importante dans le risque de maladie d'Alzheimer
La fonction hépatique peut être importante dans le risque de maladie d'Alzheimer
 100 exemplaires gratuits du livre de Chris Kresser ?
100 exemplaires gratuits du livre de Chris Kresser ?
 Les antibiotiques suffisent souvent pour traiter l'appendicite chez les enfants
Les antibiotiques suffisent souvent pour traiter l'appendicite chez les enfants
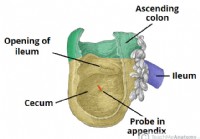 Le Cécum
1 Structure et relations anatomiques 2 Alimentation neurovasculaire 3 Drainage lymphatique 4 Pertinence clinique :Volvulus cæcal Le caecum est la partie la plus proximale du gros intestin et se situe
Le Cécum
1 Structure et relations anatomiques 2 Alimentation neurovasculaire 3 Drainage lymphatique 4 Pertinence clinique :Volvulus cæcal Le caecum est la partie la plus proximale du gros intestin et se situe
 Les régimes sans céréales sont-ils réellement risqués ?
Il est risqué déliminer des groupes daliments entiers, déclarent partout les médecins et les diététiciens. Vraiment ? De quel type de risque parle-t-il réellement ? Parce que les preuves scientifiq
Les régimes sans céréales sont-ils réellement risqués ?
Il est risqué déliminer des groupes daliments entiers, déclarent partout les médecins et les diététiciens. Vraiment ? De quel type de risque parle-t-il réellement ? Parce que les preuves scientifiq
 Combattre les effets négatifs du stress
Il y a une épidémie dinflammation du cortisol en cours… et si vous ne le savez pas, veuillez regarder cette vidéo. En résumé :le cortisol est extrêmement bon pour vous, mais cest mauvais si vos nivea
Combattre les effets négatifs du stress
Il y a une épidémie dinflammation du cortisol en cours… et si vous ne le savez pas, veuillez regarder cette vidéo. En résumé :le cortisol est extrêmement bon pour vous, mais cest mauvais si vos nivea