Az I. fázisú vizsgálatban az imatinib, ciszplatin és 5-fluoruracil vagy kapecitabin előrehaladott nyelőcsőrák és gyomor adenokarcinóma katalógusa Abstract Background katalógusa katalógusa ellenére biztosított előnyök elfogadott terápia gyomorrák prognózisa továbbra is rossz. Célzott gátlása vérlemezke-eredetű növekedési faktor receptor (PDGFR) az imatinib befolyásolhatja a tumor növekedését és erősíti a kemoterápiás hatást.
Módszerek
Ez I. fázisú vizsgálat a dóziskorlátozó toxicitás (DLT) az imatinib kombinált kemoterápiával szerint 3- pácienscsoporton dózisnövelő design. Harmincöt beteg ciszplatin (60 mg /m
2 d1 q 3w) /kapecitabin (1250 mg /m 2 ajánlat d1-14 q 21) vagy a ciszplatin (50 mg /m 2 d1 q 2w) /5-fluoruracil (2 g /m 2 d1, q 1w). Az imatinib indult d - 4 adag emelésével 300-700 mg QD 100 mg-onként. Katalógusa Eredmények
imatinib dózis szint 1 (300 mg) egy DLT figyelhető meg, további három beteget vontak be anélkül, hogy további DLT. Abban dózissal 5 (700 mg) két gyomor perforáció történt, így 600 mg imatinib alakult ki, mint a maximális tolerálható dózis. Major 3/4 fokozatú toxicitás a hányinger (6%), vérszegénység (6%) és a fáradtság (3%). Response Evaluation kiderült részleges válasz 27% -os és a stabil betegség 43% -a értékelhető betegnél.
Következtetések
kombinációja imatinib és a kemoterápia jól tolerálja. Válasz aránya nem jobb, mint a standard kezelést. További vizsgálatok egy nagyobb betegcsoport van szükség, hogy erősítse az erősítés a kemoterápia hatása az imatinib. Katalógusa Trial regisztrációs katalógusa klinikai vizsgálatok európai adatbázisa: Eudra-CT2006-005792-17 és klinikai vizsgálatokra vonatkozó adatbázisban: NCT00601510
Kulcsszavak
imatinib PDGF gyomorrák kemoterápia Háttér katalógusa Bizonyíték javára kemoterápia elôrehaladott gastrooesophagealis és gyomorrák növekszik. Számos tanulmány bizonyította, jobb összesített túlélés és az életminőség kemoterápiás képest a legjobb szupportív [1-3]. Továbbá, a különböző klinikai vizsgálatok azt mutatták, fölénye a kombinációs terápia több mint egyetlen hatóanyag terápia [4]. De reszekció továbbra is az egyetlen esélye a gyógyulásra, és a legtöbb betegnél a betegség előrehaladott kezdetben. Annak ellenére, hogy minden pozitív hatását a pre- és perioperatív kemoterápia, a visszaesési arány a gyomorrák magas. Integrációját célzott terápiák az újszerű kezelési stratégiák nyújthat további előny, de valójában e téren szerzett tapasztalatok korlátozódik csak néhány vizsgálat [5]. Katalógusa receptor tirozin-kinázok (RTK) egy érdekes molekuláris célpontja miatt döntő szerepet a jelátviteli és malignus átalakulás. Van egy alapvető funkciója a rendelet a sejtek növekedését, fejlődését, metasztázis és apoptózist [6-8]. A vérlemezke-eredetű növekedési faktor receptorok (PDGFR), mint egy transzmembrán RTK alcsoportot vannak kifejezve különböző humán tumorok, beleértve a petefészek, a gyomor- és colorectalis rák [9-12]. A vérlemezke-eredetű növekedési faktorok (PDGF) fehérjék alkotják több izoformája: PDGF-AA, a PDGF-BB, a PDGF-AB, PDGF-CC és PDGF-NN [13]. A PDGF α-receptor megköti az összes változatot, kivéve a PDGF-DD, míg a β-receptor megköti csak PDGF-BB. PDGFs hatásos kemotaktikus és mitogén növekedési faktorok fibroblasztok, endoteliális sejtek és simaizom sejtek. Ezek serkentik a növekedést a stroma szövet rosszindulatú daganatok aktiválásával úgynevezett karcinóma-asszociált fibroblasztok (CAF) [14]. Emellett azonban azt találtuk, hogy elősegítik az angiogenezist [15], hogy toborozni periciták [16], valamint, hogy befolyásolja az intersticiális folyadék nyomását (IFP) felelősek a transvascular szállítására kemoterapeutikumok [17]. Ezért gátlása a PDGF RTK- jelző ígér érdekes hatást a tumor növekedésére.
Imatinib (Glivec ®) egy rendkívül szelektív inhibitora az RTK család tartalmazó Abl, Bcr-Abl fúziós fehérje található a legtöbb esetben a krónikus mieloid leukémia ( CML), PDGFR- α és -β, és a terméket a c-kit protoonkogén (kIT). Ebben CML és olyan betegeknél, c-kit pozitív gastrointestinalis stroma tumorok imatinib terápia jól tolerálható és hatékony kezelési stratégia. Számos vizsgálat bizonyította a központi szerepet PDGF-B és PDGFR- β kifejezés az emberi gyomorrák, valamint egér modellekben [8], mint a gyomor carcinoma sejtvonalakon és sebészeti mintákban [18]. A szerzők feltételezik, ígéretes hatásokat a blokád PDGFR jelátviteli. E szerint a saját preklinikai adatok azt bizonyítják, gyomorrák expresszáló sejtek PDGFR valamint a c-kit és a növekedésük nyilvánvalóan gátolta az imatinib. Továbbá, a korábbi tanulmányok azt mutatták, imatinib hatását erősítik a ciszplatin [7] és az 5-fluoruracil és leucovorin [19], hogy bizonyos rákos sejtekben. Ezért blokkolja a PDGF által közvetített szignáltranszdukciós útvonal fokozhatja kemoterápiás hatást a kezelés a gyomorrák. Egérmodellben különösen kombinálva nagy dózisú imatinib szignifikáns hatékonyságot [8].
Ez I. fázisú vizsgálatot végeztek, hogy értékelje a biztonság és dózist korlátozó toxicitás (DLT) imatinib kemoterápiával kombinálva elôrehaladott nyelőcső és gyomor adenokarcinóma . Emellett docetaxel-alapú sémák és trastuzumab tartalmazó terápiák HER2-pozitív rák, 5-fluoruracil (FU) alapú kombinációkat ciszplatinnal vagy oxaliplatin tekintik a kemoterápiás szabvány. A PLF- kezelési séma, 5-FU (F), leucovorin (L) és ciszplatin (P) az egyik leggyakoribb rezsimek [3, 20]. Azonban az 5-FU helyett gyakrabban prodrugja kapecitabin, mivel a legutóbbi vizsgálatok bizonyították nem rosszabb a kapecitabin képest infúziós FU és hasonló toxicitás, kivéve a hasmenés és a kéz-láb szindróma [21-23]. Ezért mind a két fluoropirimidinek egyesítjük ciszplatinnal és imatinib felmérése érdekében a mérgező ez a terápia a gyomor és a nyelőcső adenocarcinoma betegek. Katalógusa módszerek
preklinikai vizsgálata katalógusa előzetes vizsgálatok a PDGFR- és c-kit (CD 117 ) - kifejezés a gyomorrák sejtek végeztünk szövetmintából 57 gyomorrákos betegeknél (mintákat letölteni az archívumból a Pathológiai Intézet, Kiel). Az átlagos életkor a betegek 66 év volt (tartomány: 26-84), 31 férfi és 26 női témák (m: f = 1,2: 1). A gyomorrák sorolták szerint Laurén diffúz típusú (27 beteg) és a bél (30 beteg). Paraffinba ágyazott mintákat vágtunk 3 um metszeteket és elhelyezni tárgylemezen. Őket paraffint és megfestjük hematoxilinnel és eozin. Előkezelés után EDTA immunfestést végeztünk egy monoklonális antitest ellen PDGFR-β (R &D Systems, hígítás 1:20), és egy poliklonális antitest ellen CD117 (WAK-Chemie, Berlin, Németország, a hígítás 1: 2000), mint primer ellenanyaggal. Biotinilált anti-egér IgG /anti-nyúl IgG-t (Vector Laboratories, hígítás 1: 200) adtunk be, mint másodlagos antitesttel. Immunreakciók tettük láthatóvá az avidin biotin komplex módszer alkalmazásával egy Vectastain ABC alkalikus foszfatáz kit. A biotinilált másodlagos antitestet, az avidin-torma-peroxidáz konjugátum, és hogy az alap dAb-oldatot alkalmazva, a gyártó utasításai szerint. Minden mintát hematoxilinnel ellenfestettük. Primer antitesteket elhagytuk a negatív kontrollok.
Páciensek alkalmassági katalógusa A multicentrikus, nyílt, fázis I vizsgálat hagyta jóvá etikai bizottságok a részt vevő központok és regisztrált a klinikai vizsgálatok európai adatbázisa (Eudra-CT 2006-005792-17 ) és a klinikai vizsgálatokra vonatkozó adatbázisban (NCT 00601510). Minden bevont betegek adták írásos beleegyezését adta. Inclusion kritériumok meghatározása: szövettanilag igazolt előrehaladott nyelőcsőrák vagy gyomor adenokarcinóma, jelenlétében legalább egy mérhető tumor szerint RECIST kritériumok megfelelő vérképző, máj- és vesefunkció - meghatározása: fehérvérsejt (WBC) számít ≥ 3000 /ul, abszolút neutrofil (ANC) ≥ 2000 /ul, a thrombocytaszám ≥ 100.000 /ul, hemoglobin szint ≥ 9,0 g /dl, összes bilirubin < 2-szer a normál érték felső határának (ULN), SGOT és SGPT < 2,5-szerese a UNL (vagy < 5 x ULN, ha a máj áttétek vannak jelen), a glomeruláris filtrációs ráta (GFR) ≥ 60 ml /perc, Eastern Cooperative Oncology Group (ECOG) teljesítmény státusz ≤ 2. A kizárási kritériumok a következők voltak: Minden más aktív elsődleges rosszindulatú daganat , súlyos kontrollálatlan orvosi betegség, szívelégtelenség (New York Heart Association III-IV), krónikus májbetegségek, ismert agyi metasztázisok ismert diagnózisa humán immundeficiencia vírus (HIV) fertőzés, ismert dihidropirimidin-dehidrogenáz-hiány, egyidejű alkalmazása Sorivudin vagy rokon anyagok korábbi sugárterápia ≥ 25%, a csontvelő vagy nagy műtét előtti 2 héten belül vizsgálat kezdetén. katalógusa kezelés tervezése
tanulmány célja, hogy értékelje a biztonság és tolerálhatóságára imatinib kemoterápiával kombinálva annak érdekében, hogy meghatározzák a maximálisan tolerálható dózis (MTD). A betegek imatinib és a kemoterápia ciszplatinnal és kapecitabin vagy ciszplatin és 5-FU /Leucovorin szerint a kezelési eljárások 1. táblázat mutatja Therapy rendet választottuk szerint a betegeknek preferenciák infúziós 5-FU-t vagy orálisan beadott capecitabine. Az imatinib orálisan egyszeri adagban kiindulási napon -4 és folytatódott a teljes kezelési ciklust. A terápiában kapcsolatos dózisemeléses kialakítás korosztályok 3-6 betegek szerint a Fibonacci rendszer. Az imatinib dózis indult 300 mg és a maximális adag szintje eléri 800 mg volt. Ha egyik három betegnél dózis korlátozó toxicitás (DLT), a dózis emelték 100 mg-onként kohorsz-to-csoportban. Ha az egyik három betegnél DLT, további három beteget vontak ebben a betegcsoportban. Dózis további kiterjesztését csak akkor megengedett, ha nem több, mint egy hat volt DLT. Az MTD a legnagyobb adag imatinib azt eredményezte, hogy DLT kevesebb, mint egy 3 vagy 2 6 betegnél per kohorsz. Csak toxicitás az első három ciklusban tartották meghatározásáért MTD. A kombinációs terápia addig folytatjuk, amíg a legjobb válasz, a betegség progressziójának jelei, elfogadhatatlan toxicitás, a halál vagy visszavonása betegek hozzájárulásával. Az előzetes tumorellenes aktivitás meghatározása a másodlagos objective.Table 1 kemoterápiás sémák
Anyag
dózis (mg /m2) Matton Application Matton ütemezése
katalógusa PLF qd 50 katalógusa cisplatin katalógusa 50 katalógusa 1 óra infúzió katalógusa d 1, 15, 29 katalógusa 5-fluoruracil katalógusa 2000
24 óra infúzió katalógusa d 1., 8., 15., 22., 29,36
leucovorin
500
2 óra infúzió
d 1, 8, 15, 22, 29,36 katalógusa XP QD 22
ciszplatin katalógusa 60 Pg: 1 óra infúzió katalógusa d 1 katalógusa kapecitabin katalógusa 1250
licit po katalógusa d 1 -14 katalógusa toxicitási és hatékonysági értékelés katalógusa Biztonsági és toxicitási vizsgálat volt által végzett rendszeres beteg interjúk, laboratóriumi vizsgálatok és fizikai vizsgálatokat. Lehetséges dóziskorlátozó toxicitást szerint osztályozzák a National Cancer Institute Common Toxicity Criteria (NCI-CTC 3.0 verzió). Dóziskorlátozó toxicitás (DLT) definiálták 3. fokozatú neutropenia lázzal vagy fertőzéssel; 4-es fokozatú neutropenia tartós ≥ 7 nap; 3. fokozatú thrombocytopenia vérzéssel vagy 4. fokú thrombocytopenia > 7 nap; nem-hematológiai toxicitás 3. vagy 4. fokozatú kivéve alopecia, hányinger és hányás; megnőtt a vizelet visszatartási paraméterek ≥ 2 fokozatú; Perifériás szenzoros neuropátia ≥ fokozat 3. közötti kapcsolat vizsgálati gyógyszer és a toxicitás értékeltük tekintetében a különbségeket a mellékhatások fluoruracil /leucovorin és kapecitabin. A dózis módosítására került sor a következő: Ha a betegnél nem hematológiai ≥ 2. fokozatú toxicitás beadása a vizsgálati gyógyszer és kemoterápia függeszteni addig, amíg a toxicitás  évfolyam 1. Ekkor a kemoterápia és imatinib folytatódtak azonos napi adagot. Ha 2. fokozatú toxicitás megismétlődött adagot a feltételezett szolgáló gyógyszer csökkent egy előre meghatározott program. Ha a kritériumok folytatása a kemoterápia nem teljesültek 2 hét után az adag módosítására vagy a kezelés megtörni a beteg kivonják a tárgyalás. Ha hematológiai toxicitás ≥ 3-as fokozatú történt kezelést meg kellett szakítani, amíg toxicitás elhatározta ≤ évfolyam 1. Az imatinib és a kemoterápia folytatta ugyanazzal a dózissal, ha toxikus oldani két héten belül. Ha a toxicitás ≥ 2. fokozatú kitartott vagy kiújult imatinib kellett beadni, és a kezelést kellett igazítani utalva a tanulmány rendszer. Dóziscsökkentés végeztünk ≥ 3-as fokozatú anaemia.
Daganatellenes hatást értékeltük függvényében objektív tumor választ. Hatékonysági vizsgálat CT vagy MRI végeztünk megkezdése előtt a vizsgálati kezelés után 6 hét és azt követően minden 12 hét, amíg a betegség progressziója vagy tanulmányi kivonását bármely más ok. A válaszok szerint meghatározott RECIST kritériumok szerint osztályozott a WHO-kritériumok. Katalógusa eredményei katalógusa kifejezése PDGFR és c-kit gyomorrákban katalógusa expressziója és térbeli eloszlása PDGFR- β vizsgáltuk immunhisztokémiai szövetmintából nyert műtét 20 beteg. Immunológiai festése PDGFR- β találtak mindegyik mintában. PDGFR-β kimutatható volt a tumorsejtek 16 beteg gyakrabban bél típusa [9 (100%) beteg], mint a diffúz típusú [6 (55%) beteg]. Citoplazmatikus festődés kevesebb, mint 10% a tumorsejtek találtak 6 esetben, egy festési 10-50% három, és egy festési nagyobb mint 50% találtak 7 daganatok. Eltekintve a tumorsejtek, gyomor felszíni epitélium kifejezve PDGFR-β 10 betegből, és simaizom sejtek a muscularis nyálkahártyára vagy muscularis propria 18 betegnél. Érdekes, PDGFR-β fejeztük is a közepesen erősen a miociták az érfalakat 19 beteg (1. ábra). 1. ábra a PDGF-immunhisztokémia. Expression of PDGFR-β gyomorkarcinómában példányok: Intestinalis (a) típusú gyomorrák kifejezve gyakrabban PDGFR-β, míg a diffúz típusú (B) gyakran nem mutatott expressziót. Megjegyzés erős expressziója PDGFR-β a felszíni epithelium (B). Érdekes, PDGFR-β-ben is megtalálható szívizomsejtek a tumor véredény (c, d). Anti- PDGFR-β, hematoxilin Counterstain; Eredeti nagyítások: X400 (a), X200 (B, D).
Meghatározásához expressziójának és térbeli eloszlása CD117 immunhisztokémiai elemzést végeztünk a neopláziás és nem neopláziás szövetmintákban a 37 betegnél. CD117 immunreaktivitás volt jelen minden minta, úgy találták, minden esetben a hízósejtek és a sejtekben Cajal. A tumorsejteket festettük CD117 4 (11%) betegnél. 3 esetben kevesebb, mint 10% a tumorsejtek kifejezve CD117 és egy esetben 10-50% -a a tumorsejteket. A 3 tumorminták gyenge expresszióját CD117 találtak néhány sejt a tumor sztróma (2. ábra). 2. ábra c-Kit-immunhisztokémia. Expressziója CD117 gyomorkarcinómában példányok: Intestinalis típusú (A, B-nyílhegy) és diffúz típusú (D) gyomorrák példányok zárt CD117-immunreaktív hízósejtek. Alkalmanként volt CD117 által expresszált tumorsejtek (b) és stromális sejtek (C-nyílhegy). Anti-CD117, hematoxilin Counterstain; Eredeti nagyítások: x400. Katalógusa Betegek katalógusa 2008 márciusától 2010 novemberéig 39 beteget vontak be a vizsgálatba. Két beteg esett ki miatt gyors romlása, valamint általános állapotuk a kezelés megkezdése előtt. Egy beteg úgy döntött, hogy chemoembolisation májáttétek, egy beteg visszavonta beleegyezését személyes okok miatt, mielőtt az első adagot. Ily módon 35 beteg a vizsgálatban való részvételre, és rendelt 5 kezelés korosztályok. A medián életkor 61 év volt (tartomány: 39-76 év), és 21 (60%) beteg ECOG PS is 0 15 (43%) beteg bizonyíték nélkül, távoli áttétek terápia indult neoadjuvánsként kezelést. A fennmaradó 20 (57%) beteg kapott palliatív kemoterápia szándék miatt távoli áttétek, inoperábilis primer tumor vagy rák megnyilvánulás, mint a visszaesés a rosszindulatú. Egy beteg kezdetben szóba rezekálható műtétre után nevezetesen zsugorodása egy paraesophagealis nyirokcsomó áttét. Harmincöt beteg tudtuk megállapítani a toxicitási és biztonsági elemzés, 25 (71%) beteg volt értékelhető a hatásosság. Kiindulási jellemzők táblázat foglalja össze 2.Table 2. A betegek kiindulási jellemzői (n = 35) hotelben Jellemzői
N = 35 Matton Átlagéletkor (tartomány), év katalógusa 61 (39 -76) hotelben férfi /női katalógusa 27/8 katalógusa ECOG /PS katalógusa ECOG 0 katalógusa 21 katalógusa ECOG 1 katalógusa 13
ECOG 2
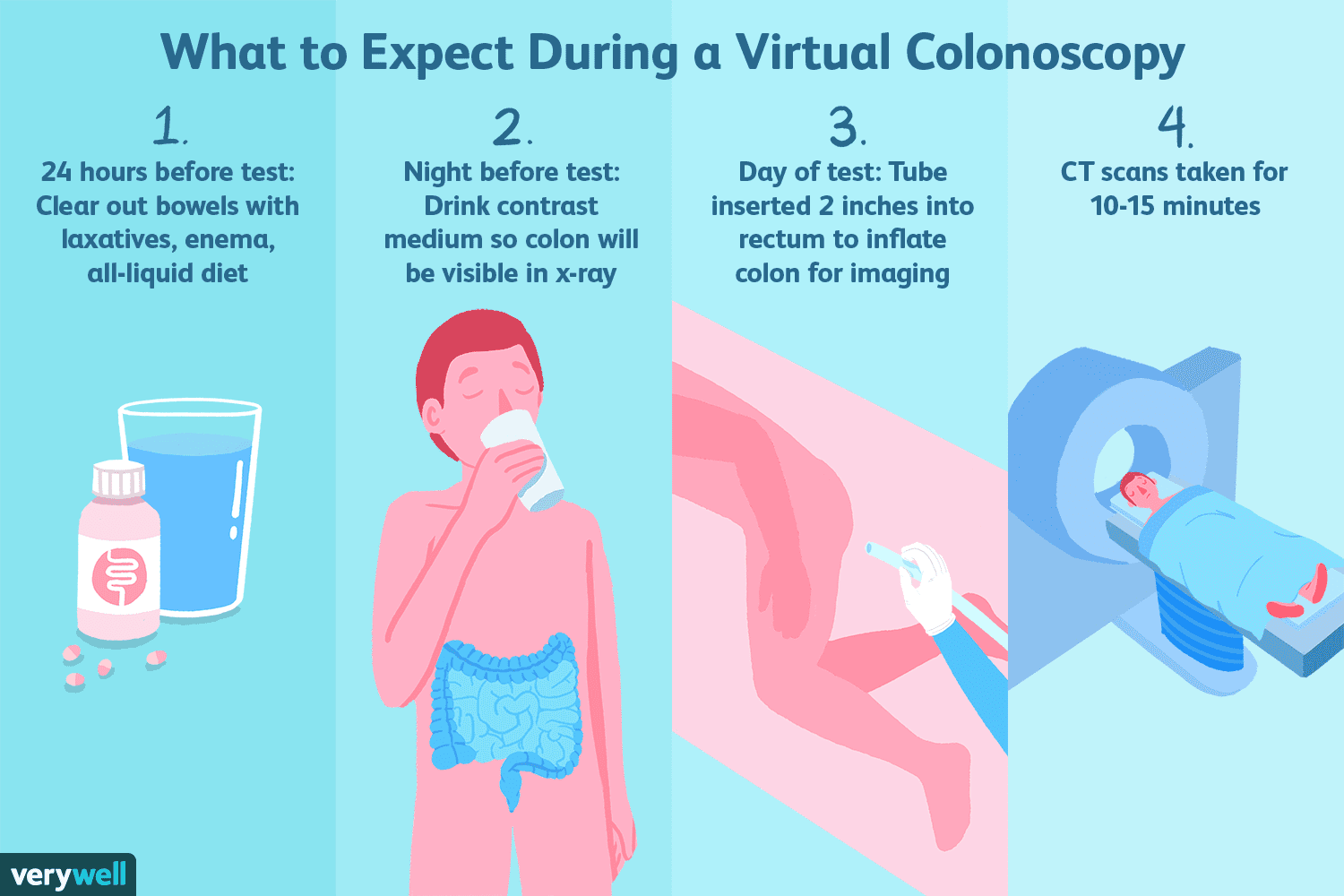 Mi az a virtuális kolonoszkópia?
A virtuális kolonoszkópia, más néven CT kolonográfia, a számítógépes tomográfia speciális típusa, amelyet a hagyományos kolonoszkópia alternatívájaként kínálnak. A vastagbélrák szűrővizsgálataként átl
Mi az a virtuális kolonoszkópia?
A virtuális kolonoszkópia, más néven CT kolonográfia, a számítógépes tomográfia speciális típusa, amelyet a hagyományos kolonoszkópia alternatívájaként kínálnak. A vastagbélrák szűrővizsgálataként átl
 Iszenciális olajok szedése IBS-hez
Valószínűleg hallotta az illóolajok körüli zajokat. Csak ezekre van szükséged, vagy mindez csak hype? Vessünk egy pillantást arra, mik azok az illóolajok, mit mondanak a kutatások az IBS-tünetek ellen
Iszenciális olajok szedése IBS-hez
Valószínűleg hallotta az illóolajok körüli zajokat. Csak ezekre van szükséged, vagy mindez csak hype? Vessünk egy pillantást arra, mik azok az illóolajok, mit mondanak a kutatások az IBS-tünetek ellen
 Esettanulmány:Montse meggyógyítja szivárgó belét
Valószínűleg mindannyian tapasztaltunk olyasmit, hogy diétáról diétára ugrálunk annak reményében, hogy megtaláljuk a varázslatost. Az igazság az, hogy nincs egyetlen varázslatos diéta, bármennyire is
Esettanulmány:Montse meggyógyítja szivárgó belét
Valószínűleg mindannyian tapasztaltunk olyasmit, hogy diétáról diétára ugrálunk annak reményében, hogy megtaláljuk a varázslatost. Az igazság az, hogy nincs egyetlen varázslatos diéta, bármennyire is