Een GSDMB
-enhancer gestuurde HSV thymidine kinase tot expressie vector voor het regelen occulte peritoneale verspreiding van maagkanker cellen
Abstract achtergrond
Maagkanker (GC) is één van de belangrijkste maligne ziekten in de wereld, met name in Azië en Japan en Korea hebben de hoogste incidentie in de wereld. Omdat de meeste van de gevallen die ongevoelig zijn voor therapieën sterven als gevolg van peritoneale verspreiding (PD) van de kankercellen, het regelen PD belangrijk patiënt overleven. GSDMB
is een lid van de gasdermin gen-familie. Omdat GSDMB
wordt uitgedrukt in vele soorten kanker, waaronder GC, is het waarschijnlijk dat het gen bevat een regulerend gebied dat wordt gebruikt voor de behandeling van kanker door middel van occulte PD celspecifieke expressie van cytotoxische genen.
Methods
We voerden reporter assays aan de regulerende regio identificeren de kankercel-specifieke expressie. Ook construeerden een lentivirale vector die therapeutische herpes simplex virus thymidine kinase (HSVtk) drukt in een GC celspecifieke wijze, en getest in een muismodel van PD.
Resultaten We identificeerden het regulerende gebied op 496 om 989 van de GSDMB
transcriptie start site en aangeduid als een GSDMB
versterker. De therapeutische lentivirale vector onderdrukt proliferatie van een GC cellijn, 60As6, in vitro
in aanwezigheid van ganciclovir en intraperitoneale toediening van de vector verlengde de overleving looptijd van muizen die intraperitoneaal werden geïnoculeerd met 60As6 een week voorafgaand aan de toediening.
Conclusies
de GSDMB
-driven HSVtk expressievector een therapeutisch effect op de occulte PD-model muizen hadden. Deze strategie kan eventueel worden gebruikt om patiënten te behandelen met GC PD.
Sleutelwoorden
Maag neoplasmen buikholte gentherapie HSV thymidine kinase Achtergrond
Maagkanker (GC) is één van de belangrijkste maligne ziekten, vooral in Azië, en de tweede belangrijkste oorzaak van kanker-geassocieerde sterfgevallen wereldwijd [1]. Het wordt gewoonlijk ingedeeld in twee typen (indeling Laurens) [2], darm- en diffuus, die vermoedelijk de pathogenese geven [3]. De diffuse-type GC (DGC) is sub-geclassificeerd als slecht gedifferentieerde GC (niet-vaste type) of ongedifferentieerde GC in de Japanse Gastric Cancer Association classificatiesysteem [4]. DGC is infiltratieve en geeft vaak agressieve invasie in de maagwand, waardoor metastase en de verspreiding van GC cellen in de peritoneale holte (peritoneale verspreiding, PD). Ondernemingen De GC gedissemineerde cellen in de buikholte leiden tot peritoneale metastasen ( PC) [5]. PC veroorzaakt intestinale symptomen, zoals buikpijn, misselijkheid en braken, en systemische symptomen zoals gewichtsverlies en ascites. PC niet alleen sterk verslechtert de kwaliteit van leven van patiënten GC, maar het is ook de belangrijkste doodsoorzaak in GC [6]. Met alleen ondersteunende zorg, de mediane overleving van patiënten met PC 3-6 maanden [7]. Indien behandeld met systemische chemotherapie, op dezelfde wijze als voor andere metastatische laesies, PC toont een slechtere respons op de therapie dan andere typen metastase in GC, vooral vanwege de slechte verdeling van het chemotherapeutische middel in de peritoneale holte. Daarom hebben de recente inspanningen gericht op innovatieve PC therapieën, zoals een combinatie van cytoreductieve chirurgie, thermische behandeling, en intraperitoneale chemotherapie. Deze gecombineerde benaderingen enigszins verbeterde de prognose voor de PC, hoewel de mediane overleving periode nog ten minste 12 maanden, duidelijk te maken dat er een praktische grens aan de effectiviteit van chirurgische cytoreductie [8, 9]. Recente studies suggereren dat het belangrijk GC patiënten identificeren occulte PD door het uitvoeren van een cytologisch onderzoek van peritoneale lavage vloeistof, omdat dergelijke gevallen vertoonden verbeterde prognose als zij omzetting negatieve cytologie verkregen door uitgebreide intra-peritoneale lavage gevolgd door intraperitoneale chemotherapie [10].
het begrip "zelfmoordgen" kankertherapie gebruikt herpes simplex virus thymidine kinase (HSVtk), ontstond in 1980 [11]. HSVtk katalyseert de fosforylering van het guanosine analoog ganciclovir (GCV) in een monofosfaatvorm die vervolgens door cellulaire nucleotide kinasen gefosforyleerd in zeer giftige ganciclovirtrifosfaat [12]. Ganciclovirtrifosfaat blokken DNA-replicatie, wat leidt tot stoppen van de celcyclus en celdood [13]. Therapie met HSVtk overdracht kankercellen, gevolgd door GCV toediening zogenaamde suïcide gentherapie, en deze techniek is recentelijk in een fase III klinische proef met glioblastoma multiforme [12].
In deze studie hebben we een therapeutische vector die HSVtk uitdrukt in kankercellen, met behulp van een regulerende gebied van de gasdermin B-gen (GSDMB
). GSDMB
is een lid van de familie gasdermin (GSDM
), die bestaat uit vier genen, GSDMA
, GSDMB
, GSDMC Kopen en GSDMD
[14, 15], en is uitgedrukt in prolifererende cellen normaal epitheel en in vele soorten kanker, waaronder slokdarm, maag, lever, dikke darm, baarmoederhals en borstkanker [14, 16-18]. GSDMB
expressie wordt aangedreven door twee promoters, de cellulaire promotor en LTR-afgeleide promoter [19-21]. De LTR-afgeleide promoter (LTR promoter) is in de meeste normale weefsels, behalve de maag en in veel kankercellijnen, terwijl de cellulaire promotor actief in normaal maagweefsel en in sommige kankercellijnen [20]. In deze studie identificeerden we een gebied stroomafwaarts van de LTR promoter, die sterke transcriptionele activiteit toonde in GC cellijnen. We gebruikten deze regio om een HSVtk-expressie virale vector te construeren voor het regelen van occulte PD.
Methods
menselijke weefsels
Maagkanker (GC) weefsels werden verstrekt door de National Cancer Center Hospital na verkregen schriftelijke toestemming van elkaar patiënt, die door het National Cancer Center Institutional review Board (ID: No.17-030) werd goedgekeurd. Weefsel monsters werden onmiddellijk ingevroren met vloeibare stikstof na chirurgische extractie en opgeslagen bij -80 ° C tot gebruik.
Microarray analyse
Totaal RNA werd geïsoleerd door het suspenderen van de cellen in lysisbuffer ISOGEN (Nippon Gene, Toyama, Japan) gevolgd door precipitatie met isopropanol. We voerden expressie analyses met behulp van menselijke expressie Array U95A versie 2 (Affymetrix, Santa Clara, CA) volgens de protocollen van de leveranciers. De uitdrukking waarde (gemiddeld verschil: AD) van elk gen werd berekend met behulp van GeneChip Analysis Suite versie 4.0 software (Affymetrix). Hiërarchische clustering van microarray gegevens werd uitgevoerd met behulp van GeneSpring (Agilent Technologies Ltd., Palo Alto, CA), Microsoft Excel en Cluster & TreeView [22, 23]. Alle microarray data zijn neergelegd in een MIAME compliant database GEO (toegangsnummer; GSE47007). Door Wilcoxon u
-test (p
< 0,05) en met een 2-voudige verandering, genen die specifiek tot expressie in diffuse type GC geselecteerd [22]
Cellijnen en primaire kweek van muizen. mesotheelcellen
Drie maagkanker cellijnen HSC-57, afgeleid van intestinale-type GC en HSC-59 en HSC-60, beide afkomstig van diffuse type GC, werden vastgesteld en gekenmerkt door een van de auteurs [24 ]. SNU16, afgeleid van diffuse type GC, werd geleverd door de American Type Culture Collection (ATCC), twee andere cellijnen met efficiëntie productie PD muizen, 60As6 en 60As6GFP (60As6 expressie groen fluorescentie eiwit) werden vastgesteld door de auteurs van de diffuse-type GC afgeleid HSC-60 cellijn na een aantal passages van de intraperitoneale transplantatie aan muizen [25]. CC-2511, een fibroblast cellijn, werd gekocht van Lonza, Japan (Tokyo, Japan). Alle cellijnen werden in Dulbecco's gemodificeerd Eagle Medium gehandhaafd. Muis mesotheelcellen werden geoogst door injectie van 10 ml verwarmd 0,25% trypsine /EDTA-oplossing in de buikholte [26]. De cellen werden gedurende 3 dagen in RPMI-1640 aangevuld met L-glutamine, fenolrood en HEPES (WAKO, Tokyo, Japan). Met-5A, een humane mesotheelcellen cellijn werd verschaft door ATCC en aangehouden in Medium 199 (Life Technologies, Tokyo, Japan) aangevuld met 3,3 nM EGF (Life Technologies), 400 nM hydrocortison (Sigma-Aldrich, St. Louis, MO USA), 870 nM insuline (Life Technologies) en 10% FBS.
RT-PCR
Totaal RNA uit humane normale organen werden verkregen van BIOCHAIN, Hayward, CA. Totale RNA's werden geëxtraheerd door gebruik van een RNeasy Mini kit (QIAGEN, Tokyo, Japan). Na het genereren van de eerste streng cDNA uit totaal RNA met behulp van Thermoscript RT-PCR System (Life Technologies, Tokyo Japan), werd PCR uitgevoerd met AccuPrime ™
Pfx DNA polymerase (Life Technologies) onder de volgende cyclingcondities van hetzij 35 (LTR transcripten ) of 25 cycli (andere): 95 ° C gedurende 1 min; 56 ° C (β-actine) of 58 ° C (andere) gedurende 1 min; en 72 ° C gedurende 1 min. De volgende primersets werden gebruikt: voor mobiele promotor transcript, 5'-CTTCCTGAGATTCAGAGGCC-3 'en 5'-CCAGAATTTGAAACTCAGCC-3'; te LTR-promoter van transcripten, 5'-TTCAGTTGCTTCAGGCCATC-3 'en 5'-CCAGAATTTGAAACTCAGCC-3'; de 3 'kant van GSDMB
, 5'-ATTCTGGACTTCCTGGATGC-3' en 5'-ATGTATGAAATCCAGGCTGG-3 '; voor MYH11
, 5'CAGTGACGATGAGAAGTTCC-3 'en 5'-CGCAGAAGAGGCCAGAGTAC; en voor β-actine
, 5'-TCATCACCATTGGCAATGAG-3 'en 5'-CACTGTGTTGGCGTACAGGT-3'.
Reporter Assay
Een genomische fragment, -1.080-1053 van GSDMB Kopen en met de LTR-promotor, werd geamplificeerd door PCR met behulp LA Taq hot start DNA polymerase (Takara) in 35 cycli van 96 ° C gedurende 30 s en 68 ° C gedurende 2 minuten, met behulp primersets: 5'-CTTCCTGAGATTCAGAGGCC-3 'en 5' -CTCGAGTTCACTGTGTTAGCCAGG-3 ', en een pGL3 basis vector (Promega, Madison, WI) geplaatst. Het werd afgebroken met behulp van de restrictieplaatsen: Nhe
I en Eco
R ik naar de -1.035-1053 fragment te genereren; Kpn
I en Eco
R I voor -426 tot 1053; Nhe
I en Afl
II voor -61 tot 1053; Nhe
I en Eco
81 I voor 129-1053; en Nhe
I en Stu
ik voor 496-1053. De 496-1053 reporter construct werd verder afgekapt met restrictie-enzymen: Nhe
I en Swa
ik voor 757-1053; Nhe
I en Pvu
II voor 860-1053; Nhe
I en Bst
X ik voor 989-1053; Xho
I en Bst
X ik voor 496-989; Xho
I en Pvu
II voor 496-860; en Xho
I en Swa
ik voor 496-757. Verdere afknotting van het 496-989 fragment werd PCR uitgevoerd met het fragment als een matrijs gebruikt Ex Taq DNA polymerase (Takara) in 35 cycli van 95 ° C gedurende 1 min, 58 ° C gedurende 1 min en 72 ° C gedurende 1 min, met de volgende primersets: voor 562-989, 5'-GCTAGCTGTGGGATTTGTACACATCC-3 'en 5'- AGATCTCGACTGGGATTACAGG-3'; en 649-989, 5'-GCTAGCTTTATTTCCACTGGAAACCG-3 'en 5'-AGATCTCGACTGGGATTACAGG-3'. Na amplificatie werden fragmenten geïnsereerd in pGL4.12 [luc2CP
] vector (Promega). De -1 kb stroomopwaartse regio van CXCR4 Kopen en CXCR7
in 35 cycli van 98 ° C gedurende 10 s, 15 s werden bereid door genomische PCR onder gebruikmaking MightyAmp DNA polymerase (Takara) 62 ° C en 68 ° C gedurende 2 min, met de volgende primersets: voor CXCR4
, 5'-GCTAGCGCGCCCACTGCAAACCTCAG-3 'en 5'-CTTAAGTCACTTTGCTACCTGCTGC-3'; en CXCR7
, 5'-GCTAGCCGGAGGCCCCCGGAGAGCAG-3 'en 5'-CTTAAGTTTGCAACAACTGTGAGC-3'. Deze fragmenten werden ingevoegd in de pGL4.12 [luc2CP
] vector. Eén microgram van elk construct en het Renilla luciferase reporter vector control (pRL-SV40 vector, Promega) werden samen getransfecteerd in 1 x 10
5 cellen gebruikt SuperFect transfectiereagens (QIAGEN). De luciferase assay werd uitgevoerd 24 uur na de invoering reporter, onder toepassing van een Dual-Luciferase Reporter Assay System (Promega). De bepaling werd in drievoud uitgevoerd.
GSDMB
enhancer-HSVtk lentivirus vector
Een pMFG-HSVtk vector werd verstrekt door RIKEN BRC via de Nationale Bio-Resource Project van het MEXT, Japan, met dank aan Dr. . Hirofumi Hamada en een HSVtk cDNA werd uit het als een Nco I-Bam
-fragment. Om de GSDMB
enhancer-HSVtk lentivirus vector, eerst de 496-989 fragment (GSDMB
versterker) te construeren werd in pcDNA3.1 geplaatst (+) (Life Technologies) tussen Nhe
I en Hind
III sites, en vervolgens werd HSVtk cDNA ingevoegd in de vector op een Bam
-plaats in de voorwaartse (voor sense-streng expressie) of achteruit (voor antisense-streng expressie) richting. Vervolgens GSDMB
enhancer-HSVtk sense en GSDMB
enhancer-HSVtk antisense fragmenten werden uit de plasmidevectoren zoals
Nhe I-Not I
fragmenten en in pLVSIN CMV-neo vectoren ingebracht tussen de Xba
I en Not
ik sites. Tenslotte werd een CMV-promoter uit het lentivirale constructen. Virale deeltjes die de vectoren te genereren werden de constructen geïntroduceerd in Lenti-X ™ 293 T-cellen (Takara) met behulp Lenti-X ™ HTX verpakkingssysteem (Takara). Na 72 H'-incubatie werd het medium verzameld en de virale titer (cfu /ml) werd bepaald door transductie in HT-1080-cellen in aanwezigheid van polybreen (5 pg /ml in kweekmedium, Sigma-Aldrich). De deeltjes werden op Met-5A en 60As6 (1 x 10 5 cellen per schaal, in drievoud) in vitro
in aanwezigheid van polybreen (5 pg /ml), en de cellen werden geïncubeerd in medium dat Gancicrovir (GCV, 5 ug /ml, WAKO) gedurende 5 dagen voor celgroei assays. De testen werden in drievoud uitgevoerd en P
-waarde van Student's t-test
tussen de gekweekte cellen met (+) en zonder (-) GCV berekend
behandeling van PD muismodel met GSDMB enhancer-HSVtk vectoren
wij eerder gemeld een muis PD model (PD muizen) die werd geproduceerd door intraperitoneale injectie van 60As6 cellen [25]. 60As6GFP cellen (1 x 10 6 cellen per muis) geïnjecteerd in de peritoneale holte van 18 muizen (6 weken oude muizen van CB17 /Icr-Prkdc < scid > /CrlCrlj Genotype: scid /scid, Charles River, Yokohama Japan) op dag 1. De muizen werden verdeeld in twee groepen; één groep werd geïnjecteerd met de antisense expressievector, en de andere groep werd geïnjecteerd met de sense vector; beide groepen werden vervolgens intraperitoneaal geïnjecteerd met 2 ml PBS oplossing die virusdeeltje (5 x 10 5 cfu) en ganciclovir (2 mg) op 8, 10 en 12 dagen. De gemiddelde overlevingstijd van elke groep en de P
-waarde van de Student's t-test
tussen de twee groepen werden berekend. De studie werd op de dierproeven goedgekeurd door het National Cancer Center Committee.
Resultaten
Identificatie van een versterker regio GSDMB
, die genexpressie drijft in GC cellen Belgique Om de promotor /enhancer gebieden te identificeren die zou effectief bij de ontwikkeling van een therapeutische vector voor peritoneale verspreiding (PS), we eerst gezocht naar genen vaker uitgedrukt in diffuse type GC dan intestinale type GC met comparatieve analyse van genexpressie tussen 12 primaire diffuse-types en 18 intestinale -types, omdat PD wordt vaker gezien bij diffuse type GC dan in de intestinale-type [22]. We hebben gemerkt dat vier van de tien Affymetrix GeneChip probe sets met de hoogste fold-verandering voor genexpressie in diffuse-type GC ten opzichte van intestinale-type waren probe sets voor MYH11
(myosine, zware keten 11, gladde spier-gen, Extra file 1: Tabel S1). Na bevestiging dat het gen niet wordt uitgedrukt in de geïmmortaliseerde humane mesotheelcellen cellijn Met-5A (gegevens niet getoond), selecteerden we MYH11
een sterke kandidaat voor het gen waarvan de promoter maakt diffuse type GC specifieke expressie van HSVtk. Echter, is het gen niet tot expressie gebracht in 60As6 cellen die werden gebruikt voor het maken van PD model muizen (aanvullende bestandsinformatie 2: Figuur S1). Het is waarschijnlijk dat MYH11
tot expressie in kanker-geassocieerde fibroblasten die bijzonder overvloedig in diffuse type GC weefsels. Vervolgens gaan van de microarray data-analyse, verschoven we onze aandacht op upstream regio's van CXCR4
(chemokine (CXC motief) receptor 4 gen) en CXCR7
(chemokine (CXC motief) receptor-gen 7), aangezien beide zijn uitgedrukt in vele soorten kanker en een belangrijke rol in metastase [27]. Het gebruik reporter assays, vonden we dat de stroomopwaartse gebieden van deze genen transcriptioneel actief in zowel de Met-5A en 60As6 cellen (aanvullende bestandsinformatie 2: Figuur S2), hetgeen impliceert dat de regio's drijven de expressie van HSVtk in humane mesotheelcellen in vivo
. Tot slot hebben we ons gericht op de GSDMB
gen, als onze eerdere studie bleek dat het sterk wordt uitgedrukt in GC weefsels en cellijnen [14].
GSDMB
wordt getranscribeerd door twee promoters, cellulaire en LTR promoters ( fig. 1a), en deze wordt voornamelijk gebruikt in normale weefsels en kankercellijnen [19-21]. We bevestigden deze bevindingen door het uitvoeren van RT-PCR analyses van RNA van verschillende soorten normale weefsels (fig. 1b). RT-PCR van GC chirurgische specimens aangetoond dat de LTR promoter werd gebruikt in 14 of 15 intestinale GC-type en met 11 van 15 diffuse type GC (fig. 1c). Fig. 1 GSDMB
gen wordt getranscribeerd door de Cellular en LTR promotors. (A) Een schematische weergave van de twee promoters. (B) Expressie van twee transcripten, één voor cellulaire promotor en anderzijds door LTR, in humane normale weefsels (RT-PCR). Vier varianten van menselijk GSDMB transcript geregistreerd in GenBank; variant 1 (NM_001042471), variant 2 (NM_018530), variant 3 (NM_001165958) en variant 4 (NM_001165959). Transcriptie van varianten 1, 3 en 4 wordt aangedreven door de cellulaire promoter en van variant 2 wordt door de LTR promoter. De 3 'kant van de GSDMB
transcripten gemeen elk. (C) Expressie van LTR transcripten bij maagkanker weefsels, 15 intestinale-type en 15 diffuse type samples (RT-PCR chirurgische specimens)
Een kritische gebied van de transcriptionele activiteit van GC cellen te identificeren, een DNA-fragment spanning -1.080-1053 bp, de positie van een transcriptie startplaats voor de LTR promoter werd geïsoleerd (Fig. 2a). De reporter assays op afgeknotte DNA-fragmenten met behulp van twee GC cellijnen HSC-57 en HSC-59, aangegeven dat een 496-989 regio had sterke transcriptionele activiteit, nog sterker dan het oorspronkelijke -1.080-1053 fragment en dat verdere afknotting van het 496-989 fragment tot aanzienlijke vermindering van de transcriptionele activiteit (Fig. 2b). Het gebied dat overeenkomt met dit fragment met een sterke transcriptionele activiteit werd genoemd GSDMB
enhancer. Fig. 2 Identificatie van GSDMB
versterker. (A) Een schematische weergave reporter constructen gebruikt in de luciferase assays. Lange terminale repeat (LTR) element van de menselijke endogene retrovirus wordt aangegeven door een dubbele pijl. De positie van de transcriptie startplaats voor de transcriptie van de LTR promoter. (B) Luciferase assays met twee maagkanker cellijnen HSC-57 en HSC-59, onthulde een gebied met een sterke transcriptionele activiteit, spanning 496-989, die werd aangeduid als GSDMB
versterker. Vector, lege reporter vector, Bar, standaarddeviatie
Bouw van een GSDMB
-versterker gedreven HSVtk lentivirus vector
We eerder gemeld een muis-PD-model (PD muizen), dat werd geproduceerd door intraperitoneale injectie van 60As6 cellen [ ,,,0],25]; In dit onderzoek hebben we een virale vector therapeutisch voor de behandeling van PD muizen. Voor het onderzoeken van de sterkte van de transcriptionele activiteit van GSDMB
versterker bij 60As6 werden reporter assays uitgevoerd via de reporter construct voor de stroomopwaartse regio van CXCR4 Kopen en CXCR7
ter vergelijking. De GSDMB
enhancer toonden sterkere transcriptie-activiteit in 60As6 cellen dan de CXCR4 golfreizen of de CXCR7
upstream regio's, en, belangrijker nog, de GSDMB
enhancer had zeer zwakke transcriptie-activiteit in de muizen peritoneale mesotheelcellen en in Met-5A, een humane mesotheelcellen cellijn (Fig. 3). Dit resultaat suggereert dat de GSDMB
enhancer maakt HSVtk expressie bijna uitsluitend in 60As6 maar niet in mesotheelcellen van de peritoneale holte van de muizen PD, en waarschijnlijk niet in menselijke peritoneale mesothelium. Fig. 3 GSDMB
versterker heeft sterke transcriptie-activiteit in een 60As6 cellijn. Luciferase assays met drie soorten gekweekte cellen: 60As6 cellen die werden gebruikt voor het maken peritoneale verspreiding (PD) model muizen in deze studie, primaire kweek cellen van muizen peritoneale mesotheelcellen en bestaande humane cellijn mesotherial Met-5A. Bar, standaardafwijking
Vervolgens hebben we het effect van het HSVtk /GCV therapie met een GSDMB
-enhancer aangedreven HSVtk lentivirus vector op 60As6 in vitro
(fig. 4a) onderzocht. Het aantal 60As6 cellen getransduceerd met de lentivirus vector was significant verminderd bij incubatie in medium aangevuld met GCV; anderzijds, dezelfde behandeling HSVtk /GCV had geen effect op de cel aantal Met-5A (fig. 4b). Fig. 4 HSVtk /GCV-therapie met behulp van de GSDMB
-enhancer gestuurde lentivirus vector verbeterde de overlevingskans van PD muizen. (A) een therapeutisch lentivirale vector voor GSDMB
enhancer (Enh)-gedreven expressie van herpes simplex virus thymidine kinase (HSVtk). (B) celproliferatie assays op 60As6 en Met-5A getransduceerd met de therapeutische vector, uitgevoerd door incubatie in het medium (+) /zonder (-) ganciclovir (GCV). (C) een behandeling met HSVtk /GCV behandeling voor PD muizen. Bar, standaarddeviatie, P
, P
-waarde van de Student's t-test
tussen de gekweekte cellen met (+) en zonder (-) GCV. (D) een microscopische observatie vertoonden een kleine populatie van 60As6GFP cellen (groene fluorescentie) geïmplanteerd in muizen op dag 10. peritoneum (e) Aantal overleefden muizen na HSVtk /GCV behandeling met de sense-streng tot expressie vector (rood) en een antisense -streng uitdrukken vector als referentie (blauw). Gemiddelde overlevingstijd van elke groep wordt getoond aan de rechterkant met P Catawiki - waarde van de Student's t-test
tussen de twee groepen
HSVtk /GCV behandeling van occulte PD muizen
We pasten HSVtk /GCV therapie PD muizen. In deze therapeutische assay, bereid we twee soorten van de GSDMB
-enhancer gestuurde lentivirus vector: een vector sprak de sense-streng van HSVtk cDNA en werd gebruikt voor de behandeling van PD muizen, terwijl de andere vector sprak de antisense-streng en werd gebruikt als controle. De therapie werd gestart zeven dagen na intraperitoneale enting van 60As6 cellen die groene fluorescentie eiwit (60As6GFP). Dit schema is ontworpen voor de behandeling van occulte PD model waarin 60As6GFP diffuus cellen werden geënt in de peritoneale holte (fig. 4c, d). Na drie doses van de behandeling, op dag 36 geen van de negen muizen die met HSVtk sense-expressievector was overleden, terwijl twee van de negen muizen referentie reeds gestorven. Geen van de negen verwijzing muizen in leven waren op dag 57, dat wil zeggen, acht weken na de injectie van 60As6GFP cellen; echter vier negen therapeutische vector behandelde muizen nog in leven waren (Fig. 4e). Dit resultaat suggereert dat de therapie de prognose van de occulte PD muizen kan verbeteren.
Discussie
De GSDMB
enhancer drijft genexpressie in GC cellen
Eerder meldden we al dat GSDMB
wordt uitgedrukt in alle GC weefsels en cellijnen bestudeerd [14], en in deze studie aangetoond dat de LTR promotor drijft GSDMB
expressie in 25 van 30 monsters GC (fig. 1c). De transcriptionele activiteit van de LTR (fig. 2a) is eerder aangetoond door reporter assays niet-GC cellijnen [20, 21]. Toch vonden we een aparte regio met een sterke transcriptie-activiteit in het stroomafwaarts van de regio LTR, en aangeduid als GSDMB
versterker. Naast de twee GC cellijnen HSC-57 en HSC-59, de transcriptionele activiteit van dit gebied werd gedetecteerd door reporter assays andere GC cellijnen, waaronder MKN74 (relatieve luciferaseactiviteit ongeveer 1,9), HSC-60 (29,4 ) HSC-42 (2,5) en HSC-44 (4,6), maar niet in HSC-58 of MKN28 (gegevens niet getoond) [14]. Zo hoeft de GSDMB
enhancer niet genexpressie in sommige GC cellen.
Truncatie van een regio die 496-562 significante vermindering van het transcriptie-activiteit van de GSDMB
enhancer (afb. 2b, 562 tot 989). In de 496-562 regio, vonden we een consensus-bindende plaatsen van een aantal transcriptiefactoren, waaronder GATA2, GATA3, GATA4, YY1, SOX5, SOX9, SOX10 en NFY-A, en base-substitutie in een van deze consensus sequenties deed laat de transcriptionele activiteit van de enhancer (gegevens niet getoond). De transcriptiefactor die samenwerkt met de enhancer en draagt bij tot de transcriptionele activiteit nog niet geïdentificeerd.
Toepassing van de therapeutische lentivirus vector voor behandeling van menselijke occulte PD
curatieve therapie niet is vastgesteld voor PD. GC patiënten met macroscopische PD hebben een slechte prognose, met een mediane overleving van 3-6 maanden. Degenen met alleen microscopisch PD hebben ook een slechte prognose; hun 5-jaarsoverleving is 0-18% [28]. Daarom is het belangrijk om occulte PD detecteren door cytologisch onderzoek van peritoneale lavage vloeistof en volledig uit te roeien kankercellen in de peritoneale holte. Meta-analyses van Cabalag et al
. aangegeven dat uitgebreide intraperitoneale lavage (EIPL, fysiologische zoutoplossing 1 nestje /dosis, 10 keer) en intraoperatieve intraperitoneale chemotherapie (IIPC) met cisplatine aanzienlijk verbeterd 5-jaars totale overleving tot meer dan 40% [28]. De resultaten van onze studie suggereren dat HSVtk /GCV therapie met een lentivirus vector verbetert de prognose voor de patiënt zelfstandig, en we nemen het zal worden gebruikt als consolidatietherapie. Solide tumoren met diffuse groei zijn samengesteld uit een groot aantal myofibroblasten en weinig schepen (bijv., Diffuse-type GC, alvleesklier kanker en scirrhous vorm van borstkanker). Afhankelijk van de omstandigheden van de micro-omgeving, zoals gebrek aan voedingsstoffen, deze tumoren een hoge prevalentie van zelden proliferatieve tumorcellen. Aldus kan diffuse type GC cellen verspreid in de buikholte uit een populatie die het cytotoxische effect van cisplatina kunnen weerstaan. De lentivirus therapeutische vector kunnen introduceren HSVtk in zowel prolifererende en niet-delende cellen. Bovendien is de GSDMB
enhancer maakt GC celspecifieke HSVtk expressie. Deze beperkte expressie vermindert mesotheelcellen celbeschadiging, hetgeen impliceert dat de gentherapie kan worden uitgevoerd met doses hoog genoeg GC cellen volledig uit te roeien, zelfs die resistent zijn tegen cisplatine, occulte PD. Het is waarschijnlijk dat combinatietherapie EIPL en IIPC, gevolgd door HSVtk /GCV therapie met een lentivirus vector, de prognose van occulte PD sterker dan EIPL en IIPC combinatietherapie alleen verbeteren. Wij zijn van mening dat dit regime waardig is inzake klinische proeven wordt geplaatst. Hoewel het lijkt dat de GSDMB
enhancer werkt niet in sommige GC cellen, verdere studies gericht op het vaststellen extra GC-specifieke enhancers, zal dit probleem op te lossen.
Conclusies
De GSDMB
driven HSVtk expressie vector had een therapeutisch effect op de occulte PD model muizen. Deze strategie kan mogelijk worden gebruikt om te voorkomen GC patiënten uit aanbestedende PD en ook gebruikt voor de GC behandeling van patiënten met PD.
Verklaringen
Verantwoording Inloggen Deze studie werd ondersteund door een Grants-in-Steun voor Wetenschappelijk Onderzoek (C .) door de Japan Society voor de Bevordering van de Wetenschap (JSPS KAKENHI Grant nummer 23501322)
Extra bestanden
Extra file 1: Tabel S1. Top tien probe sets tonen expressie specifiek voor diffuse-type maagkanker. Extra file 2: Figuur S1. MYH11
komt niet tot uitdrukking in maagkanker cellijnen. Een promotor regio zowel CXCR4 Kopen en CXCR7
genen toont een transcriptie-activiteit in zowel 60As6 en MET-5A cellen. Tegenstrijdige belangen Ondernemingen De auteurs verklaren dat ze geen concurrerende belangen.
Auteurs bijdragen
NS en HS ontworpen en regisseerde deze studie. NS uitgevoerd biologische analyses en dierproeven met ondersteuning door RK, FC en KY. Alle auteurs gelezen en goedgekeurd het definitieve manuscript.
 Zijn detoxen en reinigingen veilig?
Zijn detoxen en reinigingen veilig?
 Gefermenteerde voedingsmiddelen en probiotica in de darmgezondheid
Gefermenteerde voedingsmiddelen en probiotica in de darmgezondheid
 7 toepassingen van tea tree olie voor huidproblemen bij kinderen
7 toepassingen van tea tree olie voor huidproblemen bij kinderen
 Waarom je afvalt na het starten van SCD en GAPS
Waarom je afvalt na het starten van SCD en GAPS
 Hoogtepunten en belangrijkste aandachtspunten van de Boston Bacterial Meeting (BBM) 2019
Hoogtepunten en belangrijkste aandachtspunten van de Boston Bacterial Meeting (BBM) 2019
 Blaasontsteking (cystitis)
Blaasontsteking (cystitis)
 Maakgriep (gastro-enteritis) Symptomen Tekenen, behandelingsmiddelen, dieet
Maakgriep (gastro-enteritis) feiten Acute gastro-enteritis duurt ongeveer zeven tot veertien dagen, terwijl chronische gastro-enteritis maanden of langer kan duren. De buikgriep (gastro-enteriti
Maakgriep (gastro-enteritis) Symptomen Tekenen, behandelingsmiddelen, dieet
Maakgriep (gastro-enteritis) feiten Acute gastro-enteritis duurt ongeveer zeven tot veertien dagen, terwijl chronische gastro-enteritis maanden of langer kan duren. De buikgriep (gastro-enteriti
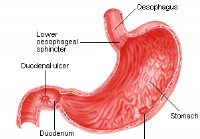 Maagzweren
Wat is een maagzweer? Een maagzweer is een laesie of zweer op de beschermende bekleding van de maag (waar het een maagzweer wordt genoemd) of twaalfvingerige darm. Artsen definiëren het vaak als een
Maagzweren
Wat is een maagzweer? Een maagzweer is een laesie of zweer op de beschermende bekleding van de maag (waar het een maagzweer wordt genoemd) of twaalfvingerige darm. Artsen definiëren het vaak als een
 Endoscopy vs. colonoscopie
Endoscopy vs. colonoscopie:wat is het verschil? Soms zijn endoscopen cameras op lange buizen, maar de laatste jaren heeft de technologie artsen in staat gesteld cameras in kleine pillen te monteren o
Endoscopy vs. colonoscopie
Endoscopy vs. colonoscopie:wat is het verschil? Soms zijn endoscopen cameras op lange buizen, maar de laatste jaren heeft de technologie artsen in staat gesteld cameras in kleine pillen te monteren o