Tilstedeværelse av S100A9-positive inflammatoriske celler i kreftvevet korrelerer med et tidlig stadium kreft og en bedre prognose hos pasienter med magekreft
Abstract
Bakgrunn
S100A9 ble opprinnelig oppdaget som en faktor utskilt av betennelsesceller. Nylig, S100A9 ble funnet å være assosiert med flere humane maligniteter. Hensikten med denne studien er å undersøke S100A9 uttrykk i magekreft og utforske sin rolle i kreft progresjon
Metoder
S100A9-uttrykk i mage vevsprøver fra 177 magekreftpasienter ble vurdert ved immunhistokjemi.. Ekspresjonen av dens dimerisering partner S100A8 og den S100A8 /A9 heterodimeren ble også bestemt ved den samme metode. Effekten av eksogent S100A9 på motilitet av magekreftceller AGS og BGC-823 ble deretter undersøkt.
Resultater
S100A9 ble spesielt uttrykt av inflammatoriske celler slik som makrofager og nøytrofiler i humane magekreft og gastritt vev. Statistisk analyse viste at en høy S100A9 legemer (> = 200) pr 200x forstørrelse mikroskopisk felt i kreftvev ble prediktiv av tidlig magekreft. Høy S100A9-positive celletall var negativt korrelert med lymfeknutemetastase (P
= 0,009) og tumorinvasjon (P
= 0,011). S100A9 ble identifisert som en uavhengig prognostisk prediktor for total overlevelse av pasienter med magekreft (P
= 0,04). Pasienter med høy S100A9 celletall var med gunstig prognose (P
= 0,021). Videre undersøkelser fant at S100A8 distribusjon i menneskelige mage kreft vev var lik S100A9. Imidlertid er antallet av S100A8-positive celler ikke positivt korrelerer med pasientens overlevelse. Den inflammatoriske celler infiltrere kreft var S100A8 /A9 negative, mens de i gastritt var positive. Videre eksogene S100A9 protein hemmet migrasjon og invasjon av mage kreftceller.
Konklusjoner
Våre resultater antydet S100A9-positive betennelsesceller i mage kreft vev er forbundet med tidlig stadium av magekreft og god prognose.
Nøkkelord
Magekreft kreft~~POS=HEADCOMP S100A9 betennelsesceller Tumor staging Survival Bakgrunn
Magekreft kreft~~POS=HEADCOMP er en av viktigste årsakene til kreftdødelighet i verden. Totalt 989,600 nye magekrefttilfeller og 738,000 dødsfall ble anslått å ha skjedd i 2008, og over 70% av nye tilfeller og dødsfall forekommer i utviklingsland som Kina [1]. Magekreft er ofte oppdages ved avanserte stadier, når prognostiske utfall er dårlig. Nesten 70-80% av pasientene har involvering av regionale lymfeknuter som har en dyp innflytelse på overlevelse [2, 3]. Derfor oppdagelsen av nye biomarkører hjelpe til tidlig oppdagelse og nøyaktig prediksjon av svulst atferd kan forbedre pasientens overlevelse [4-6]. Medlemmer Medlemmer av S100 familie av proteiner er fremstår som biomarkører i flere typer svulster [7]. S100 familiemedlem S100A9 er et 13kd protein som inneholder konserverte strukturelle motiver som består av to EF-hand Ca
2 + -binding domener. Etter kalsium bindende, samhandler S100A9 med en annen S100 familiemedlem S100A8 å danne funksjonelle heterodimer kalt calprotectin [8, 9]. S100A9 ble opprinnelig identifisert som en faktor utskilt av inflammatoriske celler slik som neutrofiler og makrofager i reumatoid artritt, inflammatorisk tarmsykdom, og andre inflammatoriske sykdommer [10-14]. S100A9, S100A8, samt S100A8 /A9 heterodimer calprotectin, blir overuttrykt i løpet av betennelse-indusert karsinogenese [15]. S100A9 uttrykk er oppregulert i tumorceller i lunge [16], prostata [17], og brystkreft [18, 19], mens den er nedregulert i humane esophageal kreftceller [20]. I kolorektal kreft vevsprøver imidlertid S100A9 proteinet ble ikke detektert i kreftcellene, men snarere i inflammatoriske celler spredt i hele tumoren stroma [21]. I tillegg S100A9 var signifikant høyere i avføringsprøver av pasienter med kolorektal kreft enn hos kontrollene [22]. I magekreft, genekspresjon og proteomikk analyse viste høy ekspresjon av S100A9 i vevet. [23, 24]. Men fordelingen i vevet og tilknytning til clinicopathological funksjoner ble ikke fullt ut demonstrert.
I denne studien brukte vi genekspresjonsanalyser å sammenligne S100A9 uttrykk i mage kreft vev og i de tilstøtende, tilsynelatende normalt vev. Immunhistokjemisk farging viste S100A9 i tumorassosierte inflammatoriske celler. Videre adressert vi sammenhengen mellom antall S100A9-positive celler i tumorvev og clinicopathological egenskaper. Vi tok også opp samlokalisering av S100A9 og S100A8 samt lokalisering av dimer kalprotektin ved immunfluorescens. Til slutt, for å få innsikt i funksjon av S100A9 i kreftceller, undersøkte vi effekten av rekombinant S100A9 protein om migrasjon og invasjon av magekreftceller AGS og BGC-823.
Metoder
Pasienter og prøver vev
Denne undersøkelsen ble utført etter godkjenning fra etikkomiteen av Peking University Cancer Hospital. Informert samtykke ble oppnådd fra hver pasient. Ett hundre syttiseks pasienter med magekreft ble studert. 124 menn og 53 kvinner (gjennomsnittsalder, 57 år, range, 26-80 år) ble diagnostisert og kirurgisk behandlet i Peking University Cancer Hospital mellom 1998 og 2004. Dybden av tumorinvasjon, histologisk grad, lymfeknutemetastaser, levermetastaser, og vaskulær invasjon ble innhentet fra kliniske og histopatologiske rapporter. Stadium av magekreft ble klassifisert i henhold til den syvende utgaven tumormetastaser (TNM) klassifisering anbefalt av American Joint Committee on Cancer. Ingen av pasientene fikk kjemoterapi eller strålebehandling preoperativt. Alle pasientene ble fulgt opp fram til januar 2010. Etter gastrektomi, ble en del av resected prøven fiksert i 10% formalin og behandlet rutinemessig for patologisk vurdering, og en annen var snap-frosset i flytende nitrogen lagret ved -80 ° C for RNA ekstraksjon. I tillegg ble 30 matchet metastatiske lymfeknuter også samlet inn fra disse pasientene. Ti tilfeller av kronisk blindtarmbetennelse vev med eksaserbasjon ble gitt av Institutt for generell kirurgi, ble det tilknyttede sykehus Qingdao University Medical College.
Immunohistochemistry (IHC)
Fire-mikrometer seksjoner fra formalinfiksert parafin-embedded vev montert på poly-L-lysin-belagte objektglass og deretter deparaffinized i xylen og rehydratisert gjennom alkohol til destillert vann. Endogen peroksidaseaktivitet ble blokkert med 3% hydrogenperoksid i 15 minutter ved romtemperatur. Etter at trykket koking lysbildene i 10 mmol /L EDTA (pH 8,0) i 3 minutter, ble seksjonene inkubert med 5% geiteserum, og deretter inkubert over natten ved 4 ° C med mus anti-S100A9-antistoff (1: 200, T1028, BMA Biomedicals, Sveits) eller mus anti-S100A8-antistoff (1: 200, T1031, BMA Biomedicals) eller muse-anti-S100A8 /A9-antistoff (1: 200, T1023, BMA Biomedicals). Primære antistoffer ble detektert ved anvendelse av en to-trinns EnVision System (Dako, Glostrup, Danmark). Pepperrot-peroksidase og diaminobenzedene hydroklorid (DAB) ble enzym og kromogen anvendes. Uttrykk av S100A9, S100A8 og S100A8 /A9 ble også påvist i Cybrdi vev microarray lysbilder (IC00-01-001, Cybrdi, Xi'an, Kina) inneholder kronisk gastritt med metaplasi (57 saker) og mage karsinom vev (23 tilfeller). Ti tilfeller av kronisk blindtarmbetennelse prøver med eksaserbasjon ble servert som positiv kontroll for S100A8 /A9.
IHC vurdering og cut-off Definisjon av S100A9 og S100A8 ble farget i de inflammatoriske celler som makrofager og nøytrofile infiltrere tumorvev. Positive celler viste en varierende grad av cytoplasma farging. Bilder ble anskaffet ved hjelp ARIOL bildeanalysesystem (Applied Imaging, San Jose, CA, USA). Skanneren er basert på en Olympus BX61 mikroskop med en motorisert stadium og autofokus evner utstyrt med et kamera. Lysbilder ble skannet på 200 × forstørrelse. Graden av monoklonale S100A9 eller S100A8 antistoffreaksjon i hvert vev seksjon ble vurdert ved å telle antallet fargede inflammatoriske celler i tre 200 x forstørrelse omfang. Dette ble utført av to uavhengige patologer ved hjelp av en automatisk mikroskop system og bildebehandling (se tilleggsfiler 1: Figur S1). Cut-off verdien av S100A9 farget betennelsesceller for prediksjon av pasientens patologisk stadium ble bestemt av mottaker drift karakteristikk (ROC) kurve.
Laser konfokal skanning
å undersøke samlokalisering av S100A9 og dens dimerization partner S100A8, eller heterodimeren S100A8 /A9, de Cybrdi vev microarray bakker (IC00-01-001) ble inkubert i 1,5 timer ved romtemperatur med mus anti-S100A9-antistoff (1: 200) som på forhånd er merket med Zenon Alexa Fluor 647 mus IgG Labeling Kit (Z-25008, rød fluorescens), og enten anti-S100A8 antistoff (1: 200) eller anti-S100A8 /A9 antistoff (1: 200) pre-merket med Zenon Alexa Fluor 488 mus IgG Merking Kit (Z-25002 , grønn fluorescens). Confocal bilder ble ervervet ved bruk av Leica TCS SP5 konfokal mikroskop (Leica, Mannheim, Tyskland). . I tillegg ble kjernene kontra med DAPI (Vector, Burlingame, CA, USA), eksitasjon ved 358 nm
Prøver av kroniske blindtarmbetennelse vev med forverring inkubert med anti-S100A9 antistoff (1: 200, rød fluorescens-merket), og anti-S100A8 /A9-antistoff. (1: 200, grønn fluorescens-merket) som en positiv kontroll for den bestemte S100A8 /A9 heterodimeren uttrykk
celle~~POS=TRUNC kultur~~POS=HEADCOMP
Begge cellelinjer i denne studien ble tidligere profilert av microarray analyse og ble regelmessig bekreftet ved hjelp STR-analyse (short tandem repeat DNA fingerprinting) [25]. Magekreft cellelinje AGS ble innhentet fra ATCC (American Type Culture Collection, Manassas, VA), og cellelinje BGC-823 ble etablert i Kina og hentet fra Cell Research Institute, Shanghai, Kina. Kreftceller ble rutinemessig dyrket som et monolag i RPMI-1640-medium (GIBCO BRL, Carlsbad, CA), supplert med 10% (v /v) føtalt kalveserum (FCS, GIBCO) og antibiotika ved 37 ° C i en fuktet 5% CO 2 atmosfære.
Cell invasjon analysen
CytoSelect 24-Well Cell Invasion assay kit ble kjøpt fra Cell Biolabs, USA. S100A9 rekombinant protein ble kjøpt fra BMA Biomedicals, Sveits. Celle invasjon ble utført med Transwell Innsett, som lar celler til å migrere gjennom et 8 um porestørrelse polykarbonatmembran. Den øvre overflaten av innsatsen membran ble overtrukket med et ensartet lag av tørket basalmembran matriseoppløsningen. Celler resuspendert i serumfritt medium ble sådd ut i det øvre kammer av hvert Transwell ved en tetthet på 10 6 celler /mL (200 ul /kammer). S100A9 rekombinant protein ble tilsatt til det øvre kammer medium ved 0, 10, 20, 50 eller 100 ng /ml. Den nederste kammeret ble fylt med 500 ul medium inneholdende 10% FCS. Celler ble tillatt å migrere i 48 timer ved 37 ° C. Celler som forble i det øvre kammer ble fjernet med en bomullsdott, og celler som hadde trengt inn til undersiden av membranen ble farget i celle Flekk løsning i 15 minutter, og tellet i ni tilfeldig valgte mikroskopiske felt (200 x) pr brønn . Hver innskuddet ble deretter overført til en tom brønn og inkubert i 200 ul av ekstraksjonsløsning. Etter 10 minutter, ble 100 ul av oppløsning fra hver prøve overført til en 96-brønners mikrotiterplate og målt i en plateleser ved OD560nm.
Cellemigrering assay
Cell bevegelighet ble vurdert ved hjelp av en sårtilheling assay. Celler ble sådd ut i seks-brønns vevskulturskåler og dyrket til konfluens for å få en celle monolag, som deretter ble såret ved hjelp av sterile 200 ul pipettespisser. Enhver celleavfall ble fjernet ved vasking med PBS. Den såret monolaget Cellen ble deretter inkubert i medium med 100 ng /ml S100A9 rekombinant protein. Kontrollceller ble behandlet med serumfritt RPMI-1640 medium. Time-lapse bildene ble tatt med en omvendt fase-kontrast mikroskop ved 200 × forstørrelse for 0, 24 og 48 timer. Cellen migrasjon evne ble evaluert ved å beregne gjennomsnittlig cellevandring avstand.
Statistisk analyse
Clinicopathologic variabler ble hentet fra kliniske og histopatologiske rapporter. ROC-kurver ble anvendt ved bestemmelse av cut-off-verdien av den S100A9-positive inflammatorisk celletall ved evaluering patologisk TNM stadium. Foreningen av S100A9-positive inflammatorisk celletall med forskjellige TNM etapper ble gjort med Wilcoxon rank-sum test. For å få assosiasjoner mellom S100A9 eller S100A8 legemer og clinicopathologic variabler, data var kryss-ordnet og en χ
2 testen ble utført. Akkumulert overlevelse ble beregnet med Kaplan-Meier-metoden, og sammenligninger mellom grupper ble gjort med en log-rank test. Total overlevelse ble målt fra tidspunktet for første operasjonen til dødsdato, regnet død uavhengig av årsak som endepunktet, eller den siste datoen for informasjon som sluttpunkt hvis noe tilfelle ble dokumentert. En multivariat analyse av Cox regresjonsmodell (bakover, trinnvis) ble opprettet for å vurdere påvirkning av hver variabel på overlevelse. Signifikans ble satt til P
< 0.05.
Resultater
Uttrykk av S100A9 i infiltrere betennelsesceller i magekreft og kronisk gastritt vev
I en tidligere gen rekke analyse, fant vi at magekreft vev ble skilles fra tilstøtende noncancerous slimhinnen ved karakteristiske forskjeller i deres genuttrykksmønster [26]. Mangfoldet av genuttrykksmønster kan gjenspeile variasjon i de iboende egenskapene til tumor- og normale celler i tillegg til variasjon i den cellulære sammensetning av disse komplekse vev. Innenfor disse genene ekspresjonen av S100A9 i magekreft vev var høyere enn for matchet tilstøtende noncancerous slimhinnen (P
= 0,00241, figur 1A). Figur 1 Uttrykk av S100A9 i magekreft og tilstøtende ikke-kreft vev. (A) Forskjellige uttrykk verdien av S100A9 i 72 mage kreft vev og paret ingen til kreft vev ved å analysere data fra Illumina Sentrix BeadChip cDNA microarray. (B-E) Immunohistokjemisk farging av S100A9 i magekreft vev (B) metastatiske lymfeknuter (C), kronisk gastritt (D), og tilstøtende ikke-kreft mageslimhinne (E). S100A9 lokalisering ble avslørt som brun eller rød granulert loci i cytoplasma av infiltrerende inflammatoriske celler, spesielt i mononukleære fagocytter og nøytrofile granulocytter. (Forstørrelse 200 x).
Immunhistokjemi av prøver fra 177 magekreftpasienter viste at S100A9 var positive i alle primære cancervev med immunofarging utelukkende lokalisert i inflammatoriske celler så som makrofager og nøytrofile infiltrerende primære tumorvev (De forskjellige celletyper i vev prøvene ble identifisert ved to uavhengige patologer) (figur 1B). Alle undersøkte metastatiske lymfeknuter (n = 30) var også positivt for S100A9 med farging utelukkende ligger i betennelsesceller rundt de metastatisk kreft vev (figur 1C). I tilstøtende ikke-kreft slimhinner, ble S100A9 uttrykt i inflammatoriske celler infiltrere gastritt. Mageslimhinnen hadde negative eller svært svak S100A9 uttrykk (figur 1D, E).
S100A9-positive inflammatorisk celletall i kreftvev er assosiert med kreft stadium og pasient overlevelse
å vurdere omfanget av S100A9 uttrykk i magekreft assosiert miljø, ble antall S100A9-positive betennelsesceller i hver svulstvev målt ved gjennomsnitt de legemer på tre felt (original forstørrelse, 200 ×) i området med flest positive celler på stedet av dypeste tumorinvasjon. Sammenheng mellom celletall og clinicopathological parametre og pasientens overlevelse ble analysert ved bruk av Wilcoxon rank sum test og Kaplan-Meier metoden. Som vist i figur 2A, gradvis reduksjon av S100A9-positive inflammatorisk celletall i kreftvev ble assosiert med økning av tumor patologisk stadium fra I til IV (Wilcoxon rank sum test for 4 etapper, P
= 0,0265). Figur 2 High S100A9 celletall i kreftvev indikerer bedre resultat i mage kreftpasienter. (A) Scatter tomt på S100A9-positive inflammatorisk celletall i hvert patologisk TNM stadium. Den blå linjen viser nivået på 200 (B) ROC kurve av S100A9 celletall for prediksjon av patologisk TNM stadium. Arrow indikerte cutoff punktet om 200. (C) Kaplan-Meier analyse av total overlevelse for hvert patologisk TNM stadium. (D) Kaplan-Meier analyse av total overlevelse for høy S100A9 legemer (≥ 200) gruppe og lav S100A9 legemer (< 200) gruppe. (Kun 176 pasienter ble inkludert i analysen for en pasient man ikke å følge opp).
Da vi testet prediksjon kraften i S100A9 legemer for tumor stadium i magekreft. Basert på TNM stadium, ble pasientene delt i to grupper, mindre avansert stadium gruppe (I + II) og avansert gruppe (stadium III + IV). Areal under kurven (AUC) erholdt fra mottakeren opererer karakteristiske (ROC) kurver ved hjelp av S100A9-positive inflammatoriske celler telle var 0,623 for patologiske TNM stadier. verdi cutoff var 198,5 (vi brukte 200 i følgende analyse) per 200 × forstørrelse feltet med 64,3% sensitivitet og 61,9% spesifisitet for tumor stadium prediksjon (figur 2B). Cutoff linje av 200 kan anvendes for å separere de mindre avansert gruppe fra den avanserte gruppen. Forskjellen var signifikante mellom de to gruppene (Wilcoxon rank sum test for to grupper, P
= 0,017, figur 2A).
Ettersom overlevelsesanalyse viste signifikant forskjellig prognose for magekreftpasienter i forskjellige kreft trinn (figur 2C) analyserte vi forholdet mellom S100A9-positive betennelsesceller teller og pasient overlevelse. Pasientene ble fordelt etter grenseverdi i høy S100A9 legemer (≥ 200) gruppe og lav S100A9 legemer (< 200) gruppe. 5-års overlevelse var 44,6% i høy legemer gruppen versus 22,5% i lav legemer gruppen (P
= 0,021, figur 2D). Median overlevelse var 35,1 ± 10,8 måneder for den høye celletall gruppen og 20,3 ± 3,0 måneder for lavt celletall gruppe, henholdsvis. Tatt sammen, kan S100A9-positive inflammatorisk celletall i magekreft vev benyttes som en prediktor for å skille tidlig stadium og avansert magekreft med cutoff av 200 positive celler /HPF. Tilstedeværelse av S100A9-positive inflammatoriske celler i kreftvevet korrelerer med en bedre prognose hos pasienter med magekreft.
Lavt antall S100A9-positive betennelsesceller i kreftvev positivt korrelerer med dårlig clinicopathological funksjoner
lav S100A9 celletall ble funnet å være korrelert med tumorinvasjon dybde (T scenen), lymfeknutemetastase (N scenen), og klinisk TNM stadium (P
= 0,011, 0,009 og 0,002, henholdsvis). Korrelasjon mellom S100A9 legemer og andre kliniske funksjoner som kjønn, alder, tumor beliggenhet, levermetastaser (M scenen), vaskulær invasjon og differensiering var ikke statistisk signifikant (alle P
> 0,05) (tabell 1). I tillegg multivariat analyse viste N stadium (P
= 0,006), levermetastaser (P
= 0,000), og S100A9 legemer (P
= 0,046) for å være uavhengige faktorer i å forutsi total overlevelse (tabell 2 ) .table en forening av S100A9-positive inflammatorisk celletall i kreftvev med clinicopathological parametre i mage kreftpasienter
variabler
lav S100A9 (positive celler < 200)
Høy S100A9 ( positive celler > = 200)
P
verdi
Sex
0,125
Mann fra 74
50
Kvinne
25
28
Age
0,089
< 50
32
18
50-59
24
12
60-69
33
33
> = 70
10
15
Tumor plassering
0.271
Cardia
26
15
Non-Cardia
73
63
Dybde tumorinvasjon **
0,011
T1
3
2
T2
7
19
T3
69
42
T4
20
15
lymfeknutemetastaser
0,009
N0
13
23
N1
32
30
N2
32
17
N3
22
8
levermetastaser
0,571
Negativ
89
68
Positive
10
10
TNM stadium
0,002
І
3
12
II
37
35
III
50
21
IV
9
10
Vaskulær invasjon
0,742
Negativ
38
31
Positive
58
43
Ikke registrert *
3
4
Differensiering **
0,472
Vel
2
4
Moderat + Dårlig
82
66
Andre typer
13
6
Ikke bestemt
2
to product: * data ufullstendig.
** Fishers eksakte test.
Tabell 2 Multivariat analyse av prognostiske faktorer for total overlevelse av magekreftpasienter
Variasjoner
P
RR
CI (95%)
Sex
0,671
1,106
0,694 til 1,765
menn versus kvinner
Age
0,179
1,148
0,938 til 1,405
< 50
50-59
60-69
> = 70
Tumor plassering
0,545
0,864
0,538 til 1,387
Cardia vs.
Non-Cardia
Differensiering
0,301
0,751
0.437- 1,292
Vel versus moderat + dårlig
lymfeknutemetastaser
0,006
1,841
1,196 til 2,835
N0 + N1 versus N2 + N3
Dybde av tumorinvasjon
0,1
1,756
0,897 til 3,435
T1 + T2 versus T3 + T4
levermetastaser
0
3,461
2,002 til 5,983
Negativ versus positiv
Vaskulær invasjon
0,107
1,452
0,922 til 2,285
Negativ versus positiv
S100A9-positive inflammatorisk celletall
0,046
0.643
0,417 til 0,991
< 200 versus > = 200
RR: relativ risiko; CI. Konfidensintervall
uttrykk status av S100A8 og S100A8 /A9 heterodimer i mage kreft vev og gastritt vev
Kronisk gastritt er en kronisk mage lesjon, patologisk preget av uspesifikke kroniske betennelse i mageslimhinnen. Den betennelsesceller i kronisk gastritt er morfologisk lik dem infiltrere primære mage kreft vev. I noen tilfeller, kronisk gastritt og med kan føre til magekreft. Neste, vi videre undersøkt uttrykk for S100A8, et nært familiemedlem av S100A9 og heterodimerisering skjemaet S100A8 /A9 i både mage kreft vev og tilstøtende ikke-tumor kronisk gastritt vev i magekreft prøvene ved å utføre immunhistokjemi. I likhet med mønsteret av S100A9, ble S100A8 uttrykt utelukkende i inflammatoriske celler infiltrere både tumorvev og tilstøtende gastritt vev. . S100A8 ble ikke uttrykt i alle magekreftceller og normale mageslimhinnen
Deretter kvantifisert vi antall S100A8-positive betennelsesceller i hver svulstvev som beskrevet tidligere for S100A9 (tilleggsfiler 1: Figur S1). Overraskende, S100A8 celletall i magekreft vev ikke korrelerer med de fleste av clinicopathological funksjoner (Tilleggs fil 2: Tabell S1) eller pasient overlevelse (tilleggsfiler 3: Figur S2). Videre er ekspresjon av heterodimerisering formen S100A8 /A9 ble ikke påvist i noen inflammatoriske celler som infiltrerer magekreft vev, mens noen S100A8 /A9-positive celler ble identifisert i kronisk gastritt vev (data ikke vist). Disse data indikerte at fordelingen av S100A9, S100A8 og S100A8 /A9 kan være annerledes i menneskemagekreft og kronisk gastritt vev.
Å bekrefte denne hypotesen, vi videre undersøkt subcellulære lokalisering mønster av S100A9, S100A8 og S100A8 /A9 heterodimer uttrykk ved å utføre immunofluorecence flekker i en vev microarray inkludert 23 tilfeller av magekreft og 57 tilfeller av kronisk gastritt. I magekreft vev, ble både S100A9 og S100A8 proteiner oppdaget i tumor-infiltrerende inflammatoriske celler (figur 3A, B), mens ingen S100A8 /A9 heterodimer ble funnet i noen tilfeller (Figur 3G). Uttrykk for S100A8 og S100A9 delvis overlappet i cytoplasma av celler (figur 3D, E). I tillegg ble S100A9 og S100A8 proteiner detektert i inflammatoriske celler i kronisk gastritt (figur 3 K, L). Fordelingen av disse to proteinene også delvis overlappet (figur 3 N, O). I samsvar med resultatene av immunhistokjemi, ble S100A8 /A9 ikke uttrykt i alle celler i mage kreft vev (figur 3G), mens ekspresjonen av S100A8 /A9 delvis overlappet med den S100A9 i inflammatoriske celler av gastritt vev (figur 3Q, S, T) . Ikke overraskende uttrykk og distribusjon av S100A8 /A9 i kronisk blindtarmbetennelse vev med forverring (positiv kontroll) var mye likt de i kronisk gastritt vev (figur 3U, V, X, Y). Til sammen kan dette uttrykket og subcellulære lokalisering av S100A9, S100A8 og S100A8 /A9 i ulike vev implisere deres ulike roller i magekreft eller kronisk gastritt miljø. Figur 3 immunfluorescens bilder av S100A9, S100A8 og S100A8 /A9 proteiner i vev microarray lysbilder som inneholder mage kreft vev (A-J) og kronisk gastritt vev (K-T), og kroniske blindtarmbetennelse vev med forverring (U-Y). S100A9 og S100A8 ble oppdaget av monoklonalt antistoff, prelabeled med Zenon Alexa Fluor Mouse IgG Merking Kit (med grønn og rød fluorescens henholdsvis). Kjernen var farget av DAPI. S100A8 /A9 heterodimerer kunne påvises ved hjelp av dimer-spesifikt antistoff 27E10 fra BMA Biomedicals prelabeled med grønn fluorescens. Samlokaliseringen av S100A9 og S100A8 eller S100A8 /A9 ble vist i fusjonerte bilder (D, I, N, S, X) og større sammenslåtte bilder (E, J, O, T, Y). Hvit pil i tre T viser samlokalisering av S100A9 og S100A8 /A9 i kronisk gastritt. Bar lengde, 50 mikrometer.
Hemmende effekt på S100A9 rekombinant protein om migrasjon og invasjon av magekreft cellelinjer in vitro
S100A9 proteinet er uttrykt i og utskilt av betennelsesceller, som fungerer som en megler i akutt og kronisk betennelse. Siden S100A9-positive inflammatorisk celletall korrelert med mindre aggressive clinicopathological egenskaper, vi videre testet direkte hemmende funksjon av rekombinant S100A9 på migrasjon og invasjon av mage kreftceller. For å evaluere invasive egenskaper av magekreftceller, ble Transwell-analyser anvendt. To gastrisk kreft-cellelinjer, AGS og BGC-823, ble behandlet med serumfritt medium eller i medium inneholdende forskjellige konsentrasjoner av S100A9 rekombinant protein (10, 20, 50 og 100 ng /ml, henholdsvis). Invasive celler ble talt i ni tilfeldig utvalgte mikroskopiske felt (200 ×). Resultatene viste at S100A9 rekombinant protein svakt hemmet AGS celle invasjon (figur 4A), mens S100A9 inhiberte signifikant BGC-823 invasjon på en konsentrasjonsavhengig måte (P
< 0,05, figur 4C). Å analysere migrere muligheten av mage kreft celler, utførte vi sårtilhelingen analysen. Begge cellelinjer ble behandlet med serumfritt medium eller i medium inneholdende 100 ng /ml S100A9 rekombinant protein. Resultatene viste at S100A9 svakt inhiberte AGS cellemigrering (figur 4B), mens cellemigrasjon avstander på BGC-823-celler behandlet med S100A9 etter 24 timer og 48 timers inkubering var signifikant lavere enn de av kontrollen (P
< 0,05, Figur 4D). Figur 4 Effekt av S100A9 rekombinant protein på invasjon og migrering av magecancercellelinjer. I transwell-analyse, ble AGS (A) og BGC-823 (C) celler behandlet med serumfritt medium eller i medium inneholdende 10, 20, 50 eller 100 ng /ml S100A9 rekombinant protein. Invasive celler ble talt i tilfeldig ni utvalgte mikroskopiske felt (200 ×). I sårheling assay ble AGS (B) og BGC-823 (D) celler behandlet med serumfritt RPMI-1640-medium eller et medium inneholdende 100 ng /ml S100A9 rekombinant protein. Bilder ble tatt til fange av en omvendt fase-kontrast mikroskop ved 0 h, 24 timer og 48 timer etter såret. Tre uavhengige eksperimenter ble utført. Resultatene ble presentert som betyr ± S.D. av disse uavhengige eksperimenter. P
verdi vs.
kontrollgruppen.
Diskusjon
Menneskelig kreft er en kronisk sykdom som stammer fra transformerte celler som genetisk samt epigenetiske forandringer. Imidlertid er kreften ikke består bare av kreftceller. Kreftvev inneholder andre celletyper, inkludert fibroblaster og epitelceller, immunceller og celler som danner blodkar og lymfekar vaskulaturen [27]. I dette komplekset svulstens mikromiljø, inflammatoriske mediatorer regulere ulike stadier av svulst utvikling, herunder initiering, markedsføring, invasjon og metastasering [28].
S100A9, et medlem av S100 familie, er rikt på granulocytter, monocytter og aktiverte keratinocytter under ulike inflammatoriske tilstander. I denne studien fant vi at S100A9 er spesielt plassert i inflammatoriske celler infiltrere mage kreft vev og kronisk gastritt vev, mens alle mage kreftceller eller tilstøtende celler av mageslimhinnen ikke uttrykte S100A9. Våre resultater er enig med tidligere studier som viser høy ekspresjon av S100A9 i infiltrerende immunceller i ulike krefttyper, inkludert tykktarmskreft [21] og bukspyttkjertelkreft [29]. Alle forfattere lese og godkjent den endelige manuskriptet.
 Naturlig kur mot forstoppelse:avføringsmykner matvarer som får deg til å bæsj
Forstoppelse er et veldig vanlig problem. Heldigvis kan det også enkelt løses ved å tilpasse kostholdet ditt. I dag spiser ikke folk nok fiber, som i utgangspunktet er grovfôr for tarmen din og mat
Naturlig kur mot forstoppelse:avføringsmykner matvarer som får deg til å bæsj
Forstoppelse er et veldig vanlig problem. Heldigvis kan det også enkelt løses ved å tilpasse kostholdet ditt. I dag spiser ikke folk nok fiber, som i utgangspunktet er grovfôr for tarmen din og mat
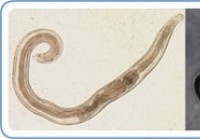 Pinworm Test
Hva er en pinworm-infeksjon? Bilde av pin-orm- og pinworm-egg (forstørret). Kilde:CDC.gov Pinworminfeksjon er forårsaket av helminth (Enterobius vermicularis ), en liten, hvit parasittisk orm. Nåleo
Pinworm Test
Hva er en pinworm-infeksjon? Bilde av pin-orm- og pinworm-egg (forstørret). Kilde:CDC.gov Pinworminfeksjon er forårsaket av helminth (Enterobius vermicularis ), en liten, hvit parasittisk orm. Nåleo
 Forholdet mellom aldring, tarmen din og allergier
Vi hører mye om barn som har matallergi, men visste du at det er mulig å utvikle matallergi når som helst i livet? Selv om det ikke er klart hvorfor, kan noen voksne utvikle en allergi mot mat som de
Forholdet mellom aldring, tarmen din og allergier
Vi hører mye om barn som har matallergi, men visste du at det er mulig å utvikle matallergi når som helst i livet? Selv om det ikke er klart hvorfor, kan noen voksne utvikle en allergi mot mat som de