Um novo artigo no jornal Vida apresenta uma revisão inicial dos fatores virais envolvidos no início e efeito da apoptose nas células infectadas.
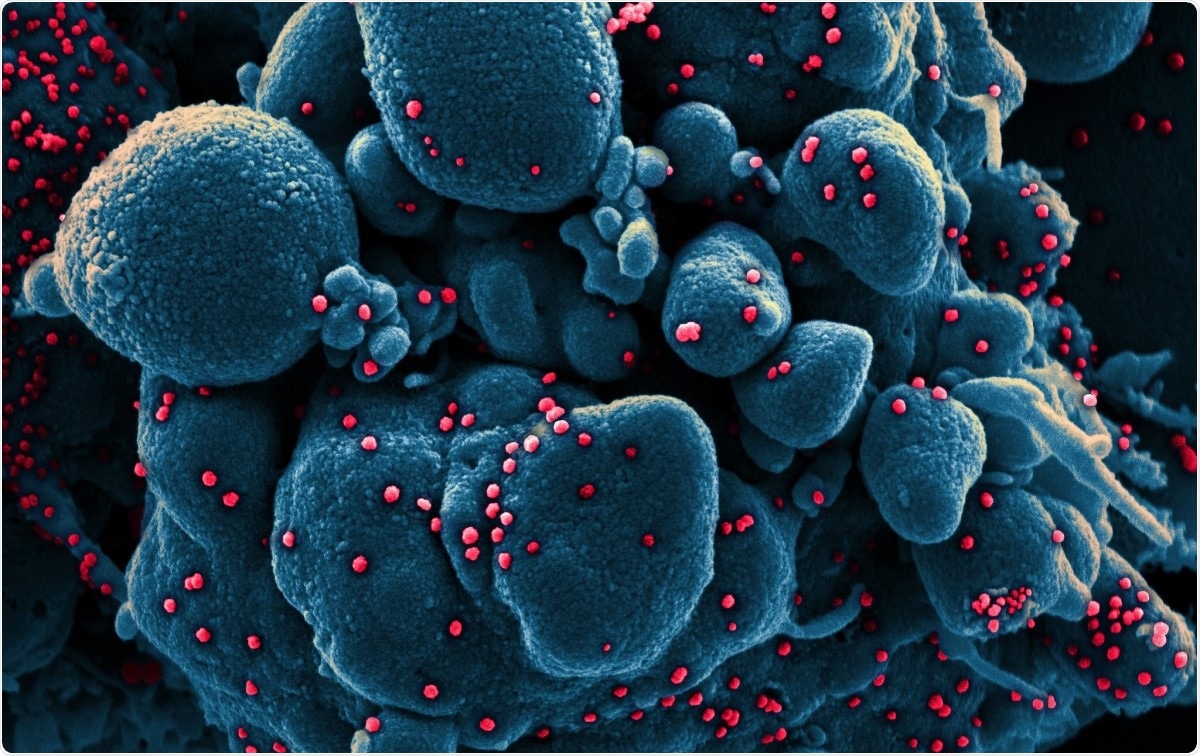 Micrografia eletrônica de varredura colorida de uma célula apoptótica (azul) infectada com partículas de vírus SARS-COV-2 (vermelho), isolado de uma amostra de paciente. Imagem capturada no NIAID Integrated Research Facility (IRF) em Fort Detrick, Maryland. Crédito da imagem:NIAID / Flickr
Micrografia eletrônica de varredura colorida de uma célula apoptótica (azul) infectada com partículas de vírus SARS-COV-2 (vermelho), isolado de uma amostra de paciente. Imagem capturada no NIAID Integrated Research Facility (IRF) em Fort Detrick, Maryland. Crédito da imagem:NIAID / Flickr Os coronavírus estão entre os maiores vírus de ácido ribonucleico (RNA) identificados até agora. Seu genoma tem cerca de 30 kb de comprimento, com quatro proteínas estruturais, e várias proteínas não estruturais e acessórias. Eles são classificados em alfa, beta, coronavírus gama e delta.
Vários coronavírus animais e humanos foram isolados até agora e causam principalmente infecções respiratórias ou gastrointestinais. Como outros vírus, eles sequestram a maquinaria da célula hospedeira em todos os estágios de sua replicação. Isso envolve a modificação da expressão de vários genes do hospedeiro, incluindo aqueles que codificam as defesas do hospedeiro para facilitar a replicação viral.
Recentemente, estudos demonstraram que no início da infecção, os coronavírus alteram o metabolismo celular e aumentam a taxa de morte celular. Isso ocorre antes que a imunidade adaptativa seja acionada, e isso poderia indicar seu papel na infecção viral produtiva.
Dois dos processos mais importantes envolvidos nesta modulação são a apoptose e a modificação do ciclo celular. A apoptose é desencadeada por uma série de vias de sinalização. A apoptose pode reduzir a propagação viral, mas o efeito oposto também pode ocorrer - a liberação de partículas virais infecciosas recém-produzidas durante a infecção lítica.
As vias celulares que ativam a apoptose podem ser desencadeadas diretamente pela própria infecção viral ou indiretamente por meio de outras cascatas de sinalização. Este último é desencadeado pela presença do vírus e recruta células do sistema imunológico para o local da infecção. O evento final é a apoptose, causando danos significativos aos tecidos na infecção lítica.
Os componentes virais dentro da célula são chamados de padrões moleculares associados a patógenos (PAMPs) e são reconhecidos por receptores de reconhecimento de padrões (PRRs). Estes respondem ativando citocinas e outras moléculas de sinalização que aumentam a expressão do gene do interferon.
Outro mecanismo de defesa envolve o reconhecimento do ácido nucleico viral por proteínas do hospedeiro que se associam, como os PRRs, com proteínas adaptadoras para ativar dois fatores-chave de transcrição, nomeadamente, Fator regulatório 3 do NFĸB e IFN (IRF3). Estes são translocados para o núcleo e aumentam a expressão dos interferons tipo I (IFNs).
Estes se ligam ao receptor IFN-α / β (IFNAR), por sua vez, desencadear um sistema de sinais envolvendo a Janus quinase / transdutores de sinal e ativadores da via de transcrição (JAK / STAT). O resultado é a regulação positiva de vários genes estimulados por IFN (ISGs).
Esses genes inativam o processo envolvido na síntese de proteínas celulares e, portanto, induzem a morte celular. Outro ISG que participa desse processo de encerramento da tradução é a combinação de 2 ′, 5′-oligoadenilato sintetase (OAS) e RNase L.
A apoptose é regulada por várias proteínas pró e anti-apoptóticas na célula hospedeira. Uma dessas famílias de proteínas é a família Bcl-2 (linfoma de células B-2), incluindo fatores que causam poração da membrana mitocondrial e eventual ativação de enzimas caspases, iniciar apoptose. Outros protegem contra a apoptose.
Outra família são as proteínas quinases ativadas por mitogênio (MAPKs), que incluem quinase 1/2 regulada extracelular (ERK1 / 2), ERK5, p38, e c-Jun N-terminal quinases (JNK). O primeiro é regulado positivamente por fatores de crescimento e mitógenos, os dois últimos por estresse celular. A via JNK pode levar à ativação de genes pró-apoptóticos ou pode interagir com genes Bcl-2 para fazer isso, ou pode ativar outros fatores de transcrição como 53 e p73.
Duas vias de apoptose foram identificadas, o extrínseco e o intrínseco. O primeiro é mediado pela ativação de ligantes de morte (FasL, TNF) em sua interação com seus respectivos receptores de morte (DRs). A caspase-8 é o principal indutor de apoptose em coronavírus animais que agem via DRs. Esta enzima, quando ativado, cliva o lance, uma proteína Bcl2, levando à liberação de citocromo c mitocondrial. Este último é a chave para a formação do apoptossomo com a clivagem e ativação da caspase 9.
A via intrínseca é baseada na permeabilização das membranas externas mitocondriais e é observada principalmente com coronavírus animais. As proteínas Bcl2 como Bax e Bak favorecem a apoptose e são necessárias para desencadear esse processo por meio da via intrínseca ou mediada por mitocôndria, junto com caspase-9.
Muitos coronavírus animais causam ativação de vias extrínsecas e intrínsecas, mostrando a intrincada rede de vias de sinalização envolvidas na apoptose.
Os genomas virais frequentemente codificam genes que são homólogos às proteínas antiapoptóticas do hospedeiro. Isso lhes permite atrasar a apoptose nos estágios iniciais da infecção e, assim, gerar uma produção adequada de novos vírions. Outras proteínas virais podem impedir a transcrição de alguns genes apoptóticos ou causar a modificação de seus produtos proteicos, para suprimir sua atividade.
A indução de apoptose por proteínas virais pode envolver a terminação da tradução dependente de cap em células hospedeiras, induzindo apoptose, como visto com o poliovírus. No caso do vírus da hepatite C, a proteína NS3 viral interage com a caspase-8, para desencadear a morte celular.
A revisão atual está focada na identificação de mecanismos pró-apoptóticos desencadeados por coronavírus animais. Por exemplo, o vírus da diarréia epidêmica suína (PEDV) desencadeia mudanças na expressão de 14 genes envolvidos na apoptose independente de caspase para promover sua replicação, bem como produzir os traços característicos da doença.
Outra maneira pela qual a apoptose está envolvida na replicação viral é pela ativação da caspase, que é necessária para a clivagem da proteína do nucleocapsídeo (N) viral durante este processo. É o caso do vírus da gastroenterite transmissível (TGEV), que ativa a família MAPK, bem como apoptose induzida por FasL e mitocôndria. Este processo também inclui a regulação negativa de microRNAs do hospedeiro que suprimem a via apoptótica mitocondrial.
Betacoronavírus, como o vírus da hepatite murina (MHV), induz apoptose. Este vírus mostra apoptose induzida pela proteína do envelope (E), novamente por meio da ativação da caspase. Nesse caso, a apoptose parece ser protetora contra a produção de vírions.
Com o vírus da encefalomielite hemaglutinante suína (PHEV), a morte celular é mediada por DRs e as vias mediadas pela mitocôndria, envolvendo caspase-8 e caspase-9, como iniciadores, e caspase-3, como um efetor da apoptose.
De forma similar, os coronavírus gama e delta mostram indução complexa de vias de sinalização celular na célula hospedeira, levando à modulação da apoptose. Assim, muitas proteínas virais modulam as vias da célula hospedeira para promover a replicação viral e as características da doença.
O fato de a apoptose ocorrer após a infecção de múltiplos hospedeiros por uma variedade de coronavírus leva à conclusão de que é uma característica comum da infecção por coronavírus humanos e animais e visa favorecer a propagação.
Com o coronavírus da síndrome respiratória aguda grave anterior (SARS-CoV), a proteína 7a forma um complexo com a proteína Bcl-XL ou outros fatores pró-sobrevivência, inativando-os e, assim, permitindo que a apoptose prossiga por meio da ativação da caspase-3. A protease semelhante a 3CL (3CLpro) também ativa a caspase-3 e a caspase-9 para induzir a apoptose em cultura de células.
Ambos os vírus SARS-CoV e SARS-CoV-2 em circulação possuem a proteína ORF3a que desencadeia a morte celular por meio da ativação da caspase na via extrínseca através dos DRs.
Um papel semelhante ainda não foi demonstrado para proteínas virais em infecções por coronavírus animais. Contudo, com PEDV, a subunidade S1 da proteína spike, e a proteína não estrutural 1 (NSP1), tem sido sugerido como o iniciador e o efetor da morte celular, respectivamente, com base em experiências recentes.
Mais estudos podem ajudar a entender como essas vias operam em outros coronavírus. O estado atual de conhecimento pode indicar a utilidade de direcionar esta via para o gerenciamento de infecções por coronavírus.
 Tudo o que você precisa saber sobre SIBO (supercrescimento bacteriano do intestino delgado)
Tudo o que você precisa saber sobre SIBO (supercrescimento bacteriano do intestino delgado)
 A moda sem glúten é perigosa?
A moda sem glúten é perigosa?
 Quanta lactose posso tolerar?
Quanta lactose posso tolerar?
 É hora de incluir microrganismos vivos e seguros como componentes de uma dieta equilibrada?
É hora de incluir microrganismos vivos e seguros como componentes de uma dieta equilibrada?
 O bug de norovírus de navio de cruzeiro pode se espalhar por via aérea, segundo estudo
O bug de norovírus de navio de cruzeiro pode se espalhar por via aérea, segundo estudo
 O panorama geral:como ter um plano pode transformar seu caminho de cura
O panorama geral:como ter um plano pode transformar seu caminho de cura
 A mentira sem glúten:por que a maioria dos celíacos está morrendo lentamente
A medicina convencional geralmente funciona assim… Eu tenho um problema, o médico descobre qual é o problema e me dá uma receita convencional geralmente apoiada por médicos, pesquisadores e FDA. E
A mentira sem glúten:por que a maioria dos celíacos está morrendo lentamente
A medicina convencional geralmente funciona assim… Eu tenho um problema, o médico descobre qual é o problema e me dá uma receita convencional geralmente apoiada por médicos, pesquisadores e FDA. E
 Fungo comum encontrado na pele pode causar doença inflamatória intestinal
As terapias que visam certos fungos comensais podem fornecer uma nova maneira de tratar a doença inflamatória intestinal (DII), de acordo com pesquisadores da LA. Backgroundy | Shutterstock
Fungo comum encontrado na pele pode causar doença inflamatória intestinal
As terapias que visam certos fungos comensais podem fornecer uma nova maneira de tratar a doença inflamatória intestinal (DII), de acordo com pesquisadores da LA. Backgroundy | Shutterstock
 Como evitar comprar azeite falso e rançoso
Recentemente, falamos sobre a importância dos polifenóis para a saúde. Esquecemos de falar sobre uma das maiores fontes que quase todo mundo com problemas intestinais pode comer e deve comer – o aze
Como evitar comprar azeite falso e rançoso
Recentemente, falamos sobre a importância dos polifenóis para a saúde. Esquecemos de falar sobre uma das maiores fontes que quase todo mundo com problemas intestinais pode comer e deve comer – o aze