gástricas em cancro gástrico
Resumo
fundo
sobre-expressão de EGFR tem sido descrito em muitos tumores humanos, incluindo o cancro gástrico. Em doentes com NSCLC mutações somáticas de EGFR, dentro do domínio da quinase da proteína, bem como a amplificação do gene foram associados com uma boa resposta clínica aos inibidores de EGFR. Em tumores gástricos dados relativos alterações estruturais do EGFR permanece controverso. Dada a sua possível relevância terapêutica, que teve como objetivo determinar a freqüência eo tipo de alterações estruturais do gene EGFR
em uma série de carcinomas gástricos primários.
Métodos
sequenciação directa do domínio de cinase do EGFR
gene foi realizado numa série de 77 carcinomas gástricos primários. análise de FISH foi realizada em 30 casos. Foram realizados estudos de associação entre EGFR
alterações e as características patológicas clínicas dos tumores.
Resultados
Dentro dos 77 carcinomas gástricos primários encontramos duas EGFR
mutações somáticas e vários EGFR
polimorfismos no exon 20. Seis sequência intrônica diferentes variantes de EGFR
também foram encontrados. Quatro carcinomas gástricos mostrou polissomia equilibrada ou EGFR
amplificação do gene. Verificamos que carcinoma gástrico com alterações de EGFR
(mutações somáticas ou cópia número variação) mostraram um aumento significativo do tamanho do tumor (p = 0,0094
) em comparação com o tipo selvagem EGFR
carcinomas.
conclusão
Nós demonstramos que as alterações estruturais do EGFR Quais são raros em carcinoma gástrico, mas sempre presente, ele leva ao crescimento do tumor. Consideramos que a procura de EGFR
alterações no câncer gástrico é provável que seja clinicamente importante, a fim de identificar pacientes suscetíveis a responder a tirosina quinase.
Fundo
O câncer gástrico continua a ser a segunda principal causa de morte por câncer em todo o mundo [1] um cenário que destaca a necessidade de terapias mais específicas e eficientes. Os mecanismos exatos subjacentes à carcinogênese gástrica ainda não são totalmente compreendidos, mas as evidências apontam para uma associação com vias envolvidas nos processos de desenvolvimento [2]. moléculas-chave destas vias são as tirosina-quinases receptoras (RTKs), que se encontram a ser aberrantemente activadas ou sobre-expresso numa variedade de tumores e, portanto, representam alvos promissores para intervenção terapêutica.
Os membros da superfamília de receptores RTK ErbB são glicoproteínas que consistem num domínio extracelular, onde a ligação de ligandos tem lugar, um domínio transmembranar lipofílico curta, e um domínio intracelular levando a actividade de tirosina-quinase [3, 4]. Eles são expressos em vários tecidos epitelial, mesenquimal e origem neuronal, em que desempenham um papel central no desenvolvimento, diferenciação e proliferação. expressão desregulada de moléculas de erbB, a saber, ERBB2, tem sido implicada no desenvolvimento de numerosos tipos de tumores, incluindo tumores gástricos. No carcinoma gástrico tem sido mostrado que a sobre-expressão ERBB2 é accionado por amplificação de genes e está associada a carcinomas com elevado potencial invasivo [5]. ErbB1, melhor conhecido como receptor do factor de crescimento epidérmico (EGFR), sobre-expressão tem sido descrito em muitos tumores humanos, incluindo os de pulmão, cólon, mama, próstata, cérebro, cabeça e pescoço, da tiróide, do ovário, bexiga, rim e também do cancro de estômago [6 -11], e tem sido correlacionada com o estágio do tumor avançado e prognóstico clínico. Muito recentemente, foi demonstrado que a activação do EGFR está associado à perda da função de E-caderina, in vitro
[12].
Os mecanismos para a conversão oncogénica de EGFR em cancro incluem amplificado número de cópias, os rearranjos estruturais do receptor e mutações de activação [13]. mutações de EGFR aglomerar no domínio de cinase de EGFR (exões 18-21), e provocar a activação independente do ligando do receptor, representando possíveis alvos para intervenção terapêutica. A este respeito, as mutações somáticas de EGFR, bem como a amplificação do gene em pacientes com cancro do pulmão de células não pequenas (NSCLC) altamente correlacionados com a resposta clínica a tirosina quinase [14, 15]. Online em tumores gástricos, os dados relativos estrutural alterações de EGFR permanece controverso. Dada a sua possível relevância terapêutica, no presente estudo que teve como objetivo esclarecer a relevância das alterações estruturais do EGFR na carcinogênese gástrica através da análise de uma série de carcinomas primários gástricos para número de cópias e mutações no domínio de tirosina quinase (exons 18-21) do EGFR
gene.
Métodos
a seleção dos casos e classificação histopatológica dos tumores
blocos representativos de 77, tumores humanos embebidos em parafina fixadas em formalina gástricos primários foram obtidos a partir do Departamento de Patologia do Hospital S. João , após consentimento informado dos pacientes. Os pacientes foram informados de que o material tumor seria usado apenas para fins de investigação. Nenhum dos pacientes incluídos na presente série tinha um histórico familiar de câncer gástrico. H & E- secções coradas foram usadas para categorizar os tumores de acordo com as classificações de Lauren e Ming. Penetração da parede gástrica ea presença e localização de metástases linfáticas foram registrados para todos os pacientes em uso de critérios padrão para o estadiamento patológico. Orceína secções coradas foram usadas para a detecção de invasão vascular.
EGFR Mutação Triagem
O ADN genómico foi extraído de 10 um após secção microdissecação das áreas tumorais para assegurar um grau de pureza de pelo menos 70% de células neoplásicas. extracção de ADN foi realizada utilizando o Kit de Purificação de DNA genómico (Gentra System) de acordo com o protocolo do fabricante. Exão iniciadores específicos foram concebidos e-ADN foi sujeito a amplificação por PCR dos exões 18, 19, 20 e 21. As quatro EGFR código
exões para o domínio da tirosina-cinase de EGFR. As sequências dos iniciadores são apresentados na Tabela 1 1.Table iniciadores utilizados para amplificação por PCR do domínio de cinase de EGFR
Exon
Primer Sequence
PCR tamanho do produto (pb)
Exon 18
Atacante
TGGGCCATGTCTGGCACTGC
283
reversa
ACAGCTTGCAAGGACTCTGG
Exon 19
Atacante
TCACTGGGCAGCATGTGGCA
241
reversa
CAGCTGCCAGACATGAGAAA
Exon 20
Atacante
CCTTCTGGCCACCATGCGAA
295
reversa
CGCATGTGAGGATCCTGGCT
Exon 21
Atacante
ATTCGGATGCAGAGCTTCTT
265
reverso
CCTGGTGTCAGGAAAATGCT
produtos de PCR foram corridos num gel de agarose a 2% e as bandas amplificadas por PCR foram extraídos do gel com o kit de purificação em gel de banda (GE Healthcare). As amostras foram, em seguida, purificado e sequenciado utilizando o kit de ABI Prism BigDye Terminator dGTP Pronto Reacção (Perkin Elmer, Foster City, CA) seguindo as instruções do fabricante e um ABI Prism 3100 Genetic Analyser (Perkin Elmer, Foster City, CA). Os resultados foram analisados usando 3100 software de coleta de dados. A sequenciação foi realizada em ambas as cadeias. Em casos com suspeita de mutações amplificação por PCR foi repetido e a amostra foi re-sequenciados para excluir artefactos de PCR.
Número EGFR Copiar Variação Triagem
Os blocos de parafina foram seccionados a 5 ^ m e secções de tecido foram secas a 60 ° C durante 30 minutos. As lâminas foram deparaffinised e lavou-se seguido por um pré-tratamento e um passo de digestão com pepsina e finalmente desidratadas. O LSI EGFR Dual Color Probe-Hib Set (Vysis ®), otimizado para detectar a região de banda 7p12 em laranja do espectro e do centrómero do cromossoma 7 (7p11.1-Q11.1, D7Z1 lócus) no espectro de verde, ambos em núcleos em interfase e nos cromossomas em metafase, foi usado. Cinco ul da sonda foram aplicados a cada deslizamento. A desnaturação foi efectuada a 80 ° C durante 8 minutos seguido de hibridação numa câmara húmida a 37 ° C durante 16 horas. Após a hibridação, as lâminas foram lavadas e incubadas com 4'-6-diamidino-2-fenilindole (DAPI) para coloração nuclear. Para a avaliação, sessenta a 100 núcleos interfásicos intactas foram analisados por dois observadores independentes, a fim de marcar os sinais para o cromossoma 7 centrômero e do gene EGFR. linfócitos circundantes e mucosa normal foram usados como controle de qualidade interno para os ensaios. Pelo menos foram seleccionados dois ou três áreas representativas das células neoplásicas, ao abrigo de um campo de amplificação de 100 × /200 ×, para contar os sinais de núcleos. Após uma visão geral sob uma amplificação de 400 ×, os sinais foram contadas usando óleo de imersão (1000 ×).
Análise estatística
estudos de associação entre alterações EGFR e as características clinicopatológicas dos casos foram realizados apenas em 30 casos (tumores analisados para mutações EGFR e cópia do EGFR variação do número). As análises estatísticas foram avaliadas pelo teste de x2 ou o teste t de Student
. Um valor p
de <. 0,05 foi considerado estatisticamente significativo
Resultados
EGFR mutação Screening
A partir dos 77 carcinomas gástricos analisados, EGFR
mutações nos exons 18-21 foram detectados em 2,6% (2/77) dos casos (Fig. 1A). Uma mutação pertencia ao exão 20 e foi uma mutação sem sentido (2300 C > T), que conduz à substituição da alanina 767 para uma valina. A segunda mutação afectada exão 21 e foi uma mutação sem sentido (2524 A > G), que conduz à substituição ao asparagina 842 para um ácido aspártico. Nenhuma das mutações foram anteriormente descritos. Não há alterações de sequências foram encontradas em exons 18 e 19. A Figura 1 alterações estruturais no EGFR. (A) A sequenciação directa mostrando uma das mutações encontradas no domínio de cinase de EGFR - mutação sem sentido (2300 C > T) no exão 20, que conduz à substituição da alanina 767 para uma valina. (B) carcinoma gástrico difuso com EGFR aumento do número de cópia causada pelo cromossoma 7 polissomia. (C) As células neoplásicas que exibem amplificação do gene com a formação de aglomerados com numerosos sinais de EGFR.
Vários polimorfismos EGFR foram encontrados no exão 20 (Tabela 2). O polimorfismo 2361G > A Gln787Gln, previamente descrito por Mu et al
[16], estava presente em 55,8% (43/77) dos casos, e em nove dos 43 casos em um estado homozigoto. Nós selecionados 50 controles normais eo 2361G > A Gln787Gln estava presente em 82% dos controles (41/50). Duas outras mutações silenciosas (EGFR a 2301 C > T e Ala767Ala a 2415 C > T His805His) foram encontrados no exão 20, nenhum deles descrito anteriormente. Ambas as alterações foram encontradas em um único caso e estavam ausentes em alterações sequência normal controls.Table 2 encontrados por sequenciação directa
Alteração
tipo
Frequência
Referências
Exon 18
2184 + 19 G > A variante Intronic
2/77
Ensembl
SNP rs17337107 (dbSNP126) [17]
Exon 19
2185-9 C > G
variante Intronic
1/77 Ainda não
descrito
2283 + 11 G > Uma variante Intronic
1/77 Ainda não
descrito
2283 + 47 G > A variante Intronic
1/77
Ainda não descrito
2283+ 49 C > T
variante Intronic
1/77 Ainda não
descrito
Exon 20
2284-60 C > T
Intronic variante
2/77
Ensembl
SNP rs10241451 (dbSNP126) [17]
2300 C > T
missense Ala 767 Val
1/77 Ainda não
descrito
2301 C > T
silenciosa Ala 767 Ala
1/77 Ainda não
descrito
2361G > A
silenciosa Gln 787 Gln
43/77
[16]
2415 C > T
silenciosa Sua 805 Sua
1/77
Ainda não descrito
Exon 21
2524 A > G
missense Asn 842 Asp
1/77 Ainda não
descrito
Encontramos seis diferentes variantes de sequência localizada em regiões intrónicas de EGFR, dois deles descrito anteriormente em Ensembl [17].
Triagem número EGFR Copiar Variação
A análise de EGFR
número de cópias, tal como determinado por fluorescência de hibridação in situ (FISH), só foi possível em 30 dos 77 casos analisados para mutações EGFR. Todos os sinais de EGFR
foram comparados com os sinais de sonda centromérica para o cromossoma 7. Mais do que 2,0 EGFR
cópias por célula (polissomia equilibrada ou amplificação de genes) foram detectados em 13,3% (4/30) dos casos. Dos quatro casos que apresentam mais de 2 cópias do EGFR
por cromossoma 7, três tinham aumento do número de cópia devido à polissomia e um tinha a amplificação do gene, um carcinoma gástrico difuso, exibindo a formação de clusters com numerosos sinais de EGFR
(Fig. 1B, C).
EGFR alterações estruturais e parâmetros clínico-patológicas dos pacientes e tumores
Tabela 3 mostra as associações estatísticas entre as alterações de EGFR e as características clinicopatológicas dos pacientes e tumores. Ao comparar carcinoma gástrico abrigar alterações EGFR com carcinomas com status de EGFR normal ou número de cópias, observamos uma associação significativa entre alterações estruturais do EGFR e aumento do tamanho do tumor. (P = 0,0094
). Não foram encontradas associações significativas entre as alterações de EGFR e outros parâmetros clínico-patológicas dos pacientes e tumores, ou seja, sexo e idade dos pacientes, localização do tumor, tipo histológico, a penetração da parede, a presença de metástases linfonodais, invasão vascular e estadiamento do tumor do tumor .table 3 Associação de EGFR alterações genéticas com os parâmetros clínico
parâmetros clínico
EGFR estatuto
|
Amplification /mutação (n = 6)
normal (n = 24)
total (n = 30)
p
valor
sexo (F /M)
1/5
10/14
11/19
0,2557
Idade (SD)
62,3 ± 14,1
56,3 ± 16,8
57,5 ± 16,2
0,4271
tumor localização
0,8548
proximal
3
11
14
distal Sims 3
13
16
Tamanho (SD)
11,6 ± 9,8
5,8 ± 2,0
6,9 ± 5,0
* 0,0094
classificação de Lauren
0,1261
intestinal
1 | 12
13
difusa
5
9
14
atípica
0 Sims 3 Sims 3
parede penetração
0,4642
precoce (T1)
0 Página 2 Página 2
avançada (T2-T4)
6
22
28
Vascular Invasion
0.7125
Ausente ( N0)
3
14
17
Presente (N = 1) Sims 3
10
13
metástases linfonodais
0,1921
Ausente
1 | 11
12
Presente
5
13
18
Staging
0,3845
I
1 | 7
8
II
0
5
5
III
5
11
16
IV
0
1 | 1
Discussão
gene de EGFR é localizado no cromossoma 7p12 e codifica para um receptor de 170 kDa, presente na membrana das células como uma monómeros inactivos. Após a ligação do ligando ao domínio extracelular, o receptor sofre alterações conformacionais, e torna-se dimerises autofosforilada em resíduos de tirosina chave no domínio intracelular de tirosina quinase (TK). Isto conduz à activação de vias de jusante que controlam a sobrevivência da célula, inibição da apoptose e a proliferação [18].
Muita atenção tem sido atraída para o efeito oncogénico de EGFR e acima de tudo para o sucesso de terapias alvo EGFR, que são bem estabelecido para os carcinomas do pulmão de células não pequenas. O papel do EGFR no cancro gástrico é muito controversa. Alguns autores relataram que o EGFR é altamente expresso em cancro gástrico, o que sugere a sua adequação como alvo para inibidores da tirosina cinase do receptor [19, 20]. Por outro lado, Takehana e colegas relataram que a sobre-expressão do receptor do factor de crescimento epidérmico é um evento raro em carcinoma gástrico [21] e ocorre predominantemente devido à amplificação do gene de EGFR, confirmando os resultados de estudos anteriores [22-24]. mutações EGFR em carcinoma gástrico primários ou linhas celulares de cancro gástrico não foram relatados [25-27]; no entanto, recentemente, mostrou que difuso hereditário mutações câncer gástrico E-caderina associado da linha germinativa missense levar a um aumento da actividade EGFR.
Nesta base, considerou-se que a procura de alterações EGFR em câncer gástrico pode ter sido importante para identificar terapia casos susceptíveis.
Aqui nós relatamos a presença de EGFR
aumento do número de cópia em 13,3% dos 30 casos em que a análise peixe foi possível. Dos quatro casos com aumento do número de cópia, apenas uma amplificação do gene apresentado, ao passo que os restantes 3 casos mostraram polissomia do cromossomo 7. Estes resultados correspondem relatórios anteriores investigando o número de cópias do EGFR no cancro gástrico [22-24]. A análise mutacional do domínio de cinase de EGFR revelaram a presença de mutações em 2,6% dos 77 carcinomas gástricos. As mutações identificadas eram do tipo missense e estavam presentes em exons 20 e 21 do gene EGFR. Nenhuma das mutações identificadas tinha sido anteriormente descrita e o seu significado funcional ainda não foi avaliado. No entanto, devido à sua localização no domínio de cinase de EGFR, é tentador especular que possam afectar a actividade do receptor e, por conseguinte, os pacientes que albergam estas mutações de EGFR podem beneficiar de inibidores da tirosina cinase como abordagem terapêutica.
Além destas mutações encontradas , foram identificadas outras alterações de sequência, todos agrupamento no exão 20. A EGFR polimorfismo 2361 G > A (descrito anteriormente em Ensembl) ocorre numa elevada percentagem de casos e em controlos normais. Em contraste, os outros dois não ainda descrito variantes silenciosas no exão 20 (2301 C > T, 2415 C > T) estavam ausentes em controlos normais. Além destes sequência de EGFR variantes nas regiões de codificação, também identificaram variações na seqüência intrônica flanqueando exons 18, 19 e 20, mas o seu efeito funcional permanece obscuro.
A correlação dos parâmetros clínicos para os casos em que ambos mutação e análise de FISH foi possível, mostrou uma associação significativa entre alterações EGFR e tamanho do tumor. Curiosamente, todos os casos com alterações em EGFR (amplificação /mutação) eram carcinomas já invadindo a membrana basal e propagada na parede gástrica (T2-T4), sugerindo que as alterações deste gene pode conferir um comportamento invasivo de células neoplásicas.
no entanto, essa hipótese precisa ser esclarecida por estudos posteriores, uma vez que não verificar uma correlação estatisticamente significativa entre alterações EGFR e invasão na parede gástrica (p = 0,4642), como acabamos de analisado um número muito baixo de carcinomas gástricos precoces ( n = 2) em nossa série. Ambos os resultados estão de acordo com os relatórios de Hirono
et ai., 1995 [23] e Tsugawa
et ai., 1998 [24], o que sugere que o EGFR está envolvido no crescimento do tumor e de activação alterações podem ser um tarde evento envolveu na progressão tumoral.
Embora nenhuma outra associação estatisticamente significativa foi encontrada, é interessante notar que alterações EGFR ocorrem principalmente em carcinomas do tipo difuso. A presença de alterações de EGFR em carcinomas difusos é em contraste com o anteriormente observado para outros membros da família de receptores ErbB no cancro gástrico. Na amplificação carcinoma gástrico ERBB2 foi detectado preferencialmente em carcinomas intestinais do estômago [5].
Conclusão
Em conclusão, neste estudo demonstramos que as alterações de activação de EGFR não são um evento frequente na carcinogênese gástrica. Alterações preferencialmente aparecem nos carcinomas gástricos do subtipo difusa e estão associados com o tamanho do tumor. Apesar da baixa frequência de alterações de EGFR, nossos resultados também indicam que há um grupo restrito de pacientes gástricas selecionados que podem se beneficiar de terapias não convencionais, incluindo inibidores farmacológicos do receptor EGFR.
Notas
Cátia Moutinho, Ana R Mateus contribuíram igualmente para este trabalho
Declarações
Agradecimentos
este estudo foi financiado por doações da Fundação para a Ciência e Tecnologia, Portugal (SFRH /BD /16747/2004, POCI /SAU -. OBS /57670 /2004 e PTDC /SAU -. OBD /64319/2006)
Autores 'arquivos enviados originais para imagens
Abaixo estão os links para os autores' arquivos enviados originais de imagens. arquivo original 12885_2007_948_MOESM1_ESM.pdf Autores 'para a figura 1 Conflito de interesses
O autor (s) declaram que não têm interesses conflitantes.
Pesquisas sobre o Estômago
Pesquisas sobre o Estômago
| |  O poder de cura da natureza
O poder de cura da natureza
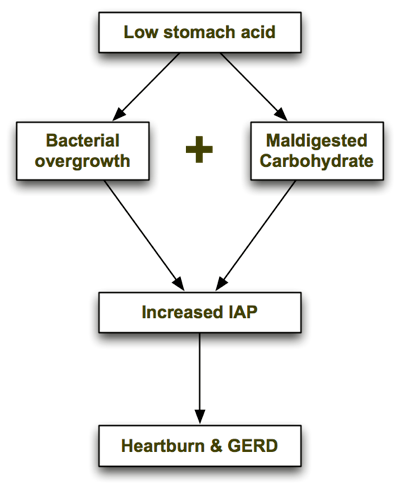 A dieta específica de carboidratos cura a DRGE?
A dieta específica de carboidratos cura a DRGE?
 Nova idade de início da triagem de câncer de cólon
Nova idade de início da triagem de câncer de cólon
 As restrições do COVID-19 levaram a uma queda de 86 por cento nas infecções por norovírus nos EUA,
As restrições do COVID-19 levaram a uma queda de 86 por cento nas infecções por norovírus nos EUA,
 A diferença entre uma colonoscopia e uma endoscopia
A diferença entre uma colonoscopia e uma endoscopia
 Desbloqueie o poder das ameixas secas!
Desbloqueie o poder das ameixas secas!
 Câncer do ducto biliar (colangiocarcinoma)
Fatos que você deve saber sobre o câncer do ducto biliar (colangiocarcinoma) Os cânceres de ducto biliar são mais comumente encontrados fora do fígado na área peri-hilar e menos comumente encontrad
Câncer do ducto biliar (colangiocarcinoma)
Fatos que você deve saber sobre o câncer do ducto biliar (colangiocarcinoma) Os cânceres de ducto biliar são mais comumente encontrados fora do fígado na área peri-hilar e menos comumente encontrad
 Receita de parfait de maracujá
Uma receita de Parfait de Maracujá super rápida e amigável para SIBO , isso é ótimo para aqueles momentos em que você quer fazer uma sobremesa, mas está com pouco tempo. Como muitos de nós, Rebecca
Receita de parfait de maracujá
Uma receita de Parfait de Maracujá super rápida e amigável para SIBO , isso é ótimo para aqueles momentos em que você quer fazer uma sobremesa, mas está com pouco tempo. Como muitos de nós, Rebecca
 9 benefícios de saúde do butirato para seu corpo e intestino
Seu intestino precisa de butirato para a saúde, e é feito pelo microbioma intestinal. Veja o que você precisa saber sobre isso. As bactérias intestinais produzem butirato, um importante ácido graxo d
9 benefícios de saúde do butirato para seu corpo e intestino
Seu intestino precisa de butirato para a saúde, e é feito pelo microbioma intestinal. Veja o que você precisa saber sobre isso. As bactérias intestinais produzem butirato, um importante ácido graxo d