Abstract
A depleção de células intersticiais de Cajal (ICC) é certificada no estômago de pacientes diabéticos . Embora electroacupuncture (EA) em ST36 é uma terapia eficaz para regular a motilidade gástrica, os mecanismos de EA em ST36 e no esvaziamento gástrico redes de ICC permanecem por ser elucidados. Os objetivos deste estudo foram investigar os efeitos da EA sobre o esvaziamento gástrico e sobre as alterações das redes ICC. Os ratos foram randomizados para o controle, ratos diabéticos (DM), ratos diabéticos com EA simulada (DM + SEA), ratos diabéticos com baixo EA frequência (DM + LEA) e ratos diabéticos com grupos EA alta frequência (DM + HEA). A expressão de c-kit em cada camada da parede gástrica foi avaliada por Western blotting. A proliferação de TPI foi identificado por imunomarcação de c-kit e Ki67 como a apoptose de TPI foi examinado por coloração TUNEL. Os resultados foram como se segue: (1) O esvaziamento gástrico foi severamente retardada no grupo DM, mas acelerada no grupo LEA e HEA, especialmente no grupo LEA. (2) A expressão de c-kit em cada camada foi reduzida aparentemente no grupo DM, mas também sobre-regulada no grupo LEA e HEA. (3) Abundante proliferaram TPI (c-kit + /Ki67 +) formando redes espessas com c-kit + células foram observadas no grupo de LEA e HEA, enquanto que as células apoptóticas (c-kit + /TUNEL +) foram mal capturado no grupo LEA e HEA . Colectivamente, de baixa e alta frequência de EA em ST36 resgatar as redes danificadas do ICC por inibição da apoptose e aumentando a proliferação no estômago de ratos diabéticos, resultando numa melhoria do esvaziamento gástrico
citação:. Chen Y, Xu JJ , Liu S, Hou XH (2013) Electroacupuncture na ST36 melhora o esvaziamento gástrico e resgata redes de células intersticiais de Cajal no estômago de ratos diabéticos. PLoS ONE 8 (12): e83904. doi: 10.1371 /journal.pone.0083904
editor: Yvette Tache, University of California, Los Angeles, Estados Unidos da América
Recebido: 09 de agosto de 2013; Aceito: 08 de novembro de 2013; Publicação: 31 de dezembro de 2013
Direitos de autor: © 2013 Chen et al. Este é um artigo de acesso aberto distribuído sob os termos da Licença Creative Commons Attribution, que permite uso irrestrito, distribuição e reprodução em qualquer meio, desde que o autor original ea fonte sejam creditados
Financiamento:. O trabalho foi parcialmente financiado por doações do National Science Foundation Natural da China (No. 30.670.775, No. 81.270.458). Sem financiamento externo adicional recebida para este estudo. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito
CONFLITO DE INTERESSES:.. Os autores declararam que não existem interesses conflitantes
Introdução
tipos de distúrbios da motilidade gastrointestinal que variam de dispepsia funcional para gastroparesia afetar gravemente a qualidade de vida dos pacientes com décadas de diabetes mellitus [1]. Gastroparesia, caracterizada por atraso do esvaziamento gástrico, ocorre em até 30% dos indivíduos com diabetes tipo 1 [2]. Apesar de várias intervenções terapêuticas, incluindo o tratamento farmacêutico e alguns tratamentos não-droga foram tentadas, os efeitos curativos para gastroparesia continuam a ser insatisfatórios.
A acupuntura tem sido empiricamente usada para tratar distúrbios gastrointestinais em países orientais há milhares de anos. Electroacupuncture (EA), que é uma modificação de acupuntura tradicional, é mais apropriado para ambientes de pesquisa e clínicos básicos para a sua reprodutibilidade. Zusanli As células intersticiais de Cajal (ICC), bem estabelecidos, como pacemakers que geram e propagam ondas lentas, ganharam na regulação gastrointestinal motilidade longo de várias décadas [9]. Três subtipos de ICC incluindo ICC intramuscular (ICC-IM), ICC myenteric (ICC-MY) e ICC submucoso (ICC-SM) formam redes intactas na parede gástrica [10]. Redes de ICC não são estáticos, mesmo em condições fisiológicas; apoptose e transdiferenciação levar à perda ICC, enquanto ICC também pode ser restaurado pela proliferação, reposição de células-tronco e aumentando a sobrevida [11], [12]. Amplos estudos têm documentado que a perda e danos da ICC causada motilidade gastrointestinal desordenada em modelos animais e pacientes com diabetes [13] - [15]. Recentemente, outros estudos relataram que a EA facilitado o aumento do ICC do cólon em ratos e ratos lento trânsito constipação após enteroenterostomia [16], [17]. Nosso estudo recente demonstrou também que a EA na ST36 poderia restaurar ICC prejudicada no cólon de ratos diabéticos [18]. Enquanto isso, causa-se que AE promoveu a proliferação e inibiu a apoptose de células cerebrais no hipocampo [19], [20]. No entanto, há um vazio sobre os efeitos da EA em ST36 no ICC em gastroparesia diabética e o mecanismo se a proliferação e apoptose da ICC estão envolvidos Portanto, os objetivos deste estudo foram:. 1) avaliar os efeitos de diferentes EA frequência no esvaziamento gástrico; 2) investigar os efeitos da EA em ST36 em redes ICC em ratos diabéticos; 3) Certificar se a apoptose e proliferação de ICC estavam envolvidos. Ética declaração Os ratos receberam cuidados humanos e este estudo foi realizado em estrita conformidade com as recomendações do Guia para o Cuidado e Uso de Animais de laboratório do National Institutes of Health, com todas as operações aprovadas pelas diretrizes éticas do Comité do animal Cuidado e Uso de Tongji Medical college, Huazhong Universidade de Ciência e Tecnologia. Animais ratos Sprague-Dawley pesava 250-300 g foram selecionados no presente estudo. Os ratos foram obtidos a partir da Experiência Centro animal de Tongji Medical College (Universidade Huazhong da Ciência e Tecnologia, Wuhan, China) e mantido sob condições de laboratório normais (22 ° C, 12/12 h claro-escuro ciclo), com livre acesso a comida e água estéril. Após uma semana de alimentação adaptativa, os animais foram oficialmente adotado em nossas experiências. Depois de um jejum, mas livre acesso à água, os modelos foram criados com uma única injeção intraperitoneal de estreptozotocina em ratos (STZ, 60 mg /kg, ou seja, de 1 ml /100 g de massa corporal; Alexis Biochemicals, San Diego, CA, USA), recém-dissolvido em 20 mM de solução tampão de citrato (pH 4,5; Sigma, St Louis, MO, EUA) . O grupo de controlo foi injectado com um volume igual de tampão de citrato. Todos os ratos foram alojados na mesma condição, com privação de água durante 4 h, mas ad libitum Os ratos foram divididos aleatoriamente em cinco grupos (10 ratos cada grupo), incluindo o controle , grupo de diabéticos (DM), ratos diabéticos com sham grupo EA (mar, apenas a acupuntura, sem corrente elétrica, 30 min /d), ratos diabéticos com grupo de baixa frequência EA (LEA, 10 Hz, 1-3 mA, 30 min /d ) e ratos diabéticos com grupo de alta frequência eA (HEA, 100 Hz, 1-3 mA, 30 min /d). EA foi implementada a ST36 acupoint com um estimulador elétrico (G6805-2A; Shanghai Huayi Medical Instrument Factory, Xangai, China) todos os dias durante 8 semanas. A corrente elétrica foi estabelecida de acordo com tremendo ligeiramente dos membros inferiores. Para atingir o objectivo de eliminar a influência do stress, os animais foram deixados a mover-se livremente no seu próprio invólucro durante o processo de EA. Após a intervenção sucessiva durante 8 semanas, os ratos em cada grupo foram testados para o esvaziamento gástrico. Em seguida, eles foram sacrificados e as amostras de antro foram cuidadosamente obtido. Cada amostra foi dividida em várias partes, uma parte relativamente pequena um foi armazenado a -80 ° C para análise de transferência de Western após camadas recentemente isolada e uma peça foi colocada em 2,5% de glutaraldeído para microscopia electrónica, e o restante foi fixado em fixador de Zamboni (2 % de paraformaldeído e uma solução saturada de ácido pícrico 1,5% de ácido na solução de 0,1 M de tampão de fosfato (PBS, pH 7,4) para a coloração de imunofluorescência. O esvaziamento gástrico foi realizada por uma modificação tal como descrito anteriormente [21]. O teste de alimentação contendo vermelho de fenol (0,5 mg /ml) como indicador e carboximetilcelulose (15 mg /ml) foi constantemente agitada e, em seguida, mantida a 37 ° C. Após a noite privadas de comida, ratos recebeu 2 ml de fenol refeição vermelho administrada através de uma agulha de gavagem. Trinta minutos mais tarde, os animais foram rapidamente sacrificados por luxação cervical. o estômago inteiro foi removido cuidadosamente após a ligadura na cárdia e pilórico, e, em seguida, o estômago foi aberto e o seu conteúdo foi vertido num tubo de ensaio e lavou-se com 40 ml de água destilada. No final da experiência, uma solução de NaOH (20 mL, 1 M) foi adicionado a cada tubo para desenvolver a intensidade máxima de cor. A absorvância da amostra lida a 560 nm com um espectrofotómetro (Hitachi, L-2900) foi de modo a reflectir a quantidade de vermelho de fenol que permanece no estômago. A taxa de esvaziamento gástrico foi calculada de acordo com a seguinte fórmula: O esvaziamento gástrico (%) = 100 x (1 - X /Y), X representa a absorvância de vermelho de fenol recolhido a partir do estômago de animais sacrificados 30 minutos depois da refeição de teste. Y representa absorção de vermelho de fenol recuperado a partir do estômago de animais de controle morto imediatamente após a administração da refeição teste. amostras frescas de antro gástrico estavam presos a um prato Sylgard e cada a camada aquosa foi cuidadosamente destacada por dissecção cortante após a remoção da mucosa. Com a ajuda de uma pinça fina pontas e tesoura microcirúrgica sob um microscópio de dissecação, foram obtidas camadas de ICC-SM, ICC-IM e ICC-MY. Todas as manipulações foram realizadas em gelo para evitar a perda de proteína. E, em seguida, amostras de CCI-SM, CCI-IM e ICC-MY foram armazenadas a -80 ° C. amostras frescas-congelados foram triturados para a suspensão de células e homogeneizou-se em tampão RIPA (Upstate, Temecula, CA , EUA) com o inibidor da protease (Sigma Chemical Co., St Louis, MO, EUA). A mistura foi centrifugada a 12000 g durante 10 min a 4 ° C, e os sobrenadantes foram recolhidos como a proteína total. A concentração de proteína foi determinada pelo método de Bradford. Subsequentemente, os equivalentes de 50 mg de proteínas extraídas foram gradualmente separadas por 10% de sódio de dodecilsulfato de electroforese em gel de poliacrilamida (SDS-PAGE) e transferidos para uma membrana de PVDF (Millipore, Bedford, MA, EUA). Seguido bloqueando locais de ligação não específica com leite seco magro a 5% em solução salina tamponada com Tris contendo 0,1% de Tween 20 (TBST) à temperatura ambiente durante 1 h, estas membranas foram incubadas com anticorpo primário a anti-c-kit (1:200, Santa Cruz Biotechnology, Inc.) durante a noite a 4 ° C, juntamente com anticorpo de coelho anti-ratinho Actina (1:400, Santa Cruz Biotechnology, Inc) serviu como o controlo interno. Após três lavagens com TBST, as membranas foram incubadas com anticorpo secundário ligado a HRP (coelho ligado a HRP de cabra e anti-cabra ligado a HRP anti-ratinho, 1:5000) durante 1 h à temperatura ambiente. Seguindo-se três lavagens de TBST, as bandas foram visualizadas através de reacção química com um agente de quimioluminescência aumentada (Amersham Pharmacia Biotech, Piscataway, NJ) e a mancha foi submetido a auto-radiograf ia. análise de densitometria foi realizada por Quantidade Um software (Departamento de Assistência Técnica Bio-Rad, Versão 4.6.2). estudos de imunofluorescência Para as preparações de coloração de montagem integrais, o estômago foi aberto e lavada diversas vezes com PBS. antro gástrico foi fixado a um prato Sylgard e esticados a 150% do seu tamanho original, e em seguida fixadas com fixador de Zamboni durante 24 h à temperatura ambiente. Os tecidos fixados foram lavados com PBS e, em seguida, a mucosa foi removido por dissecção cortante. ICC-SM localização na superfície da submucosa da camada muscular circular, CCI-IM entrelaçamento entre as células do músculo liso e ICC-MY em conjunto com plexo mientérico nervosas foram cuidadosamente preparadas utilizando afilada fórceps e tesouras microcirúrgicas sob um microscópio de dissecação. Os procedimentos de imunocoloração para detectar redes ICC e proliferação foram previamente descritos [22]. Ki67, uma proteína nuclear expressa durante todas as fases activas da célula e desapareceram na célula em repouso, foi aplicado para detectar a proliferativa ICC [23]. Após lavagem seis vezes com PBS durante 1 h, os tecidos foram incubados com soro normal de bovino a 5% em PBS contendo 0,3% de Triton X-100 (PBST) durante 1 h à temperatura ambiente e depois incubadas com o anticorpo primário c-kit (1:100; Santa Cruz, CA, EUA) e Ki67 (1:100; Abcam, Cambridge, Reino Unido) durante a noite a 4 ° C. Após lavagem em PBST, durante 30 min, a imunorreactividade foi detectada utilizando Alexa Fluor 594 conjugado com anticorpo secundário (IgG de burro anti-cabra, 1:100) e 488 conjugado com anticorpo secundário Alexa Fluor (de burro anti-IgG de RABIT, 1:100) a 37 ° C durante 1 h, seguido por lavagem em PBS três vezes, durante 30 minutos, e incubada com DAPI (0,1 mg /ml; Sigma, St. Louis, MO, EUA) durante 30 min como um corante nuclear contador. Enxaguadas duas vezes em PBS, os tecidos foram desdobrado sobre uma lâmina. Um microscópio de varrimento laser confocal (Nikon, Japão) foi utilizado para examinar os tecidos imunomarcadas. A fim de incluir todos os níveis de células e processos marcadas positivamente, o empilhamento Z ideal de imagens confocal foi fixado em 5 mm intervalos. A apoptose de ICC foram detectados com rotulagem TUNEL, um Kit de detecção de apoptose (Roche, Alemanha). preparações Whole-mount foram incubadas com o anticorpo primário c-kit (1:100; Santa Cruz, CA, EUA) durante a noite a 4 ° C e o anticorpo secundário (Alexa Fluor 594 de burro anti-IgG de cabra, 1:100) a 37 ° C durante 30 min. Sob uma circunstância humidificada e escuro, os tecidos foram incubados com tampão de TUNEL de reacção (solução de etiquetagem: solução de enzima = 09:01) a 37 ° C durante 1 h. Depois de lavada três vezes durante 30 min para remover desconectadas fluoresceína-dUTP e incubadas com DAPI como um corante nuclear contador, os espécimes foram observados sob um microscópio confocal de varrimento laser. Após a mucosa removido, as amostras de antrum foram imersas numa solução fixadora de glutaraldeído a 2,5% a 4 ° C durante 2 h. Em seguida, elas foram lavadas com PBS 0,1 M, duas vezes durante 20 min, pós-fixadas em 1% de OsO 4 (pH 7,4) durante 1 hora, desidratados em álcool graduado, clarificadas em óxido de propileno e embebidas em Epon usando moldes planos. Secções ultrafinas foram obtidos com um ultramicrotome (Leica ULTRACUTU, Alemanha), e coradas com citrato de chumbo durante 10 minutos antes de ver com um microscópio eletrônico de transmissão (Tecnai G 212, FEI, Países Baixos). A análise estatística Para a análise de imunofluorescência, antro gástrico de cada animal experimental foi amostrado no mesmo local do estômago. TPI foi reconhecido por imunorreactividade de c-kit e a presença de processos celulares abundantes. Proliferando e apoptóticos ICC foram identificados por imuno c-kit e Ki67 /TUNEL núcleo manchado juntando estruturas de membrana positiva c-kit. Dez campos aleatórios (× 200 ampliação, 0,2607 milímetro 2) por preparação de toda a montagem foram tomadas para fotografias de células positivas c-kit, c-kit + /Ki67 + e c-kit + /TUNEL + células marcadas. Estas fotografias foram também empregue para avaliar a espessura das camadas em cada pilha, com a ajuda de núcleos marcados com DAPI como um marcador dos limites superior e inferior das camadas. O número de células positivas para c-kit, c-kit /Ki67 e c-kit /TUNEL células dupla marcados foram contados com o Image-ProPlus 5.0 (Media Cybernetics). Todos os dados foram expressos como média ± SEM. Pelo menos dez visões foram tomadas em cada animal. A análise de variância (ANOVA) e teste t de Student foram usados para comparar as diferenças entre os diferentes grupos. valor P inferior a 0,05 foi considerado como diferença estatisticamente significativa. Resultados O peso corporal e nível de glicose no sangue Após 8 semanas, morte acidental ocorreu no grupo DM (dois ratos) e no grupo MAR (um rato). Os ratos foram rastreados para o mesmo peso do corpo de linha de base entre os grupos (Tabela 1). Ao fim de 1, 4 e 8 semanas, peso corporal do grupo DM foi significativamente diminuída em comparação com o controlo ( P Como se mostra na Tabela 2, não foram observadas diferenças no nível de glicose no sangue de linha de base entre os grupos. Os modelos diabéticos foram estabelecidas com sucesso com o alto nível de glicose no sangue no grupo DM em comparação com o controle no final do 1, 4 e 8 semanas (todo o P Art < 0,001). Enquanto isso, os níveis de glicose no sangue no mar, grupos Lea e HEA foram não mudou significativamente em comparação com o grupo DM (todo o P Art > 0,05). Fig.1 mostrou os efeitos da EA em ST36 no esvaziamento gástrico em diferentes grupos. O esvaziamento gástrico do grupo DM foi drasticamente retardada em contraste com o controlo ( P de Fig.2, a expressão de c-kit em cada camada da parede gástrica foi avaliada. Na ICC-IM, c-kit no grupo DM foi obviamente diminuiu em comparação com o controle (0,47 ± 0,04 vs 0,69 ± 0,05, P Efeitos da eA em redes ICC alternâncias de redes ICC especialmente morfologia ICC e densidade foram exibidos na Fig.3. Não houve diferença significativa da espessura da camada entre os grupos. Associado com células do músculo liso, o c-kit de imunorreactividade para CCI-IM foi observada nas camadas musculares, mostrando que CCI-IM tinha dois processos polares formando uma rede celular no grupo de controlo. No grupo DM, os longos processos de ICC-IM foi prejudicada, aparentemente, ea densidade de células positivas para c-kit foi reduzida para cerca de 50% do controle normal ( P Art < 0,001). Comparado com o grupo DM, nenhuma mudança significativa foi observada no grupo SEA. No entanto, uma rede celular quase intacta foi visualizado no grupo LEA e HEA ea densidade de c-kit positivo ICC-IM quase restaurada ao nível normal (ambos P Art < 0,001, em comparação com o grupo DM ). -ICC MEU serpenteando ao redor do plexo mioentérico foram localizados entre as camadas musculares lisas longitudinais e circulares. ICC-MY multipolar com numerosos ramos formando uma rede celular intacta foram mostrou claramente no grupo de controlo. No grupo DM, as células c-kit + apareceu com corpos celulares esguios e processos fracturados, ea densidade de ICC-MY estava obviamente diminuiu ( P Art < 0,001). No grupo SEA, a densidade do ICC-MY não foram significativamente alteradas em comparação com o grupo DM ( P a apoptose de ICC foi detectada por marcação TUNEL para determinar se a apoptose estava envolvido na deficiência de ICC em diabetes (Fig.4). De Todo-mount preparativos do controle, alguns núcleos de ICC foram coradas pelo método TUNEL na camada muscular, camada mioentérico e na camada submucosa. A abundância de c-kit + /TUNEL + ICC-IM, ICC-MY e ICC-SM foram observadas no grupo DM (18,48 ± 1,88 milímetros -2, 26,51 ± 1,87 milímetros -2 e 12,03 ± 1,27 milímetros -2, respectivamente). O redes celulares c-kit + estavam incompletos eo TPI apoptótica apresentado como processos encurtados com menos galhos. Um grande número de c-kit + células /TUNEL + também foram inundações em todas as camadas do grupo SEA. Sob a implementação da LEA e HEA, células em apoptose kit + foram dificilmente encontrada em ICC-IM (1,79 ± 0,33 milímetros -2 e 2,05 ± 0,30 milímetros -2), ICC-MY (2,24 ± 0,40 milímetros -2 e 2,48 ± 0,40 milímetros -2) e ICC-SM (1,09 ± 0,25 milímetros -2 e 1,39 ± 0,20 milímetros -2). redes celulares reveladas por imunocoloração c-kit apresentou alta densidade e espessura de processos celulares no grupo LEA e HEA. Efeitos da EA sobre a proliferação de ICC Considerando o aumento do número de ICC na LEA eo grupo HEA, ICC Ki67-positiva foi detectada a revelar a proliferação de ICC nos três camadas (Fig.5). No grupo controle, uma série de c-kit /Ki67 células duplamente marcadas foram observadas em ICC-IM (8,82 ± 1,02 milímetros -2), ICC-MY (10,64 ± 0,92 milímetros -2) e ICC -SM (4,67 ± 0,96 milímetros -2). O número de ICC com ramos fraturados foi notavelmente reduzida e as redes foram muito esparso com poucas células em proliferação, tanto no grupo DM e do mar. No entanto, no grupo LEA e HEA, c-kit /Ki67 células dupla marcados em ICC-IM foram caracterizados por organismos estreitamente adjacentes celulares e processos relativamente bipolares e a densidade média atingiu a 18,37 ± 1,60 milímetros -2 e 15,27 ± 1,81 mm -2 (ambos P Art < 0,001). Da mesma forma, abundante c-kit + /Ki67 + ICC-MY no grupo LEA e HEA (ambos P Art < 0,001), formando redes intactas com c-kit + células realizado um corpo de células redondas e processos longos e finos. Em ICC-SM, acompanhada por uma rede intacta de ICC, a densidade de células em proliferação no grupo LEA e HEA foram relativamente maior em contraste com o grupo DM ( P Efeitos da EA sobre alterações ultra-estruturais de ICC características ultra-estruturais típicos de ICC foram revelados por microscopia eletrônica de transmissão (Fig.6). No grupo controle, ICC-IM e ICC-MY ricos organelos celulares de bem-desenvolvidos estendida processos longos contendo mitocôndrias e retículo endoplasmático rugoso e liso. Polimórfica ICC-SM localizado na superfície da submucosa da camada muscular circular apresentou maior citoplasma elétron-densa, numerosas mitocôndrias e retículo endoplasmático. No grupo DM, uma diminuição dramática no número de ICC com características ultra-estruturais danificados foi examinado por microscopia electrónica. Estas células com mitocôndrias inchado, cristaed interrompida e cromatina condensada mostrou membrana incompleta e encurtar processos. Estas alterações foram também observadas no grupo MAR. No grupo LEA e HEA, o número de ICC foi significativo aumento e eles ligados estreitamente com as fibras nervosas e células musculares lisas que dão forma a estrutura e fenda sináptica cruzamentos. crista mitocôndrias clara, ordenada distribuídos retículo endoplasmático rugoso e partículas ribossomais foram consideradas características clássicas de ICC-IM, IM-MY e ICC-SM. Discussão No presente estudo, constatou que tanto eA baixa e alta frequência na ST36 suprimiu a apoptose de ICC e ativado a proliferação de ICC no estômago de ratos diabéticos induzidos por STZ. Como resultado, o resgate de redes ICC foi associada com um efeito preventivo sobre o esvaziamento gástrico retardado. Como um procedimento eficaz com menos efeitos colaterais, EA combinado com acupuntura e estimulação corrente elétrica, em vez de manipulações manuais está gradualmente aceito pelo Países ocidentais. ST36 é um dos pontos mais frequentemente usado para tratar distúrbios gastrointestinais, com indicações, incluindo: dor epigástrica, náuseas, vómitos, falta de apetite e distensão abdominal. Simultaneamente, o nosso estudo anterior indicou EA em ST36 poderia aumentar o movimento de propulsão do cólon, mas não observados no grupo com a EA em não-acupontos. O retardo no esvaziamento é um personagem comum de pacientes diabéticos com gastroparesia e também um dos principais fatores que contribuem para os sintomas de gastroparesia. Durante as últimas décadas, as experiências em ratos conscientes que mostrou baixo EA frequência (10 Hz) acelerou significativamente o esvaziamento gástrico, [3], [24], [25]. Além disso, 100 Hz EA foi eficaz para provocar a libertação de serotonina e dinorfina para induzir a analgesia [26]. Embora EA frequência elevada (100 Hz) também foi relatado para promover esofágica e a motilidade do cólon distai em animais [7], [8], os efeitos de 100 Hz EA sobre a motilidade gástrica têm pouco investigado. Assim, os parâmetros (10 e 100 Hz) de EA foram seleccionados de acordo com experiências preliminares que indicam efeito estimulador de motilidade gastrointestinal. Os nossos resultados demonstraram que tanto EA baixa frequência (10 Hz) e EA alta frequência (100 Hz) em ST36 melhorou significativamente atraso do esvaziamento gástrico em ratos diabéticos, e o resultado também revelou que o efeito de baixo EA frequência foi mais dramática do que a de alta EA frequência. Numerosos estudos demonstraram que a TPI desempenha um papel importante na regulação do peristaltismo gástrico, um dos principais determinantes de esvaziamento gástrico [27], [28]. Como ICC existe em diferentes camadas do antro gástrico, sob a forma de redes In vivo é digno de nota que o saldo das redes ICC é determinada principalmente pela apoptose e proliferação de ICC [11], [12]. Portanto, o mecanismo possível sobre a motilidade gástrica e os efeitos sobre as redes ICC de EA em ST36 foram exploradas através da detecção das alterações de proliferação e apoptose de ICC. Recentemente, a morte celular por apoptose é relatado para ser um processo contínuo de redes ICC e o nível de apoptose em cólon saudável indica que essas células devem ser continuamente regenerada para manter redes intactas [12]. Além disso, os resultados a partir de cobaias adultas indicaram que isquemia e reperfusão levou a uma redução no número de TPI por apoptose que podem contribuir para perturbações da motilidade gastrointestinal [30]. Além disso, um relatório recente mostrou que a terapia EA reduziu a percentagem de células apoptóticas substantia nigra nas ratazanas parkinsonianas [31]. O presente estudo tem claramente articulada que ICC apoptose detectada pelos métodos TUNEL foram inundações em redes ICC de estômago de ratos diabéticos e especulou que a depleção de redes ICC pode também levar a distúrbios de motilidade gástrica. Mas, através da intervenção de estímulos EA baixa e alta frequência, TUNEL núcleo + dificilmente eram de encontrar, sugerindo a apoptose de ICC foram reduzidos a um nível baixo como normal. Proliferação também é outro principal regulador para manter redes de ICC. Resultados anteriores demonstraram que a proliferação estava envolvida na recuperação de ICC, uma vez que foi perdido em animais adultos [32], [33].
(ST36) é um acupoint comum que frequentemente usada para tratar doenças gastrointestinais. Nos últimos anos, os efeitos de EA em ST36 sobre a motilidade gástrica foram avaliadas em numerosos estudos. Para os animais, EA em ST36 aumentou significativamente a motilidade gástrica em ratos conscientes e melhorou o esvaziamento gástrico retardado em ratos com diabetes induzida por STZ [3], [4]. Além disso, em seres humanos, EA em ST36 esvaziamento gástrico acelerado e aliviou os sintomas dispépticos, em pacientes com dispepsia funcional e indivíduos diabéticos com gastroparesia [5], [6]. Embora nestes estudos única EA baixa frequência foi adotada, EA alta frequência também foi relatado para promover esofágico e da motilidade do cólon distal em animais [7], [8]. Assim, os efeitos de diferentes EA frequência sobre a motilidade gástrica e os mecanismos subjacentes chamar a atenção das pessoas.
Significância
Materiais e Métodos
Diabetic modelo
alimentação. Uma semana após a injecção, a diabetes foi confirmada no tempo diferente através da medição de glucose em uma gota de sangue inteiro obtido por punção da ponta da cauda navio. Um nível de glicose no sangue de ≥16.7 mmol /L foi feita como um modelo padrão para o sucesso. A glucose no sangue foi rastreada pontualmente antes da injecção e 1, 4 e 8 semanas após a injecção. Além disso, perda de peso, polidipsia e poliúria foram mais indicadores para comprovar a indução bem-sucedida de rato diabético.
protocolos experimentais
Medição de esvaziamento gástrico
Western Blot
A microscopia electrónica
= 0,009, 0,000 e 0,000). Não houve diferença significativa entre o grupo SEA e DM ( P Art > 0,05). No entanto, em contraste com o grupo DM, o peso corporal foi elevado no grupo LEA às 8 semanas ( P
< 0,001) e no grupo do HEA 4 e 8 semanas ( P =
0,003, P
. < 0,001 separadamente)
Efeitos da EA sobre o esvaziamento gástrico
= 0,012). Comparado com o grupo DM, SEA não teve efeito significativo sobre o esvaziamento gástrico ( P
= 0,338), mas LEA e HEA marcadamente acelerou o esvaziamento gástrico retardado de 43,96 ± 5,02% e 69,72 ± 3,02% e 59,06 ± 3,70% ( P Art < 0.001 e P
= 0,013, respectivamente). Comparação entre o grupo LEA e HEA, a significância estatística foi alcançada ( P
= 0,04), o que representa que o efeito da LEA, obviamente excedeu a de HEA.
Efeitos da EA na expressão de c -Kit
= 0,001). Por outro lado, LEA e HEA melhorado dramaticamente a expressão de c-kit em comparação com o grupo DM (0,65 ± 0,04 vs 0,47 ± 0,04, P
= 0,004; 0,66 ± 0,03 vs 0,47 ± 0,04, P
= 0,002, respectivamente). Em ICC-MY, a expressão de c-kit foi significativamente reduzida no grupo DM em contraste com o controlo (0,57 ± 0,04 vs 0,83 ± 0,05, P
< 0,001). Mas houve diferença significativa tanto alcançado no grupo LEA e HEA comparação com o grupo DM (0,78 ± 0,05 vs 0,57 ± 0,04, P
= 0,002; 0,76 ± 0,04 & 0,57 ± 0,04, P
= 0,004, respectivamente). Em ICC-SM, o c-kit do grupo DM foi evidentemente diminuída com base no nível normal (0,56 ± 0,03 vs 0,77 ± 0,04, P
= 0,001). Consistentemente, LEA e HEA, obviamente, aumentou a expressão de c-kit em comparação com o grupo DM ( P
= 0,003 e P
= 0,007). No entanto, não houve diferença significativa entre o grupo SEA e DM na ICC-IM, ICC-MY e ICC-SM ( P
= 0,597, P
= 0.853 e P
= 0,172).
= 0,762). No entanto, uma rede celular quase intacta existiu em torno do plexo mioentérico eo ICC-MY densidade parcialmente recuperada no grupo LEA e HEA (ambos P Art < 0,001, em comparação com o grupo DM)
<. h3> Efeitos da EA sobre a apoptose de ICC
= 0,016 e P
= 0,003).
, alterações de redes ICC são um valioso a ser considerado. Redução do número e morfológicas mudanças de ICC-MY e ICC-IM no estômago de ratos diabéticos foram demonstrados em um estudo anterior [14]. Do mesmo modo, foi observada uma acentuada perda de CCI-IM e ICC-SM no antro de ratos diabéticos induzidos por STZ, mas ICC-MY não foi significativamente afectada, excepto para uma perda de ligação com as estruturas nervosas [15]. Estas diferenças de resultados nestes dois estudos provavelmente foram associados a espécies animais. A partir de um estudo de 28 pacientes com gastroparesia, um número reduzido de TPI foi encontrado no plexo mientérico por biópsias antrais de espessura total [29]. Nossos resultados mostraram que ICC-IM, ICC-MY e ICC-SM no antro de ratos diabéticos induzidos por STZ foram drasticamente reduzidos com base na técnica de western blot e imunofluorescência, e ainda mais a estrutura danificada do ICC foi mostrado por microscopia eletrônica de transmissão . Felizmente, relata-se que a baixa frequência de EA melhora a expressão do ICC no cólon de ratos trânsito constipação lentos [17]. Além disso, nosso estudo anterior sugeriu que ambos baixa e alta frequência EA restaura a expressão das ICC no cólon de ratos diabéticos [18]. No entanto, nesses estudos, eles investigar a alteração da ICC como um todo e os efeitos de diferentes EA frequência no ICC no estômago não foram elucidados. Assim, os efeitos de diferentes EA frequência em três subtipos de ICC no estômago incluindo ICC-IM, ICC-MY e ICC-SM foram o foco do presente estudo. Nossos resultados mostraram que a expressão da ICC nas três camadas foram visivelmente resgatado por baixa e alta frequência de EA, o que sugere que a EA baixa e alta frequência redes de ICC-IM, ICC-MY e ICC-SM renovado e ainda pode contribuir para uma recuperação esvaziamento gástrico.
 Você pode comer ovos quando tem diarreia?
Certos alimentos podem piorar a diarreia. Esses alimentos incluem produtos lácteos, como leite, queijo e sorvete. Sim, na maioria dos indivíduos com diarreia, os ovos ajudam a retardar os movimento
Você pode comer ovos quando tem diarreia?
Certos alimentos podem piorar a diarreia. Esses alimentos incluem produtos lácteos, como leite, queijo e sorvete. Sim, na maioria dos indivíduos com diarreia, os ovos ajudam a retardar os movimento
 O que é Melanose Coli?
Melanosis coli é uma condição na qual há uma descoloração das membranas que revestem seu cólon (intestino grosso) e reto resultante do depósito de pigmento na lâmina própria, uma camada do revestiment
O que é Melanose Coli?
Melanosis coli é uma condição na qual há uma descoloração das membranas que revestem seu cólon (intestino grosso) e reto resultante do depósito de pigmento na lâmina própria, uma camada do revestiment
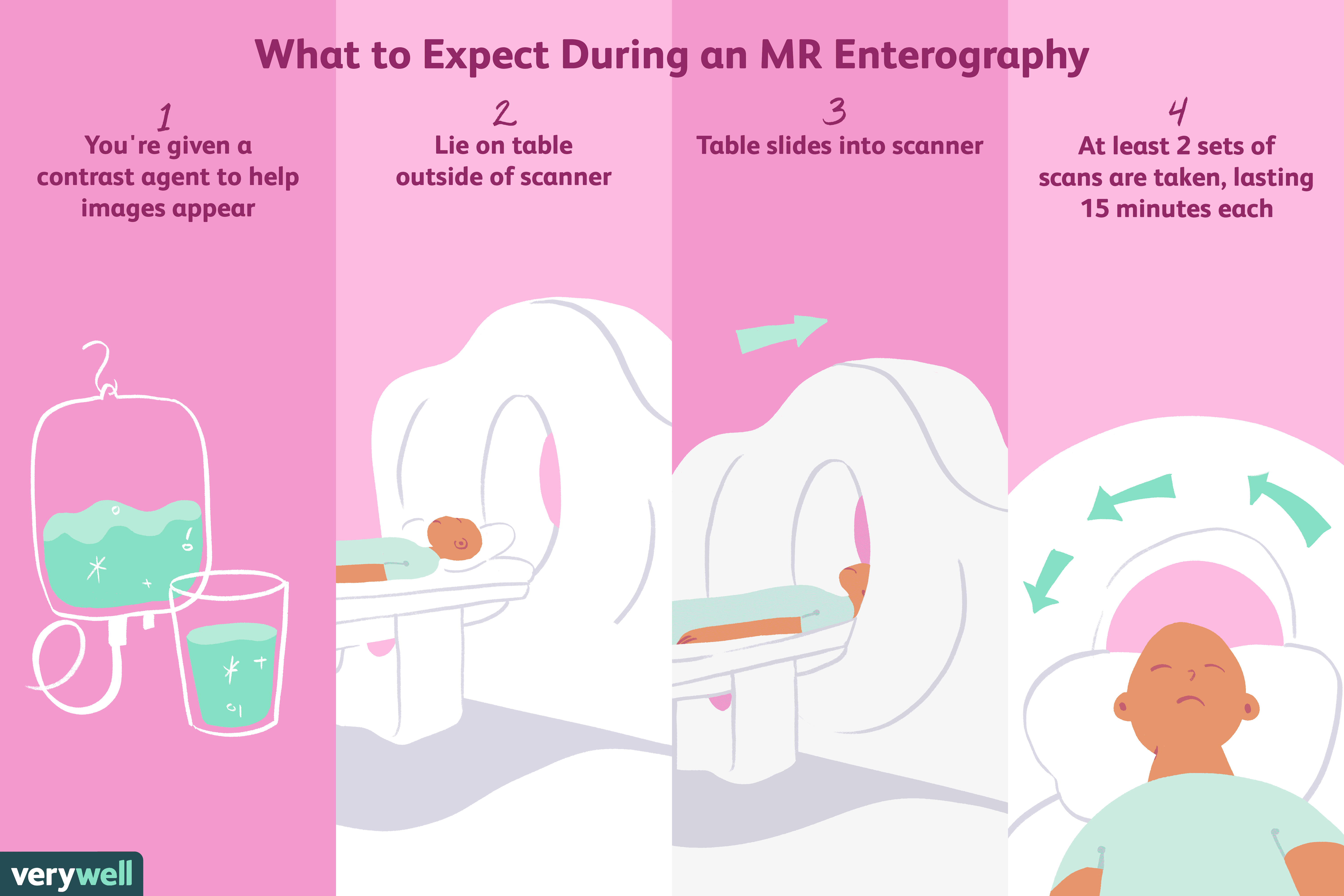 O que é enterografia por ressonância magnética?
A enterografia por ressonância magnética (MR) é um exame de imagem médica indolor, não invasivo e livre de radiação usado para diagnosticar problemas no intestino delgado. Uma forma especializada de r
O que é enterografia por ressonância magnética?
A enterografia por ressonância magnética (MR) é um exame de imagem médica indolor, não invasivo e livre de radiação usado para diagnosticar problemas no intestino delgado. Uma forma especializada de r