Baktericidne dejavnosti kationskih steroid CSA-13 in cathelicidin peptida LL-37 proti Helicobacter pylori
v simuliranem želodčnem soku
Abstract
Ozadje
svetovnega pojava sevov zdravila odpornih s H. pylori
motivira iskanje novih agentov s terapevtskega potenciala proti tej družini bakterij, ki colonizes želodec, in je povezana z razvojem adenokarcinomom. Ta študija je bila zasnovana za oceno in vitro
anti-H. pylori
potencial cathelicidin LL-37 peptida, ki je naravno prisotna v želodčnega soka, svoje optimizirano sintetičnega analogni WLBU2 in nepeptidni antibakterijsko sredstvo ceragenin CSA-13.
rezultate
V skladu s predhodnimi študijami so opazili povečano izražanje hCAP-18 /LL-37 v želodčni sluznici, pridobljenih iz H. pylori
okuženih predmetov. vrednosti MBC (minimalno baktericidno koncentracija) določi v vsebujejo hranil medijev območju 100-800 pg /ml za LL-37, 17.8-142 ig /ml WLBU2 in 0.275-8.9 g /ml za ceragenin CSA-13. Ti podatki kažejo velike, vendar zelo različne antibakterijske aktivnosti proti kliničnih izolatov H. pylori
. Po inkubaciji v simuliranem želodčnem soku (nizkem pH s prisotnostjo pepsina) CSA-13, vendar ne LL-37 ali WLBU2, ohranil antibakterijsko aktivnost. V primerjavi z LL-37 in WLBU2 peptidov, je CSA-13 aktivnost tudi bolj odporne na inhibicijo z izolirano gostiteljskih želodcu MUCINS.
Zaključek
Ti podatki kažejo, da holne temelji na kislinski antimikrobna sredstva, kot CSA-13 upirajo proteolitični degradacijo in zaviral mucin in imajo potencial za zdravljenje H. pylori
okužb, vključno s tistimi, ki so jih klaritromicina in /ali metronidazol-odporni sevi.
Ozadje
Helicobacter pylori
poteka za več kot polovico svetovnega odraslega prebivalstva [1]. Lahko kronično kolonizirajo želodčne sluznice človeški, kjer se pojavljajo v sluzi sloja in se lepi na epitelijskih celic [2]. Čeprav je večina okuženih s predmeti ostanejo brez simptomov, okužba z bakterijo H. pylori
lahko spodbujajo hudo gastritis [3] in znatno poveča tveganje za želodčne malignih bolezni [4, 5]. V nekaterih epidemioloških študijah so H. pylori
izkoreninjenje izkazalo za učinkovito pri želodčnem preprečevanja raka [6, 7]. Poleg tega je bil H. pylori
izkoreninjenje ugotovljeno, da zmanjša pogostost in resnost poškodb z kancerogenega potenciala v živalskih modelih [8, 9]. Naravni mehanizmi, ki ščitijo gostitelja s H. pylori
okužb odvisna od funkcije prirojene obrambnega sistema, v katerem antibakterijska peptidi kot cathelicidin LL-37 [10, 11], in O-glikanov v želodcu mucin [12] igrajo ključno vlogo.
LL-37 je proteolitsko predelana peptid izveden iz C-terminalne domene humanega cathelicidin (hCAP-18 /LL-37), ki je konstitutivno sprosti v zunajcelični prostor z fagocitarne granulocitov in epitelijskih celic [13] . Funkcije pripisati LL-37 vključujejo preprečevanje bakterijske rasti [14], nevtralizacijo bakterijske stene molekul biološka aktivnost [15] in aktivacije gostiteljskih celic z vezavo specifičnih celic membranske receptorje [16-18]. H. pylori
upregulates proizvodnjo LL-37 /hCAP18 jih želodčni epitela, kar kaže, da cathelicidin ali iz njega izpeljanih LL-37 prispeva k določitvi ravnovesje med gostitelja sluznice obrambe in H. pylori
mehanizme preživetja, ki urejajo kronično okužba s to želodca patogena [10, 11].
kationskih antibakterijske peptide (CAPS), vključno z LL-37 so temeljito raziskan kot potencialni vir novih protibakterijskih molekul. Inženirstva WLBU2 peptid, katerih ostanki so urejeni tako, da tvorijo amfipatični vijačno strukturo z optimalno polnjenje in hidrofobne gostote, odpravlja nekatere omejitve naravnega LL-37, kot so občutljivost na Mg
2+ ali Ca 2+ in inaktivacijo s krvjo serum [19]. Zato bi WLBU2 zdravljenje okužb, kjer je LL-37 neučinkovita. Da bi ustvarili molekule sposobne, da posnemajo sposobnost kape do kompromisov integritete bakterijske membrane, nepeptidne ceragenins z kationskih, so razvili facially amfifilne strukture, značilne za večino antimikrobnih peptidov. Ceragenins kot CSA-13 reproducira potrebno morfologijo SKP s pomočjo žolča kisline odra in priložene aminskih skupin [20]. So baktericidna proti obema Gram-pozitivnih in Gram-negativnih organizmov, vključno z bakterijami zdravila odpornih kot klinično pomembne meticilin odporen Staphylococcus aureus
(MRSA), in prejšnji študiji dovzetnost je pokazala, da ima CSA-13 je MIC 50 /MBC 50 razmerje 1 [21, 22]. V tej študiji smo primerjali baktericidno jakost LL-37, WLBU2 in CSA-13 proti kliničnih izolatov H. pylori
. Rezultati kažejo, da imajo posnema holne ki temelji kisline protimikrobne peptida kot CSA-13 potencial za zdravljenje H. pylori
okužbe, vključno s tistimi, ki jih klaritromicina in /ali metronidazol odpornim sevom povzročil.
Rezultati
imunohistokemično sondiranje človeške želodčne sluznice odsekov z anti-hCAP-18 /LL-37 protitelesa
so Mikroskopske slike sluznice biopsije po imunohistokemičnim vrednotenje z anti-hCAP-18 protitelesa /LL-37 je prikazano na sliki 1. DAB- pozitiven obarvanja kaže na prisotnost LL-37 peptida in /ali njeno matično proteina hCAP-18. Visoka intenzivnost DAB obarvanje (rjavi barvi označeno) na epitelnih celic, ki proizvajajo sluz in fundic žlez kaže na visoko akumulacijo hCAP-18 /LL-37 peptid, ki ga LL-37 specifično interakcijo s mucin, ki so poročali v prejšnjih študijah najverjetneje poganja [23, 24]. Porazdelitev hCAP-18 /LL-37 v bolj diferencirano populacije epitelijskih celic želodčne sluznice razlikuje od tistega dalo prehrani, P defenzin 2 [10] ali lizocim [25], vendar je podoben tistemu opazili v debelem črevesu [26 ]. Želodčne sluznice biopsije pri bolnikih, okuženih z bakterijo H. pylori
kažejo večjo intenzivnost DAB barvanjem v primerjavi s tistim, ki jih niso okuženih predmetov. Po prejšnjih poročilih, ta rezultat kaže na obrambni odziv gostitelja na H. pylori
[11], ki je deloma temelji na povečano izražanje hCAP-18 /LL-37, ki ga epitelijskih celic želodca. Slika 1 Prisotnost hCAP-18 /LL-37 peptid v sluznici biopsije iz človeškega želodca odkritih s pomočjo imunohistokemičnim analizo z monoklonskih protiteles za prehrano SKP-18 /LL-37. Vzorci A /B in C /D predstavljajo vzorce, pridobljene iz pylori
okuženih predmetov, ki niso okuženi in H. oz. Prikazani podatki so reprezentativna za pet poskusov.
Baktericidno aktivnost LL-37, WLBU-2 peptidi in ceragenin CSA-13 proti različnim sevom H. pylori
z opredelitvijo odpornih sevov, kliničnih izolatov H. pylori
bili podvrženi vrednotenju MIC (tabela 1), z več antibiotikov, ki se trenutno uporabljajo v kliničnem zdravljenju H. pylori
infekcije. Med sedmimi testiranih izolatov pridobljenih iz različnih predmetov, je sev 4 odporna na metronidazol in sevov 5, 6, 7 so bili odporni tako metronidazol in klaritromicin. Vsi izolati so bili občutljivi za amoksicilin in tetraciklini. V skladu s prejšnjimi poročili o učinkih HBD-1, h-BD-2 in LL-37 peptidi proti H. pylori
[10, 11] so bili ubiti vsi izolirani sevi H. pylori
po 6 urah inkubacije z LL-37, WLBU2 in CSA-13 s povprečno MBC (g /ml) vrednosti 8,9 ± 4,03; 5,23 ± 2,7 in 0,31 ± 0,25, ko je MBC ocenili v HEPES pufru, ali 300 ± 232, 53 ± 41 in 2,98 ± 3,11, ko je MBC ocenili v Brucella juho Bullion zaporedju (slika 2). Ocenjevanje vrednosti MBC v HEPES pufer z dodatkom 2 mM MgCl 2 za H. pylori
ATCC 43504 razkrila osem kratno povečanje za LL-37, in štiri kratno povečanje tako za WLBU2 in CSA-13 (podatki ne kažejo). Slika 2 dejavnost baktericidno proti H. pylori. Minimalna baktericidno koncentracijo (MBC) za LL-37 (beli stolpec), WLBU2 (siva stolpec) in CSA-13 (črni stolpci) proti H. pylori
(ATCC 43504 sev in sedem kliničnih izolatov, pridobljeni iz vzorcev sluznice iz različnih predmetov ) ocenjevali pri HEPES (panel A) ali Brucella brozga Bulion (panel B). MBC kaže koncentracije, pri kateri spojine popolno izkoreninjenje inokulum H. pylori
.
Tabela 1 Ocena občutljivosti kliničnih sevov H. pylori
na antibiotike.
H. pylori
sevi
Antibiotiki
AMX
CLR
TET
Metronidazol
ATCC 43504
0,016
0.094
0,25
64,0 ®
1
0.094
0.125
0.75
0.19
2
<0.016
0.19
0.125
0.094
3
0.016
0.25
3.0
0.5
4
0.032
0.047
2.0
32.0 ®
5
0,25
64,0 ®
1.0
96,0 ®
6
0.032
1,5 ®
1,5
32,0 ®
7
0,047
1,5 ®
2,0
48,0 ®
vrednosti MIC (mg /ml) (AMX-amoksicilin, CLR-klaritromicin, TET-tetraciklin)
Antibakterijska aktivnost LL-37, WLBU2 in CSA-13 po predhodni inkubaciji pri nizkem pH s pepsina ali mucin
Poleg znanih inhibicijo CAPS antibakterijske aktivnosti s strani dvovalentne katione, kot so Mg 2+ in Ca 2+ je proteolytic dejavnosti pepsina lahko ogrozi tudi funkcijo Caps v želodčnem okolju soka s prisotnostjo MUCINS in nizkim pH. Za rešitev te možnosti smo ocenili z antibakterijskim delovanjem proti bakteriji Escherichia coli
MG1655 po 3 urah pred inkubacijo LL-37, WLBU2 in CSA-13 v simuliranem želodčnem soku v primerjavi z dejavnostjo po njihovi inkubacijo v PBS pri pH 7,4 . Pred izvedbo ubijanje testa, pH vzorcev z nizko pH in nizkem pH /pepsin smo naravnali na 7,4. Antibakterijsko aktivnost LL-37 in WLBU2 peptidov proti E. coli
MG1655 ni bistveno spremenila po inkubacijo pri pH ~ 1.5, vendar pa je bil izgubljen po inkubacijo pri pH ~ 1.5 v prisotnosti pepsina (slika 3A in 3B). V nasprotju s tem pa je antibakterijska aktivnost CSA-13 nespremenjena z inkubacijo pri pH ~ 1.5 z ali brez pepsina (slika 3C). Po drugi strani so baktericidna aktivnosti vseh komponent ogrožena različnih obsegu ko testirati z bakterijsko ubijanje testa v prisotnosti očiščenega želodčne mucin. V tesnem soglasju z dobljenih rezultatov iz te E. coli
študije MG1655, vrednosti MBC v LL-37 peptid ovrednotene po 1H inkubacijo s pufrom pri nizkem pH, ki vsebuje pepsin ali mucin se je povečalo, vendar tiste, CSA-13 so skoraj nespremenjene (Slika 3D). Vse ovrednotili agenti izgubil antibakterijska aktivnost v PBS, dopolnjenem z 10% humanega žolča (koncentraciji, ki ne posega v E. coli
MG1655 rast - podatki niso prikazani). Ta rezultat kaže, da fizikalno-kemijske lastnosti protibakterijskih molekul spodbujajo njihovo vključitev v žolča lipoprotein, kar omejuje njihovo interakcijo z bakterijsko steno. Ni bilo študija za oceno antibakterijskim delovanjem kapice v dvanajstniku soku, vendar so ti rezultati kažejo, da lahko žolčnih refluks v želodec moti CAPS dejavnosti. Slika 3 Antibakterijska aktivnost proti E. coli MG1655 in H. pylori sev ATCC 43504. Antibakterijska aktivnost LL-37 (plošče A), WLBU2 (plošča B) in CSA-13 (panel C) proti E. coli
MG1655 po predinkubacijo (3 h pri 37 ° C) v PBS (prazni krožci), simulirani želodčni sok pri pH ~ 1.5 (kvadratov) simulirani želodčni sok s pepsinom (diamanti) simulirani želodčni sok z mucin (trikotniki) in PBS s humanim žolčne (10%) dobimo iz žolčnika (napolnjena krog). Prikazani podatki so sredstva ± SD treh do štirih poskusih. MBC LL-37 (bela stolpec) in CSA-13 (črni stolpec) (Plošča D) proti H. pylori
(ATCC 43504), po inkubacijo (1 h pri 37 ° C) v simuliranem želodčnem soku pri pH ~ 1,5 (A) simulirani želodčni sok s pepsinom (B) in v prisotnosti mucin (C)
Analitski karakterizacija LL-37 in CSA-13 po inkubaciji s pepsinom
Mass analize spektrometrije (slika 4) razkriva da tri ure inkubacije z rezultati pepsina v obsežno degradacijo LL-37. Vendar pa pri nizkem pH, pepsin prebava je zelo specifična in LL-37 peptid cepitev je omejena na mesto s hidrofobne aminokisline. Potencialni cepilna mesta napovedujejo PeptideCutter karakteristika programske opreme http:.. //Kr expasy org /orodja /peptidecutter /, kažejo, da naj bi LL-37 prebava z pepsina v naših eksperimentalnih pogojih za javnost 11 izdelkov, vključno s 3 krajših peptidov (RKSKEKIGKE, FKRIVQRIKD in LVPRTES). Te napovedi so v skladu z masno spektralno analizo, ki ne kažejo na prisotnost katere koli neokrnjene LL-37 preostalih po inkubaciji z pepsina pri nizkem pH, ki pa ne razkrivajo nastanek številnih novih vrhov z različnimi retenzijskih časov. Preostali Antibakterijska aktivnost LL-37 po zdravljenju z pepsina (slika 3A in 3D) v ubijanja testih verjetno predstavlja preostalo dejavnost teh LL-37 fragmentov. V nasprotju z opaženo degradacijo LL-37, CSA-13 Analitsko karakterizacijo ni bila spremenjena po inkubaciji s pepsinom pri nizkem pH. Slika 4 Analiza masnega spektrometrija. Analiza masnega spektrometrija LL-37 (panel A), CSA-13 (panel B) v PBS (krivulja 1) nizek pH pufra (krivulja 2) in nizek pH pufer s prisotnostjo pepsina (krivulja 3). Skupno ion Kromatogram (TIC) je prikazana za vsako stanje vzorca z vstavljenim masa-to-map (m /z) spektrov, ki prikazuje intenzivnost za boxed TIC vrhov. Molekulska masa intaktne LL-37 je 4494, ki ga je mogoče opaziti z več stroškov (m /z = 4 MW = 1124 m /z = 5 MW = 900, itd) v pozitivnem načinu ionov. Molekulska masa CSA13 je 678, kar je mogoče opaziti neposredno in z več stroškov. Podatki iz enega eksperimenta so prikazani.
Toksičnost LL-37, WLBU2 in CSA-13 proti RBC in adenokarcinom celicami
nespecifičnih vstavljanje antibakterijskih peptidov in njihovih posnema v membrane gostiteljske celice lahko povzroči toksičnost. Gostiteljska celična membrana permeabilizacijo lahko izmerimo sproščanje proteinov, kot so hemoglobin in LDH od citosol v zunajcelični prostor. Z oceno hemoglobina in sprostitev LDH (slika 5A in 5B), smo pokazali bistvene membrane permeabilizacijo z vsemi testiranimi molekul v območju, na katerem jih imajo baktericidno aktivnost v slanih odbojniki (Slika 2A, slika 3). Ta ugotovitev je bila potrjena z mikroskopskim ocenjevanje morfologije adenokarcinom celic, ki kaže nobene vidne razlike med kontrolnimi celicami in ki so prejemali 10 mg /ml LL-37, WLBU2 ali CSA-13 (slika 5C). Vendar pa so opazili povečanje hemoglobina in LDH sproščanja z naraščajočo koncentracijo. Med tremi molekulami testiranih je WLBU2 najmočnejši hemolitična sredstvo, toda vse izmed njih je pokazala podobna sposobnost za kompromis integritete adenokarcinom celične membrane (slika 5B in 5C). CSA-13 baktericidne koncentracije proti H. pylori
in E. coli
MG1655 (slikah 2A, 2B in 3C) so ocenili v slanici, kot tudi hranil vsebuje pufer so bile pod minimalni hemolitično koncentracije in pod koncentracijah, ki povzročajo motnje v adenokarcinoma celične membrane. Slika 5 Ocena toksičnosti celic. Hemoglobina in LDH izpustitev iz človeških rdečih krvnih celic in človeških adenokarcinomom želodca celic (plošča A in B oziroma) po dodatku LL-37 (krogi), WLBU2 (diamanti) in CSA-13 (trikotniki), sledi inkubacija 1 h pri 37 ° C. Prikazani podatki so sredstva ± SD treh poskusih. Morfologija človeških adenokarcinomom želodca celic pred (nadzor) in po LL-37, je WLBU2 in CSA-13 zdravljenje ovrednotili s fazno kontrastnim mikroskopom (plošče C). Podatki iz enega reprezentativnega poskusa so prikazani. Dve drugi poskusi pokazala podobne rezultate.
Razprava
Stopnja uspešno zdravljenje H. pylori
okužbo želodca, dosežena s kombinacijo terapije dveh antibiotikov in zaviralca protonske črpalke se je znižal z več kot 90% do približno 80 % v zadnjem desetletju [27]. Poleg tega je strošek te terapije je pomembno, torej potreba po večjem obsegu razpoložljivih sredstev za zdravljenje ali preprečevanje okužbe z bakterijo H. pylori
vedno obstaja [28]. Nova sredstva za zdravljenje H. pylori
okužbe so potrebne tudi zaradi povečanja težav z drogami uporom s široko uporabo antibiotikov [29] in adaptivne mehanizme preživetja patogenih bakterij za boj trenutno uporabljajo protimikrobna zdravila povzročajo. Na primer, so poročali H. pylori
sevi, ki so odporni na amoksicilin, metronidazol in klaritromicin [30, 31]. Metode za izboljšanje zdravljenja za H. pylori
bi lahko vodila vpogled v naravne mehanizme, s katerimi okuženi bolniki odzivajo na to bakterijo in razlogih, zakaj običajni mehanizmi gostitelja obrambni okvari.
Ta raziskava potrjuje predhodno poročilo o povečana hCAP-18 /LL-37 izraz v želodčne sluznice oseb, okuženih s H. pylori
[11]. Ta ugotovitev kaže, da se poveča proizvodnja bakterijska peptida LL-37 igrajo ključno vlogo pri gostiteljici obrambi proti H. pylori
[11]. Vendar pa ta baktericidno odziv pri nekaterih predmetih je nezadostna in H. pylori
okužbe lahko še vedno dosežejo kronični fazi. Pomanjkanje baktericidno funkcija LL-37 v tem okolju je predlagal, da poveča ekspresijo hCAP-18 /LL-37 peptida v želodčnem sluzi okuženih osebah lahko dodatne funkcije kot protivnetno in rasti stimulativno sredstvo. Dejansko je nedavno pokazala, da je želodcu celjenje pri podganah spodbuja-cathelicidin posredovano transaktivacije za epidermalni rastni dejavnik (EGFR receptorjev) preko transformirajočega rastnega faktorja alfa (TGFα) signalne poti [32]. Alternativno, izguba obrambo proti H. pylori
lahko posledica izgube antibakterijsko funkcija LL-37 v okolju z želodčne sluznice. Zato se lahko oblikovanje protimikrobnih zdravil, ki so bolj učinkoviti v tem okolju koristna.
Motivirani s imunohistološkega rezultati, dejavnost LL-37 proti kliničnih izolatov H. pylori
in E. coli
MG1655 pod biološko ustrezni pogoji, se je v primerjavi z sintetičnih peptidov WLBU2 in ceragenin CSA-13. Ta študija je pokazala, da je CSA-13, v nasprotju s LL-37 in WLBU2 peptidov, ohranja močno baktericidno aktivnost v prisotnosti mucin po predinkubacija s pepsinom pri nizkem pH. Ti pogoji so edinstvene izzive, povezane s H. pylori
zdravljenja, saj so te bakterije v želodcu zaščiten kislem okolju z debelo sluzi plasti in učinkovitost mnogih protimikrobnih zdravil je močno zmanjšala s kislim pH [31]. Skladno s tem je prvi učinkovita terapija za H. pylori
infekcija je kombinacija relativno pH-neobčutljiv antimikrobnih zdravil, kot so bizmutov, tetraciklini in metronidazola [33]. Poleg tega, kot želodec občasno izprazni vsebino (lokalna terapija kaže, da je razredčena in spere) ugotovitev, da ima CSA-13 baktericidno aktivnost na veliko nižjo koncentracijo nato LL-37, po istem času inkubacijski (3-6 ur) [11], kažejo, da lahko CSA-13 terapevtski potencial za zdravljenje H. pylori
okužbe. Antibakterijsko aktivnost CSA-13, ki ima manjši neto naboj in edinstveno razporeditev te dajatve nad steroidnega oder ko primerjavi z LL-37 in WLBU2 peptidov, je bilo tudi, da je manj inhibirana z mucin izolirali iz želodčne sluznice. Terapevtski potencial, ki temelji na sposobnosti CSA-13 za izkoreninjenje H. pylori
je podprl tudi že poročali antibakterijskim delovanjem proti drugimi sevi bakterij, vključno kliničnih izolatov Pseudomonas aeruginosa
[21] in S. aureus
[22]. CSA-13 je edinstveno sposobnost, da ogrozi celovitost bakterijske membrane in kemične lastnosti tega nizko molekulsko maso spojine, ki prevaja znižati stroške sinteze v primerjavi z kationski antibakterijske peptide kažejo, da imajo CSA-13 ali morda druge ceragenins potencial za zdravljenje H. pylori
okužba, vključno s tistimi, s svojimi odpornih sevov povzročil.
Zaključek
baktericidno aktivnost ceragenin CSA-13 se ohranijo po predinkubacija v simuliranem želodčnem soku in v prisotnosti mucin. To vitro
ocena kaže na velik potencial te molekule v zdravljenju okužbe želodčne sluznice.
Metode
Antibakterijska sredstva
LL-37 (NH 2-LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES-COOH) in WLBU2 ( NH 2-RRWVRRVRRWVRRVVRVVRRWVRR-COOH) peptidi so bili kupljeni od Bachem (King of Prussia, PA). CSA-13 smo pripravili kot je opisano predhodno [34]. Amoksicilin (AMX), klaritromicin (CLR), tetraciklin (TET) in metronidazol so bili kupljeni od Sigme.
Zbirka želodčnih sluznice in žolčnih vzorcev
Med gastroskopijo, ki se izvaja bodisi z GIF V2 ali Q145 (Olympus) gastroskop, več želodčne rezine sluznice so bili odvzeti iz prepyloric in corpus regijah želodcu. H. pylori
okužba je bila ustanovljena na biopsijo, ki uporabljajo test ureaze (CLO-test). Human žolč smo dobili od žolčniku pri bolnikih z holecistektomijo. Vzorce smo filtra sterilizirali skozi 0,45 pm membrane, nato pa razredčimo v PBS (1: 1) in zmešamo z protibakterijskih zdravil, ki se uporabljajo v bakterijah ubijanje testih. Študije so bili potrjeni s Medical University odbora Bialystok etiko za raziskave na ljudeh in živalih, in vsi bolniki so dali pisno soglasje za sodelovanje v raziskavi.
Imunohistokemične študije
so Imunohistokemične študije, opravljene v formalin-fiksno, paraffin- vgrajeni človeške želodčne sluznice odsekov uporabljajo zajec anti-LL-37 protitelesa (H-075-06, ki se uporablja pri 1: 100 razredčitve; Phoenix Pharamceuticals Inc.). -Parafin vgrajeni materiali so bili v prerezu na debelino 5 um in plavala na destilirano vodo pri 45 ° C. Odseki so nato nameščena na stekelca in damo v 57 ° C peči preko noči. Odseki smo deparaffinized skladu s standardnimi postopki in pogasimo z 0,9% vodikovega peroksida v metanolu za 30 minut. Oddelki inkubiramo s primarnim protitelesom pri 37 ° C za 60 minut, izperemo z 1% PBSA (1% BSA v PBS), in izpostavimo vezavo s sekundarnim protiteles (Biotinilirana kozje anti-kunčje IgG, 1: 400 redčenje). Amplification smo izvedli s kompletom za Vectastain ABC, in sistem za odkrivanje HRP je bila uporabljena za colocalize peroksidaze dejavnost z DAB podlago. Oddelki so jih nasprotno z hematoksilinom. Vzorci so bili gledati z Nikon Eclipse 80 mikroskopom manj kot 40-kratni povečavi.
Ocena MIC in MBC
minimalno inhibitorno koncentracijo (MIC) konvencionalnih antibiotikov proti sedmih različnih kliničnih izolatov H. pylori
(9 x 10 8 CFU /ml) je bila določena z Muller-Hinton agar (MH), ki vsebuje 5% ovčjo kri. Inkubacijo nadaljujemo 4 dni pri 35 ° C v mikroaerofilnih pogojih vzdrževalo z uporabo plinsko Pack-Campylobacter generiranje plin kit BR60. Klinični izolatov H. pylori
je štelo odporni na posamezne antibiotike, ko so bile vrednosti MIC nad 4 ug /ml za AMX, 1 ug /ml CLR in 16 mikrogramov /ml za TET in metronidazolom. Minimalno baktericidno koncentracijo (MBC) protibakterijskih zdravil je bila ocenjena s pomočjo inokulum na 10 8 CFU /ml. Po 6-urni inkubaciji pri 37 ° C, je bilo 10 ml alikvoti opustitve, opazili na Columbia agar z dodatkom ovčje krvi (5%).
Bakterije ubijanje testa
bakterijska dejavnosti LL-37, WLBU2 peptidov in ceragenin CSA-13 proti E. coli
MG1655 v prisotnosti mucin ali pepsina iz prašičjega sluzi (Sigma) in humanega žolča smo izmerili kot je opisano predhodno [35]. Bakterije smo gojili na fazo sredine log pri 37 ° C (z oceno optične gostote pri 600 nm kontrolirano) in resuspendiramo v PBS pufra (pH = 7,4). Prekinitve bakterije so bile nato razredčimo 10-krat v 100 ul raztopin, ki vsebujejo protibakterijskih učinkovin, ki jih sami ali s mucin (1000 g /ml), ali žolča (končna 01:10 žolčnih posnema redčenja okolje zgornjega tankega črevesa, v katerega žolč je izločajo [36] (pH = 7,4)). V drugi seriji eksperimentov so antibakterijska aktivnost teh komponent določimo po njihovi predinkubacija v simuliranem želodčnem soku [36, 37] pri pH ~ 1.5 z in brez pepsina (0,5 mg /ml). Po inkubiranju bakterije z antibakterijskimi molekulami za eno uro pri 37 ° C, so bakterijske suspenzije damo na led in razredčili 10- do 1000- krat. Alikvote vsako razredčitev (10 ul) smo opazili na LB agarske plošče, nočne kulturi pri 37 ° C. Število kolonij na vsaki razredčitvi je preštetih naslednje jutro. Enote, ki tvorijo kolonije (CFU /ml) posameznih vzorcev so bili določeni s faktorjem redčenja.
Masne spektrometrije
Analitični karakterizacijo smo izvedli na podvozju DSP-13 in LL-37 po 3H inkubaciji z pepsina (0,5 mg /ml) pri nizkem pH (~ 1,5), pri 37 ° C, z uporabo Shimadzu (Columbia, MD) instrument (sistem LC-MS sestavljen iz sistema topil dostave LC-20AB in SIL-20A samodejno vzorčevalnik sklopljen dvojna valovna dolžina UV-Vis detektor in LCMS 2010EV enojni štiripolni masni spektrometer), spojen z Shimadzu O C18 koloni (150 mm x 4.6 mm iD, 5 um velikosti delcev). Pretok mobilne faze je 1 ml /min z začetnim razmerjem 90% mobilne faze A (voda) in 10% mobilne faze B (acetonitril), obe s 0,1% (v /v) mravljično kislino. Analitska metoda, sestavljen iz naslednjih korakov: (i) injiciranjem vzorca in drži na 10% B za 5 minut, (ii) linearnim gradientom od 10% do 90% B nad 15 minut, (iii) drži na 90% B za 5. minut (iv) izokratično korak 10% B in držanje 5 minut pred naslednjo injekcijo vzorca. Masne spektrometrije je bila izvedena na eluentom uporabo elektrorazpršilno ionizacijo (ESI) v pozitivnem načinu ionov z skenirani m /z razponu od 160-2000.
Lizo eritrocitov
hemolitično aktivnost LL-37, WLBU-2 in CSA-13 (0-200 μ
g /ml), proti je bilo človeških rdečih krvnih celic (RBC) preskušajo z eritrocitov suspendiranih v PBS. RBC pripravimo iz sveže krvi (Hematokrit ~ 5%), inkubiramo 1 uro pri 37 ° C po dodatku testnih molekul. Relativna koncentracija hemoglobina v supernatantih po centrifugiranju pri 2000 x g smo spremljali z merjenjem absorbance pri 540 nm. 100% hemolize vzeta iz vzorcev, v kateri je 2% dodali Triton X-100
celična kultura
človekove želodčne adenokarcinom celic. (ATCC; CRL-1739) so bile vzdrževane v DMEM (BioWhittaker) kulture, dopolnjenem z 10% toplote -inactivated fetalni goveji serum (Hyclone) pri 37 ° C in 5% CO 2. Za LDH so test za javnost in vrednotenja celice mikroskopom, prevlečeno s 24 vdolbinicami in zrasel do sotočja. V vseh poskusih smo medij spremenjen v mediju brez seruma ~ 12 ur pred celično zdravljenje s LL-37, WLBU2 in CSA-13 (0-200 ig /ml) v posamezne vdolbinice za 1 uro. Gojišče celične kulture smo nato zbrali, centrifugirali (10 min, 5000 rpm, RT) in izpostavi ocenjevanja LDH (LDH-citotoksičnosti Vsebnost Kit; BioVision Inc.)
deklaracij
Zahvala
je to delo podpira NIH odobri HL067286 in Medical University of Bialystok podeljuje 3-22458F in 3-18714L
Avtorji "prvotna predložiti datoteke za slike
Spodaj so povezave do avtorjev prvotna predloženih spisov za slike. "Izvirno datoteko na sliki 1 12866_2009_858_MOESM2_ESM.pdf avtorjev 12866_2009_858_MOESM1_ESM.pdf avtorjev prvotni datoteki številka 2 12866_2009_858_MOESM3_ESM.pdf avtorjev prvotne datoteke za sliko 3 12866_2009_858_MOESM4_ESM.pdf avtorjev izvorne datoteke za sliko 4 12866_2009_858_MOESM5_ESM.pdf avtorjev prvotni datoteki sliki 5 konkurenčnih interesov
dr P. Savage je plačan svetovalec za Ceragenix Pharmaceuticals, naravni imunski Inc., in WittyCell. Nobena od raziskav so poročali v tem prispevku, je bil podprt s Ceragenix Pharmaceuticals ali s katerim koli drugim gospodarskim subjektom. Drugi avtorji: nihče naj ugotovi
.
 Apoptoza je pomemben posrednik patogeneze pri okužbi s koronavirusom pri živalih
Apoptoza je pomemben posrednik patogeneze pri okužbi s koronavirusom pri živalih
 Funkcionalne gastrointestinalne motnje
Funkcionalne gastrointestinalne motnje
 Kakšni so simptomi kandide v črevesju? 6 Vzroki
Kakšni so simptomi kandide v črevesju? 6 Vzroki
 Bolečine v želodcu – Kdaj k zdravniku | Arshad Malik, MD
Bolečine v želodcu – Kdaj k zdravniku | Arshad Malik, MD
 Črevesne bakterije, povezane z močnejšimi mišicami pri starejših
Črevesne bakterije, povezane z močnejšimi mišicami pri starejših
 Kaj me je naučil dr. Tom O'Bryan o motnjah, povezanih z glutenom
Kaj me je naučil dr. Tom O'Bryan o motnjah, povezanih z glutenom
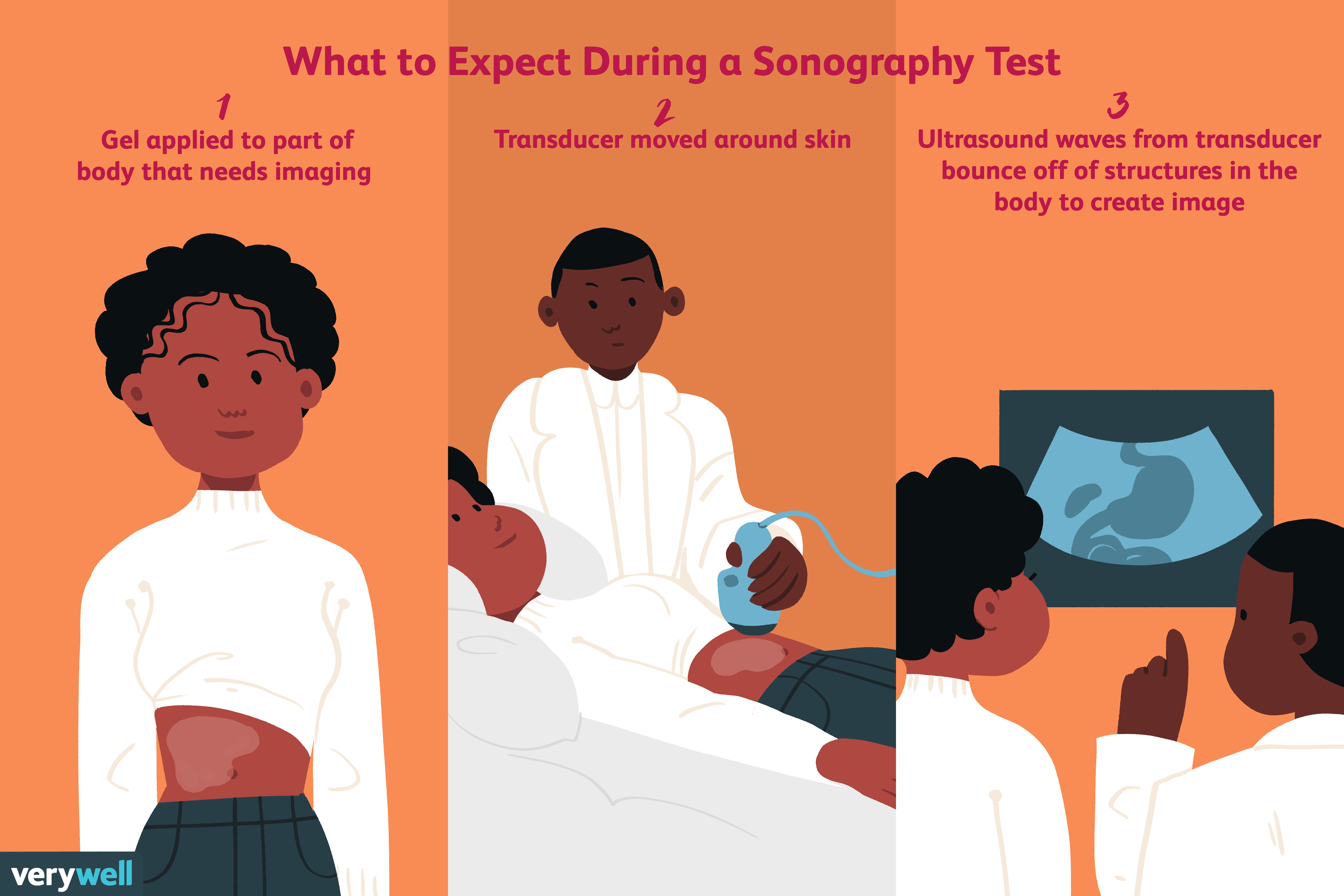 Kaj je sonografija?
Sonografija je diagnostični medicinski test, ki uporablja visokofrekvenčne zvočne valove, imenovane tudi ultrazvočni valovi, da se odbijejo od struktur v telesu in ustvarijo sliko. Primerno je, da se
Kaj je sonografija?
Sonografija je diagnostični medicinski test, ki uporablja visokofrekvenčne zvočne valove, imenovane tudi ultrazvočni valovi, da se odbijejo od struktur v telesu in ustvarijo sliko. Primerno je, da se
 Prostatitis proti BPH (povečana prostata):kakšna je razlika?
Hitra primerjava razlik in podobnosti prostatitisa in BPH Večina moških, starejših od 50 let, ima nekaj povečanja prostate zaradi proliferacije celic, ki sestavljajo prostato. . Večina teh moških i
Prostatitis proti BPH (povečana prostata):kakšna je razlika?
Hitra primerjava razlik in podobnosti prostatitisa in BPH Večina moških, starejših od 50 let, ima nekaj povečanja prostate zaradi proliferacije celic, ki sestavljajo prostato. . Večina teh moških i
 Recept za toplo zimsko ohrovtsko solato
Kakšen način za začetek praznovanja dneva Avstralije kot z eno od naših najljubših sestavin v našem receptu za toplo zimsko ohrovt ? Ohrovt je prava elektrarna in je poln hranilnih snovi ter vitaminov
Recept za toplo zimsko ohrovtsko solato
Kakšen način za začetek praznovanja dneva Avstralije kot z eno od naših najljubših sestavin v našem receptu za toplo zimsko ohrovt ? Ohrovt je prava elektrarna in je poln hranilnih snovi ter vitaminov