NMDA såvel som andre nitrosamin urenheder er blevet undersøgt i et stykke tid nu af FDA især i blodtryksmedicin kaldet Angiotensin II Receptor Blockers. Høje niveauer af nitrosaminer har ført til tilbagekaldelse af flere mærker af disse lægemidler. På nuværende tidspunkt er niveauerne af nitrosaminer påvist i mærker af ranitidin lave, og FDA vil frigive erklæringer om tilbagekaldelse. Dette var en advarselsrapport.
Rapporten siger, ”Patienter bør kunne stole på, at deres medicin er så sikre, som de kan være, og at fordelene ved at tage dem opvejer enhver risiko for deres helbred. Selvom NDMA kan forårsage skade i store mængder, de niveauer, FDA finder i ranitidin fra foreløbige tests, overstiger næsten ikke de mængder, du kan forvente at finde i almindelige fødevarer. ”
Ranitidine er et meget udbredt håndkøbs- og receptpligtigt lægemiddel, der tilhører H2 (histamin-2) blokker af lægemidler og er nyttig til at reducere syresekretionen i maven. Det bruges til behandling af halsbrand, syreindtagelse osv. Recept ranitidin bruges til behandling af syrepeptisk lidelse, mavesår og duodenalsår forebyggelse og behandling og behandling af GERD (gastroøsofageal reflukssygdom).
Fra nu af ser FDA på kilden til NDMA i ranitidinfremstilling og håber, at hvis den fjernes, stoffet kunne erklæres sikkert igen. Rapporten siger, ”FDA vil træffe passende foranstaltninger baseret på resultaterne af den igangværende undersøgelse. Agenturet vil give flere oplysninger, når det bliver tilgængeligt. ”
Advarslen gentager, at personer ikke må stoppe med at tage ranitidin baseret på denne advarsel. Personer, der ønsker at afbryde deres ranitidinrecepter, skal tale med deres læger om alternative behandlingsmuligheder, siger FDA.
FDA tilføjede i advarslen, "Forbrugere og sundhedspersonale bør rapportere eventuelle bivirkninger med ranitidin til FDA's MedWatch -program for at hjælpe agenturet med bedre at forstå problemets omfang." De beder forbrugerne om at udfylde og indsende en rapport online på www.fda.gov/medwatch/report.htm og udfylde den relevante formular og indsende via fax på 1-800-FDA-0178.
Den 24. september, FDA udsendte igen en advarsel, der advarede sundhedspersonale og patienter om, at de havde tilbagekaldt 14 masser af receptpligtige ranitidinkapsler distribueret af Sandoz Inc. Denne tilbagekaldelse skyldtes mængderne af NDMA fundet i partierne.
Fungerende FDA -kommissær Ned Sharpless, M.D., i en erklæring sagde, ”FDA er forpligtet til at sikre, at den medicin, amerikanerne tager, er sikker og effektiv. Vi begyndte at teste ranitidinprodukter umiddelbart efter at vi fik at vide om den potentielle urenhed. Når vi identificerer tab af kvaliteten af lægemidler, der udgør potentielle risici for patienter, FDA gør alt for at forstå problemet og give vores bedste anbefaling til offentligheden så hurtigt og præcist som muligt. ” ”Vi vil fortsætte med at undersøge og arbejde for at sikre, at denne form for urenheder ikke overskrider acceptable grænser, så patienter kan fortsætte med at tage den medicin, de har brug for, uden bekymring, " han tilføjede.
I den anden rapport gav FDA oplysninger til patienter og sundhedspersonale om ranitidin produceret af Sandoz og sagde, at hvis patienten var på en af de tilbagekaldte lægemidler, han eller hun bør følge tilbagekaldelsesinstruktionerne på FDA's websted. Rapporten tilføjede, at de patienter, der ikke er ikke-tilbagekaldte mærker af ranitidin, fortsat kan gøre det. Rapporten tilføjede, "Det er vigtigt at huske, at ikke alt ranitidin, der markedsføres i USA, tilbagekaldes." Rapporten sagde, at patienter, der tager OTC ranitidin, kan overveje andre alternativer til deres symptomer.
Janet Woodcock, M.D., direktør for FDA’s Center for Drug Evaluation and Research, i en erklæring sagde, ”Vi fortsætter vores undersøgelse sammen med vores internationale kolleger, og vi vil holde den amerikanske offentlighed informeret om yderligere tilbagekaldelser samt de potentielle risici ved at tage ranitidinprodukter. ”
For at opdage niveauerne af NDMA har FDA udsendt en protokol for tilsynsmyndighederne og producenterne. Niveauerne af NDMA i ranitidin fremstillet af disse producenter skal rapporteres af dem ved hjælp af disse tests. Yderligere skal de sende prøverne til FDA til test af forskerne ved agenturet.
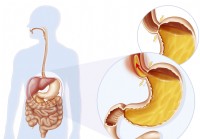 Alt om alle lukkemusklerne i din krop
Sphinctere er specielle, cirkulære muskler, der åbner og lukker bestemte kropsdele. Oftest er en lukkemuskels handling at regulere passagen af en slags væske, såsom galde, urin eller fækalt material
Alt om alle lukkemusklerne i din krop
Sphinctere er specielle, cirkulære muskler, der åbner og lukker bestemte kropsdele. Oftest er en lukkemuskels handling at regulere passagen af en slags væske, såsom galde, urin eller fækalt material
 Lavere risiko for tarmobstruktion med mindre invasiv kirurgi:Undersøgelse
Seneste fordøjelsesnyt Når nyretransplantation mislykkes, er det bedst at prøve igen Lad ikke halsbrand ødelægge din feriefest Efterspørgslen efter levertransplantation stiger kraftigt Lavdosis CT-sc
Lavere risiko for tarmobstruktion med mindre invasiv kirurgi:Undersøgelse
Seneste fordøjelsesnyt Når nyretransplantation mislykkes, er det bedst at prøve igen Lad ikke halsbrand ødelægge din feriefest Efterspørgslen efter levertransplantation stiger kraftigt Lavdosis CT-sc
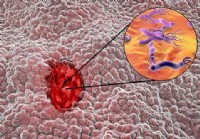 Hvordan ved du, om du har et sår?
Hvad er et sår? Et sår er et sår, der opstår i mavens indre slimhinde eller øvre tyndtarm. Det mest almindelige symptom på et mavesår er en sløv eller brændende smerte i maven, mellem navlen og bry
Hvordan ved du, om du har et sår?
Hvad er et sår? Et sår er et sår, der opstår i mavens indre slimhinde eller øvre tyndtarm. Det mest almindelige symptom på et mavesår er en sløv eller brændende smerte i maven, mellem navlen og bry