Dieses Experiment wurde entworfen, um die Lokalisierung und neurochemischen Phänotypisierung von sympathischen Neuronen versorgen präpylorischen Bereich des Schweinemagen in einem physiologischen Zustand und während der Acetylsalicylsäure (ASS) induzierte Gastritis zu etablieren. Um die sympathische Perikarya den Mägen der beiden Kontrolle und Acetylsalicylsäure behandelt (ASS-Gruppe) wurden die Tiere mit neuronalen retrograden Tracers Fast Blue (FB) zu lokalisieren injiziert. Sieben Tage nach der FB-Injektion wurden die Tiere unterteilt in eine Steuer- und ASA-Supplementierung Gruppe. Die ASS-Gruppe betrug 100 mg /kg Körpergewicht gegeben ASA oral für 21 Tage. Auf dem 28 th Tag alle Schweine wurden mit einer schrittweisen Überdosis des Anästhetikums eingeschläfert. Dann vierzehn Mikrometer dicke Cryostatschnitten wurden für die herkömmliche Doppelmarkierungs Immunofluoreszenz verarbeitet, gerichtet primären Antiseren unter Verwendung von gegenüber Tyrosin-Hydroxylase (TH), Dopamin β-Hydroxylase (DβH), Neuropeptid Y (NPY), Galanin (GAL), neuronale Stickstoffmonoxid -Synthase (nNOS), leu 5-Enkephalin (lenk), Kokain- oder Amphetamine regulierte Transkript Peptid (CART), Calcitonin-Gen-verwandtes Peptid (CGRP), Substanz P (SP) und vasoaktive intestinale Peptid (VIP). Die Daten in dieser Studie zeigen, dass postganglionären sympathischen Nervenfasern präpylorischen Bereich des Schweinemagen stammen aus der Zöliakie-Schädel-Ganglion mesentericum Komplex (CCMG) zu liefern. In Kontrolltieren zeigten sich die FB-markierten Neuronen TH (94,85 ± 1,01%), DβH (97,10 ± 0,97%), NPY (46,88 ± 2,53%) und GAL (8,40 ± 0,53%). In ASA Gruppe wurden TH- und DβH- positive Nervenzellen reduziert (85,78 ± 2,65% und 88,82 ± 1,63% beziehungsweise). Darüber hinaus führte ASA- induzierte Gastritis bei erhöhten Expression von NPY (76,59 ± 3,02%) und GAL (26,45 ± 2,75%) sowie der novo-Synthese von nNOS (6,13 ± 1,11%) und LENK (4,77 ± 0,42%) in verfolgt CCMG Neuronen. Zusätzlich wird ein Netzwerk von cart-, CGRP-, SP-, VIP-, Lenk-, nNOS- immunoreaktive (IR) Nervenfasern, die FB-positive Perikarya umschließenden wurden in beiden intakt und ASA-behandelten Tieren beobachtet. Die Ergebnisse dieser Studie zeigen, Beteiligung dieser Neuropeptide in der Entwicklung oder vermutlich Gegenwirkung von Magenentzündung Citation. Palus K, Całka J (2015) Der Einfluss von Längerer Acetylsalicylsäure Supplementation-induzierte Gastritis auf der Neurochemie von die Versorgung der Sympathische Neurons präpylorischen Region des Schweinemagen. PLoS ONE 10 (11): e0143661. doi: 10.1371 /journal.pone.0143661 Herausgeber: Michael Bader, Max-Delbrück-Centrum für Molekulare Medizin (MDC), DEUTSCHLAND Empfangen: 16. August 2015; Akzeptiert: 6. November 2015; Veröffentlicht: 25. November 2015 Copyright: © 2015 Palus, Całka. Dies ist ein offener Zugang Artikel unter den Bedingungen der Lizenz Creative Commons Attribution verteilt, die uneingeschränkte Nutzung erlaubt, die Verteilung und Vervielfältigung in jedem Medium, vorgesehen sind der ursprüngliche Autor und Quelle genannt Datenverfügbarkeit: Alle relevanten Daten sind innerhalb der Papier Finanzierung:. Veröffentlichung durch die Zahl für wissenschaftliche Forschung staatliche Komitee polnischen unterstützt 1890 /B /P01 /2010/39, der 15,610 gewähren die Universität von Ermland und Masuren in Olsztyn (gesetzliche Forschung). 003-300 und KNOW (Leading National Research Centre) Scientific Consortium "Gesunde Tiere - Safe Food", Beschluss vom Ministerium für Wissenschaft und Hochschulbildung Nr 05-1 /wissen2 /2015 Interessen im Wettbewerb: die Autoren. erklärt haben, dass keine Interessenkonflikte bestehen. Einführung die vergangenen 30 Jahre haben in Studien der Innervation des Magen-Darm-Trakt immer schneller Fortschritte gezeigt. In der Regel werden die Magen- und Darm innervated beide von Neuronen innerhalb intramuralen ganglia gefunden und gehören somit zu enterische Nervensystem (ENS) [1, 2], sowie durch extrinsische Zellkörper Ursprung in sympathischen, parasympathischen und sensorischen Ganglien [3- 5]. Neuere Untersuchungen haben gezeigt, dass sympathischen Ganglien sind nicht nur Zentren der Nerven Integration, sondern auch den Besitz von wichtigen Eigenschaften, die durch ihre Neuronen. Unter anderem gehören sie die Konvergenz der zentralen Impulse, Projektion der viszeralen Impulse an den prä- und postsynaptischen Ebenen, den Zugriff auf /unter Berücksichtigung der zentralen Fasern des viszeralen Schutz und Schrittmacheraktivität [6, 7]. Allerdings sympathischen postganglionären Neuronen, die den Magen-Darm-Trakt liefern nicht direkt auf seine Funktionen beeinflussen, aber ihre Effekte durch die ENS ausüben [8, 9] oder die Arterien verengen, die das Verdauungsorgan [10] liefern. Darüber hinaus wird der Magen-Funktion von vielen neuronalen Sendern und Neuropeptide vermittelt und moduliert, die eine Rolle bei der Regulierung der Motilität spielen, Säuresekretion, Hormonfreisetzung, lokale Durchblutung und Schleimhaut Abwehrmechanismen [3]. Es gibt eine große Menge an veröffentlichten Studien beschreiben sympathischen Innervation des Magens, basiert vor allem auf kleinen Labortieren, wie Ratte [10-12], Maus [13, 14], Meerschweinchen [15, 16], Kaninchen [17] oder Haustieren, wie Hund [7] und Katze [18, 19]. Die Autoren berichten, dass prävertebralen Ganglien zB. Zöliakie-Ganglion bilden die Hauptquelle der postganglionären sympathischen Innervation der Baucheingeweide. Während nur einzelne Perikarya wurden in Grenzstrangganglion zB gefunden. sympathischen Kette Ganglien [16, 20]. Bisher ist relativ wenig über Innervation des Magens in den Hausschwein bekannt, die eng, dass in Bezug auf anatomische und physiologische Eigenschaft in der menschlichen ähneln [21, 22]. Frühere Studien auf dem Gebiet beschreiben nur die extrinsische Innervation von Dünn- und Dickdarm [4, 20] oder konzentrieren sich auf die enterale Nervensystem [23, 24]. Das autonome Nervensystem zeichnet sich durch hohe Plastizität in Reaktion gekennzeichnet zu verschiedenen pathologischen Stimuli, und die Fähigkeit, an die sich ändernden Umgebungsbedingungen [25, 26] anzupassen. Diese Anpassung beinhaltet die durch eine erhöhte Expression einiger Neurotransmitter und reduziert anderer oder Aktivierung der Expression von zuvor inaktiven Gene [26, 27] in der chemischen Phänotyp von Neuronen zu verändern. In den letzten Jahren besteht eine zunehmende Menge an Literatur ist seit beschreibt Änderns der chemischen Codierung von sympathischen Neuronen den Gastrointestinaltrakt während Ileitis Zuführen [20], proliferative Enteropathie [28], Kolitis [4] und Axotomie [29-31]. Darüber hinaus schlagen einige Autoren, dass sympathischen Neuronen nicht nur ihre chemische Eigenschaft zu ändern, sondern zeigen auch die Fähigkeit, sich zu regenerieren [32]. Interessanterweise deuten einige Autoren, dass sympathische Nervensystem eine Rolle als Modulator der Magen-Darm-Entzündung spielen, weil sympathischen Neuronen lymphatischen Gewebe liefern. Darüber hinaus wurden die Anwesenheit der Rezeptoren für die sympathischen Neurotransmitter in Immunzellen bestätigt [33]. Acetylsalicylsäure, auch Aspirin (ASS) bekannt, ist eines der am häufigsten verwendeten nicht-steroidale entzündungshemmende Medikamente (NSAIDs) weltweit und ist besonders für seine therapeutischen Eigenschaften bewertet. Die Vorteile der breiten therapeutischen Möglichkeiten, wie die Prävention von Herz-Kreislauf-Erkrankungen, Behandlung von Symptomen der Vielzahl von entzündlichen Erkrankungen, Anti-Tumor-Aktivität oder Schmerzlinderung sind seit vielen Jahren bekannt [34]. Aspirin verhindert Prostaglandinsynthese durch das Enzym Cyclooxygenase (COX) über irreversible Acetylierung der Hydroxylgruppe von 1 Serinrest Hemmung [35, 36]. COX genannt auch als Prostaglandin endoperoxidase Synthase ist ein membrangebundenes Hämoprotein und Glykoprotein-Enzym, die die Umwandlung von Zellmembran Phospholipide katalysiert, bei der Synthese der Prostanoide beteiligt umfassend: Prostaglandin (PG), Prostacyclin (PGI) und die Thromboxane (TXA) und existiert als 3-Isoformen (COX-1, -2 und -3) [34, 37]. Eicosanoide, aus einer Reaktion von COX-1, sind in der Plättchenaggregation beteiligt katalysierten abgeleitet, der Schutz der Magenschleimhaut, und viele andere physiologische Prozesse, während die mit der Teilnahme von COX-2 gebildet nur in der Entwicklung der Entzündungsreaktion beteiligt sind. COX-3 ist ein post-transkriptionalen Modifikation von COX-1 im Zentralnervensystem auftreten [38]. Aspirin ein nicht-selektives NSAID und inhibiert die enzymatische Aktivität von COX-1 mehrere hundertmal mehr effektiv, verglichen mit dem COX-2 [38, 39]. Tatsächlich seine Wirkung führt sowohl nützlich (fiebersenkend und entzündungshemmend) und toxisch (Magen-Darm-Verletzungen) Effekte [40]. Selbst kleine Dosis von Aspirin induziert oberflächliche Verletzungen im Magen-Epithel und führt zu abnormalen Ionenfluss mit erhöhter H + Rückdiffusion. Darüber hinaus ist die Hemmung der COX-1, was zu Mangel an Prostaglandinen (PGs) in Magen- und Darmschleimhaut, als Hauptmechanismus der Schleimhaut Schäden übernommen, die gehören Blutungen, Erosionen und Ulzerationen [41]. Diese Schäden treten am häufigsten in der Human Antrum und präpylorischen Bereich, obwohl sie auch in den proximalen Teil des Duodenums [34] zu sehen. Außerdem verringerte Pegel von Prostaglandin E2 (PGE2) setzt die Schleimhaut durch Salzsäure und Galle verursachte Schäden und verringert die Fähigkeit der Regeneration von Schleimhautzellen durch Freisetzung von Schleim abnimmt, eine Hemmung von oberflächenaktiven Mitteln und Phospholipiden Synthese, Verringerung der Sekretion von HCO 3 und Störungen des Blutflusses in der Mikrozirkulation [40, 42]. Derzeit ist der Einfluss von Aspirin-induzierten Gastritis auf adaptive Prozesse und neurochemischen Eigenschaften von sympathischen Neuronen Magen Versorgung eher fragmentarisch Aus diesem Grund wurde dieses Experiment entworfen, um festzustellen: 1.) Die Lokalisation und Verteilung von sympathischen Neuronen versorgen präpylorischen Bereich des Magens in Hausschwein; 2) die neurochemischen Phänotyp zurückverfolgt perykarya in physiologischen Zustand; 3) mögliche Veränderungen der neurochemischen Kodierung verfolgt Neuronen während Gastritis bei längerer Acetylsalicylsäure Supplementierung induziert. Ethik Statement Das experimentelle Verfahren einschließlich Einschläferung wurde genehmigt durch die lokale Ethikkommission für Tierversuche an der Universität von Ermland nad Mazury in Olsztyn (Ausweis-Nummern 05/2010). Alle Operation wurde unter Natrium Thiopental durchgeführt, und alle möglichen Anstrengungen unternommen wurden das Leiden der Tiere zu minimieren. Die Studie wurde auf zehn jugendlichen weiblichen Schweinen des Large White Polish durchgeführt Rasse, etwa 8 Wochen alt und mit einem Gewicht von ca. 20 kg. Die Tiere wurden unter normalen Lichtverhältnissen in einer temperaturgeregelten Umgebung gehalten. Sie wurden von kommerziellen Getreidemischung und Leitungswasser ad libitum Danach wurden die Schweine randomisiert einer von zwei Versuchsgruppe zugeordnet. Kontrolle (C-Gruppe, n = 5) und ASS-Gruppe ( n = 5). vor der Fütterung; (100 mg /kg Körpergewicht Acetylsalicylsäure, BAYER), 1 h die Tiere ASA Gruppe bildet, ab dem siebten Tag nach der FB Injektion wurden Acetylsalicylsäure oral gegeben. Gastroskopie Untersuchung wurde durchgeführt, Läsionen in der Magenschleimhaut bei Tieren, von ASS-Gruppe in den ersten Tag auszuschließen und die Gastritis durch ASA-Behandlung in den letzten Tag des Aspirin-Supplementierung (unter Verwendung eines Video-Endoskop Olympus GIF 145 mit Arbeitslänge 1030 verursacht zu bestätigen mm und einem Durchmesser 9,8 mm). nach der 4-Wochen-Überlebenszeit (21 st Tag der ASA-Behandlung), wurden sowohl Steuerung als auch ASA Schweine tief reanaesthetized und durch eine Überdosis von Natrium-Thiopental geopfert. Dann wurden sie transkardial mit 4% gepuffertem Paraformaldehyd (pH 7,4) perfundiert. Gastritis bei Tieren von ASA-Gruppe wurde durch histopathologische Untersuchung von Fragmenten des präpylorischen Magenwand nach Perfusion (unter Verwendung von Routinemethoden histopathologischen) gesammelt bestätigt. Im Anschluss an die Perfusion wurden die folgenden Gewebe gesammelt: die Zöliakie-Schädel-Ganglion mesentericum Komplex (CCMG) (auch bekannt als die Zöliakie-mesenterica superior Ganglion-Komplex (CSMG)); Brust-, Lenden- und Becken sympathischen Kettenganglien (schg), Schädel- und mittleren zervikalen Ganglion, Neben Ganglien, kleine Ganglien der intermesenteric und Nieren-Geflechte, Schwanz- mesenteric Ganglien (CAMG). Gesammelte Gewebe wurden nachfixiert durch Eintauchen in der gleichen Fixativ für 20 Minuten in Phosphatpuffer gespült (pH 7,4) über drei Tage und schließlich in 30% gepuffertem Saccharoselösung gelagert wurden, bis sie an den Boden des Behälters für eine weitere Verarbeitung sank . Immunhistochemie und Statistiken Vierzehn-um dicke Cryostatschnitten der Gewebeproben wurden unter einem Fluoreszenzmikroskop (51, Olympus, Polen Olympus BX) analysiert, mit einem Filter ausgestattet geeigneten set für Beobachtung von FB, zu lokalisieren und sympathischen Neuronen mit dem Tracer zählen. Um die relative Anzahl der FB-positive Perikarya bestimmen, die Neuronen wurden in jedem vierten Abschnitt gezählt. Nur Neuronen mit dem deutlich sichtbaren Kern berücksichtigt. Dann werden ausgewählte Abschnitte mit FB-markiertem Perikarya wurden für Routinedoppelmarkierungs Immunofluoreszenz-Technik verarbeitet, primäre Antiseren in verschiedenen Arten und Spezies-spezifischen Sekundärantikörper (Tabelle 1) angehoben werden. Kurz gesagt, nach dem Lufttrocknen bei Raumtemperatur für 45 min. und in 0,1 M phosphatgepufferter Kochsalzlösung (PBS, pH 7.4., 3 x 10 min) steigt, die Abschnitte wurden mit einem Gemisch blockiert, das 10% Pferdeserum und 0,1% Rinderserumalbumin in 0,1 M PBS, 1% Triton X- 100, 0,05% Thimerosal und 0,01% Natriumazid für 1 h bei Raumtemperatur nicht-spezifische Hintergrundfärbung zu reduzieren. in PBS nach dem Spülen (3 x 10 min.) wurden die Schnitte über Nacht bei Raumtemperatur mit primären Antiseren gegen Tyrosinhydroxylase (TH), Dopamin-β-hydroxylase (DβH), Neuropeptid Y (NPY), Galanin (GAL) inkubiert, neuronaler Stickstoffmonoxid-Synthase (nNOS), leu 5-Enkephalin (lenk), Kokain- oder Amphetamine regulierte Transkript Peptid (CART), Calcitonin-Gen-verwandtes Peptid (CGRP), Substanz P (SP) und vasoaktive intestinale Peptid (VIP) ( Tabelle 1). Nach anschließender Spülung in PBS (3 x 10 min.) Wurden die Schnitte mit einem Gemisch aus sekundären Antikörpern (Tabelle 1) für 1 h bei Raumtemperatur inkubiert primäre Antikörper in dieser Studie verwendet zu visualisieren. Nach der Färbung wurden die Schnitte mit Karbonat-gepufferte Glycerin (pH-Wert 8,6) und Deck schlüpfte montiert. Standardkontrollen, dh Präabsorption für das Neuropeptid-Antiseren mit geeigneten Antigen (20 ug Antigen /ml verdünntem Antiserum, alle Antigene erworben von Peninsula, Sigma oder AbD Serotec) und der Auslassung sowie die Ersetzung aller primären Antiseren durch nicht-immune Seren wurden ausgeführt, um die immunhistochemische Markierung zu testen. Es gab keine Fluoreszenz in all diesen Kontroll Färbungen zu erkennen, was die Spezifität der Methode und Antikörper angewendet bestätigt. Die Schnitte wurden dann unter einem Olympus BX51 Mikroskop untersucht, ausgerüstet mit Filtern für AlexaFluor 488, AlexaFluor 546, und Fast Blue, und Bilder wurden mit einer Digitalkamera an einen PC angeschlossen erfasst, ausgestattet mit Olympus Zelle F Bildanalysesoftware (Olympus, Tokyo, Japan). Die Abschnitte für die gleiche Kombination von Antigenen auf quantitative Untersuchungen zugeordnet gefärbt wurden von mindestens 100 &mgr; m, getrennt doppelt Analyse neuronaler somata vermeiden. Die Anzahl der FB-positive Perikarya für jede Kombination von Antikörpern zählte, war über 200 Neuronen pro Tier. Die Daten aus beiden Gruppen wurden gesammelt, statistisch Statistica analysiert unter Verwendung von 10-Software (StatSoft Inc., Tulsa, OK, USA), und wurden als Mittel ± Standardabweichung vom Mittelwert (SEM) dargestellt. Signifikante Unterschiede wurden unter Verwendung des Student-t-Test für unabhängige Stichproben ausgewertet (* P < 0,05 und ** P < 0,001). Ferner ist für semi-quantitative Bewertung der Dichte von Nervenfasern immunoreaktiv zu jeder Substanz untersucht, eine willkürliche Skala wurde verwendet, wobei (-) - Abwesenheit von Fasern; (+) - Einzelfasern; (++) - Seltene Nervenfasern; (+++) - Stellt eine sehr dichte Nervenfasern Ergebnisse
Materialien und Methoden
Tiere und chirurgische Verfahren
zugeführt. Alle wurden die Tiere preanesthetized mit Azaperon (Stresnil, Jansen Pharmaceutica NV, Belgien, 4 mg /kg Körpergewicht, im) 15 Minuten vor der Anwendung des Haupt Betäubungsmittel, Natrium Thiopental (Thiopental, Sandoz, Kundl-Rakusko, Österreich; 10 mg /kg Körpergewicht, intravenös). Um die sympathischen Zellkörper zu lokalisieren, wurden die Schweine auf mittlere Laparotomie unterzogen und Injektionen des fluoreszierenden retrograden neuronale Tracer Fast Blue (FB, EMS-CHEMIE GmbH, Deutschland) in die rautenförmigen Teil (ca. 4 cm x erhalten 4 cm) der Magenvorderwand präpylorischen bei einem Gesamtvolumen von 50 &mgr; l einer 5% igen Lösung (1 &mgr; l pro 1 Injektion). Um ein Auslaufen des Tracers in das umgebende Gewebe, die Nadel der Spritze Hamilton minimieren wurde nach jeder Injektion für 20s an der Stelle belassen, und danach wird die Injektionsbereich wurde anschließend mit isotonischer Kochsalzlösung gespült und vorsichtig mit Gaze abgewischt. Nach der Operation Injektionen des Antibiotikums (Betamox L.A., ScanVet, Polen, 15 mg /kg Körpergewicht, i.m.) und Analgetika (Meloxicam-Metacam, Boehringer Ingelheim Vetmedica GmbH, Deutschland, 0,4 mg /kg Körpergewicht, i.m.) angewendet wurden. Um postoperative Schmerzen zu minimieren, wurden die Meloxicam (Metacam, Boehringer Ingelheim Vetmedica GmbH, Deutschland, 0,4 mg /kg Körpergewicht, i.m.) Injektionen verabreicht einmal täglich. Der Gesundheitszustand der Tiere wurde durch Tierarzt mindestens 4 Mal täglich überwacht
 Mukormykose (Zygomykose)
Mukormykose (Zygomykose)
 Was ist der Unterschied zwischen Durchfall und Ruhr?
Was ist der Unterschied zwischen Durchfall und Ruhr?
 Nanotechnologie und COVID-19-Diagnose und -Behandlung
Nanotechnologie und COVID-19-Diagnose und -Behandlung
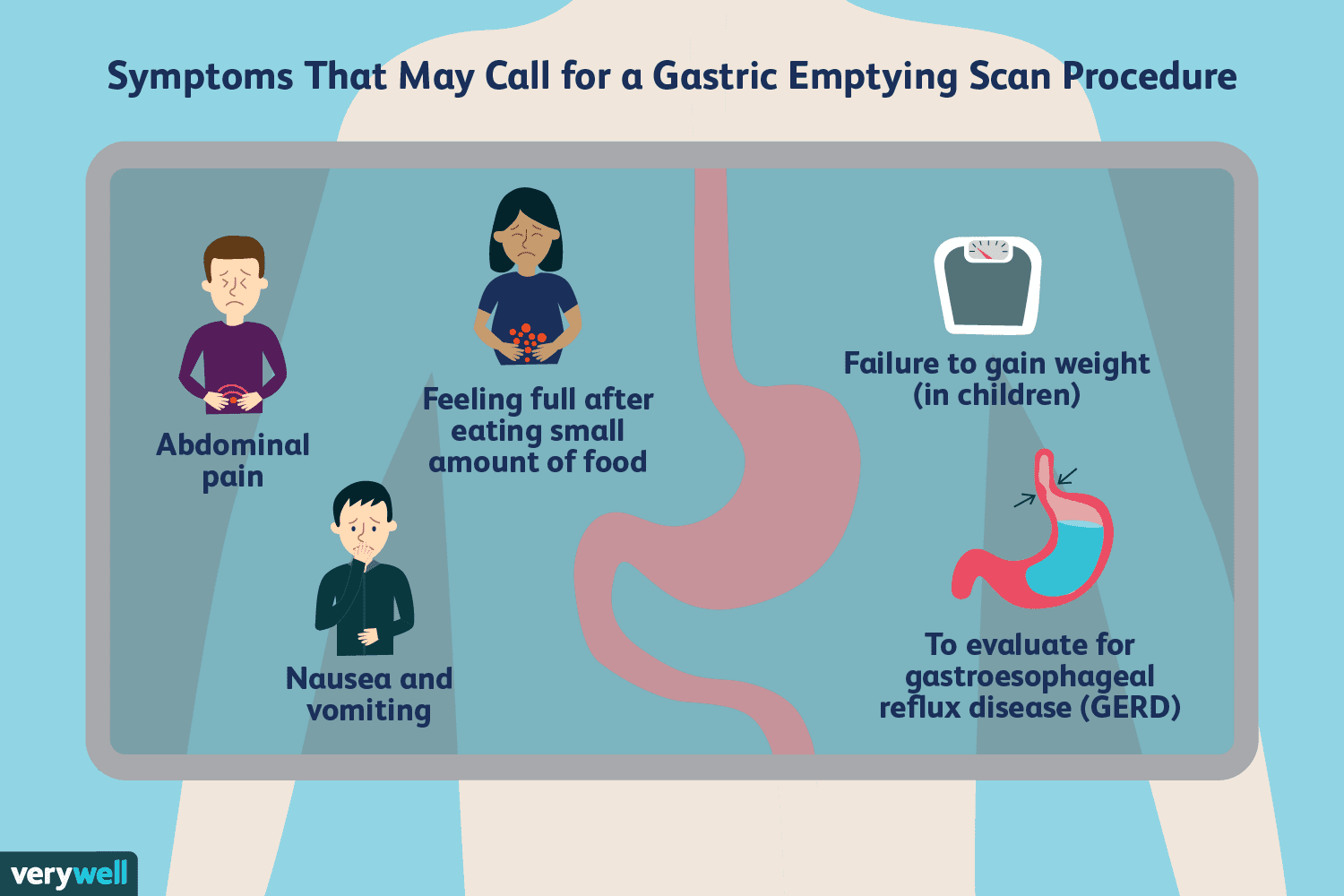 Was ist ein Magenentleerungsscan?
Was ist ein Magenentleerungsscan?
 Lebenstests sind darauf ausgelegt, Überzeugungen aufzudecken
Lebenstests sind darauf ausgelegt, Überzeugungen aufzudecken
 Sommergefahr:Grillbürstendrähte verursachen große gesundheitliche Probleme
Sommergefahr:Grillbürstendrähte verursachen große gesundheitliche Probleme
 Was ist Gastritis? Symptome, Behandlung und Ernährung
Gastritis kann zu Magenschmerzen und Verdauungsproblemen führen. Was sollten Sie über Gastritis wissen? Was ist die medizinische Definition von Gastritis? Gastritis ist eine Entzündung der Magenschle
Was ist Gastritis? Symptome, Behandlung und Ernährung
Gastritis kann zu Magenschmerzen und Verdauungsproblemen führen. Was sollten Sie über Gastritis wissen? Was ist die medizinische Definition von Gastritis? Gastritis ist eine Entzündung der Magenschle
 Wie helfen Wirtsfaktoren wie das Lungenmikrobiom bei einer SARS‐CoV‐2 Infektion?
Das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) ist ein RNA-Virus, das zur Gattung Coronaviridae und zur Untergattung Betacoronavirus gehört. Es ist der neuartige und hochanstecke
Wie helfen Wirtsfaktoren wie das Lungenmikrobiom bei einer SARS‐CoV‐2 Infektion?
Das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) ist ein RNA-Virus, das zur Gattung Coronaviridae und zur Untergattung Betacoronavirus gehört. Es ist der neuartige und hochanstecke
 Bauchschmerzen:Ursachen, Arten und Vorbeugung
Was sind Magenschmerzen oder -beschwerden? Magenschmerzen und -beschwerden können verschiedene Ursachen haben. Manchmal können Sie für kurze oder lange Zeit Schmerzen/Unbehagen in einem bestimmten
Bauchschmerzen:Ursachen, Arten und Vorbeugung
Was sind Magenschmerzen oder -beschwerden? Magenschmerzen und -beschwerden können verschiedene Ursachen haben. Manchmal können Sie für kurze oder lange Zeit Schmerzen/Unbehagen in einem bestimmten