Altered expresión de un marcador de células progenitoras putativo DCAMKL1 en la mucosa gástrica de rata en regeneración, metaplasia y displasia
Abstract
Antecedentes
Doublecortin y calcio /calmodulina dependiente de la proteína quinasa-1 (DCAMKL1) es un marcador candidato para las células progenitoras en la mucosa gastrointestinal. células de linaje en la mucosa gástrica se derivan de células progenitoras, pero este proceso puede ser alterado después de la lesión. Por lo tanto, hemos explorado la expresión DCAMKL1 en condiciones patológicas.
Métodos
Un análisis inmunohistoquímico se realizó en el estómago de ratas con lesión aguda superficial, úlcera crónica, metaplasia intestinal y displasia.
Resultados
DCAMKL1 se expresan exclusivamente en células en reposo inmaduras en el istmo de las glándulas normales fúndica, donde se cree que las células progenitoras putativo para residir. células DCAMKL1-positivas y células proliferantes arrojan en el lumen después de una lesión superficial y re-aparecieron durante el proceso de regeneración, principalmente en la mucosa superficial. En la mucosa marginal alrededor de la úlcera activa, las células parietales y principales disminuidos, hiperplasia foveolar era evidente, y el factor trébol familia 2 (TFF2) /espasmolítico que expresa el polipéptido metaplasia (SPEM) surgió en la base de empaquetadura. DCAMKL1 células volvieron a surgir en la mucosa profunda se yuxtaponen con las células proliferantes y SPEM. En la cicatrización de la úlcera, la población de células TFF2 se expandió y parecía redifferentiate a células principales, mientras que las células proliferantes y células DCAMKL1 aparecieron encima y por debajo de las células TFF2 para promover la curación. SPEM apareció y células PCNA aumentó en la mucosa intestinalized, y DCAMKL1 se expresó en la proximidad de las células PCNA en la mucosa de profundidad. DCAMKL1, PCNA y TFF2 se expresaron en diferentes células displásicas que recubren glándulas dilatadas cerca SPEM.
Conclusión
El aspecto ultraestructural de las células DCAMKL1-positivos y los patrones de expresión de DCAMKL1 en estados normales y patológicos indican que las células pertenecen a una población de células progenitoras. DCAMKL1 expresión está estrechamente asociado con células TFF2 /SPEM después de la lesión. células DCAMKL1 repoblar cerca de las células proliferantes, hiperplásicas, metaplasia y displasia, y la zona progenitor desplaza de acuerdo con las circunstancias patológicas.
Antecedentes
El ratón y la unidad gástrico humano muestra la conversión monoclonal, lo que indica la presencia de células madre multipotentes [ ,,,0],1, 2]. Electron autorradiografía microscópica en el ratón han implicado que las células libres de gránulo en el acto istmo como células madre multipotentes [3]. Los procesos de diferenciación y migración de linajes de células pueden ser alteradas por lesión. La zona de células progenitoras en el istmo se daña fácilmente con etanol intraluminal, fármacos anti-inflamatorios no esteroideos o Helicobacter pylori gratis (H. pylori
). La inflamación crónica del estómago puede conducir a la atrofia y pérdida de células especializadas como efectos tangibles de la lesión de las células progenitoras de tejidos específicos o pérdida. Sin embargo, el comportamiento de las células progenitoras después de daño de la mucosa aguda o crónica y el mecanismo de restauración de estas células durante la regeneración de la mucosa no se conocen bien.
La población de células progenitoras es importante en el mantenimiento y la regeneración del epitelio gástrico, pero a largo células progenitoras vivido corren el riesgo de la acumulación de mutaciones que conducen al cáncer [4]. Neoplasia puede seguir metaplasia celular debido a la inflamación crónica y la reparación. Sin embargo, un análisis preciso de la función y la alteración de las células progenitoras en la secuencia de la gastritis-metaplasia-displasia-cáncer no se ha realizado, principalmente debido a la falta de marcadores de células progenitoras discretos en el estómago.
Musashi-1, una marcador de las células progenitoras en el ratón intestino delgado, no se expresa en células progenitoras putativo, pero se encuentra en las células parietales en la rata istmo fúndica [5]. El fragmento promotor /potenciador vilina-1 es un marcador de posibles células progenitoras gástricos en el istmo de las glándulas pilórico [6]. Un estudio linaje indicó que el marcador de células progenitoras intestinal LGR5 se expresa en la base de glándulas fúndicas y pilórico potenciales en el estómago neonatal, mientras que la expresión en adultos fue predominantemente restringido a la base de las glándulas pilórico [7]. Por lo tanto, no hay marcadores definitivos para progenitores en glándulas fúndicas adultos.
DCAMKL1 es uno de los productos de las transcripciones enriquecidos en Ontogenia gen que se encuentra en comparación con gástrica ratón y pequeños conjuntos de datos progenitoras intestinales [8]. El análisis inmunohistoquímico usando un anticuerpo DCAMKL1 reveló tinción de células individuales en las secciones de las criptas intestinales en o cerca de la posición 4 y en las células gástricas istmo [8]. Después de que el primer informe, la localización específica de las células en un nicho de células madre DCAMKL1-expresión se muestra en el intestino delgado de ratones [9, 10] y en el colon de ratones y seres humanos [11, 12], mientras que DCAMKL1 se coexpressed con Musashi -1 en las células parietales del estómago de ratones [13]. Francia el primer objetivo de este estudio fue determinar si DCAMKL1 es un marcador de células progenitoras en el estómago de rata. El segundo objetivo fue determinar los patrones temporales y espaciales de la aparición de células que expresan específicamente DCAMKL1 en varias condiciones patológicas gástricos.
Métodos Preparación de los animales
MyBestPlay Todos los animales protocolos fueron aprobados por el Comité de Investigación Animal de la Universidad de Keio. Las ratas macho Wistar que pesaban aproximadamente 200 g se mantuvieron en ayunas durante 24 horas con acceso libre al agua. Para producir lesión superficial aguda en la mucosa fúndica, etanol absoluto (1 ml) se instiló en el estómago por intubación gástrica. Para producir úlceras profundas crónicas, se inyectó ácido acético 20% (50 l) en la submucosa fúndica de la pared anterior usando una microjeringa. Las ratas se sacrificaron 3 días y 1, 2 y 3 semanas después de la inyección de ácido acético. Comentario El método para inducir la metaplasia intestinal en la mucosa gástrica de rata se ha descrito en otra parte [14, 15]. Brevemente, las ratas recibieron dos dosis de rayos X de 10 Gy cada uno y se sometieron a eutanasia 6 meses después de la irradiación. El método para la inducción de la displasia en la mucosa gástrica de rata también se ha descrito en otra parte [14]. En pocas palabras, se le dio 50 g /ml de N-metil-N'-nitro-N-nitrosoguanidina (MNNG) (Aldrich Chemical Co., Milwaukee, WI) a las ratas ad libitum
durante 4 meses.
Anticuerpos
conejo anti-DCAMKL1 de inmunoglobulina (Ig) G (Abcam, Cambridge, Reino Unido; dilución final 1: 100), ratón anti-antígeno nuclear de proliferación celular (PCNA) IgG (DAKO, Carpinteria, CA; listo para usar), anti conejo -PCNA IgG (Abcam; 1: 200), el ratón anti-H
+ /K + - trifosfato de adenosina (ATPasa) α subunidad IgG (Research Diagnostics Inc. Flandes, NJ; 1: 200), anti ovejas -pepsinogen II IgG (Estados Unidos Biológica, Swampscott, MA; 1: 100), ratón anti-MUC6 IgM (Kanto Kagaku, Tokio; 1: 100), ratón anti-IgG MUC5AC (Abcam; 1: 100), anti-ratón TFF2 IgM (Abcam; 1: 200), conejillo de indias descarboxilasa anti-histidina (HDC) IgG (ARP, Belmont, MA; 1: 100), anticuerpo de cabra anti-ghrelina IgG (Santa Cruz Biotechnology, Santa Cruz, CA; 1: 100 ), y el ratón anti-IgG de somatostatina (Biomeda, Foster City, CA; 1:25) se utilizaron como anticuerpos primarios
Análisis histológico comentario El tejido del estómago se fijó en formalina al 10% tamponada neutra durante la noche, y luego. se incluyeron en parafina y se seccionaron (4 m). Las secciones fueron teñidas con hematoxilina y eosina (H & E) usando técnicas estándar. ácido periódico de Schiff (PAS) se realizó tinción con azul de -Alcian para detectar linajes de células mucosas.
Para el análisis inmunohistoquímico, las secciones embebidas en parafina se desparafinaron y pretratado con un procedimiento de recuperación adecuado para cada antígeno. Las secciones se incubaron en 0,3% H 2O 2 en metanol durante 10 minutos para inactivar la peroxidasa endógena y después se lavaron con solución salina tamponada con fosfato (PBS) que contiene 0,1% de Tween 20 (PBST). Después de la incubación con solución de bloqueo (Block Ace, Dainippon Seiyaku, Tokio, Japón) durante 10 minutos, las secciones se incubaron con un anticuerpo primario durante 1 hora a temperatura ambiente. A partir de entonces, cada paso fue seguido por lavado 3 veces con PBST durante 3 minutos. Las secciones se incubaron con IgG conjugada-HP o IgM durante 40 minutos. Las células marcadas se colorean de color marrón con clorhidrato de 3,3 'diaminobencidina (DAB) usando un kit de reactivos DAB (Dako), y después de contraste con hematoxilina de Mayer.
Para la inmunotinción de doble color, se utilizó un método indirecto immunoalkaline fosfatasa siguiente el procedimiento de inmunoperoxidasa indirecto descrito anteriormente. Después de la reacción con DAB, las secciones se incubaron con un segundo anticuerpo primario durante 1 hora, seguido de incubación con IgG ALP conjugado o IgM durante 40 minutos. Las células marcadas se tiñeron de color azul con un kit de sustrato de ALP III (Vector azul, Vector Laboratories, Burlingame, CA).
Para la recuperación de antígenos de pepsinógeno II y MUC6, proteinasa K (DAKO), se aplicó por vía tópica a las secciones desparafinadas para 6 minutos. Para la recuperación de antígenos de PCNA (IgG de ratón), las secciones se calentaron en agua destilada en un autoclave durante 10 minutos. Para la recuperación de antígenos de MUC5AC, las secciones se calentaron en tampón de citrato en un autoclave durante 10 minutos. Ningún procedimiento de recuperación de antígenos se utiliza para DCAMKL1, H + /K + -. ATPasa, PCNA (IgG de conejo), TFF2, HDC, la grelina o somatostatina tinción
Puntuación de las células y las células PCNA DCAMKL1
se analizaron las secciones que se sometieron a inmunotinción doble color usando DCAMKL1 y PCNA para determinar el número de células inmuno. Las secciones se utilizan de 5 ratas, y 10 unidades gástricos bien orientadas se analizaron en cada sección.
Electron Microscopy
microscopía Pre-incrustación de electrones con inmunoperoxidasa se llevó a cabo como sigue. Pequeños trozos de especímenes frescos de la corpus gástrico de las ratas no tratadas fueron fijadas en paraformaldehído al 4% durante 24 horas, seguido de fijación en glutaraldehído al 0,1% y 4% de paraformaldehído durante 1 hora. Se prepararon y se incubaron con anticuerpo anti-DCAMKL1 durante 48 horas secciones de criostato (6 m), seguido de incubación con IgG anti-conejo conjugado con HP durante 24 horas. Las secciones fueron fijadas con glutaraldehído al 0,5% durante 5 minutos, se hacen reaccionar con DAB, post-fijaron con 2% de tetróxido de osmio, se deshidrataron a través de una serie de etanol, y se embebieron en resina epoxi. Ultrathin secciones se cortaron con un ultramicrotomo y se tiñeron en solución de acetato de uranilo y citrato de plomo solución. Las muestras fueron examinadas utilizando un microscopio electrónico de transmisión (JEM-1200EX, JEOL, Tokio, Japón).
Resultados
las células normales de la glándula fúndica
DCAMKL1 que expresan se distribuyeron en el tercio superior de las glándulas normales fúndica, en una región conocida como el istmo (Figura 1A). En la microscopía electrónica, se encuentran también DCAMKL1-células en el istmo (Figura 1B, a). La célula DCAMKL1 era más pequeña que la célula parietal, que era rico en la mitocondria, y carecía de los gránulos secretores visto en la célula endocrina (Figura 1B, b). DCAMKL1 inmunoreactividad se encontró de forma difusa en el citoplasma, dando una alta relación nucleocytoplasmic (Figura 1B, c). células DCAMKL1 estaban presentes en los revestimientos de células epiteliales, ya que las células tenían desmosomas en la unión con las células epiteliales adyacentes (Figura 1b, d). Las células DCAMKL1 tenían un aspecto inmaduro con pocas mitocondrias, vesículas o gránulos de secreción (Figura 1B, c y 1B, d). Figura 1 Distribución y ultraestructura de las células en el estómago de rata normal DCAMKL1 expresan. (A) Una micrografía de luz, que muestra la ubicación de las células DCAMKL1 en la mucosa fúndica. Escala: 100 micras. El recuadro muestra una vista ampliada de la zona se indica en A. Escala: 10 micras. micrografías electrónicas (B) de la transmisión. (A, c) Los cortes ultrafinos sin contratinción. (B, d) Los cortes ultrafinos con tinción de contraste. (A) células DCAMKL1 en la glándula fúndica. Escala: 2 micras, aumento x 5600. (B) La célula DCAMKL1 (D) era más pequeña que la célula parietal (P), que era rico en la mitocondria, y carecía de los gránulos secretores visto en la célula endocrina (E). Escala: 2 micras, aumento x 7000. (C) DCAMKL1 tinción fue predominantemente citoplasmática. Escala: 1 m, aumento x 14400. (D) Las puntas de flecha indican desmosomas. La flecha blanca indica DCAMKL1 inmunorreactividad. Escala:. 2 m, aumento x 8400
A continuación comparó la distribución de células DCAMKL1 con los de los linajes de células epiteliales conocidos. DCAMKL1 células se entremezclan con la proliferación de células marcadas por PCNA en el istmo (Figura 2a), pero no las células DCAMKL1 contenida PCNA. células DCAMKL1 residido debajo células foveolares (tiñeron con Azul de Alcian, figura 2b) y por encima de las células mucosas del cuello (teñidas con MUC6 y TFF2, la Figura 2c, d). Las células parietales y células principales en el istmo eran adyacentes a las células DCAMKL1, pero las células DCAMKL1 no coexpresan H + /K + -ATPasa o pepsinógeno (Figura 2e, f). células DCAMKL1 también eran discreta de linajes de células endocrinas. La población de células DCAMKL1 era distante de células Enterocromafines similares, los cuales fueron distribuidos principalmente en la base fúndica (Figura 2g). Una mayoría de las células A-como residía en la base fúndica con algunos distribuido en el istmo pero distinto de células DCAMKL1 (Figura 2h), y las células D claramente difieren de las células DCAMKL1 (Figura 2I). células foveolares Figura 2 de doble color inmunotinción que muestra la localización de las células DCAMKL1 que expresan y linajes de células epiteliales que comprenden la proliferación de células con núcleos PCNA-marcado (a), teñida con azul de Alcian (b), MUC6-tiñeron las células mucosas del cuello (c), TFF2 Las células teñidas mucosas del cuello (d), H + /células parietales con tinción de ATPasa K + (e), pepsinógeno II-tiñeron las células principales (f), HDC-tiñe las células enterocromafinas similar a (g), la grelina-manchado A- como las células (h), y las células D de la somatostatina-manchado (I). Escalas: 100 m. El recuadro en (e) muestra una vista ampliada de la zona se indica. Tenga en cuenta que las células DCAMKL1 eran distintas de las células parietales
aguda superficial lesión de la mucosa y una renovación rápida
El análisis histológico del proceso de lesión de la mucosa y la reparación después de la administración de etanol usando H &. Tinción E y de doble color de DCAMKL1 y PCNA inmunotinción se muestra en la figura 3. Inmediatamente después de tratamiento con etanol, las células y las células PCNA DCAMKL1 separan de la glándula y arrojan en el lumen con células foveolares (figura 3AA y 3ba). DCAMKL1 células y células PCNA casi habían desaparecido en la mucosa dañada 1 hora después del tratamiento con etanol (Figura 3 bis ter y 3BB). células DCAMKL1 luego reaparecieron después de 6 horas, y algunos estuvieron presentes cerca de la superficie de la mucosa (Figura 3AC y 3bc). células PCNA aumentó a las 24 horas después de etanol (Figura 3AD y 3Bd), mientras que varias células y células PCNA DCAMKL1 estuvieron presentes en la superficie de la mucosa (Figura 3AE y 3be). La distribución de las células y las células PCNA DCAMKL1 tenía la apariencia morfológica de mucosa fúndica sin tratar después de 96 h (Figura 3AF y 3BF). Figura 3 El análisis inmunohistoquímico de lesión de la mucosa superficial después del tratamiento con etanol. (A) inmunotinción doble color para las células y las células PCNA DCAMKL1. secciones gástricas tomadas a los 5 minutos (a), 1 hora (B), 6 horas (C), 24 horas (d, e) y 96 horas (F) después del tratamiento con etanol. (B) H & secciones teñidas-E, que muestran la evolución temporal de daño de la mucosa gástrica y reparación después de la administración de etanol. (Af) secciones seriadas de las respectivas secciones en A. escalas: 100 micras. Cursos de Tiempo, de los cambios en el número de células PCNA DCAMKL1 y se muestran en la Figura 4. El número de células DCAMKL1 cambió casi de forma concomitante con la de PCNA células, pero el reclutamiento de células DCAMKL1 comenzaron a las 6 horas después del tratamiento con etanol, antes de reclutamiento de células PCNA. Figura 4 cursos de tiempo de las cantidades de células DCAMKL1 (A) y células PCNA (B) en una glándula después de la administración de etanol. Cada barra representa la media ± SE de los resultados de 5 ratas. El eje Y muestra el número de células por la glándula y el eje X muestra el tiempo después de la administración de etanol.
Úlcera
Las úlceras profundas crónicas que implican capas mucosas enteros y que penetran en la muscularis mucosa se produjeron 3 días después del tratamiento con ácido acético ácido. La mayoría de las úlceras sanaron después de 2 semanas de tratamiento y algunos se repitieron después de 3 semanas. Un análisis histopatológico de la regeneración de la mucosa se realizó utilizando tejidos tomadas en 1 a 3 semanas después del tratamiento. cystically glándulas dilatadas eran prominentes en la mucosa de regeneración del margen de la úlcera alrededor del cráter de una úlcera activa (Figura 5a, b). Estas glándulas estaban llenas de células que expresan MUC5AC, un marcador de células foveolares (Figura 5C). Además, TFF2, un marcador de las células mucosas del cuello en ratas no tratadas, muestra una tinción intensa en la base de las glándulas regenerativas fúndica (Figura 5d), similar a la de la tinción TFF2 de células de las glándulas antrales profundas y consistentes con la aparición de una célula SPEM fenotipo [16, 17]. En contraste, la expresión de MUC6, se observó otro marcador de las células mucosas del cuello en ratas no tratadas, se deterioró en la mucosa regenerativa y sólo débil tinción MUC6 en las células en la base de la glándula (Figura 5e). Las células principales también disminuyó en el margen de la úlcera y las células débilmente teñidas con pepsinógeno se visualizaron sólo a base de empaquetadura (Figura 5F). Por lo tanto, hay un solapamiento en la expresión de TFF2, MUC6 y pepsinógeno en las células en la base (Figura 5, d-f). Las células parietales estaban ausentes en el tejido de la mucosa marginal de la úlcera activa (Figura 5 g). células PCNA aumento en las glándulas y mesénquima de la margen de la úlcera y un marcado aumento en estas células se observó en la base de la glándula (Figura 5H). Figura 5 Los patrones de las células epiteliales de la mucosa marginal de una úlcera activa. (A) Un H & E-sección teñida tomada en 1 semana después de tratamiento con ácido acético, que muestra un cráter de tejido de granulación y tejido marginal que rodea el cráter. Escala: 1000 m. (B) una vista ampliada de la mucosa margen de la úlcera se indica en (a). Escala: 100 micras. (C-h) secciones en serie de (b) se tiñeron con MUC5AC (c), TFF2 (d), MUC6 (e), pepsinógeno II (f), H + /K + -ATPasa (g), y PCNA (h). (I-k) inmunotinción doble color para DCAMKL1 con MUC5AC (i), con DCAMKL1 TFF2 (j), y PCNA con TFF2 (k). Escalas: 100 m. (L) inmunotinción doble color para DCAMKL1 con PCNA. Escala: 10 micras. El recuadro en (h-k) muestra una vista ampliada de la zona se indica.
A continuación, exploramos expresión DCAMKL1 en la mucosa marginal de la úlcera activa. Dispersas células que expresan DCAMKL1 estuvieron presentes cerca de los forros de células MUC5AC (Figura 5i) y yuxtaponen con células SPEM (Figura 5J). células PCNA también se distribuyeron en las proximidades de las células SPEM y algunas células SPEM coexpressed PCNA (Figura 5k), lo que implica que el linaje SPEM se multiplica y proliferativa. células DCAMKL1 se entremezclan con las células PCNA en la base de la glándula, pero no coexpresan PCNA (Figura 5L). Esto indica que las células DCAMKL1 se mantienen en un estado de reposo. La zona de progenitor de células PCNA y células DCAMKL1 fue desplazada desde el istmo en la glándula normal a la base en el margen de la úlcera activa.
En la etapa de curación, el tamaño de la úlcera reduce y se han restaurado las células epiteliales (Figura 6a) . En la cicatrización de la úlcera, un gradiente de regeneración epitelial estuvo presente desde el borde de la úlcera a las glándulas regeneradas distantes de la úlcera (Figura 6b). En la mucosa regenerativa de la cicatrización de la úlcera, las células mucosas similar aumentó notablemente. Estas células se localizaron en la base en el margen de la úlcera y se expandieron para los cuellos de las glándulas como la curación procedió. células MUC5AC disminuyeron en el cuello y estaba presente principalmente en el foveolas (Figura 6c), similar a la ubicación en la mucosa fúndica normal. Los expansión de las células mucosas-como en la cicatrización de la úlcera fueron teñidos en parte por MUC5AC, pero predominantemente teñidas con TFF2 (Figura 6d). MUC6 se expresó en células en la base de la glándula pero no en aquellos en el cuello (Figura 6E), mientras que pepsinógeno se expresó en células en el cuello (Figura 6f). Las células parietales, que habían desaparecido en la úlcera activa, reaparecieron encima y por debajo de la población de células TFF2 en la mucosa de la cicatrización de la úlcera (Figura 6 g). En la mucosa normal, las células parietales se derivan de las células progenitoras en el istmo, madurar en ella, y luego tomar varios días para migrar a la base [18], mientras que en la cicatrización de la úlcera, las células parietales repoblaron el cuello y la base de la glándula simultaneamente. PCNA se expresó fuertemente justo por encima de TFF2 células cerca de la úlcera, lo que indica una mayor amplificación de las células epiteliales en esta región (Figura 6H). Algunas células PCNA también se distribuyeron a continuación las células TFF2. células DCAMKL1 reaparecieron arriba y yuxtaponen con la mitad inferior de la población de células TFF2 (Figura 6i). Este perfil de distribución dual de la zona progenitor puede contribuir a la promoción de la rápida y eficaz la regeneración de la mucosa. Figura 6 Los patrones de las células epiteliales y células DCAMKL1 en la mucosa de regeneración de una curación de la úlcera. (A) Un H & E-sección teñida tomada a las 2 semanas después del tratamiento ácido acético, que muestra el tejido de regeneración de la cicatrización de la úlcera. Escala: 1000 m. (B) una vista ampliada de la mucosa de regeneración se describe en (a). Se identificó un gradiente de regeneración epitelial de la (lado derecho) de borde de la úlcera en la mucosa regenerada distante de la úlcera (lado izquierdo). Escala: 100 micras. (C-h) secciones en serie de (b), se tiñeron con MUC5AC (c), TFF2 (d), MUC6 (e), pepsinógeno II (f), H + /K + -ATPasa (g), y PCNA (h). (I) la inmunotinción doble color para DCAMKL1 y TFF2 en una sección en serie de (b).
Intestinal metaplasia y displasia
En ratas irradiadas, metaplasia intestinal que contienen células caliciformes identificadas por tinción PAS-Alcian azul formase en el fúndica glándula (Figura 7a). Las células que expresan DCAMKL1 se encontraron por debajo de las células foveolares en el compartimento luminal de la mucosa, así como en la mucosa de profundidad (Figura 7b, c). células PCNA aumentado notablemente en la mucosa intestinalized y células DCAMKL1 en el compartimiento luminal eran distal a las células PCNA (Figura 7C). células TFF2-expresión, de conformidad con SPEM, surgieron en la base de la mucosa intestinalized (Figura 7d). células PCNA se encontraron proximal a las células DCAMKL1 de profundidad en el revestimiento epitelial intestinalized, con un patrón de distribución similar a la de la pequeña cripta intestinal (Figura 7e, f). Figura 7 expresión DCAMKL1 en la mucosa intestinalized. (A) la tinción de PAS-Alcian azul que muestra la mucosa con metaplasia intestinal que contienen células caliciformes. Escala: 100 micras. (B-d) secciones en serie de (a), se tiñeron con DCAMKL1 (b), DCAMKL1 y PCNA (c), y TFF2 (d). (E, f) vistas ampliadas de las áreas descritas en (b) y (c), respectivamente. Escalas:. 10 micras
en ratas tratadas con MNNG, dilatación quística de las glándulas con displasia se obtuvo en la mucosa y submucosa (Figura 8a). SPEM evolucionó y se expandió cerca de las glándulas dilatadas y expresión segmentaria de TFF2 se encuentra en las células que recubre las glándulas (Figura 8b). DCAMKL1 se expresa escasamente en estas glándulas (Figura 8c). TFF2 y DCAMKL1 se expresaron en diferentes células en las glándulas dilatadas (Figura 8d, 8e), y PCNA también se expresó en células distintas de las células DCAMKL1, indicando la naturaleza proliferativa de las glándulas (Figura 8f). Figura 8 expresión DCAMKL1 en las glándulas dilatadas con displasia. (A) Un H & E-sección manchadas, que muestra la dilatación quística de las glándulas. (B) Ampliación de SPEM. Las flechas indican la expresión segmentaria de TFF2 en las glándulas dilatadas. (C) Expresión de DCAMKL1 en la glándula dilatada. (D-f) Las secciones seriadas de la glándula dilatada para TFF2 (d), DCAMKL1 (e) y DCAMKL1 con PCNA (f). Escalas:. 100 micras
Discusión Francia El estudio mostraron que las células que expresan DCAMKL1 son exclusivamente presentes en el istmo de la glándula fúndica de rata, en la que se cree que las células progenitoras multipotentes a residir [1, 3]. Hemos demostrado que las células DCAMKL1 son discretos a partir de células epiteliales diferenciadas, incluyendo linajes de células endocrinas. Además, la microscopía inmunoelectrónica mostraron que DCAMKL1 se expresó en células epiteliales inmaduras con pocos orgánulos, que corresponden a las células libres de gránulo propuesto anteriormente como células progenitoras presuntivos en el istmo gástrico [3]. DCAMKL1 se coexpresan con Musashi-1 en las células parietales del estómago de ratón [13], mientras que este estudio demostró que las células DCAMKL1 eran distintas de las células parietales, que expresan Musashi-1 en el estómago de rata [5].
Cambios secuenciales en pérdida celular y la recuperación de la glándula gástrica después de la lesión de la mucosa superficial con etanol se resumen en la Figura 9. los cursos de tiempo de los cambios en el número de células PCNA DCAMKL1 y 6 a 96 horas después de tratamiento con etanol en ratas son consistentes con los de ratón [13 ]. Además, se analizaron los cambios anteriores en estos tipos de células. DCAMKL1 células y células descamadas PCNA con células foveolares inmediatamente después del tratamiento con etanol. Una superficie de la mucosa denudada después de la exposición de etanol se vuelve a epitelizada en 1 a 2 horas mediante la migración rápidamente las células del epitelio foveolares cerca ileso [19]. Dado que esta restitución temprana no se basa en la proliferación celular, sino sobre la migración, no se requiere la movilización de las células progenitoras. Después de un período de latencia de aproximadamente 8 horas, una explosión de actividad proliferativa ocurrió hasta las 24 horas para restaurar el foveolas a su longitud original [20]. Este curso de tiempo de la proliferación epitelial después de la exposición de etanol es similar a la observada en el presente estudio. Figura 9 cambios secuenciales en la pérdida celular y la recuperación de la glándula gástrica después de la lesión de la mucosa superficial con etanol.
Un informe reciente ha demostrado que las células en proliferación PCNA-positivas contienen células prefoveolar [21]. El aumento del número de células proliferantes se deriva probablemente a partir de células progenitoras, pero el proceso de repoblación de células progenitoras después de la lesión es oscura. En este estudio, las células DCAMKL1 fueron reclutados antes de la restauración de células proliferantes, y el número y distribución de las células DCAMKL1 cambiado casi de forma concomitante con las de las células en proliferación después de 24 horas. Este hallazgo implica que las células que expresan DCAMKL1-son células que dan lugar a la proliferación de células progenitoras. Varias células DCAMKL1 y células PCNA estuvieron presentes en la superficie de la mucosa durante el período de regeneración temprana. desplazamiento transitoria de la zona progenitor hacia la superficie puede ayudar a facilitar la restauración rápida y preferencial de las células foveolares, que es el linaje que está más dañado y se pierde de lesión de la mucosa superficial. Dado que las células DCAMKL1 reclutados reaparecieron dentro de un día después de que se perdieron las células indígenas, los repoblar las células DCAMKL1 en la mucosa lesionada pueden migrar de las glándulas no lesionados o contratar a partir de la progenie de un linaje de células madre multipotentes que se somete a la expansión continua o extinción en el nicho [9, 22].
los procesos de reconstrucción de la mucosa y la repoblación de células progenitoras en una úlcera crónica profunda difieren claramente de las de lesión superficial aguda (Figura 10). linajes de células diferenciadas se mantienen después de una lesión aguda superficial, mientras que la diferenciación ordenada de los linajes de células de la mucosa de la úlcera activa fue perturbado y linajes de células inherentes fueron reemplazados por linajes de células mucosas de nuevo desarrollo. Parietal y células principales se perdieron, hiperplasia foveolar era evidente, y SPEM surgieron en el epitelio de regeneración que rodea la úlcera activa. Estos hallazgos imitan cambios patológicos en varios modelos experimentales inducidos por la atrofia aguda o crónica oxíntica [16, 17, 23, 24]. En el margen de la úlcera, MUC6 y pepsinógeno parecen ser coexpressed con TFF2 en la base de empaquetadura. Este hallazgo apoya la hipótesis de que las células principales transdifferentiate a SPEM [17, 25], y que el proceso de re-diferenciación de las células mucosas del cuello a las células principales se modifica en una úlcera activa. Una explicación alternativa, que es más probable basa en los resultados actuales, es que SPEM se deriva de las células progenitoras y células principales de redifferentiates. El hallazgo de que SPEM se asocia con aumento de la proliferación apoya esta propuesta [16, 24]. Figura 10 Las alteraciones de los linajes de células de la mucosa en el margen de las úlceras activas y curativas.
Ulceración crónica de la mucosa en el tracto gastrointestinal inicia un proceso de curación de la base de la mucosa en el borde de la úlcera, y puede inducir nuevos linajes de células que corresponden a Spem [26 ]. Estos parecen ser derivado de las células madre multipotentes en la cripta del intestino delgado y colon, mientras que SPEM y la proliferación de células en la base del margen de la úlcera gástrica está lejos de la zona progenitoras normales en el istmo. El modelo de la úlcera crónica en este estudio desarrolló varias semanas después del tratamiento, lo que hace que la migración de las células madre derivadas de médula ósea poco probable porque el injerto de estas células como células epiteliales gástricas se produce en ratones después de sufridas
la infección por H. felis en más de 1 año , pero no en ratones con una úlcera gástrica inducida por ácido acético [27]. La presencia de una segunda población de progenitores, células progenitoras crípticos en el estómago, está prevista desde hace muchos años [16, 24], pero todavía no se ha identificado. En este estudio, se encontró que las células progenitoras DCAMKL1 putativo en la proximidad de dos linajes de células mucosas, células y células foveolares SPEM, en la hiperplasia en el margen de la úlcera. células DCAMKL1 yuxtapuestos con SPEM son compatibles con las células progenitoras crípticos. El marcador de células progenitoras intestinal LGR5 está presente en la base de las glándulas y no en el istmo [7], y que una población de células progenitoras aumentó notablemente durante la inflamación [6]. Se postula que las células que expresan DCAMKL1 en la base de la glándula gástrica son la población de progenitores de segunda línea, que se enmascara en condiciones fisiológicas.
 Las mujeres enfrentan un mayor riesgo de cálculos biliares y necesitan atención médica
Las mujeres enfrentan un mayor riesgo de cálculos biliares y necesitan atención médica
 resultados:dieta de azúcar en sangre de 8 semanas
resultados:dieta de azúcar en sangre de 8 semanas
 7 remedios caseros que pueden ayudar a aliviar el reflujo ácido
7 remedios caseros que pueden ayudar a aliviar el reflujo ácido
 La conexión cerebro-intestino en el SII
La conexión cerebro-intestino en el SII
 Linfadenitis mezenterialny aguda - Diagnóstico de abdomen agudo
Linfadenitis mezenterialny aguda - Diagnóstico de abdomen agudo
 Dieta baja en FODMAP
Dieta baja en FODMAP
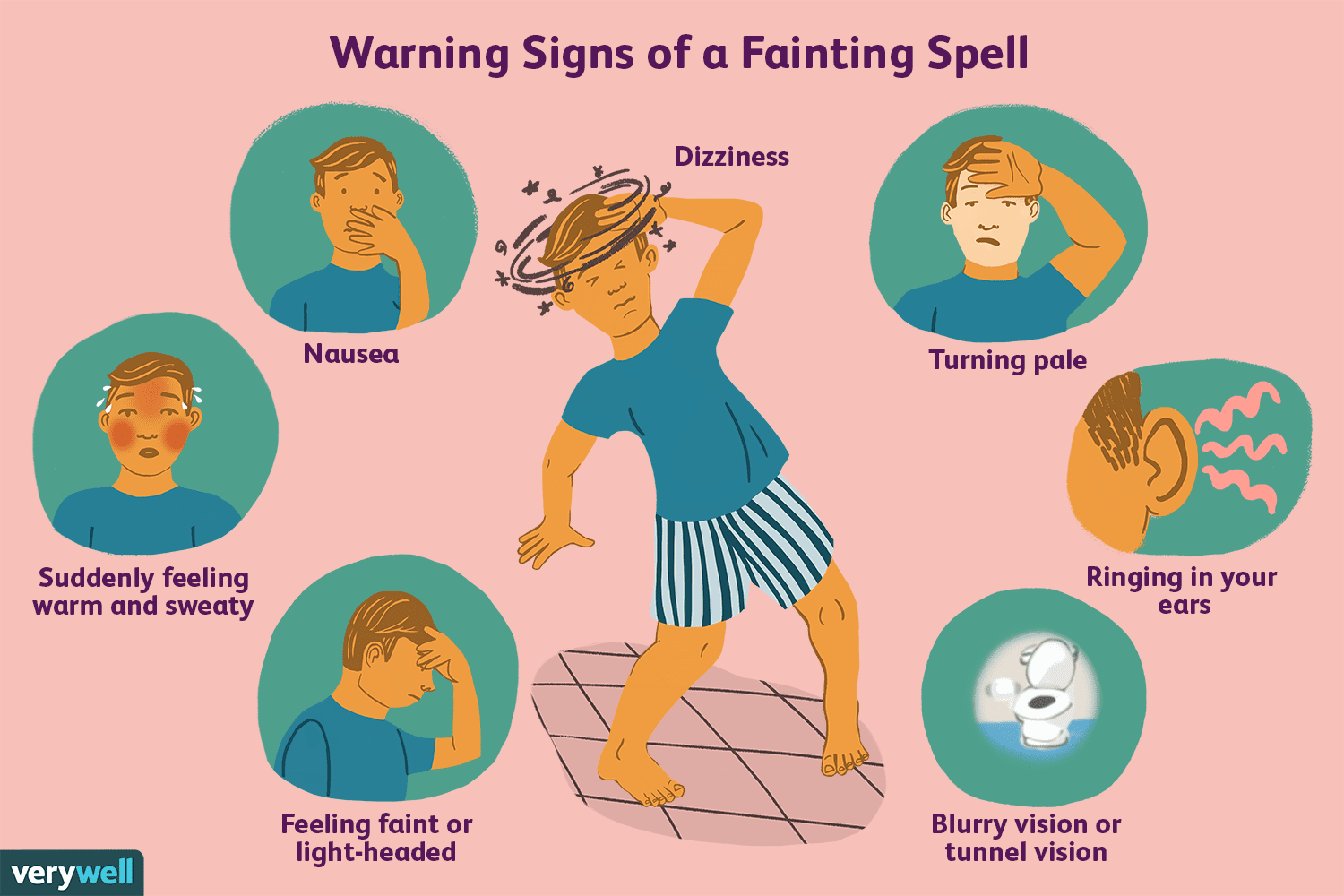 Descripción general del reflejo vasovagal
¿Alguna vez comienza a sudar y siente que se va a desmayar durante una evacuación intestinal, o se siente mareado al ver sangre? Es posible que tu nervio vago esté causando esta sensación y desencaden
Descripción general del reflejo vasovagal
¿Alguna vez comienza a sudar y siente que se va a desmayar durante una evacuación intestinal, o se siente mareado al ver sangre? Es posible que tu nervio vago esté causando esta sensación y desencaden
 SIBO desde una perspectiva masculina
Todos tenemos historias SIBO muy diferentes y compartirlas puede ayudarnos a empoderarnos en nuestro viaje. Esta semana nos acompaña el bloguero invitado Josh Sabourin de SIBO Survivor. Josh se une a
SIBO desde una perspectiva masculina
Todos tenemos historias SIBO muy diferentes y compartirlas puede ayudarnos a empoderarnos en nuestro viaje. Esta semana nos acompaña el bloguero invitado Josh Sabourin de SIBO Survivor. Josh se une a
 Defecar 101:4 señales de que su caca es saludable
No creerías algunas de las fotos de caca que la gente nos envía por correo electrónico. Te ahorraré los detalles, pero he visto más selfies de caca de personas para toda la vida. Nuestro equipo comen
Defecar 101:4 señales de que su caca es saludable
No creerías algunas de las fotos de caca que la gente nos envía por correo electrónico. Te ahorraré los detalles, pero he visto más selfies de caca de personas para toda la vida. Nuestro equipo comen