sea posible aspectos epidemiológicos de adenocarcinoma gástrico:? son diagnósticos predictivos y las medidas preventivas para posible
Resumen México La incidencia de cáncer gástrico ha sido testigo de cambios importantes en el pasado? décadas. Hasta hace poco, el cáncer gástrico era una enfermedad común en la mayoría de países. Una notable disminución en la incidencia de la mayoría de la población occidental se ha producido desde la década de 1970, y elucidar las causas detalladas de esta tendencia puede ser potencialmente de gran valor para las medidas preventivas específicas. Además, se puede añadir a la comprensión de la enfermedad maligna y la prevención en general. Por otra parte, el número absoluto de casos en todo el mundo se prevé que aumente durante muchos años por venir. El cáncer gástrico se diagnostica normalmente en una fase avanzada en pacientes sintomáticos, y con frecuencia no hay opciones curativos o paliativos o terapéuticos eficaces. Este hecho pone de relieve la necesidad de una investigación con el objetivo de aumentar nuestra comprensión de la etiología de este tipo de cáncer, lo que facilita el diseño de estrategias preventivas específicas de éxito para las diferentes poblaciones. Las perspectivas de futuro en cuanto a la disminución de las muertes por cáncer gástrico sería identificar estos instrumentos de diagnóstico inteligentes. En este artículo, se presenta un resumen de la epidemiología del cáncer gástrico, con especial énfasis en su etiología.
Palabras clave
predictivo preventivo medicina personalizada Neoplasia adenocarcinoma de estómago factor de Riesgo Introducción Epidemiología
En los últimos años, la investigación en relación etiológica cáncer gástrico ha sido dominada por el papel de la bacteria Helicobacter pylori (H. pylori)
. Aproximadamente la mitad de la población mundial está infectada con esta bacteria, y se está convirtiendo cada vez más claro que también otros factores ambientales son de importancia fundamental en la etiología del cáncer gástrico, tales como el tabaquismo, la dieta y el reflujo gastroesofágico. El riesgo podría estar influenciado tanto a través de la interacción con esta bacteria y al afectar el riesgo de forma independiente.
La incidencia de cáncer gástrico
adenocarcinoma gástrico es actualmente el cuarto cáncer más común en todo el mundo y la segunda causa principal de muerte relacionada con el cáncer [1] . Sólo el cáncer de pulmón, mama y colon son más comunes. Se ha estimado que 934.000 nuevos casos de cáncer gástrico se presentan cada año, y que 700.000 personas mueren anualmente de esta enfermedad [1], lo que representa más del 10% de todas las muertes por cáncer. Dos tercios de los pacientes viven en países en desarrollo. Ha habido un marcado descenso de su incidencia en los países desarrollados desde la década de 1930, que ha sido descrito como uno de los mayores triunfos médicos del siglo pasado. El desarrollo refleja un cambio en la incidencia en lugar de un diagnóstico precoz, un tratamiento mejor, o cambios en la definición [2]. Los autores de un estudio reciente concluyó que las tendencias descendente constante de la mortalidad por cáncer gástrico en todo el mundo han seguido durante las últimas décadas [3]. Sin embargo, como consecuencia del envejecimiento y la creciente población mundial, se prevé que el número absoluto de casos de cáncer gástrico seguirá aumentando hasta el año 2050 [2, 4]. El cáncer gástrico está estrechamente asociada con la edad, el pico de incidencia está entre el 5 y 7 décadas de la vida. Hay un predominio masculino en general, con 2-3 hombres por cada mujer afectada, pero la disminución de la incidencia se ha producido en ambos sexos. Sin embargo, el aumento de la atención se ha dirigido a lo que parece ser una tendencia de aumento en la incidencia de cáncer en el cardias gástrico. La clasificación de los tumores del estómago proximal es potencialmente poco fiables y los médicos podrían utilizar diferentes definiciones cuando se informa a los registros de cáncer, pero la aceleración de la incidencia de cáncer de cardias parece ser real [5]. Un sistema ampliamente utilizado de clasificación fue propuesta por Siewert en 1998 [6]. Para el cáncer de cardias, hay un hombre aún más pronunciada a la proporción femenina, alrededor de 6: 1, y este tipo de cáncer es más común entre los blancos y en los países occidentales [7-9]. Estos patrones epidemiológicos en huelga todavía se explican sólo en parte. La elucidación de las causas modificables de estas tendencias podría dar lugar a una aceleración de la disminución de la incidencia de cáncer gástrico no cardias, así como un reverso de la tendencia opuesta con respecto a la incidencia del cáncer de cardias.
A nivel mundial, hay un 10- fold variación en las tasas de incidencia reportadas nacionales de cáncer gástrico [1]. Sin embargo, la subestimación de las zonas menos desarrolladas del mundo donde la disponibilidad de servicios de salud, los métodos de diagnóstico, presentación de informes y el cáncer deficiencias prácticas de exhibición hacen comparaciones válidas difícil. Una alta incidencia de cáncer gástrico se han observado en Japón, Corea del Sur, América Central y del Sur, y Europa del Este, mientras que las bajas tasas de incidencia se han registrado en partes de Asia Oriental, Escandinavia, Europa Occidental, América del Norte, Australia, y regiones de África . En 2002, la estimación promedio mundial de incidencia ajustada por edad fue de 22,0 por cada 100.000 personas-año en los hombres y 10,3 por cada 100.000 personas-años en las mujeres [1]. En muchas poblaciones, la disminución de la incidencia de cáncer gástrico ha seguido un fenómeno cohorte de nacimiento, es decir, la tasa de incidencia en las generaciones posteriores tienden a caer, lo que implica compartidos factores de riesgo temporales [10].
Histología del cáncer gástrico
adenocarcinomas representar más del 95% de las neoplasias gástricas. Otros tipos incluyen tumores de células de estroma (GIST), linfomas, lipomas, adenomas, tumores carcinoides, y metástasis. Laurén sugirió que los casos de adenocarcinoma gástrico deben ser divididos en dos grupos histológicamente distintas: 1) el tipo intestinal, con epitelio glandular compuesto por células de absorción y células caliciformes, y 2) el tipo difuso, con pequeñas células pobremente diferenciados en un patrón de crecimiento no cohesivo disociada [11, 12]. Además, se producen tumores mixtos, que representa una combinación de los tipos intestinales y difusos [12, 13]. El tipo intestinal es más común que el tipo difuso en las zonas con una alta incidencia de la enfermedad [14].
Existen marcadas diferencias clínicas y genéticas con respecto a los dos tipos histológicos de adenocarcinoma gástrico, y mucho evidencia apoya la posibilidad de que por separado etiologías de la enfermedad [2, 15]. Sin embargo, no hay diferencias claras en el patrón de factores de riesgo se han puesto de manifiesto en los estudios donde se han analizado los dos tipos histológicos de cáncer gástrico por separado [16-18]. Una amplia gama de anomalías genéticas y epigenéticas, incluyendo mutación puntual, la pérdida de heterocigosidad, inestabilidad microsatélite, y la hipermetilación, se describen en el tipo intestinal y sus lesiones precursoras [19]. El tipo difuso se caracteriza por ausencia de lesiones tales pre-neoplásicas, y la mutación o silenciamiento epigenético del gen de la E-cadherina parece ser un importante evento cancerígeno [19, 20]. Por otra parte, el tipo difuso es más frecuente en individuos más jóvenes y tiene un macho a hembra relación más equitativa [12]. Gran parte de la disminución de la incidencia de cáncer gástrico parece ser el resultado de una tasa decreciente de nuevos casos de tipo intestinal. Una hipótesis clásica con respecto a la patogénesis de definir el tipo intestinal fue presentado en 1975 por Correa et al. [21]. De acuerdo con esta sugerencia, que ha sido cambiado ligeramente durante los años, el desarrollo de cáncer gástrico sigue la secuencia: H. pylori-superficial, gastritis atrófica gastritis-intestinal /completa metaplasia-colónica /incompleta metaplasia-displasia-carcinoma
[ ,,,0],21, 22]. La progresión de estas lesiones sigue un modelo de estado estacionario, con episodios de progresión a lesiones más avanzadas, y los episodios de regresión a las lesiones menos avanzadas. atrofia gástrica conduce a la pérdida de las células parietales y hiposecreción de ácido gástrico, a su vez conduce a un aumento del pH del jugo gástrico, lo que facilita la proliferación de bacterias anaerobias que reducen el nitrato a nitrito, abundante en muchos alimentos. A partir de nitrito, N-nitrosaminas cancerígenas se pueden generar. agentes reductores tales como ácido ascórbico impide la formación de compuestos nitrosados y nitrados [23]. producción intramucoso de nitrosaminas cancerígenas También se ha sugerido [24]. Ha habido preocupaciones de que el tratamiento generalizado con inhibidores de la bomba de protones podría conducir a un aumento en el cáncer gástrico [25, 26], ya que tal terapia causa gastritis corpus-dominante en pacientes con infección por H. pylori
que se asocia con hiposecreción [27 ]. Sin embargo, no hay un fuerte apoyo para un efecto adverso tales inhibidores de la bomba de protones [28].
Es muy posible que el tipo de cáncer intestinal se presenta en una mucosa gástrica que ha sufrido una secuencia de mutaciones y cambios histopatológicos que pueden han comenzado en las primeras décadas de la vida. Aunque los mecanismos exactos que conducen a la transformación neoplásica se desconocen, el enfoque se ha dirigido a la posibilidad de que "estrés oxidativo" podría ser crucial en el proceso carcinogénico [29, 30]. Esto sugiere implícitamente que counteractive medidas "antioxidantes" podrían proteger el ADN de las células de la mucosa de un bombardeo continuo de agentes genotóxicos. Recientemente, la evidencia intrigante de que las células madre derivadas de la médula ósea están involucrados en el desarrollo del cáncer gástrico se ha convertido disponible [31, 32]. células madre de tejido periférica en la mucosa gástrica pueden ser dañados por la inflamación crónica [31]. Esto a su vez conduce a la contratación y el injerto permanente de células madre derivadas de médula ósea en el nicho de células madre de tejido. Con inflamación en curso y lesiones estas células se exponen a un entorno de tejido anormal caracterizado por los niveles de citoquinas y factores de crecimiento elevadas que son propensos a iniciar la diferenciación, pero no para regular programas de crecimiento apropiada y en lugar de progresar a través de las etapas de la metaplasia y displasia [31, 32] .
etiología del cáncer gástrico
Los factores ambientales son de mayor importancia que los factores genéticos en la etiología del cáncer gástrico [15]. agrupación familiar de los casos se produce, lo que sugiere un papel causal genética prominente en algunos casos, pero las exposiciones que no sea hereditaria en general, juegan un papel más decisivo en la población en general. El apoyo a estas conclusiones es la observación de que las primeras generaciones de migrantes procedentes de zonas de alta incidencia sostener el riesgo de su país de origen, sino que la tasa de incidencia en las generaciones posteriores cae [33]. Este patrón también se observa, por ejemplo, para el cáncer de colon, pero en el caso de cáncer gástrico esta adaptación parece ser más lenta. Estas observaciones refuerzan la hipótesis de que los factores que actúan en la vida temprana podría tener un papel muy importante en la carcinogénesis gástrica.
La edad avanzada está relacionada con un mayor riesgo. En este contexto, es un indicador de cambios degenerativos y daños en el ADN acumulado. Además, el cáncer gástrico se produce predominantemente en los grupos socioeconómicos más bajos. Esta relación inversa con el nivel socioeconómico se observa en casi todas las poblaciones [34, 35], pero no existe una correlación exacta a nivel nacional del desarrollo económico [1].
Causas genéticas
Alrededor del 10% de los pacientes con gástrico cáncer tienen antecedentes familiares de esta enfermedad, y hay un poco mayor correlación entre la enfermedad de gemelos idénticos en lugar de hermanos [36]. Sin embargo, muchos genes que subyacen síndromes de cánceres hereditarios tienen un papel más extendida en cánceres esporádicos, como resultado de mutaciones somáticas que surgen durante la iniciación del tumor o la progresión [20]. El descubrimiento de la mutación de la línea germinal en el gen de la E-cadherina, que codifica para una proteína de adhesión celular, en los cánceres gástricos familiares del subtipo histológico difuso, es un ejemplo de progresar comprensión de la genética de cáncer gástrico. También se ha demostrado que la expresión de E-cadherina disminuye a lo largo de la cascada de Correa [37], y que H. pylori
infección se asocia con regulación a la baja de E-cadherina [38, 39]. Otros estudios han demostrado asociaciones interesantes entre los polimorfismos en los genes que codifican para las citoquinas pro-inflamatorias y riesgo de cáncer gástrico [40]. Las mutaciones en el gen de la interleucina-1B se han considerado como uno de los más cruciales, aunque un reciente meta-análisis no proporcionó ningún apoyo para tal asociación [41].
Helicobacter pylori Francia El Premio Nobel de Fisiología o Medicina en 2005 fue otorgado a los médicos australianos Barry J. Marshall y J. Robin Warren "por su descubrimiento de la bacteria Helicobacter pylori
y su papel en la gastritis y la úlcera péptica" [42]. Este notable descubrimiento fue hecho en 1983, y desde entonces se ha convertido cada vez más claro que esta bacteria también juega un papel causal importante en la etiología del cáncer gástrico. En 1994, IARC clasificó por H. pylori
definida como carcinógeno de clase 1 [43]. Como resultados contradictorios acumulan, algunos científicos llegaron a creer que esta decisión fue tomada un poco antes de tiempo, pero añaden juntos, los resultados obtenidos en los últimos 20 años indican claramente que H. pylori
juega un cierto papel causal en la etiología del cáncer gástrico [44 -46]. La resistencia media de la relación según lo determinado por los meta-análisis produce un tamaño del efecto de aproximadamente el doble de riesgo [47-49]. H. pylori
infección se ha encontrado en los estómagos humanos en todo el mundo. La mayoría de las infecciones parecen ser adquiridas en la infancia, que suele durar muchas décadas o para toda la vida [50]. El modo de transmisión no se conoce completamente, pero la vía de transmisión bacteriana fecal-oral es probablemente el [51] más importante. Aproximadamente la mitad de la población mundial está infectada, y la ocurrencia está fuertemente correlacionada con el nivel socioeconómico bajo [52]. En algunos países de bajos ingresos, el 70-90% de los habitantes están infectados, mientras que en los países de ingresos altos, la prevalencia es del 25-50%. H. pylori
infección está asociada con una inflamación de la mucosa gástrica. Los mecanismos exactos por los que esta bacteria causa el cáncer gástrico aún no se han dilucidado [53], pero el resultado clínico de esta infección está determinado por una interacción entre H. pylori
, factores del huésped derivada, y los factores ambientales [32]. En algunas zonas del mundo una muy alta prevalencia de la infección por H. pylori
corre paralela con bajas tasas de cáncer gástrico [54]. Son muchos los factores de virulencia de bacterias que podrían desempeñar un papel en la H. pylori
resultados de las enfermedades relacionadas han sido identificados. Citotoxina asociados gen A (CagA) de las cepas positivas son, por ejemplo, asociados con un aumento en el riesgo adicional de adenocarcinoma gástrico [53]. En los países occidentales, en torno al 60% de H. pylori CagA
aislamientos poseen, en comparación con prácticamente todos los aislados en Japón [55]. Como resultado de los polimorfismos de codificación para este factor de virulencia, las poblaciones infectadas con cepas de Asia Oriental CagA-positivas pueden estar en una especialmente grande el riesgo de cáncer gástrico [56]. Sin embargo, los anticuerpos contra CagA parecen persistir más tiempo en el suero de anticuerpos utilizados convencionalmente utilizados para la detección bacteriana. Esto podría explicar en parte la asociación observada fuerte entre las cepas CagA positivas y cáncer gástrico [57, 58]. Una respuesta fuerte, pero ineficaz, inmune se asocia típicamente con H. pylori
infección. Los polimorfismos genéticos influyen en la variación individual en la medida y el patrón de respuesta de citoquinas, y por lo tanto parecen contribuir a la evolución clínica de la persona [59]. Se ha propuesto que los factores ambientales y factores relacionados con el huésped puede ser más importante que el H. pylori
factores de virulencia en la producción de cáncer gástrico [60]. En línea con esta sugerencia es la observación de un cambio rápido en la incidencia mundial de este tipo de cáncer. Esto podría ser explicado por una disminución similar en la prevalencia de un factor de virulencia bacteriana en particular, pero no hay evidencia en contra de esta hipótesis [61]. H. pylori
se puede diagnosticar mediante una variedad de pruebas y se trata fácilmente con antibióticos, y los hallazgos recientes de un estudio aleatorizado japonesa que muestran que las tasas de cáncer gástrico se reducen sustancialmente, pero no abolida, por erradicación del H. pylori
han intensificado el debate de la erradicación preventiva [62]. Todavía no existen vacunas preventivas [63]. Antes se sugieren recomendaciones de estrategias preventivas, es importante para evaluar los posibles efectos negativos de tales intentos. Hay indicios de una relación inversa entre H. pylori
riesgo de infección y de adenocarcinoma de esófago, un cáncer con una incidencia más rápidamente creciente, que es una de las razones para mantener una actitud prudente hacia los programas de vacunación gran escala [58, 64, sesenta y cinco]. Además, la cuestión de la resistencia a los antibióticos debe ser considerado [66]. Mejor saneamiento y mejora de la salud pública, probablemente, ha llevado a la disminución observada en la prevalencia de la infección por H. pylori Hoteles en el mundo industrializado.
Frutas y verduras
Hay evidencia sustancial de que una dieta rica en frutas y verduras es protector frente al cáncer gástrico [67, 68]. Los estudios prospectivos han demostrado repetidamente reducciones significativas en el riesgo de cáncer gástrico en asociación con alto consumo de frutas y hortalizas [69-71]. Los hallazgos en numerosos estudios de casos y controles también han apoyado este efecto protector [18, 72, 73]. Cancerígenos N-nitrosaminas pueden, sin embargo, ser generados a partir de nitrito. Este anión se forma a partir de la reducción de nitrato, abundante en muchos alimentos. Para las personas que consumen una dieta occidental típica, hortalizas representan el 60-80% de la ingesta diaria de nitrato [74]. Las mayores concentraciones de nitratos están presentes en los vegetales de hoja verde como la ensalada y espinacas, aunque los niveles de nitratos en las hortalizas pueden variar considerablemente dependiendo, por ejemplo, en el uso de fertilizantes de nitrógeno [75]. Pequeñas cantidades de nitrito también provienen de la carne procesada [74].
Fumar tabaco
La relación entre el tabaquismo y el cáncer gástrico ha sido objeto de muchos estudios en los últimos años, y en su conjunto estos estudios indican que el tabaquismo es una factor de riesgo moderado [76]. En un meta-análisis de la relación entre el tabaquismo y el cáncer gástrico, el exceso de riesgo asociado con el tabaquismo se estima en un 50-60% [77]. El riesgo relativo fue mayor en los hombres (59%) que en mujeres (11%). Si esta asociación es cierto, la alta prevalencia de consumo de tabaco en el mundo sugiere que un número considerable de casos de cáncer gástrico (80.000) podría deberse al consumo de tabaco [77]. Una reciente revisión sistemática y meta-análisis sólo teniendo en cuenta los estudios de cohortes, demostraron que el riesgo de cáncer gástrico se incrementa en un 60% en varones fumadores y un 20% en las mujeres fumadoras, en comparación con los no fumadores, y que las asociaciones son más débiles en los ex fumadores [78]. Una diferencia en el riesgo en función de la localización anatómica del tumor dentro del estómago es una posibilidad. Algunos estudios prospectivos han indicado que el cáncer gástrico no cardias se asocia con un riesgo más fuerte [79], mientras que otros, por ejemplo, un estudio prospectivo de gran tamaño [80], han demostrado lo contrario. Existe cierta evidencia de un fuerte aumento en el riesgo entre las personas con H. pylori
cepas CagA positivas que fuman, lo que sugiere una interacción entre estas exposiciones en relación con el desarrollo del cáncer gástrico [81]. El tabaquismo es un factor de riesgo típicamente adquiridos temprano en la vida, y algunos datos indican que el inicio temprano del consumo de tabaco es un factor de riesgo en sí misma [82]. Es biológicamente plausible que la que los mecanismos de defensa anti-cancerígenos más fácilmente se ven superadas en un organismo más joven. El mismo tipo de asociación se ha demostrado con respecto a fumar y el cáncer de pulmón [83].
Alcohol
Sobre la base de la mayoría de la investigación anterior, el consumo de alcohol parece ser una causa probable de cáncer gástrico [17, 68, 84- 86], aunque algunos resultados son parte contradictorios [82, 86, 87].
obesidad
aunque el índice de masa corporal (IMC) está vinculada con un aumento global en el riesgo de cáncer en general, y es un establecido y un fuerte factor de riesgo para el adenocarcinoma gástrico cardias [84, 88, 89], los resultados de los estudios de casos y controles que abordan el riesgo de cáncer gástrico y no han indicado una relación entre el bajo índice de masa corporal y el cáncer gástrico [90-93], mientras que los estudios prospectivos han cedido resultados contradictorios [84, 89, 94-102]. En su conjunto, la obesidad no parece jugar un papel importante en la etiología del cáncer gástrico distal del cardias.
Por reflujo gastroesofágico
cáncer del cardias gástrico se asocia positivamente con las exposiciones de reflujo gastroesofágico, la obesidad y el tabaco de fumar [ ,,,0],103]. La obesidad y el reflujo se asocian entre sí, pero ambos también son factores de riesgo independientes del cáncer de cardias [104]. La actividad física
Sólo en algunos estudios se ha investigado la actividad física en relación con el riesgo de cáncer gástrico. Un estudio prospectivo ha demostrado un aumento del riesgo asociado a las medidas de aumento de la actividad [105], mientras que otros no han demostrado ninguna asociación [106, 107]. Un estudio de cohorte prospectivo reciente en Noruega, por otro lado, indicó que la actividad física recreativa protege contra el cáncer gástrico [101]. Otro estudio prospectivo de gran tamaño que investiga el cáncer gástrico en relación con la actividad física en una cohorte de hombres y mujeres en Estados Unidos encontró evidencia de una reducción en el riesgo, la asociación inversa con la actividad física fue más fuerte para adenocarcinoma de cardias gástrico no [108]. Un mecanismo biológico que une la actividad física a una disminución del riesgo de riesgo de cáncer gástrico es deficiente, sino múltiples vías son plausibles, por ejemplo, una predisposición genética de las personas habitualmente activas [109], una función inmune mejorada con el aumento de nivel y la actividad de las células asesinas naturales inhibidores de tumores [110] de circulación, sobre regulación de la actividad de los sistemas scavenger libres y niveles de oxidantes [111, 112 ], y la disminución de los niveles de insulina y factores de crecimiento de tipo insulina [113]. el consumo de sal
la hipótesis de que la ingesta de sal en la dieta alta aumenta el riesgo de adenocarcinoma gástrico se generó en la década de 1960, y la evidencia ha ganado el apoyo de , los estudios ecológicos de caso-control y de cohorte, principalmente de los países asiáticos de alta incidencia, en los últimos decenios [67, 68, 114, 115]. La incidencia de caída de esta malignidad ha coincidido con la propagación de la refrigeración, que debe ser inversamente asociado con la salazón y otros métodos basados en la sal de conservación de alimentos [68]. La sal se cree que aumenta el riesgo de adenocarcinoma gástrico a través de la inducción de la inflamación crónica de la mucosa gástrica. Una alta concentración de sal en la mucosa gástrica podría conducir a la erosión difusa, y la proliferación inducida en el medio ambiente inflamado podría promover el efecto de carcinógenos derivados de alimentos [22]. Sin embargo, pocos estudios prospectivos han evaluado la asociación entre la ingesta de sal con el riesgo de adenocarcinoma gástrico, especialmente en las sociedades occidentales, y los resultados de estos estudios han sido inconsistentes, lo que deja algunas dudas sobre el papel de la sal en la etiología del cáncer gástrico [114] . Los autores de un estudio reciente del consumo de sal y el riesgo de cáncer gástrico llegaron a la conclusión, sin embargo, esta limitación de sal y alimentos salados es una estrategia práctica para la prevención del cáncer gástrico [116].
Las exposiciones ocupacionales ¿Cuántas estudios de cáncer gástrico tienen llevado a cabo en los entornos laborales. Existe evidencia de que las ocupaciones en el carbón y la minería del estaño, procesamiento de metales, particularmente de acero y hierro, y las industrias de fabricación de caucho conduce a un mayor riesgo de cáncer gástrico [117]. Otras ocupaciones "polvo" también han sido implicados, pero la evidencia no es fuerte [118-121]. La mayor parte de estas investigaciones han utilizado los títulos de trabajo como un sustituto de la exposición de las exposiciones cancerígenas específicas [117], y con frecuencia ha habido una falta de información con respecto a posibles factores de confusión. Por lo tanto, el potencial efecto dañino de varias exposiciones ocupacionales específicos sigue siendo incierto.
El estatus socioeconómico
estatus socioeconómico bajo consistentemente se ha demostrado que se asocia con un mayor riesgo de cáncer gástrico [2, 122], y los últimos datos también soporta una relación similar con el cáncer de cardias [99, 123]. El estatus socioeconómico es un proxy potencial de una serie de factores, por ejemplo, patrones de estilo de vida, los hábitos dietéticos, el IMC, la infección por H. pylori
y el hábito de fumar [124]. Algunos investigadores también hacen hincapié en la influencia potencial sobre el riesgo de enfermedad de las actividades de mercadeo comercial, la posición social relativa, los niveles de ingreso y educación (a menudo utilizados como medidas representativas de la condición socioeconómica), el acceso al sistema de salud, y la fuerza o la ausencia de redes sociales [125]. Siguiendo estas líneas de argumentación, el factor H. pylori ambiental
que ha atraído más atención últimamente podría ser visto como uno de los agentes causales subyacentes a la afirmación "la pobreza es un carcinógeno."
Las hormonas sexuales femeninas comentario El todavía inexplicable 2-3: 1 predominio masculino en el cáncer gástrico ha llevado a la hipótesis de que las mujeres premenopáusicas están protegidos de desarrollo de adenocarcinoma gástrico en virtud de su alta exposición al estrógeno endógeno. El hallazgo global que las mujeres desarrollan el tipo intestinal de adenocarcinoma gástrico en promedio 10-15 años más tarde que los hombres [126], y que la incidencia de este tipo de cáncer aumenta después de la menopausia, ha despertado un interés en nuevas investigaciones. Un estudio prospectivo indica que la terapia de reemplazo hormonal con estrógenos se asocia con una reducción del riesgo de cáncer gástrico, especialmente de la página no cardias [127]. Otros estudios han demostrado indicaciones adicionales que favorecen tal asociación [128]. Sin embargo se necesita más investigación antes de que se ha demostrado un efecto tan potencial.
Otras causas
cirugía gástrica previa para condiciones benignas se ha demostrado que se asocia con el cáncer gástrico [129, 130]. Veinte años después de la resección gástrica para una enfermedad benigna se ha encontrado que aumentar el riesgo relativo. El riesgo de cáncer en el remanente gástrico (cáncer "muñón") puede relacionarse con la producción de nitrosaminas por las bacterias en el remanente de estómago relativamente hypoacidic o como resultado del daño bilis a largo plazo para la mucosa gástrica. Sin embargo, ya que la enfermedad de úlcera péptica está también relacionada con el cáncer gástrico, la relación entre la cirugía gástrica para esta condición benigna y el cáncer gástrico es difícil establecer [131].
Hay un exceso de riesgo de desarrollar adenocarcinoma gástrico en personas con anemia perniciosa . Esto parece ser una enfermedad autoinmune que conduce a tipo de gastritis atrófica crónica A (tipo B está representado por H. pylori
gastritis relacionada) se encuentra principalmente en el cuerpo del estómago [132]. La gastritis atrófica es una etapa en el modelo de carcinogénesis gástrica de Correa y debe ser considerado como un estado pre-maligna si se encuentra en un paciente, incluso en ausencia de infección por H. pylori
.
virus de Epstein-Barr pueden desempeñar un papel etiológico en un subconjunto de los adenocarcinomas gástricos [133, 134]. Este virus es ubicuo en todas las poblaciones humanas, y alrededor de 10% de los cánceres gástricos a través de la proliferación monoclonal mundo muestran de células infectadas por virus de Epstein-Barr [135]. En contraste con el linfoma de Burkitt y el carcinoma nasofaríngeo, las cuales son endémicas en África y el Sudeste de Asia, de Epstein-Barr-positivos cánceres gástricos son no endémica y se distribuye de manera más uniforme en todo el mundo [135]. cáncer gástrico linfoepitelioma podría ser la principal, si no el único cáncer, el cáncer gástrico positivo para Epstein-Barr [136].
Un aumento del 20% en el riesgo relativo de cáncer gástrico entre las personas con grupo sanguíneo A, en comparación con aquellos con el grupo sanguíneo 0, ya se informó en 1953 [137]. Esta diferencia se ha atribuido a la naturaleza de la secreción de mucopolisacáridos en el estómago de los grupos sanguíneos A los individuos, y para una mayor susceptibilidad a los carcinógenos ingeridos.
Seguimiento de los sobrevivientes de las bombas atómicas, expuestas a la radiación ionizante, ha revelado un aumento del riesgo de cáncer gástrico, así como de cáncer en muchos otros sitios [96, 138].
Los pacientes con inmunodeficiencia primaria tienen un mayor riesgo de desarrollar neoplasias hematológicas, ya veces también el carcinoma. El riesgo de desarrollar gastritis crónica atrófica, metaplasia y cáncer distal parece ser especialmente pronunciado [139]. Real Pronóstico
Casi dos tercios de todos los casos de cáncer gástrico se presentan en el mundo en desarrollo. Un diagnóstico de cáncer gástrico en los países occidentales se iluminó con alguna esperanza de curación, mientras que en los países en desarrollo el diagnóstico es casi sin excepción terminales. Sin embargo, el pronóstico en el hemisferio occidental también es decepcionante, y el estimado de supervivencia a 5 años en las sociedades occidentales es solamente 24-27% [2, 140]. No ha sido sólo una ligera mejora durante los últimos 20-30 años, a pesar de todos los intentos de mejorar la supervivencia con, por ejemplo, diferentes técnicas quirúrgicas y varias combinaciones de fármacos quimioterapéuticos [141]. El pronóstico individual depende en gran medida del estadio del tumor en la presentación. En Japón, la detección se lleva a cabo para el cáncer gástrico, lo que resulta en la detección de hasta un 40% de estos cánceres en una etapa temprana con pronóstico mucho mejor como resultado [142]. En Europa, la proporción de cáncer gástrico precoz es inferior al 15% [142].
La prevención del cáncer gástrico
ensayos quimioprevención del cáncer gástrico se han intentado con éxito variable. En un ensayo chino, se encontró una reducción en la mortalidad por cáncer gástrico y la incidencia después de 5 años en personas que recibieron suplementación diaria con el beta-caroteno, vitamina E y selenio [143]. Un estudio realizado en una población de bajo riesgo de los médicos varones no mostró efecto del beta-caroteno después de un promedio de 12 años de seguimiento [144]. Varios estudios han demostrado la prevención de la progresión de cambios en la mucosa preneoplásicas después de H. pylori
erradicación y la suplementación con antioxidantes [145-147]. En un reciente ensayo clínico en una zona de alto riesgo en Venezuela, la suplementación con vitaminas antioxidantes no se ha encontrado útil en la prevención de las lesiones precancerosas gástricas [148]. Un ensayo en una zona de alta incidencia en Colombia estudió diversas intervenciones en lesiones precancerosas al inicio del estudio.
 Hemorroides:10 cosas que los médicos gastrointestinales quieren que sepas
Hemorroides:10 cosas que los médicos gastrointestinales quieren que sepas
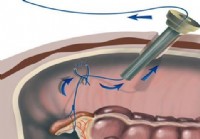 ¿Qué es una técnica de apendicectomía por puerto único?
¿Qué es una técnica de apendicectomía por puerto único?
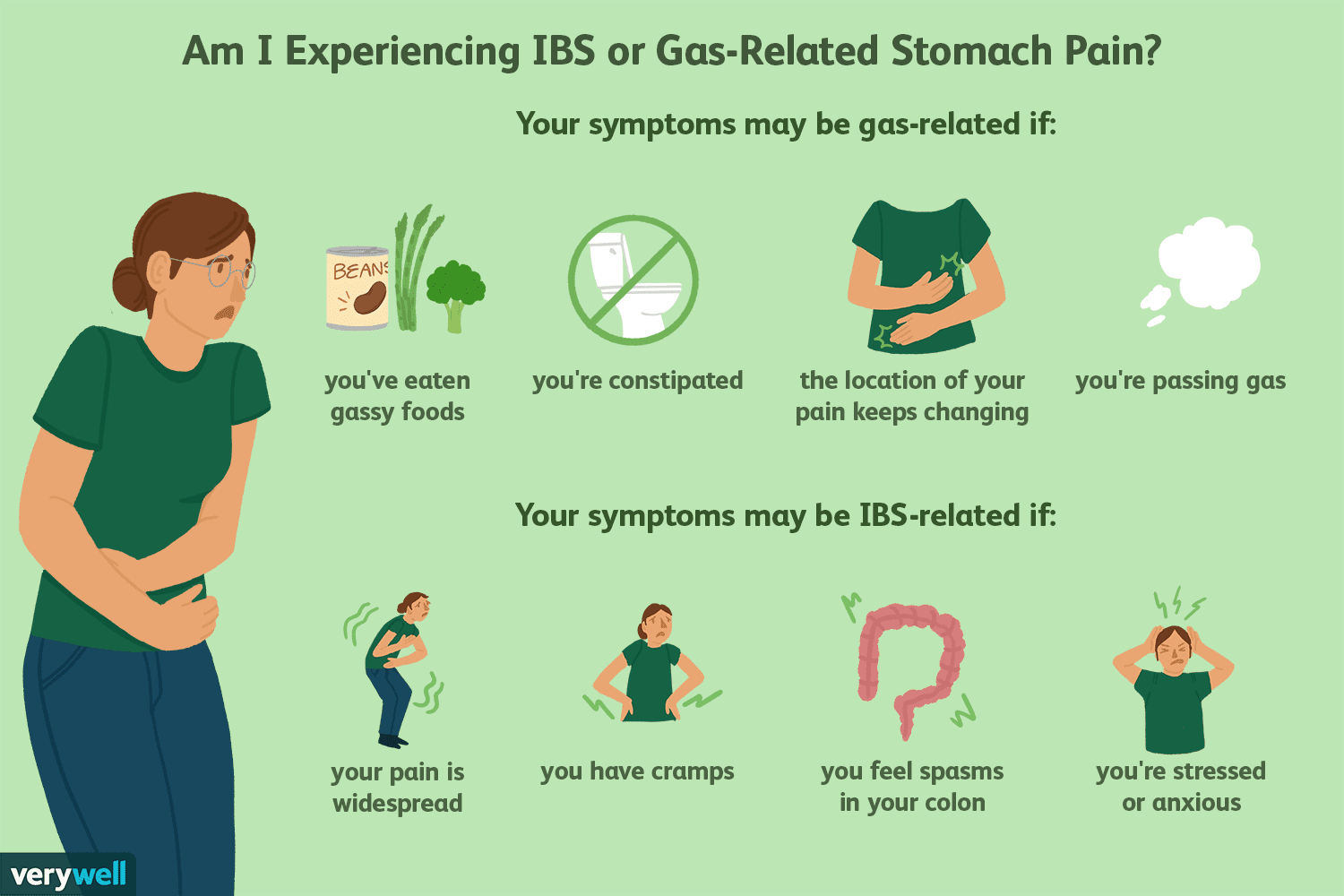 Dolor por gas atrapado y otras fuentes de dolor abdominal del SII
Dolor por gas atrapado y otras fuentes de dolor abdominal del SII
 La disbiosis de la microbiota oral causa problemas intestinales y de salud
La disbiosis de la microbiota oral causa problemas intestinales y de salud
 Manejo de problemas digestivos después de una histerectomía
Manejo de problemas digestivos después de una histerectomía
 Cómo ayudar a su hijo a desarrollar un microbioma intestinal fuerte
Cómo ayudar a su hijo a desarrollar un microbioma intestinal fuerte
 ¿Cuánto tiempo se puede vivir con nefritis lúpica?
Con el tratamiento adecuado, se espera que del 80 al 90 por ciento de las personas con nefritis lúpica vivan durante su vida normal. La nefritis lúpica (inflamación del riñón) es una enfermedad ren
¿Cuánto tiempo se puede vivir con nefritis lúpica?
Con el tratamiento adecuado, se espera que del 80 al 90 por ciento de las personas con nefritis lúpica vivan durante su vida normal. La nefritis lúpica (inflamación del riñón) es una enfermedad ren
 ¿Los cálculos biliares pueden desaparecer por sí solos?
¿Qué es la vesícula biliar? Algunos cálculos biliares pueden disolverse y desaparecer con una intervención, mientras que otros necesitan un tratamiento más extenso. La vesícula biliar Es un pequeñ
¿Los cálculos biliares pueden desaparecer por sí solos?
¿Qué es la vesícula biliar? Algunos cálculos biliares pueden disolverse y desaparecer con una intervención, mientras que otros necesitan un tratamiento más extenso. La vesícula biliar Es un pequeñ
 Así es como su intestino y digestión influyen en su sueño
Descubra cómo interactúan el intestino y el sueño para influir en la digestión, el metabolismo e incluso la salud mental, y cómo aprovechar el poder del sueño para mejorar el bienestar. Hay muchas ra
Así es como su intestino y digestión influyen en su sueño
Descubra cómo interactúan el intestino y el sueño para influir en la digestión, el metabolismo e incluso la salud mental, y cómo aprovechar el poder del sueño para mejorar el bienestar. Hay muchas ra