inhibición de la H gástrica, la actividad K-ATPasa gástrica y de las células epiteliales de la secreción de IL-8 por el pirrolizina derivado ML 3000
Resumen
Antecedentes
ML 3000 ([2,2-dimetil-6- (4-clorofenil) -7-fenil-2,3-dihidro-1H-pirrolizina-5-il] -acético) es un inhibidor tanto de la ciclooxigenasa y 5-lipoxigenasa in vitro, y se muestra prometedor como un nuevo fármaco no esteroide antiinflamatorio (NSAID). A diferencia de los AINE convencionales que se asocian con efectos ulcerogénicos gástricos, ML 3000 causa poco o ningún daño a la mucosa gástrica, a pesar de que deprime significativamente la síntesis de prostaglandinas gástricas.
Métodos
Como parte de un esfuerzo por aclarar los mecanismos que subyace a la gástrico ahorradores de propiedades de ML 3000, se estudiaron los efectos de ML 3000 en H, K-ATPasa actividad in vitro, sobre la acumulación de ácido en las células parietales gástricas aisladas, y en la secreción de IL-8 por las células epiteliales gástricas en cultivo.
resultados
H SCH28080 sensible, la actividad K-ATPasa en microsomas gástrico porcino altamente purificado fue dosis-dependiente inhibido por ML 3000 (CI
50 = 16,4 M). La inhibición es reversible, e insensible a ML 3000 acidificación en el rango de pH 2.0-8.0. En las células parietales gástricas de conejo, España ML 3000 acumulación de ácido estimulada por histamina inhibe de forma dependiente de la dosis (IC 50 = 40 M) y la acumulación de ácido estimulada por forskolina (IC 50 = 45 M). Por último, en células de adenocarcinoma gástrico humano (AGS), ML 3000 dependiente de la dosis inhibió tanto la línea de base y la IL-1β estimulada (20 ng /ml) IL-8 secreción con IC 50 años de 0,46 M y 1,1 M respectivamente.
Conclusión
Los datos indican que ML 3000 afecta a los mecanismos de ácido-secretoras aguas abajo de la movilización de AMPc inducidos por la histamina de activación H 2 receptor, que inhibe directamente H, actividad específica K-ATPasa, y que la célula epitelial gástrica basal inhibición de la secreción de IL-8 puede ser mediada por ML 3000 inhibición de la actividad de 5-lipoxigenasa. Llegamos a la conclusión de que estos datos de inhibición de la función gástrica puede ser la base de las propiedades ahorradores gástricos de ML 3000. Antecedentes
Las propiedades farmacológicas de los fármacos anti-inflamatorios no esteroideos (AINE) se derivan de su supresión de la síntesis de prostaglandinas a partir del ácido araquidónico [1] . sin embargo inhibición de la síntesis de prostaglandinas gástricas se acompaña de disminución del flujo sanguíneo de la mucosa gástrica, con la sensibilidad de la mucosa concomitante a la lesión tópica por una variedad de irritantes [2]. Una estrategia farmacológica prometedora para evitar complicaciones gástricas de la administración de NSAID se centra en ciclooxigenasa concurrente y la inhibición de 5-lipoxigenasa, con el objetivo de la supresión de la síntesis de leucotrienos. 5-lipoxigenasa convierte el ácido araquidónico en leucotrienos, entre los que el leucotrieno B4 es quimiotáctico para los leucocitos y de este modo contribuye a mecanismos inflamatorios que conducen a úlceras gastrointestinales [3]. El pirrolizina derivado ML 3000 ([2,2-dimetil-6- (4-clorofen-il) -7-fenil-2,3-dihidro-1H-pirrolizina-5-il] -acético) es un inhibidor de ambas la ciclooxigenasa y 5-lipoxigenasa in vitro [4, 5], y se muestra prometedor como un nuevo AINE. ML 3000 reduce la síntesis de la prostaglandina E2 gástrico en el estómago de la rata y la sangre, aunque no se detectó una inhibición significativa de la síntesis de B4 gástrico o de los leucotrienos en la sangre [6]. Lo más importante, ML 3000 no tiene efecto sobre la adhesión de leucocitos en las vénulas mesentéricas, y no causa ningún daño de la mucosa gástrica [6].
En modelos animales, ML 3000 se encontró que ser farmacológicamente benigna. Por lo tanto, el compuesto no afectó a la actividad locomotora de la rata o el sueño hexobarbital inducida, no tuvo efectos cardiovasculares o respiratorias en ratas y perros, se afectará sin sobre la función neuromuscular en los gatos, y causado ni daño gástrico ni perturbación peristáltica [7]. ML 3000 provocó una respuesta espasmogénica débil en el íleon de cobaya, y causó una pequeña reducción transitoria en la producción de orina en ratas [7]. Los estudios de genotoxicidad indicar que ML 3000 no tiene efectos sobre las frecuencias de mutación génica en bacterias o células de mamífero, en la síntesis de ADN no programada, o en la frecuencia de aberraciones cromosómicas en las células de médula ósea de rata [8]. ML 3000 estudios de distribución y excretor marcadas con 14C en ratas indican la circulación enterohepática y conjugación glucurónido de ML 3000 [9]. Francia El perfil farmacológico de ML 3000 como estudiado en modelos animales muestran efectos antiinflamatorios, analgésicos, antipiréticos, actividad antiasmática, y antiaggregative a una dosis que no causa ningún daño gástrico [4, 10]. Las propiedades agudas y crónicas anti-inflamatoria de ML 3000 estudiaron en la rata modelo de edema de la pata inducido por adyuvante [11] muestran que, aunque la indometacina es un tanto más potente como un agente anti-inflamatorio, no hay daño gástrico se observó con ML 3000 hasta 100 mg /kg /d po, mientras que la dosis ulcerogénica (UD 50) para la indometacina fue 7 mg /kg /d po
ulceración gástrica inducida por AINE limita significativamente la utilidad de estos fármacos. Claramente, la combinación de propiedades ahorradores anti-inflamatorias y gástricas exhibidas por ML 3000 hace de este compuesto un candidato atractivo para el estudio adicional. Dos funciones de la mucosa gástrica que desempeñan papeles importantes en la ulceración gástrica son la secreción de ácido y la interleucina-8 secreción. inhibidores de la secreción de ácido se encuentran entre los medicamentos más recetados altamente, lo que refleja el dicho fisiológica "Sin ácido, no úlcera". Violación farmacológicos o fisiopatológico de las barreras de la mucosa gástrica a la parte posterior difusión de HCl conduce a una rápida erosión de la monocapa epitelial gástrica y la consiguiente ulceración de la mucosa. La inhibición de la secreción de ácido por el antagonismo en el receptor de la histamina de las células parietales H2 (cimetidina), o por derivatización covalente directo y la inactivación de la bomba gástrica de protones (omeprazol, lansoprazol, rabeprazol, esomeprazol, etc) es de rutina para la mejora y la promoción de la curación de gástrico úlceras. Por lo tanto, los efectos ahorradores gástricos de ML 3000 pueden estar relacionadas con la inhibición de la secreción de ácido por el compuesto.
Un efecto de ahorro gástrico complementaria de ML 3000 puede implicar la modulación de la secreción gástrica de la citoquina pro-inflamatoria IL-8. lesión gástrica inducida por aspirina se ha informado que se asocia con aumento de la producción antral de IL-8 [12]. La bacteria Helicobacter pylori ulcerogénico
se ha demostrado que aumenta la velocidad y la amplitud de IL-8 secreción tanto in vitro como in vivo [13-15], y a un máximo de regular IL-8 la expresión del gen [16]. efectos de IL-8 prosecretory similares se observan como un resultado de la estimulación de IL-1β de las células epiteliales gástricas. Comparación de los efectos de ML 3000 y de otros AINE en estas actividades secretoras gástrico puede dilucidar el mecanismo por el cual ML 3000 impide la formación de lesiones de la mucosa gástrica.
A fin de aclarar mecanismos subyacentes a la gástrico ahorradores de propiedades de ML 3000, se investigado el efecto de ML 3000 en dos funciones gástricas secretoras de la mucosa con funciones en la ulcerogénesis: secreción de ácido clorhídrico, y la secreción de la citoquina inflamatoria interleuquina-8. Nuestros datos muestran que ML 3000 inhibe cerdo gástrico microsomal H, la actividad K-ATPasa, inhibe la acidificación estimulada por histamina en las células parietales gástricas de conejo, e inhibe la IL-1β estimulada por IL-8 secreción por las células epiteliales gástricas humanas.
Métodos
Reactivos
ML 3000 y ZD-2138 fueron proporcionados por Forest Laboratories, Inc., Nueva York, NY, omeprazol fue proporcionado por AstraZeneca R & D, Mölndal, Suecia, SCH 28080 era de Schering-Plough Research Institute, Kenilworth, NJ, TEDBC vino de Tocris Cookson, Inc., Ballwin, MO, y NS 398 vino de Cayman Chemicals, Inc., Ann Arbor, MI. El ácido araquidónico, indometacina, ácido acetilsalicílico, naproxeno, PGE 2, leucotrienos B4 y D4, y la IL-1β fueron adquiridos de Sigma-Aldrich Corp., St. Louis, MO. Sulfóxido de dimetilo (Sigma-Aldrich) se utilizó para solubilizar ML3000, SCH28080, ZD-2138, TEDBC, NS 398, y la indometacina. ácido acetil salicílico y el naproxeno se disolvieron en tampón de ensayo ATPasa (vide infra
). El ácido araquidónico y PGE 2 se disolvieron en etanol absoluto, y omeprazol se disolvió en metanol. Los leucotrienos B4 y D4 fueron suministrados disuelto en una mezcla 70:30 de metanol y acetato de amonio 17 mM. IL-1β se disolvió en solución salina tamponada con fosfato (pH 7,4), 0,1% w /v albúmina de suero bovino. Todos los ensayos que utilizan estos compuestos incluyen controles de disolvente apropiado, y todos los disolventes estaban presentes en concentraciones de menos de 1% w /v en la mezcla final del ensayo.
Preparación de H, K-ATPasa
microsomal gástrico H, K-ATPasa se preparó a partir de cerdos homogeneizados de mucosa gástrica por diferencial y sacarosa /Ficoll centrifugación en gradiente de paso tal como se describe anteriormente [17]. Esta preparación produce una relativamente pesado (7% de Ficoll /interfaz de la sacarosa 1,1 M) fracción microsomal GII, que no mostró latencia de la actividad de K-ATPasa, y que comprendía ~ 90% H, K-ATPasa, basado en la densitometría de una banda de 94 kDa por análisis de SDS-PAGE. microsomas GII se almacenaron a -80 ° C en 20% de glicerol.
H, K-ATPasa Ensayo
actividad hidrolítica del ATP de microsomas gástricas porcinas se cuantificó como la liberación de ortofosfato de ATP sustrato utilizando un procedimiento de verde de malaquita colorimétrico [18] . ATPasa ensayos se llevaron a cabo en microplacas de 96 pocillos. Brevemente, 100 l de tampón /pocillo de ensayo (60 mM Tris-HCl, pH 7,4, MgCl 2 mM 2, mM EGTA 1, ± KCl 7,5 mM, ± 50 M SCH28080), que contiene 80 ng microsomal H, K-ATPasa , ML 3000 (10 -9 M a 10 -4 M) u otros compuestos, y 1 mM ATP se incubó durante 30 min a 37 ° C. La actividad enzimática se detuvo por adición (45 l /pocillo) de reactivo colorimétrico (0,07% verde de malaquita, 3,7 NH 2SO 4, 2,27% de tetrahidrato de molibdato de amonio, 0,134% de Tween-20). Después de 10 segundos, la reacción de color se desarrolló mediante la adición (45 l /pocillo) de citrato de sodio 15%. Después de 45 min a temperatura ambiente, absorbancia de los pocillos a 570 nm se midió en un lector de microplacas.
A medir los efectos de ML 3000 acidificación sobre la inhibición de la ATPasa, ML 3000 alícuotas (10 mM en 5 mM Tris-HCl) eran titulada a pH que van desde 2,0 hasta 7,4 durante 30 min. microsomas gástricos en suspensión en tampón de ensayo ATPasa estándar a pH 7,4 se incubaron durante 30 min con partes alícuotas acidificada de ML 3000 (16,6 M concentración final ML 3000) y luego la actividad de ATPasa se midió como se ha descrito anteriormente. Para medir la inhibición de la actividad de omeprazol H, K-ATPasa, microsomas gástricas en suspensión en tampón de ensayo ATPasa a pH 6,1 se incubaron durante 30 min con concentraciones variables de omeprazol. la acidificación de omeprazol a pH 6,1 era necesario para permitir la formación del sulfóxido reactivo con tiol inhibidor intermedio [19]. Los microsomas gástricos se transfirieron a tampón de ensayo ATPasa estándar a pH 7,4, y se midió la actividad de ATPasa como se describe anteriormente. La actividad específica H, K-ATPasa se calculó como la diferencia en las actividades microsomal ATPasa en presencia y ausencia de la H gástrica reversible específicos, K-ATPasa SCH28080 inhibidor, y se expresó como pmoles P i /mg de proteína /hr. H, K-ATPasa actividad de microsomas gástrica de cerdo recién preparado varió de 140 a 170 moles de p i /mg de proteína /hr. Representación gráfica de los datos muestra el porcentaje de inhibición de la actividad de H, K-ATPasa como una función de concentraciones de compuesto. Se aislaron
célula primaria Preparación
células parietales gástricas de conejos blancos de Nueva Zelanda mediante digestión con pronasa /colagenasa de mucosa fúndica seguido por enriquecimiento de células en gradientes discontinuos Nycodenz como se describe anteriormente [20]. preparaciones de células parietales contenían aproximadamente 10 7 células /estómago, de los cuales 80 ± 5% son células parietales basado en inmunocitoquímica con H, anticuerpo monoclonal K-ATPasa específica Acumulación de ensayo de ácidos.
acumulación aminopirina en parietal las células se evaluó en 96 placas de filtro así con membranas Durapore, como se describe anteriormente [21]. Brevemente, las células se preincubaron con [ 14C] -aminopyrine y luego 100.000 células /200 l por pocillo se incubaron con o sin compuestos de ensayo durante 15 minutos antes de la incubación durante 30 min en ausencia o presencia de 100 mM de histamina o 100 mM de forskolina. Todas las determinaciones se realizaron por cuadruplicado. acumulación aminopirina Basal se determinó como la acumulación aminopirina en las células no tratadas restados de acumulación en presencia de KSCN (un reflejo de isótopo no específica atrapando). Representación gráfica de los datos muestra el porcentaje de inhibición de la acumulación de ácido estimulada por histamina por las células como una función de la concentración de estos compuestos.
células gástricas Adenocarcinoma
células de adenocarcinoma gástrico humano (células AGS, ATCC CRL 1739), se mantuvieron en AGS medio (F-12 de Ham, suero bovino fetal 10%, 100 unidades /ml de penicilina G, 0,25 ug /ml de anfotericina B, 100 ug /ml de estreptomicina) a 37 ° C en un CO 5% 2/95% de aire incubadora y se utiliza entre los pasajes 42 y 56. para los estudios de secreción de IL-8, las células AGS se sembraron en placas de 96 pocillos (50.000 células /100 l /pocillo) y se dejó que se adhirieran durante 18 horas a 37 ° C en 5% CO 2/95% de aire. Las células fueron incubadas con los compuestos de ensayo en presencia y en ausencia de IL-1β durante 24 horas, en la que se extraen muestras de tiempo de medio de los pocillos y se almacenaron a -70 ° C. IL-8 concentraciones de las muestras se determinaron mediante un ensayo de inmunoabsorción ligado a enzimas (IL-8 humana Duo-Set sistema de desarrollo de ELISA, R & D Systems Inc, Minneapolis, MN). Representación gráfica de los datos muestra el porcentaje de inhibición sin estimular o se estimularon la secreción de IL-8 en función de la concentración de estos compuestos Análisis estadístico
Todos los experimentos se llevaron a cabo al menos tres veces.; puntos de datos en cada ensayo representan medios de medición de muestras por triplicado. Los puntos de datos se ajusta una ecuación logística de tres parámetros se graficaron como curvas de dosis-respuesta sigmoidal utilizando el paquete estadístico Prism (GraphPad Software, Inc., San Diego, CA). Las concentraciones inhibitorias mitad de la máxima (IC 50) e IC 50 95% intervalos de confianza (IC) también se calcularon usando Prism. Los puntos de datos que no encajan una logística de tres parámetros se dibujan como curvas simples punto a punto. error estándar fue la medida de la varianza se utiliza para barras de error en la representación gráfica de los datos
Resultados
Efectos de ML 3000 en H, K-ATPasa actividad
gástrico H, K-ATPasa actividad fue dosis-dependiente inhibido por ML 3000, con una concentración inhibitoria media-máxima (IC 50) de 16,4 M (IC = 6,84 a 39,3 M) (Figura 1A). La actividad inhibidora de ML 3000 se comparó con la de un inhibidor de la bomba de protones clásica (PPI), el benzimidazol sustituido omeprazol. La Figura 1B muestra el efecto de omeprazol en la actividad H, K-ATPasa bajo condiciones de ensayo idénticas a las de la Figura 1A; el CI calculado 50 para el omeprazol fue de 1,7 M (IC = 0,26 - 11.3 m). Estos datos muestran que ML 3000 es considerablemente menos potente que el omeprazol con respecto a H gástrico, actividad inhibidora K-ATPasa, al menos en el entorno de este particular, ensayo in vitro en las condiciones especificadas. Para determinar si ML 3000 muestra propiedades ácido-activación comparables, una concentración inhibitoria media-máxima de ML 3000 se ajustó a diferentes valores de pH y se midieron los efectos sobre la actividad H, K-ATPasa. Como se muestra en la Figura 2A, la acidificación de ML 3000 no tuvo un efecto significativo en su H, el perfil inhibidor K-ATPasa. Estos datos indican que ML 3000, en contraste con omeprazol, no requiere la acidificación para la inducción de la actividad inhibidora. Dado que los IBP son inhibidores irreversibles de la actividad H, K-ATPasa, la unión covalente a la subunidad catalítica α, hemos tratado de determinar si la inhibición de ML 3000 H, K-ATPasa fue reversible o irreversible. H gástrico, microsomas enriquecidos-K-ATPasa se trataron con una concentración máximamente inhibidora de ML 3000 y después se diluyó con un gran exceso de tampón para reducir la concentración de 3000 ML de 100 mM a 3,3 mM. Los resultados, mostrados en la Figura 2B, indican que la dilución de ML 3000 restauró la actividad H, K-ATPasa, y son consistentes con ML 3000 H inhibir, la actividad de K-ATPasa de una manera reversible, es decir., ML 3000 no lo hace de forma covalente derivatizar cualquiera subunidad de la H gástrico, K-ATPasa, al menos bajo las condiciones de la presente ensayo in vitro de la actividad de H, K-ATPasa. A este respecto, ML 3000 es cinéticamente similar a SCH28080, el inhibidor reversible específico de gástrico H, K-ATPasa. Figura 1 la inhibición dependiente de la dosis de la actividad de H, K-ATPasa por ML 3000 (A) y por el omeprazol (B). (UN). microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 7,4 se incubaron durante 30 min con concentraciones variables de ML 3000 y la actividad de ATPasa se midió a continuación a pH 7,4. La concentración inhibitoria semimáxima (IC50) de ML 3000 fue de 16,4 M (IC = 6,84 a 39,3 M). (SEGUNDO). microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 6,1 se incubaron durante 30 min con concentraciones variables de omeprazol, y luego transferidos a tampón de ensayo ATPasa estándar a pH 7,4 por medida de la actividad ATPasa. La IC50 para el omeprazol fue de 1,1 M (IC = 0,26 - 11.3 m). Los puntos de datos muestran la media ± S. E. a partir de tres ensayos independientes en cada uno de los cuales se midió la actividad de la ATPasa sensible a SCH28080 por triplicado.
Figura 2 Efecto de ML 3000 acidificación sobre la actividad H, K-ATPasa (A), y la inhibición ML 3000 de H, la actividad K-ATPasa es reversible (B). (A) ML 3000 alícuotas (10 mM en 5 mM Tris-HCl) se titularon a pH que van desde 2,0 hasta 7,4 durante 30 min antes de la adición de tampón de ensayo ATPasa estándar (pH 7,4) que contenía microsomas gástricos. (B) microsomas gástricas fueron tratados con una concentración máximamente inhibidora (100 mM) de ML 3000. Después se diluyó la suspensión microsomal con un gran exceso de tampón para reducir la concentración de 3000 ML de 100 mM a 3,3 mM. En ambos (A) y (B), los puntos de datos muestran la media ± S.E. a partir de tres ensayos independientes en cada una de las cuales se midió la actividad ATPasa SCH28080 sensible por triplicado.
El ácido araquidónico y la prostaglandina E 2 (PGE 2) también forma dosis-dependiente inhibido H, K-ATPasa actividad, con IC 50 de 16,7 M (IC = 8,9-31,5 mM) y 15 mM (IC = 3,96 a 57,3 M), respectivamente (Figura 3A y 3B). Desde ML 3000 también muestra la inhibición de 5-lipoxigenasa, estudiamos los efectos de dos inhibidores de la lipoxigenasa en microsomal H, la actividad K-ATPasa. Figura 4A muestra que 2- (1-tienil) etil 3,4-dihydroxybenzylidenecyanoacetate (TEDBC), un potente inhibidor de la 5-, 12-, y 15-lipoxygenses, inhibido microsomal H, la actividad K-ATPasa con una CI 50 de 22,6 M (IC = 6,3 - 81,2 m). Por el contrario, la 5-lipoxigenasa específicos inhibidor de 6 - ((3-fluor-5- (metoxi-3,4,5,6-tetrahidro-2H-piran-4-il) fenoxi) metil) quinoleína (ZD-2138 ) tenía un efecto mínimo en H, la actividad K-ATPasa (~ 20% de inhibición a 10 -5 M) (Figura 4B). Estos datos son consistentes con microsomal gástrica de 12 y 15-lipoxigenasas que juegan un papel en H, la activación de K-ATPasa, o con la interacción directa de TEDBC con H, K-ATPasa subunidades alterando la conformación de la enzima y por lo tanto la actividad. Es evidente que ambas interpretaciones son provocativos y merecen más estudio. Figura 3 Inhibición de la H, la actividad K-ATPasa por el ácido araquidónico (A) y la prostaglandina E 2 (B). microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 7,4 se incubaron durante 30 min con concentraciones variables de ácido araquidónico o de la actividad ATPasa PGE2 y a continuación se midió a pH 7,4. IC50 para el ácido araquidónico fue de 16,7 M (IC = 8,9-31,5 mM), y la IC50 para PGE2 fue de 15 M (IC = 3,96 a 57,3 m). Los puntos de datos muestran la media ± S. E. a partir de tres ensayos independientes en cada uno de los cuales se midió la actividad de la ATPasa sensible a SCH28080 por triplicado.
Figura 4 Inhibición de la actividad H, K-ATPasa por el TEDBC inhibidor de 5-, 12- y 15-lipoxigenasa (A), y la 5-lipoxigenasa inhibidor ZD-2138 (B). microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 7,4 se incubaron durante 30 min con concentraciones variables de TEDBC o ZD-2138 y la actividad de ATPasa se midió a continuación a pH 7,4. En (A), los puntos de datos muestran una actividad ATPasa SCH28080 sensible media medida por triplicado en uno de tres ensayos independientes; se muestran datos típicos. Los puntos de datos del mundo del espectáculo (B) media ± S. E. a partir de tres ensayos independientes en cada una de las cuales se midió la actividad ATPasa SCH28080 sensible por triplicado.
Con el fin de comparar el efecto inhibidor H, K-ATPasa de ML 3000 con otros AINE, medimos los efectos del ácido acetilsalicílico, NS 398, naproxeno, indometacina y sobre la actividad de la bomba de protones. Los cuatro AINE fueron sin efectos inhibidores sobre microsomal H, la actividad K-ATPasa en concentraciones de hasta 10 -4 M (10 -3 M para el ácido acetil salicílico) (Figura 5A, 5B, 5C y 5D). La indometacina se había informado anteriormente para inhibir H gástrica, K-ATPasa en algo más alta concentración (K i = 0,67 × 10 -3 M) [22]. Nuestros datos diferencian claramente ML 3000 de otros AINE en términos de efecto inhibidor sobre el H gástrica, la actividad K-ATPasa; la base mecánica de esta diferencia, y la posible correlación con la propiedad gástrico con conservación observada de ML 3000, aún no se han investigado. Figura 5 Efectos del ácido acetil salicílico, NS 398, naproxeno, indometacina y sobre la actividad de H, K-ATPasa. microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 7,4 se incubaron durante 30 min con concentraciones variables de ácido acetil salicílico, NS 398, naproxeno o indometacina y la actividad de ATPasa se midió a continuación a pH 7,4. Los puntos de datos muestran una actividad ATPasa sensible SCH28080 media medida por triplicado en uno de tres ensayos independientes; Los datos típicos se muestran en cada caso.
Por último, a fin de establecer si la inhibición ML 3000 de H gástrico, K-ATPasa refleja los efectos del compuesto sobre las vías metabólicas de los leucotrienos funcionales putativos presentes en microsomas gástrico de cerdo, se estudiaron los efectos de leucotrieno B4 y D4 en la actividad H, K-ATPasa. problemas de solubilidad impidieron el estudio de las concentraciones de LTB4 o LTD4 mayores de 1 mM. Como se muestra en la Figura 6A y 6B, ni de leucotrienos mostró ninguna actividad inhibidora frente a H, K-ATPasa a concentraciones fisiológicas (10 -9-10 -8 M); sólo a concentraciones no fisiológicas de más de 10 -7 M estaba allí cualquier atenuación significativa de la actividad de H, K-ATPasa. Figura 6 Efectos de los leucotrienos B4 y D4 en H sensible SCH28080, actividad específica K-ATPasa. microsomas gástricos en suspensión en tampón de ensayo ATPasa a pH 7,4 se incubaron durante 30 min con concentraciones variables de leucotrieno B4 o leucotrieno D4 y actividad de ATPasa se midió a continuación a pH 7,4. Los puntos de datos muestran la media ± S. E. a partir de tres ensayos independientes en cada una de las cuales se midió la actividad ATPasa SCH28080 sensible por triplicado.
Efectos de ML 3000 sobre la acumulación de ácido estimulada por histamina célula parietal gástrica
ML 3000 dosis-dependiente inhibido estimulada por histamina (100 M) la acumulación de ácido por las células parietales gástricas de conejo, con una concentración inhibitoria media-máxima (IC 50) de 40 mM (figura 7A). ML 3000 también dependiente de la dosis (100 mM) la acumulación de ácido estimulada por forskolina inhibido por las células parietales gástricas de conejo, con una CI 50 de ~ 45 M (Figura 7B). Estos datos indican que ML 3000 afecta ácido secretora mecanismos celulares parietal aguas abajo de la movilización de cAMP inducida por la histamina H 2 activación del receptor. Los datos son consistentes con ML 3000 de inhibición de la secreción ácida de las células parietales que resulta de la interacción directa de ML 3000 con el H gástrico, K-ATPasa. Sin embargo, el discepancy entre ML 3000 IC 50 en vesículas microsomales (15 mM) y en las células parietales aisladas (40-45 m) sugiere que ML 3000 el acceso a la H intracelular, compartimento K-ATPasa en las células parietales se puede disminuir por las limitaciones de permeabilidad en la membrana plasmática. Alternativamente, ML 3000 puede estar sujeto a modificaciones metabólicas citoplasmáticas que limitan la potencia inhibidora del compuesto. Figura 7 ML 3000 inhibe la acumulación de ácido en las células parietales gástricas de conejo. (A) la inhibición dependiente de la dosis por ML 3000 de (100 mM) la acumulación de ácido estimulada por histamina por las células parietales gástricas de conejo (IC50 = 40 m). (B) la inhibición dependiente de la dosis por ML 3000 de (100 mM) la acumulación de ácido estimulada por forskolina por las células parietales gástricas de conejo (IC50 = 45 mM). Los puntos de datos muestran la media ± S. E. a partir de cuatro ensayos independientes en cada una de las cuales se midió la acumulación de ácido en las células parietales por duplicado.
Por último, como se encontró con microsomal H, K-ATPasa, otros AINE, como el ácido acetilsalicílico, naproxeno, y NS 398 (hasta concentraciones de 10 -4 M) no tuvo ningún efecto sobre la acumulación de ácido por las células parietales de conejo aisladas (datos no mostrados)
Efectos de ML 3000 en inducida por IL-1β IL-8 secreción en el adenocarcinoma gástrico humano (AGS) células
en condiciones de línea de base, las células AGS (5 × 10 4 en 100 l de medio de cultivo) secretada IL-8 en un período de 24 horas a una concentración de ~ 225 pg medio /ml. Cuando estimulada por IL-1β (1 ng /ml), AGS células IL-8 secreción durante un período de 24 horas aumentó ~ 27 veces, a una concentración de ~ 6.000 pg /ml. ML 3000 inhibió tanto la línea de base y la IL-1β estimulada por IL-8 secreción, con CI 50 años de 0,46 M (IC = 0,09 - 2.4 M) y 1,1 M (IC = 0,52 - 2.2 M), respectivamente (Figura 8A y 8B ). Figura 8 Efectos de ML 3000 en inducida por IL-1β IL-8 secreción en células de adenocarcinoma gástrico humano (AGS). ML 3000 inhibió tanto la línea de base (A) y la IL-1β estimulada (B) IL-8 secreción, con CI50 de 0,46 M (IC = 0,09 a 2,4 M) y 1,1 M (IC = 0,52 a 2,2 M) respectivamente. El inhibidor de 5-lipoxigenasa específicos ZD-2138 mostró una inhibición dependiente de la dosis de la línea de base de células AGS IL-8 secreción (C), con una CI50 de 58 nM (CI = 15,6 a 218 nM) y el efecto mínimo sobre células AGS IL-1β estimulada por IL-8 secreción (D). Los puntos de datos muestran la media ± S. E. a partir de tres ensayos independientes en cada uno de los que la IL-8 concentraciones se midieron por triplicado. comentario El inhibidor de la 5-lipoxigenasa específica (ZD-2138), que fue sin efecto sobre microsomal H, la actividad K-ATPasa, mostró de dosis de respuesta inhibición de la línea de base de células AGS IL-8 secreción (Figura 8C), con una IC 50 de 58 nM (CI = 15,6 a 218 nM). ZD-2138 mostró un efecto mínimo sobre estimulada por IL-1β IL-8 secreción por las células AGS (Figura 8D). H, la inhibición K-ATPasa por ML 3000, que hemos demostrado en el presente estudio, no subyacen inhibición de la secreción de IL-8 en este modelo porque inmunocitoquímica con H, anticuerpo monoclonal K-ATPasa específica no muestra H, K-ATPasa expresión en células AGS (datos no mostrados).
Discusión
Este estudio proporciona información sobre los efectos de ML 3000 sobre aspectos de la fisiología gástrica relacionada con ulcerogénesis. Se investigaron tres modelos experimentales de la función gástrica; H funcional altamente purificado, K-ATPasa (bomba de protones) aisladas de la mucosa gástrica de los cerdos de matadero, células parietales gástricas de conejo aisladas, y las células de adenocarcinoma gástrico humano en cultivo. En el primer modelo, ML 3000 inhibió la bomba de protones con una CI 50 de 16,4 mM. El inhibidor de la bomba de protones (PPI) omeprazol muestra un IC 50 de 1,1 M en el mismo ensayo. A diferencia de los IBP, ML 3000 actividad inhibitoria fue independiente del pH y era reversible. NSAIDS selectivos y no selectivos no mostraron H, actividad inhibidora K-ATPasa en el mismo ensayo. En el segundo modelo, ML 3000 inhibió tanto la histamina y la acumulación de ácido estimulada por forskolina (IC 50 = 40 y 45 mM), en consonancia con ML 3000 inhibición de la bomba de protones. En el tercer modelo, ML 3000 inhibió tanto la línea de base y la IL-1β estimulada por interleuquina-8 secreción de las células AGS (IC 50 = 0,46 y 1,1 M respectivamente), aunque este último efecto parece no relacionada con la actividad inhibidora de la 5-lipoxigenasa de ML 3000 (Figura 8D).
Publicado IC 50 para el omeprazol con respecto a la gama de actividad de la bomba de protones gástrica de 470 nM a 36 mM dependiendo de las condiciones del ensayo [23-25]. Para otros IBP, picoprazol IC 50 es de 2 M [26], al rabeprazol IC 50 es 72 nM [23], y lansoprazol IC 50 es de 2,1 M [27]. La amplia gama de publicado PPI IC 50 valores para microsomal H, K-ATPasa refleja la necesidad mecanicista para la acidificación compuesto para permitir la formación de un sulfóxido reactivo con tiol intermedio que luego derivado contiene irreversiblemente H, K-ATPasa α subunidad residuos de cisteína principales para la inhibición del enzima.
Estos ML 3000 de datos también contrastan dramáticamente con la inhibición de omeprazol de la acumulación de ácido en las células parietales aisladas. Ácido capacidad secretora IC 50 (en las células parietales aislados) de inhibidores de la bomba de protones (IBP), tales como omeprazol, rabeprazol, y lansoprazol se encuentran en el rango nM 59-360 nM [27, 28]. La mayor potencia de los IBP en el contexto de la capacidad de secreción de ácido en comparación con microsomal H, K-ATPasa (IC 50 años que van desde 72 nM a 40 mM) refleja la activación de ácido más completa de los IBP en aislado canalículos célula parietal que ocurre en en Los ensayos in vitro de microsomas a pH 6.1 o superior. Francia El PGE 2 Los datos están en contraste con un estudio previo en el que ningún efecto inhibidor de PGE en el sector porcino H gástrica, K-ATPasa [29] se informó 2 . Las diferencias en el ensayo de ATPasa específico utilizado en este estudio pueden explicar esta discrepancia. Desde ML3000 y ácido araquidónico son anfífilos aniónicos, sus efectos inhibidores podrían resultar de interacciones específicas con H, sitios de unión de subunidades K-ATPasa, o de interacciones hidrofóbicas menos específicos con los lípidos de membrana microsomal asociados-K-ATPasa H, o una combinación de ambos factores.
la reversibilidad de la inhibición de ML 3000 de la actividad de H, K-ATPasa in vitro, que se muestra en la Figura 2B, contrasta con el carácter irreversible de la inhibición de H, K-ATPasa por benzimidazoles sustituidos, tales como omeprazol o lansoprazol.
 La protección de los pulmones durante la cirugía abdominal podría reducir las complicaciones
La protección de los pulmones durante la cirugía abdominal podría reducir las complicaciones
 Tu microbioma intestinal:donde comienza tu salud
Tu microbioma intestinal:donde comienza tu salud
 Diez maneras de ir más allá de la dieta sin gluten
Diez maneras de ir más allá de la dieta sin gluten
 ¿Por qué mi caca es verde?
¿Por qué mi caca es verde?
 5 síntomas sutiles de reflujo ácido (ERGE)
5 síntomas sutiles de reflujo ácido (ERGE)
 ¿Tengo los síntomas del síndrome del intestino permeable?
¿Tengo los síntomas del síndrome del intestino permeable?
 La dieta baja en FODMAP para principiantes
Ya sea que su médico le haya recomendado una dieta baja en FODMAP o si ha oído hablar de ella y se pregunta si puede ser una buena opción para usted, esta guía lo guiará a través de todos los concepto
La dieta baja en FODMAP para principiantes
Ya sea que su médico le haya recomendado una dieta baja en FODMAP o si ha oído hablar de ella y se pregunta si puede ser una buena opción para usted, esta guía lo guiará a través de todos los concepto
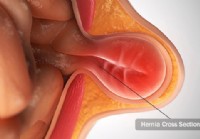 Hernias:causas, tipos y tratamientos
¿Qué es una hernia? Incluso si no tienes abdominales marcados, tu barriga todavía tiene paredes de músculos que te sostienen, te ayudan a moverte y mantienen las cosas en su lugar dentro de ti. Una
Hernias:causas, tipos y tratamientos
¿Qué es una hernia? Incluso si no tienes abdominales marcados, tu barriga todavía tiene paredes de músculos que te sostienen, te ayudan a moverte y mantienen las cosas en su lugar dentro de ti. Una
 ¿Cuánto tarda un niño en recuperarse de una apendicectomía?
¿Qué es la apendicectomía pediátrica? La mayoría de los niños podrán irse a casa dentro de un día después de una apendicectomía si el apéndice no está roto. Después de apendicectomías que involucra
¿Cuánto tarda un niño en recuperarse de una apendicectomía?
¿Qué es la apendicectomía pediátrica? La mayoría de los niños podrán irse a casa dentro de un día después de una apendicectomía si el apéndice no está roto. Después de apendicectomías que involucra