cáncer gástrico familiar: detección de una causa hereditaria ayuda a comprender su etiología
Resumen
A nivel mundial, el cáncer gástrico es una de las formas más comunes de cáncer, con una alta morbilidad y mortalidad. Varios factores ambientales predisponen al desarrollo de cáncer gástrico, tales como la infección por Helicobacter pylori
, la dieta y el tabaquismo. Agrupación familiar de cáncer gástrico se ve en 10% de los casos, y aproximadamente el 3% de los casos de cáncer gástrico surgen en el contexto de cáncer gástrico difuso hereditario (CGDH). En las familias con CGDH, cáncer gástrico presenta a una edad relativamente joven. Las mutaciones de la línea germinal en el gen CDH1
son la principal causa de CGDH y se identifican en aproximadamente el 25-50% de las familias que cumplen con criterios estrictos. gastrectomía profiláctica es la única opción para prevenir el cáncer gástrico en individuos con una mutación CDH1
. Sin embargo, en la mayoría de las familias con múltiples casos de cáncer gástrico ninguna anormalidad genética germinal puede identificarse y por lo tanto las medidas preventivas no están disponibles, a excepción de asesoramiento general estilo de vida. Las investigaciones futuras deberían centrarse en la identificación de nuevos factores de predisposición genética para todos los tipos de cáncer gástrico familiar.
Palabras clave
cáncer gástrico difuso hereditario Genética cáncer gástrico CDH1
E-cadherina Introducción general
Con un estimado de 900.000 nuevos casos por año (8,6% de todos los nuevos casos de cáncer, excepto el cáncer de piel), cáncer gástrico (CG) es la cuarta forma más común de cáncer en todo el mundo. A pesar de que la incidencia está disminuyendo rápidamente en el mundo occidental, sigue siendo la segunda causa más común de muerte por cáncer, con 740.000 muertes al año y una supervivencia a 5 años del 20% [1]. Las áreas de alto riesgo incluyen el Este de Asia (Japón, China y Corea), Europa del Este, y partes de América Central y del Sur. Las tasas de incidencia son bajos en el norte de Europa, América del Norte y Australia [1]. Con una edad media al diagnóstico de más de 60 años, el cáncer gástrico es predominantemente una enfermedad de los ancianos [2]. Sólo el 6-7% de los pacientes con cáncer gástrico presentes antes de los 50 años, y menos del 2% antes de los 40 años [2, 3].
Carcinoma gástrico es una enfermedad heterogénea, que se refleja en la diversidad de los distintos esquemas de clasificación histopatológicos [4]. Los más comúnmente utilizados son los de la OMS [4] y Lauren [5]. El esquema práctico de Lauren divide GC aproximadamente en tres tipos principales; el tipo difuso, el tipo intestinal y un grupo resto compuesto de tipo mixto e indeterminado [5]. Intestinal GC muestra los componentes glandulares o tubulares con diferentes grados de diferenciación. GC difusa consiste en células individuales cohesivos mal y sin formación de la glándula. A menudo las células en anillo de sello están presentes; por lo que también se conoce como el carcinoma de células en anillo de sello [4]. En América del Norte la distribución de los diferentes subtipos es de aproximadamente 50% intestinal puro, 35% difusa puro y 15% mezcla difusa-intestinal [6]
etiología del cáncer gástrico:. Factores ambientales
El cáncer gástrico es una enfermedad multifactorial , resultante de una combinación de factores ambientales y alteraciones genéticas. Los factores ambientales están implicados principalmente en la etiología de tipo intestinal de GC. El principal factor ambiental involucrado es la infección por Helicobacter pylori gratis (H.Pylori
), que comúnmente se adquiere durante la infancia y persiste a no ser erradicado [7]. H.Pylori
puede inducir una secuencia de gastritis, metaplasia intestinal, displasia y cáncer gástrico con el tiempo [8]. Un meta-análisis de 12 estudios reveló que la infección con H. pylori
aumenta el riesgo de desarrollar CG sobre seis veces [9] y la OMS ha clasificado H. pylori
como un carcinógeno de clase I en 1994 [10, 11 ].
el tabaquismo es un importante factor de riesgo de comportamiento para el desarrollo de GC. Una gran revisión sistemática de 42 estudios mostró que el riesgo de GC se incrementa en un 60% en hombres y 20% en las mujeres fumadoras en comparación con no fumadores [12]. Fumar también aumenta el efecto carcinogénico de la infección con H. pylori
[13]. Otro factor de riesgo importante para el desarrollo de GC es la dieta. Un consumo adecuado de frutas y verduras probablemente reduce el riesgo de desarrollar CG [4]. El consumo de sal, por otra parte, está fuertemente asociado con un mayor riesgo de desarrollar carcinoma gástrico. Por lo tanto, los ajustes de la dieta que reducen el consumo de sal, por ejemplo después de la sustitución de la preservación de la sal de los alimentos por los refrigeradores, son factores importantes en la disminución de la incidencia de la GC, [4]. pimientos carnes y pescados ahumados, encurtidos de hortalizas y chile también se asocian con GC en algunas poblaciones [4]. El consumo de alcohol se ha estudiado en varias poblaciones, pero los resultados no han sido concluyentes [4]. México La incidencia de CG está disminuyendo en todo el mundo, que se debe principalmente a la disminución de la incidencia de la distal, tipo intestinal de GC. La incidencia de CG difuso, para los que no se conocen los factores de riesgo ambientales claras, no ha disminuido [4]. En las personas jóvenes, en los que los carcinomas son más probable que sea debido a la susceptibilidad genética, una mayor proporción muestra el tipo difuso, lo que sugiere que, especialmente en este subtipo genética de la línea germinal juegan un papel [4]
etiología del cáncer gástrico:. Factores genéticos
agregación familiar de cáncer gástrico se sabe que ocurre en aproximadamente el 10% de los pacientes [14]. Los estudios epidemiológicos han demostrado que en la población general, el riesgo de cáncer gástrico en los parientes de primer grado con cualquier tipo de cáncer gástrico se incrementa 2-3 veces [15]. Hasta el momento, sin embargo, en la gran mayoría de estos pacientes la causa genética subyacente sigue siendo desconocido. El gen de susceptibilidad GC más importante es CDH1
, que representa el 1-3% de los cánceres gástricos [16]. Predisponente CDH1
mutaciones se han encontrado en aproximadamente el 30% de los estrictamente seleccionado cáncer gástrico difuso hereditario (CGDH) familias [17, 18]. Por otra parte, CDH1
mutaciones de línea germinal también pueden ocurrir en aproximadamente el 7% de los pacientes diagnosticados antes de los 50 años de edad con tumores que muestran ya sea una difusa o una histología mixta [19]. El reconocimiento, la vigilancia y el tratamiento de CDH1
portadores de la mutación se describen extensamente a continuación.
Cáncer gástrico en el cáncer gástrico intestinal familiar y otros síndromes de cáncer hereditario ¿Cuántas familias con CG de tipo intestinal que exhiben un patrón de herencia autosómica dominante han sido documentado. Sin embargo, en este tipo de familias, las enfermedades que causan mutaciones en la línea germinal para GC intestinal no se han encontrado aún.
Un aumento del riesgo de desarrollar el tipo GC tanto difuso e intestinal se ha demostrado en varios síndromes de cáncer hereditario bien conocidos, además de CGDH. Estos síndromes incluyen el síndrome de Lynch [20-22], síndrome de Peutz-Jeghers [23], el síndrome de Li-Fraumeni [24-26], de mama y ovario hereditario [27, 28], la poliposis adenomatosa familiar (PAF) [29-31 poliposis], asociada a MUTYH adenomatosa (MAP) [32], síndrome de poliposis juvenil [33], y el síndrome de Cowden [34]. El riesgo de por vida de GC en estos síndromes varía sustancialmente entre las poblaciones estudiadas, pero es generalmente baja. Por ejemplo, aunque las anomalías gástricas benignas tales como pólipos de glándulas fúndica desarrollan en aproximadamente 12,5 a 84% de los pacientes con PAF, sólo el 40% de estos pólipos adenomatosos exhiben características y un porcentaje aún menor (alrededor del 0,5%) se convierte en el adenocarcinoma gástrico [35]. En el síndrome de Lynch, el riesgo de por vida de GC varía entre el 2,1% en los Países Bajos y el 30% en Corea [36]. Claramente, el riesgo de desarrollar CG en estos síndromes es mayor en las zonas con alta incidencia de CG en la población general, como el Este de Asia, lo que indica que en este tipo de formas hereditarias de factores ambientales GC puede desempeñar un papel importante. Por lo tanto, en todas estas familias consejos de estilo de vida es importante, aunque su efecto sobre el riesgo de CG no se conoce con precisión. En la mayoría de los síndromes mencionados no existe un acuerdo acerca de las recomendaciones de la vigilancia del estómago.
Identificación de nuevos genes del cáncer gástrico hereditario subyacente
En aproximadamente dos tercios de las familias que cumplen los estrictos criterios CGDH, sin CDH1
mutación se encontraron y siguen siendo genéticamente inexplicable. La mayoría de estas familias podría llevar a mutaciones en otros, aún no se ha identificado, los genes de susceptibilidad GC. Como socio de unión de la E-cadherina, β- mutado y γ-catenina se han considerado como candidatos para la predisposición CG difuso [37]. El gen de la β-catenina (CTNNB1
) fue evaluada recientemente en una serie de 40 familias con historia positiva de GC de los Países Bajos, sin encontrar mutaciones [Vogelaar et al., Datos no publicados, 2012].
También en las familias con el tipo intestinal GC exhibir un patrón de herencia autosómica dominante, los genes de susceptibilidad genéticos pueden jugar un papel. No gen se ha asociado con este tipo de GC aún. En pacientes cuidadosamente seleccionados secuenciación de próxima generación de técnicas que permiten el exoma o incluso a escala del genoma de detección de aberraciones genéticas basa, puede ser explotado para desentrañar la predisposición genética de una manera imparcial.
Hereditario el cáncer gástrico causado por la línea germinal mutaciones CDH1
difusa
En 1998, Guilford et al
. mutaciones identificadas línea germinal en el gen CDH1
como una causa de cáncer gástrico difuso hereditario (CGDH) [38]. CDH1
codifica la proteína E-cadherina, que desempeña un papel importante en la adhesión célula-célula y el mantenimiento de la integridad epitelial [39]. La tasa de detección es de aproximadamente 50% en familias con dos tipos de cáncer gástrico en familiares de primer grado con al menos un caso de cáncer gástrico difuso (DGC) diagnosticados antes de los 50 años, o tres o más DGC en parientes cercanos diagnosticados a cualquier edad [18]. El porcentaje disminuye si se incluyen también casos aislados de DGC por debajo de la edad de 35 años [17]. CDH1 línea germinal
mutaciones se encuentran en todos los grupos étnicos [40]. Los tipos más comunes de mutación son pequeñas inserciones o deleciones (35% de las mutaciones). mutaciones sin sentido se producen en el 28% de las familias, las mutaciones sin sentido y mutaciones del sitio de empalme son a la vez, en el 16% de las familias. Grandes deleciones exonic son relativamente poco frecuentes, con una frecuencia de alrededor del 5% [41].
Tanto para hombres y mujeres, CDH1
portadores de mutaciones tienen un riesgo acumulado de carcinoma gástrico por 80 años de edad de 80%, con una edad media al diagnóstico de 40 años. Además, las mujeres que llevan una mutación CDH1
tienen un riesgo de por vida del 60% de desarrollar cáncer de mama lobular [40].
Asesoramiento y criterios genética para CDH1
pruebas de mutación
El asesoramiento genético es un componente esencial de la gestión de CGDH. Incluye el análisis de la historia de la familia de al menos tres generaciones y confirmación histopatológica de tumores malignos (pre) gástricos. Los criterios internacionales revisadas según lo establecido por el Consorcio Internacional de Enlace en el cáncer gástrico (IGCLC) para seleccionar los pacientes con un mayor riesgo de cáncer gástrico familiar para CDH1
pruebas de mutación se muestran en la Tabla 1 [40]. Las pruebas genéticas se inicia preferiblemente en un familiar afectado. En la mayoría de los países la edad más temprana en la que los familiares en situación de riesgo se les debe ofrecer la prueba se ajusta a la edad de 18. Se han reportado casos raros de cáncer gástrico antes de los 18 años, pero el riesgo general de DGC antes de la edad de 20 años es muy baja [42, 43] .table 1 criterios clínicos para el estudio de las mutaciones de la línea germinal CDH1 [40] •
1 difusa caso de cáncer gástrico por debajo de los 40 años, o
•
2 casos de cáncer gástrico en una familia, una confirmados de cáncer gástrico de menos de 50 años, o
• página 3 casos confirmados de cáncer gástrico difuso en 1º o 2º grado parientes independiente de la edad, o
•
personales o familiares de cáncer gástrico difuso y de mama lobular cáncer, con un diagnóstico debajo de la edad de 50
mecanismo de iniciación CGDH
Propuestos En 2009, Humar y Guilford propusieron un mecanismo de iniciación CGDH [44]. E-cadherina se sabe que juega un papel importante en la polaridad celular y la arquitectura epitelial de tejido [45, 46]. Se propone que las mutaciones en CDH1
perturban la adhesión célula-célula mediada por E-cadherina, lo que provoca la interrupción de la organización espacial correcta de las células. Esto a su vez puede interferir con los procesos que regulan la división celular, tales como la orientación del huso mitótico. polaridad celular suprimida también puede conducir a la interrupción de la determinación del destino celular [44, 47, 48]. Estos procesos perturbados en última instancia, pueden dar lugar al desplazamiento de células con capacidad de auto-renovación en la lámina propia y dar lugar a la formación de carcinomas de células en anillo de sello con la capacidad para la división celular sostenido y por lo tanto a la progresión [44].
Total profiláctica gastrectomía en CDH1
portadores de la mutación
gastrectomía profiláctica es actualmente la única opción para eliminar el riesgo de desarrollo de GC en CDH1
portadores de la mutación [49]. El pronóstico de los pacientes con una gastrectomía profiláctica es muy bueno. La mortalidad global estimada para gastrectomía total es de 2-4% con un riesgo casi el 100% de la morbilidad a largo plazo. problemas asociados siguientes gastrectomía incluyen dolor abdominal después de comer, el síndrome de dumping, la intolerancia a la lactosa, mala absorción de grasas y esteatorrea y la plenitud postprandial [40, 50-52]. El momento óptimo para la gastrectomía profiláctica en individuos con mutaciones de CDH1
todavía no se conoce. especímenes de gastrectomía preventivos de CDH1
portadores de la mutación revelan múltiples lesiones pequeñas de células en anillo de sello con bajas tasas de proliferación; Algunas de estas lesiones progresan a un carcinoma agresivo más allá de la mucosa muscular de [53]. No se sabe por qué sólo algunas de estas lesiones se desarrollan en los carcinomas agresivos. Se ha observado ninguna correlación entre la edad del paciente y el número de pequeños focos de células en anillo de sello. Blair et al.
Asesorar CDH1
portadores de la mutación con biopsias gástricas normales considerar la gastrectomía una vez que las personas son mayores de 20 años de edad [43]. Otros autores recomiendan considerar la gastrectomía preventiva cuando el portador de la mutación CDH1
es de 5 años más joven que el miembro de la familia más joven con DGC, que por lo general significa que la gastrectomía preventiva se pospone hasta una edad superior a 18 años [54]. En el caso
de una gastrectomía preventiva, se recomienda una gastrectomía total con reconstrucción de Roux-en-Y. No hay necesidad de una disección radical de ganglios linfáticos en el entorno profiláctica ya los adenocarcinomas de la mucosa sin invasión submucosa tienen un bajo riesgo de metástasis en los ganglios linfáticos [55].
Análisis patológico de los especímenes de gastrectomía preventivas Análisis FODA patológica de toda la gastrectomía muestra incluye una evaluación exhaustiva microscópicamente con hematoxilina y eosina (H & e) y una mancha de mucina, tal como ácido periódico de Schiff (PAS). PAS-tinción ha demostrado ser útil como una mancha principal, el aumento de la tasa de detección de pequeños focos de células en anillo de sello invasiva y reduce el tiempo de cribado [56]. La técnica de "brazo de gitano" se puede utilizar para incluir la mucosa completa [57]. El informe de patología debe mencionar todas las anomalías gástricas y localización, como (pre) lesiones malignas, metaplasia intestinal, displasia, la inflamación y la presencia de H. pylori
gastritis -asociado. La confirmación histológica de los márgenes de resección esofágica consiste en proximal y distal mucosa duodenal es esencial, ya que los nuevos GC restante se puede desarrollar en la mucosa gástrica.
Patología de CGDH
mapeo patológico de especímenes completos gastrectomía ha demostrado que CGDH en fase inicial se caracteriza por la presencia de unos pocos a cientos hasta focos de estadio T1a carcinoma de células en anillo de sello (SRCC) restringido a la lámina propia superficial, sin metástasis ganglionares (Figura 1a y 1b) [43, 54, 58, 59]. La mayoría de estos focos aparecen relativamente indolente con células neoplásicas mitóticamente inactivas. Estas células son pequeñas a nivel del cuello-zona y por lo general se agrandan hacia la superficie de la mucosa gástrica que muestra la morfología de células en anillo de sello distintivo. El modelo propuesto histológico para el desarrollo CGDH por Carneiro et al.
Comienza con carcinoma de células en anillo de sello in situ (Tis), que corresponde a la presencia de células en anillo de sello dentro de la membrana basal, y un patrón de propagación pagetoide de células en anillo de sello debajo el epitelio de las glándulas conservado y foveolas dentro de la membrana basal [60]. Esto es seguido por aumento de la proliferación de las células pagetoide anillo de sello y, finalmente, a carcinoma invasivo [60]. Llama la atención es la discrepancia entre los numerosos carcinomas T1a y más a menudo ausencia de carcinoma lesiones in situ (Tis), lo que indica que la invasión por lo general se produce sin carcinoma morfológicamente detectable in situ [60]. cambios de fondo en la mucosa gástrica de especímenes gastrectomía profiláctica consisten en hiperplasia foveolar, formación de nudos del epitelio superficial, vacuolización del epitelio superficial y la gastritis linfocítica crónica leve y sin H.pylori
infección o metaplasia intestinal [41, 60, 61]. Avanzada CGDH presenta como un carcinoma difuso mal diferenciado a veces con unas pocas células en anillo de sello (linitis plástica), sino también los subtipos no diferenciadas o mixtos con desdiferenciación mucinoso y tubular a veces se ven [Van der Post et al., Datos no publicados, 2012]. Estos carcinomas gástricos avanzados de CDH1
portadores de mutaciones no muestran características que podrían discriminar entre ellas los cánceres gástricos esporádicos. Figura 1 intramucoso carcinoma de células en anillo de sello. a. Típico pequeño foco intramucoso de un carcinoma de células en anillo de sello en una muestra de gastrectomía preventivas de un portador de la mutación CDH1 (H & E, 100 aumentos). segundo. Detalle de las células en anillo de sello entre glándulas foveolares normales y un fondo normal sin signos de gastritis. (H & E, 200 aumentos).
Endoscopia de vigilancia Francia El "protocolo de vigilancia de Cambridge 'se recomienda para CDH1
portadores de mutaciones que no (todavía) quieren someterse a una gastrectomía profiláctica, a los individuos en el 50% riesgo de ser portadora que (todavía) no dispuesto a hacerse la prueba de la mutación, así como para los miembros de familias sin CGDH un conocido CDH1
mutación [62]. Este protocolo comprende H.Pylori
-testing, gastroscopia anual con el endoscopio 'alta definición', una inspección cuidadosa de la mucosa durante 30 minutos, insuflación y desinflado del estómago, biopsias de alteraciones de la mucosa y 30 biopsias aleatorias de diferentes regiones gástricas (antro , angulus, corpus, fondo de ojo, cardias) [40]. La endoscopia se debe realizar usando una luz de endoscopio de alta definición blanco en una sesión específica con al menos 30 minutos asignados para permitir una inspección cuidadosa de la mucosa en la inflación y la deflación, y para dar tiempo a múltiples biopsias que deben tomarse [40]. El uso de mucolíticos tales como acetilcisteína puede ser útil para obtener buenas vistas. La endoscopia permite la inspección directa y biopsia de áreas sospechosas, pero CG difuso es difícil de detectar en una etapa temprana y tratable ya que las lesiones tienden a extenderse hacia la lámina propia y sin masas exofíticos visibles. Los principales problemas son la dificultad de identificar (sub) lesiones de la mucosa y sesgos en el muestreo en macroscópicamente de aspecto normal de la mucosa gástrica [63]. por lo tanto, deben ser evaluados por los patólogos con experiencia con este tipo de lesiones tales especímenes. Varios estudios han demostrado que a pesar de CDH1
portadores de mutaciones tenían biopsias negativas anteriores a la gastrectomía profiláctica, se detectaron focos en sus muestras de gastrectomía [49, 53, 58, 59]. Actualmente no se recomiendan otras técnicas, tales como técnicas de imagen, chromoendoscopic trimodal, endomicroscopía confocal y técnicas de imagen molecular, pero es necesario explorar aún más en un contexto de investigación [40].
Conclusión México La incidencia global de GC está disminuyendo , que es más probable debido a la reducción de los factores de riesgo ambientales. Las mutaciones de la línea germinal en el gen CDH1
se han identificado como una causa importante de CGDH, pero aún así en más de dos tercios de las familias CGDH estrictamente seleccionados la causa genética sigue siendo desconocido. Además, la base genética de los casos familiares con un cáncer gástrico de tipo intestinal es en gran parte desconocida. La elucidación de nuevos genes de susceptibilidad al cáncer gástrico será un paso importante hacia opciones adicionales para la prevención del cáncer gástrico. Por lo tanto, la identificación de nuevos factores de predisposición de cáncer gástrico genéticos es uno de los objetivos importantes en el futuro próximo.
Notas
Ingrid P Vogelaar, Rachel S van der Post contribuyeron igualmente a este trabajo.
Declaraciones
Autores 'archivos presentados originales para imágenes
a continuación se presentan los enlaces a los autores originales presentados archivos de imágenes. 'archivo original para la figura 1 13053_2012_438_MOESM2_ESM.jpeg autores 13053_2012_438_MOESM1_ESM.tiff Autores archivo original para la figura 2 Conflicto de intereses México La autores declaran que no tienen intereses en competencia
Contribuciones de los autores
Todos los autores contribuyeron a la búsqueda en la literatura y preparación de manuscritos. Todos los autores leído y aprobado el manuscrito final.
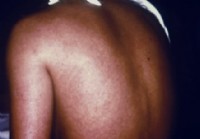 Enfermedad del virus de Marburgo
Datos que debe saber sobre la enfermedad del virus de Marburgo Imagen:Una mujer con infección por el virus de Marburg tiene un sarpullido en la espalda; FUENTE:CDC La enfermedad del virus de Marburg
Enfermedad del virus de Marburgo
Datos que debe saber sobre la enfermedad del virus de Marburgo Imagen:Una mujer con infección por el virus de Marburg tiene un sarpullido en la espalda; FUENTE:CDC La enfermedad del virus de Marburg
 Bacon Pemmican:la mejor comida paleolítica para viajes
¡Pemmican nunca ha sabido tan bien! El tocino realmente hace que todo sea mejor y esta receta de Bacon Pemmican cambiará la forma en que viajas. Pemmican es el alimento de viaje original de nuestros
Bacon Pemmican:la mejor comida paleolítica para viajes
¡Pemmican nunca ha sabido tan bien! El tocino realmente hace que todo sea mejor y esta receta de Bacon Pemmican cambiará la forma en que viajas. Pemmican es el alimento de viaje original de nuestros
 ¿Cómo puedo aliviar el reflujo ácido?
¿Qué es el reflujo ácido? El reflujo ácido se puede aliviar con simples cambios en el estilo de vida, como evitar ciertos alimentos y bebidas, comer comidas pequeñas y no comer demasiado cerca de l
¿Cómo puedo aliviar el reflujo ácido?
¿Qué es el reflujo ácido? El reflujo ácido se puede aliviar con simples cambios en el estilo de vida, como evitar ciertos alimentos y bebidas, comer comidas pequeñas y no comer demasiado cerca de l