Extracto
Antecedentes
Debido a la baja tolerancia a la quimioterapia, el número máximo de ciclos de quimioterapia adyuvante postoperatoria es 4 en ensayos clínicos gástricos adyuvantes. El objetivo de este estudio es evaluar retrospectivamente la seguridad y eficacia de adyuvante basada en epirubicina la quimioterapia y la radioterapia triplete en el tratamiento de estómago resecado localmente avanzado o adenocarcinoma de la unión gastroesofágica.
entre enero de 2004 julio de 2008, noventa y siete pacientes consecutivos con adenocarcinoma gástrico o de la unión gastroesofágica en estadios T3-4 /N + fueron tratados con radioterapia postoperatoria y quimioterapia. El plan de tratamiento recomendado fue la resección radical seguida de 1-2 ciclos de quimioterapia adyuvante (ACT), la quimiorradioterapia postoperatoria (CRT), y, por último, 4-5 ciclos de ACT. Los pacientes se clasificaron en dos grupos dependiendo del número de ciclos de ACT: el grupo 1 recibió 4-6 ciclos (n = 59), y el grupo 2 recibieron 0-3 ciclos (n = 38). La agrupación detallada es la siguiente: RT sola, 2; RT y CT, 18; RTQT concurrente y CT, de 41 años; y CRT, 36. De los 97 pacientes, 77 pacientes recibieron terapia concurrente (CRT, (5-fluorouracilo o capecitabina), y 20 recibieron radioterapia sola, debido a la negativa del paciente (n = 15) o la toxicidad del tratamiento (n = 5). Después una mediana de seguimiento de 44 meses, la enfermedad a 3 años la supervivencia libre (DFS) y supervivencia global (SG) fueron 66,5% y 69,5% para el grupo 1 y el 45,5% y el 50% para el grupo 2, respectivamente (p = 0,005 y . p = 0,024) El análisis multivariado reveló que 4-6 ciclos de ACT, la invasión linfovascular, o metástasis peritoneal fueron factores pronósticos independientes para la supervivencia libre de enfermedad o la supervivencia global (p. < 0,05)
Conclusiones /Importancia
Este estudio demuestra que la quimiorradioterapia concomitante con quimioterapia basada en epirubicina triplete adyuvante es factible y aceptable para los pacientes de carcinoma gástrico o de la unión gastroesofágico Los pacientes pueden beneficiarse de más ciclos de ACT
Visto:.. Li G, Zhang Z, X Ma, Zhu J, Cai G (2013) postoperatoria Quimioradioterapia Combinado con base-epirubicina trío quimioterapia para localmente avanzado Adenocarcinoma de estómago o de la unión gastroesofágica. PLoS ONE 8 (1): e54233. doi: 10.1371 /journal.pone.0054233
Editor: Dominique Heymann, Faculté de Médecine de Nantes, Francia |
Recibido: 31 de julio de 2012; Aceptado 11 de diciembre de 2012; Publicado: 25 Enero 2013
Derechos de Autor © 2013 Li et al. Este es un artículo de acceso abierto distribuido bajo los términos de la licencia Creative Commons Attribution License, que permite el uso ilimitado, distribución y reproducción en cualquier medio, siempre que el autor original y la fuente se acreditan
Financiación:. Los autores declaran que su estudio no ha recibido el apoyo de ningún patrocinio comercial. Ellos no reciben ninguna financiación de las organizaciones
Conflicto de intereses:. Los autores han declarado que no existen intereses en competencia
Introducción
El cáncer gástrico es el cuarto más frecuentemente diagnosticado. cáncer en el mundo y representa el 8% de todos los nuevos diagnósticos de cáncer. El cáncer gástrico es responsable del 10% de todas las muertes por cáncer, y es una de las neoplasias más frecuentemente diagnosticados en Asia [1], [2]. La mayoría de los pacientes con cáncer gástrico presente en una fase avanzada, y el pronóstico sigue siendo pobre, sobre todo en las etapas más avanzadas [3], [4].
La cirugía es el tratamiento del cáncer gástrico primario, pero el tratamiento quirúrgico por sí solo tiene una alta tasa de recurrencia locorregional y distante [3], [4], y la investigación significativa se ha centrado en la identificación de terapias adyuvantes eficaces para reducir el riesgo de recaída después de la cirugía. Un meta-análisis de la quimioterapia adyuvante postoperatoria (ACT) mostró beneficios de supervivencia moderados [5] - [9], y cinco años de seguimiento de datos de un ensayo ACTOS-GC [10] demostraron que la terapia adyuvante postoperatoria con S-1 lata mejorar la supervivencia global y la supervivencia libre de recaída en pacientes con estadio II o III de cáncer gástrico que habían sido sometidos a una gastrectomía D2. Además, el gástrico quirúrgico estudio adyuvante INT 0116 [11] mostró que la recaída supervivencia libre (p < 0,001) y supervivencia global (p = 0,005) se benefician de la CRT adyuvante para pacientes con un alto riesgo de recaída. En ese estudio, el régimen de quimioterapia simultánea fue de 5-fluorouracilo (5-FU) más leucovorina, pero este régimen es ahora cree que es insuficiente para prevenir la metástasis a distancia. Un régimen de epirubicina, cisplatino y 5-fluorouracilo (ECF) se ha utilizado cada vez más en la enfermedad avanzada y ha sido investigado en el tratamiento adyuvante en los estudios de fase II. El estudio del Consejo de Investigación Médica adyuvante gástrico en infusión Quimioterapia (MAGIC) [12] demostró que un régimen perioperatorio de ECF se redujo el tamaño del tumor y el estadio y mejoró significativamente la supervivencia libre de progresión (SLP) y supervivencia global (OS) en el cáncer gástrico operable o esofágico inferior adenocarcinoma. El 2-VERDADERO juicio posterior confirmó que en el triple régimen basado en la epirubicina [epirubicina (50 mg /m 2 en el día 1) + cisplatino (30 mg /m 2 en los días 1-3) 5 -FU (425 mg /m 2 /día los días 1-5)], la sustitución de cisplatino con oxaliplatino y de 5-FU con capecitabina resultó en una menor toxicidad [13]. La informado recientemente Cáncer y Leucemia Grupo B (CALGB) 80101 ensayo demostró un resultado similar con ECF y 5-FU (ASCO 2011). Sin embargo, la eficacia de CRT con ciclos óptimos de la quimioterapia no ha sido bien estudiado; esta información es necesaria para optimizar el tratamiento del cáncer gástrico localmente avanzado. El objetivo de este estudio es evaluar la eficacia de la RSC adyuvante y el efecto del número de ciclos de quimioterapia adyuvante basada en epirubicina en pacientes con estadio T3-4 /N + gástrico o gastroesofágico adenocarcinoma de la unión. 1 los sujetos del estudio se recogieron los datos de las personas que consienten acuerdo con los protocolos aprobados por la Junta de Revisión Ética de la Universidad Fudan de Shanghai Centro de cáncer. Entre enero de 2004 julio de 2008, 97 pacientes consecutivos diagnosticados de adenocarcinoma localmente avanzado y no metastásico de la unión gastroesofágica estómago o se inscribieron en este estudio. diagnósticos patológicos se obtuvieron en todos los casos ante la estadificación y el tratamiento. El estudio diagnóstico consistió en una historia clínica completa, exploración física, el estado funcional, hemograma completo, pruebas de función hepática y renal, endoscopia, el tórax, tomografía computarizada (TC) y la ecografía de la pelvis. Dentro de la cohorte, 59 pacientes (grupo 1) fueron tratados de acuerdo a un protocolo clínico institucional que consistió en cirugía seguida de quimioterapia adyuvante /radioterapia y 4-6 ciclos de quimioterapia adyuvante basada en epirubicina. Los 38 pacientes restantes (grupo 2) fueron tratados con cirugía seguida de quimioterapia /radioterapia y 0-3 ciclos del documento utilizando el mismo régimen a causa de la progresión de la enfermedad temprana (n = 3), rechazo del paciente (n = 15), o la toxicidad del tratamiento (n = 20). Las características de los pacientes se enumeran en la Tabla 1; no hubo diferencias significativas entre los dos grupos. 2 Detalles del tratamiento El protocolo de tratamiento recomendado en nuestro instituto es la resección radical seguida de 1-2 ciclos de ACT, CRT postoperatoria, y 4- 5 ciclos de ACT, como se muestra en la Figura 1. 2,1 cirugía. la cirugía se realizó con gastrectomía total o subtotal. Este procedimiento implicaba la resección de todos los ganglios linfáticos perigástricos y algunos celíaca, esplénico o-esplénica hiliar, hepaticartery, y los ganglios linfáticos cardial, dependiendo de la localización del tumor en el estómago. Las áreas de los ganglios linfáticos regionales se definen de acuerdo con las definiciones de la Sociedad Japonesa de Investigación para el cáncer gástrico [14], [15]. La estadificación patológica se basa en el Comité Común 2002 sobre el Cáncer (AJCC) sistema de estadificación TNM [16]. 2.2 radioterapia. Todos menos cuatro pacientes completaron la radioterapia adyuvante (RT) con o sin ACT suficiente postoperatorio. La dosis de irradiación prescrito fue 45-50,4 Gy con 25-28 fracciones, 1,8 Gy por fracción, cinco días por semana. El volumen de destino incluido el lecho tumoral, estoma de la anastomosis, remanente gástrico (T3, T4), y el drenaje de los ganglios linfáticos regionales. El lecho tumoral se define por preoperatoria y postoperatoria de formación de imágenes CT, radiografía de bario, y, en algunos casos, clips quirúrgicos [11]. Perigástrica, celiaca, paraaortic locales, esplénica, hepatoduodenal o hepática portal, y los ganglios linfáticos pancreaticoduodenales fueron incluidos en el volumen de destino de radiación, y los ganglios linfáticos y paracardial paraesofágicas También se incluyeron si el paciente tenía tumores en la unión gastroesofágica. La exclusión de los nodos del bazo se dejó en pacientes con lesiones antrales para proteger el riñón izquierdo [17]. Algunos pacientes usan un coordinador activa la respiración (ABC, n = 15) para reducir la incertidumbre relacionada con la respiración, durante las simulaciones y los tratamientos. Todos los pacientes fueron fijadas con ventosa de vacío durante la simulación y el tratamiento (solución CIVIC Médico, Iowa). Los tratamientos se entregan usando 3-dimensional radioterapia conformal (3D-CRT, n = 93) o radioterapia de intensidad modulada (IMRT, n = 4) con un fotón 6-MV. Simulación de conjuntos de datos computarizadas fueron adquiridos en el simulador de CT (Philips Medical Madison, WI) con un grosor de corte de 5 mm por lo menos 3 horas después de las comidas. Todos los planes de tratamiento se han optimizado con un sistema de planificación de tratamiento comercial (TPS, Philips Sistemas de Oncología de Radiación, Pinnacle versión 8.0 m, Milpitas, CA). Todos los tratamientos se entregan con un acelerador Elekta Sinergia Slinear equipado con un dispositivo de portal electrónico de imágenes (EPID) y un sistema de haz cónico de kilovoltaje CT (Elekta Sinergia S, Elekta Oncología Sistemas, Crawley, Reino Unido). Las tolerancias de los tejidos normales se definen como sigue: 1) menos de 30% del hígado recibir 30 Gy, dosis media de hígado de menos de 23 Gy; 2) de menos de 50% de los riñones que recibieron 15 Gy, significa dosis de ambos riñones de menos de 16 Gy; y 3) inferior al 40% del corazón recibir 40 Gy. 2.3 quimioterapia. De acuerdo con las directrices de nuestro instituto, todos los pacientes fueron recomendados para recibir la radioterapia con quimioterapia concurrente (5- fluorouracilo o capecitabina) y de cuatro a seis ciclos de quimioterapia adyuvante basada en triplete epirubicina tanto antes (1-2 ciclos) y después (4-5 ciclos) quimiorradioterapia. 2.4 quimioterapia concurrente. fluorouracilo (225 mg /m 2 /día) se administró con capecitabina oral o intravenosa continua (625 mg /m 2, bid) simultáneamente con la radiación. 2,5 quimioterapia adyuvante. Todos los pacientes fueron recomendados para recibir cuatro a seis ciclos adicionales de ACT (ECF) que consta de epirubicina (50 mg /m 2 en el día 1), cisplatino (30 mg /m 2 en los Días 1- 3), y 5-FU (425 mg /m 2 /día en los Días 1 a 5) o un régimen ECF modificado que consiste en la epirrubicina (50 mg /m 2 en el Día 1), el oxaliplatino (130 mg /m 2 en el Día 1) y 5-FU (425 mg /m 2 /día en los días 1-5) (EOF) o epirubicina (50 mg /m 2 en el Día 1) , oxaliplatino (130 mg /m 2 en el día 1), y capecitabina (625 a 825 mg /m 2 /día, dos veces al día, por vía oral en los días 1-14) (EOX). Los pacientes se clasificaron en dos grupos de acuerdo con el número de ciclos de ACT. El 61% (59/97) de los pacientes que recibieron 4-6 ciclos de ACT se registra como el grupo 1 y el 39% restante (38/97) se registraron como grupo 2. 3 Seguimiento Todos los pacientes fueron evaluados cada 3 meses durante los primeros 3 años después de la finalización del tratamiento y cada 6 meses durante 3 años adicionales a partir de entonces. Exámenes de seguimiento, incluyendo la historia y examen físico, hemograma completo, química del suero, la ecografía del hígado, y una radiografía de tórax, se llevaron a cabo de forma rutinaria ya sea por el oncólogo de radiación o asistir al cirujano en cada sesión de seguimiento. Las tomografías computarizadas del tórax y la endoscopia tracto digestivo superior del abdomen y se llevaron a cabo de forma rutinaria cada 6 meses. tomografías computarizadas de tórax, tomografía computarizada o ecografía del abdomen y la pelvis, la endoscopia del tracto digestivo superior, y /o tomografía por emisión de positrones (PET) se llevaron a cabo de inmediato si alguno de los síntomas de la enfermedad se produjo o se detectaron niveles elevados de marcadores tumorales. 4 los efectos adversos evaluación toxicidades agudas y tardías fueron clasificados según los CTCAE 3.0 y la Organización /Grupo de Radioterapia Oncológica Europea para la Investigación y Tratamiento del cáncer (RTOG /EORTC) criterios [18], [19]. toxicidades tardías se definieron como síntomas que ocurren o que duran >primera; 90 días después del inicio de la RT. Debido a la dificultad para diferenciar las toxicidades subyacentes de la cirugía, CRT o ACT, se reportaron en conjunto estas toxicidades. Los sitios de recaída fueron clasificados como una recurrencia local si un tumor se detectó en el volumen de radiación CTV (anastomosis quirúrgica, estómago residual, o cama gástrico y algunos ganglios linfáticos regionales), como regional si se ha detectado un tumor en la cavidad peritoneal (incluyendo otros ganglios linfáticos intra-abdominal y el peritoneo), y como distante si las metástasis eran fuera de la cavidad peritoneal y el hígado. Todos los pacientes fueron incluidos en el análisis de la tasa de supervivencia a los efectos tóxicos Los intervalos hasta la recidiva local, carcinomatosis regional y metástasis a distancia se miden a partir de la finalización de la cirugía para el fracaso del tratamiento documentado. La duración global de supervivencia se calculó a partir de la finalización de la cirugía hasta la muerte o la fecha de la última visita de seguimiento para los pacientes que todavía viven. El método de Kaplan-Meier [20] se utilizó para estimar la DFS, OS, y las tasas de control local. La asociación entre cada uno de los posibles factores pronósticos y la tasa de control local estimada, DFS, o el sistema operativo se probó con la prueba de log-rank [21]. El análisis multivariante se realizó mediante el modelo de regresión de Cox [22]. Todos los análisis estadísticos se realizaron utilizando el software SPSS 13.0. Dentro de la cohorte de pacientes, 51 habían sido sometidos previamente a la disección D2 estándar (eliminación de todos N2 [15] ganglios linfáticos invadidos), y el resto habían sufrido disecciones D1 (eliminación de todas las invadido N1 [15] ganglios linfáticos). La mediana del número de ganglios linfáticos resecados fue de 16. positiva relación de los ganglios linfáticos (ganglios linfáticos positivos /total de ganglios linfáticos eliminado) estaba bien equilibrado entre cada subgrupo de pacientes, y la mediana de los nodos linfáticos positivos en relación el grupo 1 y grupo 2 fueron 0,36 (0-1) y 0,33 (0-0,96), respectivamente. La mediana del tiempo de seguimiento para todos los pacientes fue de 44 meses (rango 10-99 meses). De los 97 pacientes, 93 (95,9%) completaron toda la radioterapia sin interrupción, mientras que 4 pacientes no completaron la radioterapia debido a la toxicidad aguda (vómitos). Setenta y siete pacientes completaron la quimioterapia concurrente. Entre los 20 pacientes que no completaron la quimioterapia concurrente, la terapia se interrumpió en 5 debido a la toxicidad aguda, y los demás se negó a someterse a quimioterapia concurrente a causa del temor de los efectos adversos. La agrupación detallado fue el siguiente: RT sola, 2; RT y CT, 18; RTQT concurrente y CT, de 41 años; y CRT, 36. 1 los resultados del tratamiento La tasa de control local de 3 años, la SSE y la SG fueron 90%, 58% y 62%, respectivamente (Figura 2). Cuarenta y un pacientes (42%) tuvieron recaída de la enfermedad (19 en el grupo 1 y 22 en el grupo 2), y 40 pacientes (41%) fallecieron (18 en el grupo 1 y 22 en el grupo 2). La recurrencia local desarrollado en 5 pacientes (4%) en el grupo de TRC (CRT + ACT). Un total de 14 pacientes tenían metástasis a distancia, 9 de los cuales tenían < 4 y 5 de los cuales tenía ≥ 4 ciclos de ACT. Además, 15 y 12 pacientes desarrollaron carcinomatosis peritoneal regional en el CRT y grupos CRT + ACT, respectivamente. La supervivencia sin enfermedad y la supervivencia global de 3 años fueron del 69,5% y del 66,5% para el grupo 1 y el 50% y el 45,5% para el grupo 2, respectivamente (p = 0,024 y p = 0,005). Las tasas de control local fueron de 94% y 89% para los grupos 1 y 2, respectivamente (p = 0,24) (Figura 3). Los efectos de la edad, el género, la patológica categorías T y N, positiva relación de los ganglios linfáticos, la exhaustividad de la cirugía, la invasión linfovascular, y actuar sobre el control local, carcinomatosis peritoneal, metástasis a distancia, DFS y OS se evaluaron mediante análisis univariados y multivariados (Tablas 2 y 3). la pérdida de peso de los pacientes no se incluyó en los factores equilibrados, ya que este estudio fue retrospectivo y la pérdida de peso podría estar influenciada por muchos factores, como el apoyo nutricional y la condición recuperación de la cirugía. Para los pacientes en riesgo nutricional, se recomienda el soporte nutricional. El análisis multivariado reveló que el número de ciclos de ACT (4-6 vs 0-3) y la invasión linfovascular fueron factores pronósticos independientes de DFS (p = 0,010 yp = 0,003, respectivamente), mientras que la metástasis peritoneal fue un factor pronóstico independiente para el sistema operativo ( p. < 0,01) 3 efectos adversos La toxicidad que se observó entre los 97 pacientes se resumen en la Tabla 4. los principales efectos tóxicos fueron hematológicas y gastrointestinales. El efecto tóxico hematológica más frecuente fue la leucopenia, que se desarrolló en 30 pacientes (31%), mientras que la trombocitopenia grave fue poco frecuente (2%). Un paciente (1%) murió debido a un fallo adyuvante inducida por quimioterapia hígado, así como neutropenia febril, y otro paciente presentó edema de la anastomosis estoma 3 meses después de la finalización de la quimiorradioterapia. Inducida por la radiación de grado 3 o más efectos tóxicos agudos digestivos, como náuseas /vómitos, dispepsia y diarrea, se observaron en 23 pacientes (23%). gastrectomía complicaciones inducidas, como la fístula anastomosis, la necrosis pancreática, o dehiscencia de la herida, no se observaron. Discusión Los resultados del tratamiento, según lo indicado por SLE y la SG, siguen siendo sombrío para aquellos pacientes adenocarcinoma gástrico avanzado. resección completa del tumor con la suficiente disección de ganglios linfáticos es el factor más importante para el control de la enfermedad y la supervivencia a largo plazo de los pacientes con cáncer gástrico. Liquidación de la enfermedad locorregional con cirugía sola (incluso D2) no es suficiente para la mayoría de los pacientes con localmente avanzado adenocarcinoma gástrico y el tratamiento adyuvante es imprescindible para aumentar aún más el control del tumor y mejorar los resultados del tratamiento. Varias estrategias, incluyendo neoadyuvante y /o ACT, terapia de radiación, y su combinación, se han estudiado en un intento de mejorar los resultados del tratamiento. control locorregional ha mejorado como la radioterapia se ha convertido en uno de los métodos de tratamiento para el cáncer gástrico [23], e incluso la SSE y la SG se aumenta en un estudio INT 0116 y su informe de actualización con CRT postoperatoria concurrente [11], [24]. Sin embargo, sólo el 10% de los pacientes en este estudio se sometieron a resección D2, y no estaba claro si el CRT postoperatoria compensado por el simple resección insuficiente. Dos estudios recientes en Corea informaron de que la TRC adyuvante después de la gastrectomía D2 mejoró significativamente los resultados del tratamiento en pacientes con adenocarcinoma gástrico no metastásico [25], [26]. Por lo tanto, CRT concurrentes postoperatoria es un tratamiento eficaz para el cáncer gástrico avanzado locorregional. Sin embargo, en el estudio INT 0116, CRT postoperatoria no disminuyó significativamente la recaída regional o recidivas a distancia. De hecho, el 72% de aquellos en el grupo de cirugía solamente y el 65% de los del grupo de quimiorradioterapia tenido una recaída regional, y el 18% de aquellos en el grupo de cirugía solamente y el 33% de los del grupo de quimiorradioterapia tenido recaída distante. La eficacia de neoadyuvante más ACT con un régimen basado en la epirubicina se informó en el ensayo MAGIC [12]. Las tasas de supervivencia global fueron 36,3% y 23,0% para los pacientes tratados con o sin quimioterapia posoperatoria, respectivamente. Estos estudios y la frecuencia de recurrencia después de la resección del cáncer gástrico nos animaron a estudiar la combinación de la CRT y la quimioterapia basada en epirubicina adyuvante en pacientes con adenocarcinoma de la unión gastroesofágica o de estómago. En el presente estudio, los pacientes con cáncer gástrico localmente avanzado (definido como la etapa T3, T4, o N +) fueron tratados con gastrectomía seguida de la CRT y la ACT. Estos regímenes mejoró sustancialmente el resultado del tratamiento, incluyendo el control del tumor y la supervivencia global. El control de la metástasis peritoneal de 3 años y las tasas de supervivencia fueron del 52% frente a 50% (p = 0,023) y el 77% frente al 69,5% (p = 0,024) en los pacientes con menos de ACT ACT versus más, respectivamente. Las tasas de control local 3 años para los CRT + ACT y CRT únicos grupos fueron de 94% y 89% (p = 0,240), respectivamente. Por lo tanto, nuestros resultados son comparables a los de estudios anteriores. El recientemente reportado estudio multicéntrico del Grupo de Oncología de Radiación Transtasmanio (TROG) [27], que incluía un régimen de terapia adyuvante que consiste en un ciclo de ECF , seguida de radioterapia concurrente con la infusión de 5-FU y luego dos ciclos adicionales de ECF, indicó que el régimen adyuvante con ECF antes y después de la quimiorradioterapia conformada tridimensional es factible y se puede enviar de forma segura en un ambiente de grupo cooperativo. Se encontró que un adicional de 4-6 ciclos de quimioterapia adyuvante en ACT /radioterapia fue un factor pronóstico importante para el control remoto y peritoneal y la supervivencia global y no aumentó significativamente la incidencia de complicaciones a largo plazo. A lo mejor de nuestro conocimiento, nuestro informe es el único análisis de este tipo de estrategia de tratamiento. Nuestros resultados revelaron menores tasas de toxicidad, el cumplimiento de un tratamiento similar, y la supervivencia global más alta en comparación con los del estudio TROG. El régimen de quimiorradioterapia utilizado en nuestro estudio fue generalmente bien tolerado, con un 61% de los pacientes (en comparación con 67% en el estudio TROG) de completar todos los cursos de tratamiento (CRT + 4-6 ciclos de ACT) y sólo el 9% (6% en el TROG) de los pacientes incapaces de completar CRT simultánea debido a la toxicidad relacionada con el tratamiento. Los (GI) las tasas de toxicidad hematológicas y gastrointestinales también fueron similares a los del ensayo TROG. Sin embargo, la supervivencia libre de enfermedad y supervivencia global 3-años fueron más altos que los del estudio TROG (61% y 70% vs. 58,6% y 61,6%, respectivamente), que puede ser debido al tratamiento quirúrgico más a fondo y más ciclos de la quimioterapia. En nuestro estudio, 53 pacientes (52%) habían sido sometidos previamente a la disección D2 formal y la disección D1 (extirpación de todos los ganglios linfáticos N1 invadido) se había realizado en el resto (48%), mientras que en el estudio TROG, 20% fueron sometidos a menos que una disección de ganglios linfáticos D1. Además, nuestro estudio incluyó a más ciclos de ACT que el estudio TROG. El ensayo de fase III del artista [28] en comparación con el tratamiento postoperatorio con capecitabina y cisplatino (XP) frente a XP más radioterapia con capecitabina (XP /XRT /XP); en este ensayo, la adición de la quimioterapia XRT a XP no redujo significativamente la recurrencia después de la resección curativa y D2 disección de ganglios linfáticos en el cáncer gástrico. En un análisis de subgrupos de pacientes con ganglios linfáticos positivos patológicos, hubo un aumento estadísticamente significativo en la SSE en el XP /XRT brazo /XP (estimado de 3 años tasa de SSE de 77,5%) en comparación con el brazo XP-sola (3- DFS año, 72,3%; p = 0,0365). En este estudio, el 60% de los pacientes fueron etapas Ib o II, y los pacientes etapa relativamente temprana puede tener un mejor pronóstico y puede no beneficiarse tanto del tratamiento adyuvante. Esto también puede explicar el aumento de la DFS en ese estudio en comparación con los que en el presente estudio. Un estudio retrospectivo francesa [29] llegó a la conclusión de que la quimioterapia basada en cisplatino postoperatorio seguida de radioterapia conformada mediante la combinación de 5-FU era factible. Las tasas generales y supervivencia libre de enfermedad fueron comparables a los reportados previamente en la literatura, con un buen control de la enfermedad local y regional. A pesar de un mayor uso de la quimioterapia adyuvante con cisplatino, recurrencias distantes y peritoneal siguen siendo las recaídas observadas con mayor frecuencia. El FNCLCC francesa (Federación Nacional de los Centros de Lucha Contra el Cáncer) ACCORD07-9703 FFCD ensayo aleatorio [30] informó que preoperatoria 5-FU y cisplatino en pacientes con adenocarcinoma resecable del estómago y el esófago inferior mejoraron significativamente global a 5 años y la supervivencia libre de enfermedad en comparación con la cirugía sola: 38% vs. 24% y 34% vs. 21%, respectivamente . El juicio CLÁSICA [31] demostraron que la quimioterapia adyuvante con capecitabina más oxaliplatino (8 ciclos), después de una gastrectomía D2 mejoró significativamente la supervivencia libre de enfermedad a 3 años al 74% del 59,0% con cirugía sola El curso Intergrupo de EE.UU. ensayo (CALGB 80101) es un ensayo de fase III aleatorizado con un régimen a base de ECF que es similar a la utilizada en el estudio TROG. Los pacientes en el ensayo del Intergroup que también reciben un ciclo de ECF antes de quimiorradioterapia y dos ciclos después de la quimiorradioterapia. Sin embargo, debido a la alta tasa de toxicidad aguda (como se informó en el estudio TROG), las dosis de los fármacos se reducen en los ciclos posradioterapia. Se utilizó un régimen de quimioterapia con menor toxicidad (EOF o EOX) para la mayoría de los pacientes, permitiendo a estos regímenes ser mejor tolerado. El holandés /ensayo sueco (aleatorizado de fase III de prueba de la quimioterapia adyuvante o quimioterapia en el cáncer gástrico resecable (críticos) estudian; ClinicalTrials.gov NCT00407186 ID) está comparando tres cursos postoperatorios de epirubicina, cisplatino y la quimioterapia capecitabina versus quimiorradioterapia con capecitabina y cisplatino en pacientes con cáncer gástrico tratados con tres cursos preoperatorios de epirubicina, cisplatino y capecitabina quimioterapia seguida por medio de cirugía con linfadenectomía D2 y sin esplenectomía y pancreatectomía. Un ensayo de fase III (artista-II) para comparar la quimioterapia versus quimioterapia con RT en pacientes con disección de ganglios linfáticos D2 y ganglios positivos linfático patológico está prevista para confirmar los beneficios de la TRC adyuvante. El juicio es Topgear investigar si la adición de quimioterapia a la quimioterapia es superior a la quimioterapia sola en el entorno adyuvante mediante la mejora de la respuesta inicial patológica completa (pCR) tasas, así como la supervivencia global posterior en pacientes sometidos a cirugía adecuada (D1 disección) para el cáncer gástrico resecable. varias cuestiones importantes. En primer lugar, porque nuestro estudio fue un estudio retrospectivo, no se determinó el número de pacientes necesarios para poder estadístico adecuado. En términos más generales, como el papel de neoadyuvante más ACT en el manejo del cáncer gástrico avanzado queda claro, si la adición de la quimioterapia preoperatoria puede mejorar aún más el resultado del tratamiento debe ser determinada. Además, no está claro si la quimiorradioterapia preoperatoria y quimioterapia postoperatoria es superior a nuestro método con respecto a los resultados del tratamiento y la tolerancia. En nuestro estudio, la principal recurrencia observada fue la metástasis peritoneal, lo que indicaba que era necesario un tratamiento adicional para reducir la recurrencia regional. En tercer lugar, si un régimen de quimioterapia basada en epirubicina en el tratamiento adyuvante de quimioterapia es más eficaz, la perspicacia del ensayo ARTISTA [28] de la elección del régimen de quimioterapia adyuvante postoperatoria puede ayudar a reducir la tasa de toxicidad. Por último, el análisis multivariado reveló que hubo diferencias significativas en el control remoto o regional o tasas de supervivencia global en términos de los diversos factores pronósticos; Sin embargo, la supervivencia libre de enfermedad mostró diferencias significativas en el control remoto y regional o tasas de supervivencia global en términos de los factores pronósticos, según la evaluación de la prueba de log-rank. Los estudios futuros deben tratar de resolver estas cuestiones. El desarrollo de una estrategia óptima de quimiorradioterapia adyuvante para el adenocarcinoma localmente avanzado del estómago sería un logro significativo en el campo, y los esfuerzos de colaboración entre las instituciones de tratamiento del cáncer son la mejor estrategia para alcanzar este objetivo. la gastrectomía con disección de los ganglios linfáticos y CRT seguido de ACT es factible y tolerable para el tratamiento del cáncer gástrico localmente avanzado. La adición de suficiente ACT para el CRT postoperatoria mejoró significativamente 3 años de control de la carcinomatosis abdominal y la tasa de supervivencia general a 3 años. En comparación con la estrategia de CRT basada en 5-FU, este novedoso régimen de CRT con un régimen ACT aumento utilizado en un entorno adyuvante debe ser optimizado y estudiado en ensayos prospectivos más para determinar si se puede mejorar aún más el resultado final del tratamiento.
Métodos y materiales
5 estadístico El análisis
.
Resultados
2 factores pronósticos
.
Conclusiones
 hidromorfona (Dilaudid)
hidromorfona (Dilaudid)
 ¿Cuál es la diferencia entre la impactación fecal y el estreñimiento?
¿Cuál es la diferencia entre la impactación fecal y el estreñimiento?
 Cómo hacer chucrut:la forma rápida y sencilla
Cómo hacer chucrut:la forma rápida y sencilla
 Pérdida de la barrera epitelial intestinal responsable del MIS-C relacionado con COVID-19 en niños,
Pérdida de la barrera epitelial intestinal responsable del MIS-C relacionado con COVID-19 en niños,
 Síndrome de Marfan:síntomas, causas y tratamiento
Síndrome de Marfan:síntomas, causas y tratamiento
 ¿Es el síndrome del intestino irritable?
¿Es el síndrome del intestino irritable?
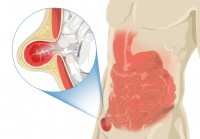 Hernia inguinal
En esta página: ¿Qué es una hernia inguinal? ¿Qué tan comunes son las hernias inguinales? ¿Quién es más probable que tenga una hernia inguinal? ¿Cuáles son las complicaciones de las hernias inguinal
Hernia inguinal
En esta página: ¿Qué es una hernia inguinal? ¿Qué tan comunes son las hernias inguinales? ¿Quién es más probable que tenga una hernia inguinal? ¿Cuáles son las complicaciones de las hernias inguinal
 Las 7 mejores grasas para un intestino sano (y 5 que debe evitar)
Algunos datos rápidos sobre la grasa: La grasa es uno de los 3 macronutrientes en los alimentos que comemos (los otros dos son las proteínas y los carbohidratos) La grasa contiene 9 calorías por gram
Las 7 mejores grasas para un intestino sano (y 5 que debe evitar)
Algunos datos rápidos sobre la grasa: La grasa es uno de los 3 macronutrientes en los alimentos que comemos (los otros dos son las proteínas y los carbohidratos) La grasa contiene 9 calorías por gram
 Férula vaginal y evacuaciones intestinales
Férula vaginal es el término que se usa para describir el proceso en el que una mujer usa sus dedos para presionar la vagina para ayudar a que las heces salgan del recto. Por lo general, esto se hace
Férula vaginal y evacuaciones intestinales
Férula vaginal es el término que se usa para describir el proceso en el que una mujer usa sus dedos para presionar la vagina para ayudar a que las heces salgan del recto. Por lo general, esto se hace