Des tendances constantes démontrent une plus grande amélioration de la réduction des besoins en oxygène à la fin du traitement au jour 14 dans le bras traité par opaganib pour les principaux critères d'efficacité primaires et secondaires, en corrélation avec l'amélioration clinique telle que définie par l'échelle ordinale de l'Organisation mondiale de la santé (OMS).
Le bras traité à l'opaganib a démontré une plus grande amélioration de l'accès à l'air ambiant dans les 14 jours (52,6 % contre 22,2 %) ; une plus grande amélioration de la réduction à 50 % d'oxygène supplémentaire au jour 14 (89,5 % contre 66,7 %) ; une proportion plus élevée de patients sortis au jour 14 (73,7 % contre 55,6 %) et une réduction plus importante des besoins médians en oxygène total (ASC) sur 14 jours (68,0 % contre 46,7 %).
Les premières données de l'étude mondiale de phase 2/3 COVID-19 portant sur 270 patients hospitalisés sont attendues pour le premier trimestre de 2021 et une analyse intermédiaire de la futilité du DSMB est attendue dans les semaines à venir. L'opaganib cible un composant cellulaire humain impliqué dans la réplication virale, minimisant potentiellement la probabilité de résistance due à des mutations virales.
TEL AVIV, Israël et RALEIGH, NC, Le 31 décembre, 2020, RedHill Biopharma Ltd. (Nasdaq :RDHL) (« RedHill » ou la « Société »), une société biopharmaceutique spécialisée, a annoncé aujourd'hui que les données préliminaires de son étude de phase 2 aux États-Unis avec l'opaganib administré par voie orale (Yeliva®, ABC294640) chez les patients hospitalisés pour une pneumonie COVID-19 a démontré des signaux positifs d'innocuité et d'efficacité.
Le randomisé, en double aveugle, L'étude de validation de concept de phase 2 contrôlée par placebo aux États-Unis avec l'opaganib (NCT04414618) a inclus 40 patients nécessitant une assistance en oxygène. L'étude n'avait pas de puissance statistique et visait à évaluer l'innocuité et à identifier les signes préliminaires d'activité. Les patients de l'étude ont été randomisés selon un rapport 1:1 pour recevoir soit de l'opaganib soit un placebo en plus des soins standard (SoC) et ont été suivis jusqu'à 42 jours après le début du traitement.
Analyse complète des données, incluant des analyses de biomarqueurs viraux et inflammatoires, facteurs de risque de base et stratifications du traitement de fond SoC, est attendu dans les semaines à venir. La Société fournira les données pour examen par les pairs lorsqu'elles seront disponibles.
« Nous sommes ravis de ces premiers résultats encourageants de notre étude exploratoire de phase 2 qui confirment l'innocuité de l'opaganib et démontrent des signaux d'activité prometteurs lors du traitement de patients atteints de COVID-19 et qui ont besoin d'un soutien en oxygène. Ces résultats préliminaires soutiennent notre phase 2 mondiale en cours/ 3 étude dans la pneumonie COVID-19 sévère, qui devrait être lu au premier trimestre 2021. Nous continuons à travailler avec diligence pour compiler un ensemble de données robuste pour prendre en charge le dépôt potentiel de demandes d'utilisation d'urgence mondiales », a déclaré Mark L. Levitt, MARYLAND, Doctorat., Directeur médical chez RedHill.
L'opaganib possède un double mode d'action unique, à la fois anti-inflammatoire et antiviral, agissant à la fois sur la cause et les effets du COVID-19. L'opaganib cible la sphingosine kinase-2, un composant cellulaire humain impliqué dans la réplication virale et non le virus lui-même."
Galaad Raday, Président directeur général, RedHill Biopharma
Les preuves croissantes de nouvelles mutations du SRAS-CoV-2 émergentes à l'échelle mondiale soulignent l'importance de ce mécanisme unique, ce qui minimise potentiellement le risque de résistance virale au traitement. Les tendances d'amélioration des patients montrées par les données préliminaires de premier plan soutiennent l'étude de phase 2/3 en cours avec l'opaganib, qui fournira une compréhension plus approfondie de l'activité de l'opaganib."
L'efficacité de l'opaganib dans la pneumonie COVID-19 sévère est explorée plus avant dans une étude mondiale de phase 2/3 en cours et devrait rapporter des données de première ligne au premier trimestre 2021. Cette étude (NCT04467840) est menée dans environ 30 cliniques dans plusieurs pays et est en voie de recruter jusqu'à 270 patients.
L'étude a fait l'objet de deux examens sans aveugle des données de sécurité par un comité indépendant de surveillance des données et de la sécurité (DSMB), avec des recommandations unanimes de poursuivre l'étude. Une analyse de futilité DSMB intermédiaire sera menée dans les semaines à venir, évaluer les données des 135 premiers sujets qui ont atteint le critère d'évaluation principal.
Les premiers résultats de l'étude américaine de phase 2 sur l'opaganib chez les patients hospitalisés pour une pneumonie au COVID-19 sont préliminaires et ont été fournis à la Société par un tiers indépendant à la suite d'une analyse indépendante initiale et restent soumis à un examen et une analyse supplémentaires.
Un tel examen et analyse peut aboutir à des résultats incompatibles avec les résultats divulgués dans ce communiqué et peut ne pas être reproduit dans des études futures.
 Une « coloscopie virtuelle » ne suffit pas pour prévenir le cancer du côlon
Une « coloscopie virtuelle » ne suffit pas pour prévenir le cancer du côlon
 Mars Mois de la sensibilisation au cancer colorectal
Mars Mois de la sensibilisation au cancer colorectal
 Ce qu'il faut savoir sur Keytruda (Pembrolizumab)
Ce qu'il faut savoir sur Keytruda (Pembrolizumab)
 Le Prilosec peut-il provoquer un cancer de l'estomac ?
Le Prilosec peut-il provoquer un cancer de l'estomac ?
 Réapprovisionner votre armoire de magasin SIBO - Partie 2
Réapprovisionner votre armoire de magasin SIBO - Partie 2
 Qu'est-ce que le régime d'exclusion de la maladie de Crohn ?
Qu'est-ce que le régime d'exclusion de la maladie de Crohn ?
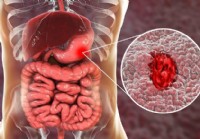 Troubles digestifs :guide visuel des ulcères d'estomac
Quest-ce quun ulcère ? Lorsque votre estomac est en bonne santé, il est recouvert dune couche de mucus collant. Cela le protège de lacide dur qui décompose vos aliments. Si quelque chose perturbe ce
Troubles digestifs :guide visuel des ulcères d'estomac
Quest-ce quun ulcère ? Lorsque votre estomac est en bonne santé, il est recouvert dune couche de mucus collant. Cela le protège de lacide dur qui décompose vos aliments. Si quelque chose perturbe ce
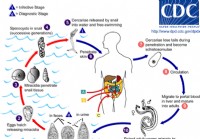 Schistosomiase
Ce que vous devez savoir sur la schistosomiase Cycle de vie de la schistosomiase La schistosomiase est une maladie parasitaire causée par Schistosoma organismes pouvant causer une infection aiguë et
Schistosomiase
Ce que vous devez savoir sur la schistosomiase Cycle de vie de la schistosomiase La schistosomiase est une maladie parasitaire causée par Schistosoma organismes pouvant causer une infection aiguë et
 Comment deux enfants du Michigan ont lancé une expérience de conseil en santé inhabituelle
Beaucoup dentre vous ont demandé plus de détails en coulisses sur la façon dont nous avons pu transformer notre passion pour la santé en une carrière à temps plein au cours des 6 dernières années. C
Comment deux enfants du Michigan ont lancé une expérience de conseil en santé inhabituelle
Beaucoup dentre vous ont demandé plus de détails en coulisses sur la façon dont nous avons pu transformer notre passion pour la santé en une carrière à temps plein au cours des 6 dernières années. C