Résidant dans les interfaces environnementales, les tissus épithéliaux du corps représentent des passerelles potentielles pour les agents pathogènes. Ces tissus sont aussi naturellement colonisés par une communauté complexe de bactéries, virus, champignons et parasites, et c'est ce qu'on appelle le microbiome. Il est probable que, au cours de l'évolution, des interactions permanentes avec ces micro-organismes ont abouti au développement de voies de signalisation robustes qui aident à protéger le corps. Une équipe de chercheurs dirigée par le Prof. Dr. Andreas Diefenbach, Directeur de l'Institut de Microbiologie de la Charité, Maladies infectieuses et immunologie, ont étudié le rôle du microbiome dans la réponse immunitaire du corps contre les agents pathogènes nocifs et les effets qui en résultent sur les voies de signalisation.
La présence d'une infection déclenche la réponse immunitaire de l'organisme. Un rôle clé dans ce processus est joué par les «cellules dendritiques conventionnelles» (cDC). Ceux-ci font partie du système immunitaire inné du corps et portent une gamme de récepteurs de reconnaissance de formes, qui leur permettent de détecter rapidement les agents pathogènes envahissants. La réponse initiale des cellules implique la libération de cytokines, des protéines de signalisation qui attirent les cellules immunitaires vers le site de l'infection. À la fois, ces cellules utilisent également la phagocytose pour engloutir et digérer les agents pathogènes invasifs, après quoi ils présentent des particules individuelles comme des antigènes sur leur surface cellulaire. Cette, à son tour, conduit à l'activation des cellules T (qui font partie du système immunitaire adaptatif) et entraîne une réponse immunitaire ciblée. En revanche, lorsque l'activation des lymphocytes T est déclenchée par des cDC présentant des antigènes endogènes, cela conduit à une réponse immunitaire défectueuse et indésirable et entraîne des maladies auto-immunes.
L'équipe de chercheurs dirigée par le professeur Diefenbach a découvert que les cDC sont incapables de déclencher des réponses immunitaires dans des conditions stériles (c'est-à-dire, chez les souris sans germe). Les chercheurs ont conclu que les cDC doivent recevoir des informations pendant que la cellule est dans son «état basal» (qui se caractérise par l'absence d'infection) et que ces informations doivent provenir du microbiome. Ces signaux dérivés du microbiome amorcent les cDC pour une future réponse contre les agents pathogènes.
Nous voulons comprendre la nature des effets continus du microbiome sur la fonction des cDC. Dans cette étude, nous avons pu montrer que, à leur état basal, ces cellules immunitaires spécialisées sont soumises à la signalisation ininterrompue contrôlée par le microbiome des interférons de type I (IFN-I)."
Pr Andreas Diefenbach, qui détient également une chaire Einstein en microbiologie et dirige le groupe de recherche en immunologie des muqueuses du DRFZ
Les interférons sont des cytokines, c'est-à-dire des molécules de signalisation spéciales qui sont connues pour jouer un rôle dans l'activité antivirale. "Jusqu'à maintenant, nous ne savions que peu de choses sur le rôle de l'IFN-I dans l'état basal. CDC, qui ne reçoivent pas cette signalisation IFN-I pendant l'état basal, ne peuvent pas remplir les fonctions physiologiques qu'ils remplissent dans le cadre de la lutte de l'organisme contre les agents pathogènes, " explique le microbiologiste. Les résultats de l'étude suggèrent que le microbiome contrôle l'aptitude de notre système immunitaire. Il exerce ce contrôle en amenant le système immunitaire à un état de « préparation » afin d'accélérer sa réponse aux agents pathogènes ?.
Les chercheurs ont utilisé divers modèles animaux afin de mieux comprendre la manière dont l'IFN-I contrôlé par le microbiome amorce les cDC de l'état basal pour un combat futur. Grâce à la technologie de séquençage, les chercheurs ont pu comparer les épigénomes et transcriptomes des cDC d'animaux sans germe avec ceux d'animaux témoins et d'animaux déficients en récepteurs IFN-I. Les chercheurs ont voulu savoir ce qui se passe au niveau moléculaire dans les cDC lorsqu'elles ne sont plus exposées à l'IFN-I. Décrire les observations des chercheurs, le premier auteur de l'étude, Laura Schaupp, dit :« Fait intéressant, lorsque nous avons examiné les cDC d'animaux sans germe et ceux sans signalisation IFN-I, nous avons pu observer de faibles niveaux d'expression parmi les gènes impliqués dans la chaîne respiratoire mitochondriale. les rendant incapables de déclencher une réponse immunitaire. Les cellules manquent effectivement du carburant nécessaire pour répondre aux agents pathogènes. » Cela suggère que le microbiome est d'une importance cruciale pour le fonctionnement des cDC. Il semble essentiel à la capacité des cDC à monter une réponse efficace aux infections bactériennes ou virales, y compris les réponses médiées par les cellules T. ??
Les découvertes des chercheurs pourraient contribuer au développement de nouvelles approches thérapeutiques. De nombreuses maladies auto-immunes, comme le lupus érythémateux disséminé, sont causées par une production accrue d'IFN-I. D'autres études ont montré que le microbiome influence l'efficacité des inhibiteurs de points de contrôle dans les immunothérapies anticancéreuses. « Ces phénomènes continueront de nous intéresser beaucoup, " dit le professeur Diefenbach. " Par exemple, est-il possible de modifier la composition du microbiome de manière à réduire la disponibilité de l'IFN-I, exerçant ainsi une influence positive sur les maladies auto-immunes ? Ou serait-il possible d'améliorer les réponses aux immunothérapies anticancéreuses en exerçant une influence positive sur la production sous-jacente d'IFN-I ?" L'équipe de chercheurs prévoit maintenant de mener d'autres études qui exploreront ces questions.
 Salade de poulet aux agrumes
Salade de poulet aux agrumes
 La colite ulcéreuse est-elle une maladie auto-immune ?
La colite ulcéreuse est-elle une maladie auto-immune ?
 Types et fonctions des enzymes digestives
Types et fonctions des enzymes digestives
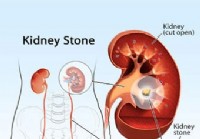 Les premiers signes de calculs rénaux (néphrolithiase)
Les premiers signes de calculs rénaux (néphrolithiase)
 Prendre soin de votre santé intestinale pendant la rentrée scolaire
Prendre soin de votre santé intestinale pendant la rentrée scolaire
 Perforation couverte d'un ulcère perforé - Diagnostic de l'abdomen aigu
Perforation couverte d'un ulcère perforé - Diagnostic de l'abdomen aigu
 Probiotiques SCD – Ce que vous devez vraiment savoir
Il y a quelques mois, jécoutais un podcast de Chris Kresser et il a dit quelque chose qui a secoué mon etch-a-sketch. Vous voyez ce que je veux dire, nest-ce pas ? Jutilise ce terme chaque fois que
Probiotiques SCD – Ce que vous devez vraiment savoir
Il y a quelques mois, jécoutais un podcast de Chris Kresser et il a dit quelque chose qui a secoué mon etch-a-sketch. Vous voyez ce que je veux dire, nest-ce pas ? Jutilise ce terme chaque fois que
 Qu'est-ce que la procédure de retrait rectal d'un corps étranger ?
Quelles sont les causes dun corps étranger rectal ? Le médecin prendra lhistorique complet du patient pour savoir si la cause des problèmes est un corps étranger rectal. Le rectum est la partie
Qu'est-ce que la procédure de retrait rectal d'un corps étranger ?
Quelles sont les causes dun corps étranger rectal ? Le médecin prendra lhistorique complet du patient pour savoir si la cause des problèmes est un corps étranger rectal. Le rectum est la partie
 Nouvel outil pour déchiffrer le microbiome intestinal
Les millions de bactéries résidant dans lintestin jouent un rôle très important dans la santé et la maladie. Cependant, un problème constant a été le manque de compréhension de la composition réelle d
Nouvel outil pour déchiffrer le microbiome intestinal
Les millions de bactéries résidant dans lintestin jouent un rôle très important dans la santé et la maladie. Cependant, un problème constant a été le manque de compréhension de la composition réelle d