Maintenant, chercheurs du Wyss Institute de l'Université Harvard, Faculté de médecine de Harvard (HMS), et Brigham and Women's Hospital ont conçu avec succès un système de transmission de signaux génétiques dans lequel un signal moléculaire envoyé par la bactérie Salmonella Typhimurium en réponse à un signal environnemental peut être reçu et enregistré par E. coli dans l'intestin d'une souris, rapprocher les scientifiques du développement d'un "microbiome synthétique" composé de bactéries programmées pour remplir des fonctions spécifiques. L'étude est rapportée dans ACS Biologie Synthétique .
"Afin d'améliorer la santé humaine grâce à des bactéries intestinales modifiées, nous devons commencer à comprendre comment faire communiquer les bactéries, " a déclaré Suhyun Kim, un étudiant diplômé dans le laboratoire de Pamela Silver au Wyss Institute et HMS, qui est le premier auteur de l'article. "Nous voulons nous assurer que, à mesure que les probiotiques modifiés se développent, nous avons un moyen de les coordonner et de les contrôler en harmonie."
L'équipe a exploité une capacité qui se produit naturellement dans certaines souches de bactéries appelée « détection de quorum, " dans lequel les bactéries envoient et reçoivent des molécules de signal qui indiquent la densité globale de la colonie bactérienne et régulent l'expression de nombreux gènes impliqués dans les activités de groupe. Un type particulier de détection de quorum connu sous le nom de détection d'acyl-homosérine lactone (acyl-HSL) a n'a pas encore été observé dans l'intestin des mammifères, L'équipe a donc décidé de voir s'ils pouvaient réutiliser son système de signalisation pour créer un système de transfert d'informations bactériennes en utilisant le génie génétique.
Les chercheurs ont introduit deux nouveaux circuits génétiques dans différentes colonies d'une souche de E. coli bactéries :un circuit « signaleur », et un circuit "répondeur". Le circuit de signalisation contient une seule copie d'un gène appelé luxI qui est activé par la molécule d'anhydrotétracycline (ATC) et produit une molécule de signalisation à détection de quorum. Le circuit répondeur est structuré de telle sorte que lorsque la molécule de signalisation s'y lie, un gène appelé cro est activé pour produire la protéine Cro, qui active alors un "élément de mémoire" dans le circuit du répondeur. L'élément mémoire exprime deux gènes supplémentaires :LacZ et une autre copie de cro. L'expression de LacZ fait virer au bleu la bactérie si elle est étalée sur une gélose spéciale, produisant ainsi une confirmation visuelle que la molécule signal a été reçue. La copie supplémentaire de cro forme une boucle de rétroaction positive qui maintient l'élément de mémoire allumé, s'assurer que la bactérie continue à exprimer LacZ sur une période de temps prolongée.
Les chercheurs ont confirmé que ce système fonctionne in vitro dans les deux E. coli et S. Typhimurium bactéries, observant que la bactérie répondeuse est devenue bleue lorsque l'ATC a été ajouté à la bactérie signaleuse. Pour voir si cela fonctionnerait in vivo, ils ont administré à la fois le signaleur et le répondeur E. coli bactéries aux souris, puis ont donné aux souris de l'ATC dans leur eau de boisson pendant deux jours. Lorsque les échantillons fécaux des souris ont été analysés, plus de la moitié des souris ont montré des signes clairs de transmission du signal 3OC6HSL qui ont persisté après deux jours sous ATC.
« C'était excitant et prometteur que notre système, avec des circuits à copie unique, peut créer une communication fonctionnelle dans l'intestin de la souris, " a expliqué Kim. " Le génie génétique traditionnel introduit de multiples copies d'un gène d'intérêt dans le génome bactérien via des plasmides, ce qui impose une charge métabolique élevée aux bactéries modifiées et les rend facilement supplantées par d'autres bactéries de l'hôte.
Finalement, l'équipe a répété l'expérience in vivo, mais a donné aux souris un signaleur S. Typhimurium bactéries et E. coli bactéries répondeuses, pour voir si le signal pouvait être transmis à travers différentes espèces de bactéries dans l'intestin de la souris. Toutes les souris ont montré des signes de transmission du signal, confirmant que les circuits conçus permettaient la communication entre différentes espèces de bactéries dans l'environnement complexe de l'intestin des mammifères.
Les chercheurs espèrent poursuivre cette ligne de recherche en créant plus d'espèces de bactéries afin qu'elles puissent communiquer, et en recherchant et développant d'autres molécules de signalisation pouvant être utilisées pour transmettre des informations entre elles.
"Finalement, nous visons à créer un microbiome synthétique avec des espèces de bactéries complètement ou principalement modifiées dans notre intestin, dont chacun a une fonction spécialisée (par exemple, détecter et soigner les maladies, créer des molécules bénéfiques, améliorer la digestion, etc.) mais aussi communique avec les autres pour s'assurer qu'ils sont tous équilibrés pour une santé humaine optimale, " a déclaré l'auteur correspondant Silver, Doctorat., un membre fondateur du corps professoral du Wyss Institute qui est également professeur Elliot T. et Onie H. Adams de biochimie et de biologie des systèmes à HMS.
« Le microbiome est la prochaine frontière de la médecine et du bien-être. Concevoir de nouvelles technologies pour améliorer les microbes intestinaux tout en appréciant qu'ils fonctionnent dans le cadre d'une communauté complexe, comme cela a été fait ici, représente un grand pas en avant dans cette direction, " a déclaré le directeur fondateur de Wyss, Donald Ingber, MARYLAND., Doctorat., qui est également le professeur Judah Folkman de biologie vasculaire au HMS et le programme de biologie vasculaire du Boston Children's Hospital, ainsi que professeur de bio-ingénierie à SEAS.
 COVID-19 :Toujours voir des patients mais capacité limitée
COVID-19 :Toujours voir des patients mais capacité limitée
 Comment définir des résolutions SIBO réussies pour le nouvel an
Comment définir des résolutions SIBO réussies pour le nouvel an
 Proctalgie chronique remplacée par ses syndromes de sous-type
Proctalgie chronique remplacée par ses syndromes de sous-type
 Chirurgie de la gaine gastrique :aperçu
Chirurgie de la gaine gastrique :aperçu
 Œsophagite (douleur, symptômes, causes, grades et traitement)
Œsophagite (douleur, symptômes, causes, grades et traitement)
 La greffe fécale traite les infections intestinales graves et récurrentes
La greffe fécale traite les infections intestinales graves et récurrentes
 IBS post-infectieux
Beaucoup dentre nous ont connu un bug destomac à un moment donné. Les symptômes typiques de la fièvre, des vomissements et de la diarrhée ont tendance à disparaître en quelques jours. Malheureusement,
IBS post-infectieux
Beaucoup dentre nous ont connu un bug destomac à un moment donné. Les symptômes typiques de la fièvre, des vomissements et de la diarrhée ont tendance à disparaître en quelques jours. Malheureusement,
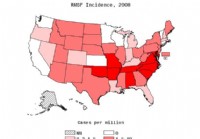 Fièvre pourprée des montagnes Rocheuses
Ce que vous devez savoir sur la fièvre pourprée des montagnes Rocheuses Incidence signalée de RMSF par million de personnes en 2008 ; NN=non rapporté. SOURCE :CDC. La RMSF est une maladie potentielle
Fièvre pourprée des montagnes Rocheuses
Ce que vous devez savoir sur la fièvre pourprée des montagnes Rocheuses Incidence signalée de RMSF par million de personnes en 2008 ; NN=non rapporté. SOURCE :CDC. La RMSF est une maladie potentielle
 Surmonter n'importe quelle maladie
En repensant à ce quil a fallu pour que ma santé soit là où elle est aujourdhui, il y a eu des centaines de moments où jai failli abandonner. Cétait les moments où jétais si malade, si faible et si f
Surmonter n'importe quelle maladie
En repensant à ce quil a fallu pour que ma santé soit là où elle est aujourdhui, il y a eu des centaines de moments où jai failli abandonner. Cétait les moments où jétais si malade, si faible et si f