Inactivation de Bacillus cereus
cellules végétatives par l'acide gastrique et la bile pendant in vitro
transit gastro-intestinal
Résumé de l'arrière-plan
agent pathogène alimentaire Bacillus cereus
peut causer une intoxication alimentaire diarrhéique par la production d'entérotoxines dans le petit intestin. La condition préalable à la maladie diarrhéique est donc la survie pendant le passage gastro-intestinal.
Méthodes
cellules végétatives de 3 B. cereus différents
souches ont été cultivées dans une matrice alimentaire réelle composite, lasagne verde, et leur survie lors de la simulation subséquente de Résultats de passage gastro-intestinal a été évaluée à l'aide in vitro
expériences en simulant le transit à travers le tractus gastro-intestinal supérieur humain (de la bouche à l'intestin grêle).
Pas de survie des cellules végétales a été observée, en dépit des niveaux d'inoculum élevés de 7,0 à 8,0 log UFC /g et la présence de divers composants potentiellement protecteurs alimentaires. Les fractions significatives (env. 10% de l'inoculum consommé) des cellules végétatives de B. cereus ont survécu passage gastrique, mais ils ont ensuite été inactivés par l'exposition à la bile dans l'intestin milieu faiblement acide (pH 5,0). En revanche, le faible nombre de spores présentes (jusqu'à 4,0 log spores /g) ont montré une excellente survie et sont restés spores viables tout au long de la simulation de passage gastro-intestinal.
Conclusion
Les cellules végétatives sont inactivées par l'acide gastrique et la bile pendant le passage gastro-intestinal , alors que les spores résistent et survivent. Par conséquent, la forme physiologique (cellules ou spores végétatives) du B. cereus
consommé détermine la survie gastro-intestinale ultérieure et donc la dose infectieuse, qui devrait être beaucoup plus faible pour les spores que les cellules végétatives. Aucune différence significative dans la capacité de survie gastro-intestinale a été trouvée parmi les différentes souches. Cependant, la variabilité des souches considérable a été observée dans la tendance de la sporulation pendant la croissance dans le milieu et la nourriture de laboratoire, ce qui a des implications importantes pour le potentiel de survie gastro-intestinale des souches de B. cereus différents.
Mots-clés
Bacillus cereus
Bile In vitro
simulation Gastrointestinal passage Contexte
B. cereus
peut causer des émétique et diarrhéiques et l'intoxication alimentaire par la production de resp. émétique (cereulide) et les toxines diarrhéiques (entérotoxine non hémolytiques (Nhe), hémolysine BL (Hbl), cytotoxine K (CYTK), etc.) [1]. Contrairement à la toxine cereulide extrêmement stable, les entérotoxines sont facilement dégradés par des enzymes acides et digestives (protéases) et entérotoxines ainsi préformées dans les aliments ne conservent pas leur toxicité pendant le passage gastro-intestinal [2]. Par conséquent, la condition préalable à une intoxication alimentaire diarrhéique est entérotoxine production par B. cereus
dans le petit intestin, de sorte que la survie gastro-intestinale du végétative B. cereus
a été étudiée. Il a été précédemment montré que env. 10% des cellules végétales ont survécu passage gastrique [3]. Ensuite, les bactéries survivantes sont confrontés à la bile dans la lumière du duodénum, la partie proximale de l'intestin grêle.
Bile se compose principalement d'acides biliaires (environ 72% des lipides totaux), en plus de phospholipides (env. 24% ) et du cholestérol (env. 4%) [4]. Chez l'homme, les acides biliaires sont constitués principalement d'acide cholique (entre 50% et 80%) et de l'acide chénodésoxycholique (entre 20% et 50%) [5, 6]. Ils sont synthétisés dans le foie à partir du cholestérol et conjugué à la glycine (env. 75%) ou de la taurine (env. 25%), avec des rapports de conjugaison selon l'alimentation entre autres facteurs [6, 7]. Sécrétion de la bile est déclenchée par la graisse et la libération de l'acide de l'estomac dans le duodénum, ce qui entraîne 7 à 15 mM de sels biliaires dans l'intestin grêle après un repas, ce qui correspond à 5 à 10 g Oxgall /L [7-10]. Déconjugaison des acides biliaires par les bactéries intestinales indigènes se produit principalement dans l'iléon distal, où env. 95% des acides biliaires est réabsorbé, dont env. 15% est non conjugué [7, 10]. Les acides biliaires conjugués et non conjugués sont absorbés par diffusion passive le long de la totalité de l'intestin, mais ce procédé est plus efficace pour les acides biliaires non conjugués. En outre, les systèmes de transport spécifiques actifs sont présents dans l'iléon distal, qui sont plus efficaces dans l'absorption des acides biliaires conjugués. Après l'absorption de l'intestin, les acides biliaires sont transportées vers le foie via le sang, reconjugué et sécrétés à nouveau dans la vésicule biliaire. Ce processus de recyclage des acides biliaires est appelée circulation entéro-hépatique.
Le rôle physiologique des acides biliaires est d'augmenter la solubilité des graisses alimentaires et de faciliter sa dégradation et l'absorption. En raison de leurs propriétés détergentes, les acides biliaires modifie également les membranes cellulaires et ont des effets cytotoxiques et bactéricides, visibles par une fluidité membranaire accrue et une perméabilité à [11-14] ainsi. En fonction de la concentration de la bile, la perturbation de l'intégrité de la membrane cellulaire se produit presque instantanément, ce qui provoque des fuites et la mort cellulaire, ou plus lentement et subtilement en modifiant la perméabilité de la membrane et de la fluidité, l'activité des protéines essentielles dans la membrane cellulaire et le caractère hydrophobe de la membrane [15 ]. En plus de la destruction de l'intégrité de la membrane cellulaire bactérienne, la bile induit également des lésions de l'ADN, la dénaturation et le repliement des protéines, conduisant à la mort des bactéries [16].
Bactéries Gram-positives ont tendance à être plus sensibles à la bile que Gram- bactéries négatives, mais la tolérance de la bile est très souche spécifique, donc des déclarations générales pour les espèces ne sont pas possibles [17-19]. Malgré les effets bactéricides de la bile, certains micro-organismes ont développé une résistance à la bile par induction de la bile et des enzymes métabolisant les systèmes de transport ou en modifiant la perméabilité de la membrane, la fluidité ou la charge. Certains agents pathogènes entériques peuvent même dépendre de la bile comme un signal hôte pour la régulation de la virulence. Par exemple, Salmonella enterica sérotype Typhimurium possède la polychimiothérapie efflux pompe AcrAB pour l'élimination de la bile et le transport à travers la membrane externe [20]. En outre, l'invasion des cellules epitheliales de l'hôte par cette bactérie est induite par des concentrations de bile abaissées, de sorte que, après le passage à l'iléon distal ou dans la couche de mucus [21].
Le co-ingestion d'aliments est un facteur important dans le antibactérienne l'activité de la bile dans l'intestin. Bile inactivation des bactéries est influencée par la présence de composants alimentaires, ce qui peut créer des micro-environnements de protection ou de la bile se lient. Par exemple, la concentration de la bile maximale tolérée par B. cereus
pendant la croissance dans un milieu intestinal a été de 3 g /L de bile de porc lorsque la soupe de pois a été complétée, alors que seulement 0,9 g /l et 0,6 g /L de bile ont été tolérées en présence de lait et l'absence de nourriture, respectivement [22]. Aussi pour Lactobacillus curvatus, la présence d'une matrice alimentaire, à savoir la viande, l'augmentation de la tolérance à la bile et ensuite sa survie gastro [23]. De même, la tolérance à la bile de Bifidobacterium breve a été renforcée par des protéines de soja [24].
Dans cette étude, la survie gastro-intestinale du végétal B. cereus
cellules a été étudiée et liée au rôle bactéricide de la bile. B. cereus
inoculum a été cultivé dans le composite à matrice alimentaire lasagnes verde in vitro avant la
simulation du passage gastro-intestinal pour inclure les effets protecteurs éventuels des particules alimentaires sur la survie gastro-intestinale de B. cereus
. Matériaux et méthodes
B. cereus
souches, la culture et le dénombrement
B. cereus
souches ATCC 14579, NVH 1230-1288 et 73 FF (tableau 1) ont été cultivées et ensuite repiquées dans 10 ml de Tryptone Soya Broth (TSB, Oxoid) pendant 24 h à 30 ° C. Après centrifugation et remise en suspension dans 1 ml de solution physiologique peptonée Sel (PPS, 8,5 g /L de NaCl (Fluka) et 1 g /L neutralisent peptone bactériologique (Oxoid)), 830 ul de la sous-culture a été inoculé dans 83 g de lasagnes verde (achetée en le supermarché local) dans des sacs stomacher et incubé pendant 24 h à 22 ° C. lasagne verde Retail a été acheté dans le supermarché local, qui contenait en moyenne de 4,7 log UFC /g bactéries totales (écart type de 1,3 log UFC /g, analyse de 11 produits différents au cours d'une période de 6 mois) et ≤ 2,0 log UFC /g B . cereus
. Le pH moyen de ce produit alimentaire était de 5,52 (écart-type ± 0,06) .Table 1 La simulation du passage gastro-intestinal a été réalisée avec trois souches de B. cereus différentes: le type souche B. cereus ATCC 14579, l'isolat clinique B. cereus NVH 1230 -88 à partir d'une épidémie d'empoisonnement alimentaire diarrhéiques et l'isolat alimentaire B. cereus FF 73 de la matrice alimentaire pertinente, à savoir lasagne verde
souche B. cereus
Origin
mininal température de croissance ( ° C)
Hbl production
production Nhe
ATCC114579
souche de type
> 10
+
+
NVH2 1230 -88
cliniques (fèces humaines) 8
+
- FF3 73
alimentaire (lasagne verde)
10
+
+
1ATCC = American type Culture Collection, États-Unis; 2NVH = Norwegian School of Veterinary Science, Oslo, Norvège; Collection alimentaire 3FF = Flandre, Belgique.
Le nombre total et B. cereus
nombre ont été déterminées par étalement des dilutions appropriées en SPA sur Tryptone Soya Agar (TSA) et la gélose mannitol-jaune d'oeuf-polymyxine B (PPCS .., respectivement des concentrations de spores ont été déterminées par étalement après chauffage à 80 ° C pendant 10 min
In vitro
simulation du passage gastro-intestinal
l'expérience de simulation dynamique gastro-intestinale comprend cinq phases: 1) la bouche, 2) l'estomac, 3), le duodénum, 4), la dialyse et 5) l'iléon [25]. En bref, le verde lasagnes contenant le B. cereus
inoculum (83 g) a été mélangé avec du milieu de la salive (56 ml, pH 6,5, 37 ° C) par Stomacher pendant 1 min (Stomacher Lab Blender 400, Seward) et incubées 10 min avant le transfert au récipient de l'estomac. Le pH gastrique a diminué de 5,0 à 3,0 pendant les 90 premières minutes et à 2,0 au cours de la dernière 90 min par l'acide ajouté en continu (M HCl 0,28). La vidange gastrique a été initié 30 min après le début de la phase gastrique en 5 fractions par pompage discontinue de telle sorte qu'approximativement. 25% du contenu gastrique a été éliminé au bout de 1 h, 50% au bout de 2 h, et 75% au bout de 3 h. La vidange gastrique fractionnée a donné lieu à un chevauchement de 150 min entre l'estomac et de la phase du duodénum, dans lequel le B. cereus
inoculum a été divisée en sous-populations qui ont été soumis à divers temps d'incubation différents à la phase de l'estomac (min. 30 min, max . 180 min) et la phase duodénale (min. 10 min, max. 160 min). Le récipient intestinal est anaérobie (balayé avec de l'azote gazeux) et contenait milieu intestinal à 10,0 g /l de la bile (Oxgall, Difco) et le pH est le pH a été ajusté automatiquement par un régulateur de pH (Fermac 260, Electrolab) de rester à un pH de 5,0 pendant la premier 45 min et à pH 6,0 au cours de la dernière 115 min. Et la fin de la phase duodénum, le contenu gastrique complets ont été transférés et la concentration de la bile a été abaissée par dilution à 5 g /L. Au cours de la phase suivante, ≥ 90% de cette bile a été éliminé par dialyse et de la concurrence avec des bactéries intestinales humaines a été simulées pendant la phase de iléon finale. Cependant, après l'élimination des cellules végétatives de B. cereus, l'expérience a été arrêtée gastro-intestinale, ce qui entraîne des expériences constituées par les trois premières phases seulement. La tolérance de Bile de Les expériences ont été réalisées en triple avec différents B. cereus
inoculum à des jours différents. de B. cereus
B. cereus
souche NVH 1230-88 a été cultivée et ensuite repiqué dans 10 ml TSB pendant 24 h à 30 ° C. Ensuite, 100 ul de la sous-culture a été inoculé dans des tubes de verre contenant 9,9 ml de TSB et incubées à 37 ° C. Le pH du BST est soit neutre (pH = 7,2) ou acide (pH = 5,0) et supplémenté avec des concentrations de bile différentes, permettant ainsi à des concentrations finales de 0,0 (témoin TSB), 1,0, 5,0 et 10,0 g /l oxgall (Difco ). La survie de B. cereus végétative
cellules a été évaluée en plaquant les diltutions appropriées PPS sur TSA. Production
Toxin production d'entérotoxines Nhe et Hbl a été déterminée en analysant 1 échantillons mL après filtration (0,2 filtres um seringue, Whatman) avec les Duopath® cereus Enterotoxins (Merck) selon les instructions du fabricant. les résultats de la croissance de B. cereus de
lasagne verde The verde lasagne a été ensemencé avec environ . 6,0 UFC /g B. cereus
et incubé pendant 24 h à 22 ° C pour obtenir un inoculum très concentré de végétation B. cereus
cellules cultivées dans une matrice alimentaire composite microbiote alimentaire en simulant le stockage des lasagnes contaminés à température ambiante. Cela a abouti à lasagne verde contenant env. 8,5 log UFC /g bactéries totales, dont B. cereus
constitué 7.0 à 8.0 UFC /g, selon la souche (tableau 2). B. cereus
NVH 1230-1288 a montré une concentration de spores stable de 3,5 spores log /g, provenant de l'inoculum du BST. En revanche, la sporulation supplémentaire était évident à partir d'env. 4,0 spores de log /g à 4,5 log spores /g après 30 h pour B. cereus
FF 73. Remarquablement, B. cereus
ATCC 14579 n'a pas produit de spores après 30 heures d'incubation, avec seulement un nombre très faible ( 3,0 spores /g) observées dans seulement 1 des 3 sacs répliqués. Après inoculation et incubation, le vert de lasagnes est donc fortement contaminé par B. cereus
cellules végétatives (7.0 à 8.0 log UFC /g) dans la phase stationnaire de croissance et de faibles quantités de spores de B. cereus
(jusqu'à 4,0 log des spores /g) .Tableau 2 croissance des trois souches différentes de B. cereus dans la matrice alimentaire avant la simulation du passage gastro-intestinal; valeurs moyennes des expériences indépendantes en triple exemplaire, exprimés en log UFC /g ± écart-type sont présentés
souche B. cereus
Temps (h)
0
22
24
26
28
30
B. cereus
Nombre total de ATCC14579
5,8 ± 0,1 8,3 ± 0,6
8,4 ± 0,3 8,8 ± 0,2
8,8 ± 0,3
8,9 ± 0,2
total B. cereus
5,7 ± 0,1 6,9 ± 0,1
6,9 ± 0,1 6,7 ± 0,3
7,2 ± 0,3 7,0 ± 0,2
B. cereus de spores
< 2.0 ± 0.0
< 2.0 ± 0.0
< 2.0 ± 0.0
< 2.0 ± 0.0
< 2,0 ± 0,0 2,3 ± 0,6
B. cereus
NVH 1230-1288
Nombre total
5,9 ± 0,1 8,2 ± 0,2
8,4 ± 0,1 8,9 ± 0,0
8,9 ± 0,1 8,8 ± 0,2
total B. cereus
6,2 ± 0,3 7,9 ± 0,2
8,2 ± 0,1 8,5 ± 0,2
8,3 ± 0,3 7,9 ± 0,1
B. cereus de spores
3,5 ± 0,6 3,5 ± 0,2
3,3 ± 0,6 3,4 ± 0,6
3,3 ± 0,6 3,4 ± 0,6
B. cereus
FF 73
Nombre total
5,7 ± 0,1 8,5 ± 0,1
8,7 ± 0,1 9,0 ± 0,0
9,0 ± 0,3
8,9 ± 0,3
total B. cereus
5,7 ± 0,1 8,1 ± 0,2
8,0 ± 0,1 8,3 ± 0,1
8,2 ± 0,1 8,3 ± 0,2
B. cereus de spores
3,8 ± 0,2 3,9 ± 0,4
3,9 ± 0,4 4,0 ± 0,5
4,0 ± 0,3 4,5 ± 0,1
Aucune production d'entérotoxines a été détectée lasagne verde après 24 h par B. cereus
ATCC 14579 et B. cereus
NVH 1230-1288, tandis que Nhe a été détecté sporadiquement (en réplicats 1 sur 3) dans le cas de B. cereus
FF 73. Cela est probablement dû au pH acide 5.5 de lasagne verde et la température assez basse d'incubation de 22 ° C, qui ne sont pas optimales pour la production d'entérotoxine [1]. Cependant, entérotoxines préformées dans les aliments ne sont pas responsables de l'intoxication alimentaire diarrhéique, car ils sont rapidement dégradées au cours du passage gastro-intestinal [2].
In vitro
de simulation du passage gastro-intestinal de B. cereus
cellules végétatives
le lasagne verde contaminé par 7.0 à 8.0 log UFC /ml B. cereus
cellules végétatives dans la phase stationnaire de croissance a été soumis à la simulation in vitro
de passage gastro-intestinal (Figure 1). Survie de B. cereus
(< 1 log de réduction) a été observée pendant la phase de la bouche et les 30 premières minutes de la phase de l'estomac quand le pH gastrique était compris entre 5,0 et 4,0. Ensuite, lorsque le pH gastrique a diminué au-dessous de 4,0, les cellules végétales sont rapidement inactivées dans la phase de l'estomac, perceptible comme un déclin rapide du B. cereus total
chiffres à des valeurs similaires du B. cereus
nombre de spores en les vaisseaux gastriques. Le B. cereus
totaux et de spores compte pendant la phase duodénum est resté environ. 1,0 log UFC /mL pour B. cereus
ATCC 14579, env. 2,5 log UFC /mL pour B. cereus
NVH 1230-88 et env. 3,5 log UFC /mL pour B. cereus
FF 73. Fait intéressant, les chiffres de spores de B. cereus
NVH 1230-1288 ont diminué au cours de la phase de l'estomac au cours de la dernière heure et le pH plus acide. Depuis le total B. cereus
nombre n'a pas changé, ce qui indique l'initiation de la germination des spores. B. cereus ATCC 14579
a montré la production de spores incompatibles, ce qui entraîne l'absence de spores pendant les deux premières simulations et d'un nombre très faible (légèrement au-dessus de la limite de détection de 1,0 spores /ml) au cours des deux dernières expériences. Figure 1 Inactivation des cellules végétatives pendant la dynamique de simulation in vitro de passage gastro-intestinal avec B. cereus ATCC 14579 (1), B. cereus
NVH 1230-88 (2) et B. cereus
73 FF (3); B. cereus
totale (a) et de spores (b) les chiffres ont été déterminées par étalement sur PPCS avec et sans traitement thermique (10 min à 80 ° C), respectivement, dans le verde de lasagne (□), la phase de la bouche (◊), la phase de l'estomac (Δ) et la phase duodénale (○); les valeurs moyennes et écart-type d'expériences en triple sur des jours différents sont présentés.
Aucun test de détection des entérotoxines Nhe et Hbl ont été réalisées, car aucune croissance n'a été observée au cours de l'une des phases gastro-intestinales, ce qui est une condition préalable à la production d'entérotoxine [1 ]. bile de la tolérance de B. cereus
la croissance et la survie de B. cereus
NVH 1230-88 a été déterminée en présence de diverses concentrations biliaires (figure 2). Dans des conditions optimales, à savoir le BST neutre avec un pH de 7,2, l'effet de la bile était dépendante de la concentration. La concentration minimale de 1,0 g /l Oxgall a entraîné une réduction de la population d'env. 30% en comparaison avec le contrôle (BST sans bile) au temps 0 h. En outre, après 1 h, le nombre viable a été réduit avec env. 40% par rapport à la concentration dans du TSB avec 1,0 g /l Oxgall à 0 h. Cependant, au bout de 2 h la récupération et l'excroissance des cellules restantes a été observée, en raison du B. cereus
concentration était similaire à celle de 0 h, et enfin au bout de 3 h, la population avait augmenté avec env. 1 log par rapport à celle à 0 h. Cependant, la présence de 5,0 g /l Oxgall induit une baisse permanente à 4,1 log UFC /ml en moyenne (l'inactivation de 88% des cellules végétales) et de 10,0 g /l Oxgall à 3,9 log UFC /mL (inactivation de 94 %). Figure 2 Survie de B. cereus dans NVH 1230-1288 Tryptone Soya Broth (TSB) à 37 ° C avec un pH de 7,2 (A) et un pH de 5,0 (B) avec la bile (Oxgall, Difco) des concentrations variables: 0,0 g /L (blanc ), 1,0 g /L (gris clair), 5,0 g /L (gris foncé) et 10,0 g /L (noir).
Dans TSB à pH acide 5,0, env. 99% du B. cereus
inoculum a été immédiatement inactivée par l'exposition à la bile, quelle que soit la concentration de la bile, ce qui entraîne constante B. cereus totale
chiffres d'env. 3,0 log UFC /mL. Le B. cereus
inoculum compris entre 0,1 et 0,2% de spores, le nombre de spores donc constants ont été obtenus tout au long de l'expérience: 2,6 (± 0,2) log spores /mL au début et à 2,5 (± 0,3) log spores /mL à la fin. Rapport de prise de cette population de spores en compte, les cellules végétatives constituaient encore la majorité (env. 60%) de 1% de la bile résistant B. cereus
.
La survie des cellules végétatives pendant le passage gastrique était similaire à celle des études précédentes avec un milieu de pommes de terre en purée [3]. Au cours de ces expériences, env. 10% des cellules végétatives survécu passage gastrique, la plupart d'entre eux dans la première fraction gastrique lorsque le pH gastrique était compris entre 5,0 et 4,0. Ces cellules ont été transférées dans le vaisseau vivant intestinal et donc entre 5,5 et 6,5 log UFC /mL B. cereus
étaient attendues dans le récipient intestinal. Cependant, le nombre beaucoup plus bas, qui rapprochaient les comptages de spores de B. cereus, ont été obtenus lors de la phase duodénum. Ceci indique que les cellules végétales qui ont survécu ont été inactivés passage gastrique dans le milieu intestinal. Lot d'expériences d'incubation dans du TSB et diverses concentrations de bile ont montré que la majorité (99,1%) des cellules végétales a été inactivée immédiatement après l'exposition à la bile à un pH de 5,0, indépendamment de la concentration de bile dans l'intervalle de 1,0 à 10,0 g Oxgall /L. En conclusion, végétative B. cereus
cellules qui ont survécu passage gastrique ont été éliminés lors de la phase duodénum ultérieure par l'effet bactéricide de la bile.
L'effet bactéricide de la bile sur végétative B. cereus
cellules était dépendante du pH. A pH 7,0, l'inactivation a été corrélée avec la concentration de la bile, et la concentration de la bile la plus faible (1 g /L) a même permis la survie et la croissance. En revanche, à un pH de 5,0, l'inactivation instantanée de la majorité (> 99%) des cellules végétales sont produites, indépendamment de la concentration de la bile (dans la plage de 1,0 à 10,0 g /L). Semblable à nos résultats, l'inactivation de Listeria monocytogenes par des acides biliaires a été également fortement augmenté à un pH acide 5,5 [26]. L'inactivation des bactéries par la bile est semblable à celui par des acides organiques, qui sont particulièrement efficaces à la fois à un faible pH. La constante de dissociation d'acide logarithmique (pKa) d'acides biliaires non conjugués est d'environ 5,1, mais la conjugaison avec de la glycine diminue le pKa env. 3.7 [27]. Conjugaison avec de la taurine conduit à un pKa encore inférieur d'env. 1,5 [28]. En conséquence, la majorité des acides biliaires conjugués est dissocié et ionisé dans la plupart des valeurs physiologiques du pH intestinal, soit 95,24% à pH 5,0 et 99,95% à pH 7,0 pour les acides biliaires glycoconjugués. Seules les formes syndiqués d'acides biliaires peuvent passivement traverser la membrane cellulaire, tandis que les acides biliaires conjugués dissociées et ionisées nécessitent des systèmes de transport actifs spécifiques [29]. Par conséquent, 4,67% des acides biliaires conjugués peut entrer dans le B. cereus
cellules à un pH de 5,0, comparativement à seulement 0,03% à pH 7,0. En outre, le pH interne des cellules viables de B. cereus de
est toujours comprise entre 6,0 et 7,5, en fonction du pH et de la culture des conditions extérieures [30]. Une fois que les acides biliaires non dissociés ont diffusé dans les cellules de B. cereus, la majorité d'entre eux (99,50 à 99,98%) subit une dissociation intracellulaire, ce qui entraîne une acidification interne létale.
Il a été rapporté que certains composants alimentaires ont augmenté la bile la tolérance de B. cereus
cellules végétatives en milieu intestinal à pH 6,5 [22]. Toutefois, le composite à matrice alimentaire lasagnes verde n'a pas atténuer les effets néfastes de la bile sur B. cereus
au cours de nos expériences à pH 5,0. Il est possible que les effets du type d'aliment ne sont observées à un pH plus optimale pour cet agent pathogène d'origine alimentaire, lorsque les différences entre les traitements plus prononcés sont attendus. Le plus Contrairement aux cellules végétatives, des spores de B. cereus
n'a pas été inactivée par la bile , bien qu'ils ne germent pas dans le milieu intestinal contenant de 5 à 10 g /l Oxgall. Cela coïncide avec les observations de la simulation dynamique de passage gastro-intestinal des spores [25], où les spores ont été affecté au cours de la bouche, de l'estomac et de la phase duodénum et seulement commencé la germination au cours de la dialyse, lorsque la concentration de la bile a été abaissée de 5,0 g /L Oxgall à < 0,5 g /l et celles des expériences d'incubation des lots [31], dans laquelle les spores ont germé dans les 2 h dans du milieu de simulation intestinale contenant 1,0 g /L de la bile. D'autres études ont également rapporté que les spores sont capables de germer et de se multiplier dans un fluide intestinal simulé contenant de la bile (1,5 g Oxgall /L) [32], et que la résistance à la bile de B. cereus
spores était supérieure à celle des cellules végétales [33 ]. En conclusion, les fortes concentrations de bile (≥ 5 g /l Oxgall) ne permettent pas la germination des spores, alors que de faibles concentrations de bile (< 5 g /L). Induire la germination et l'excroissance
Outre son importance dans la digestion des nutriments et de l'absorption, de la bile est également un composé antimicrobien important dans l'intestin [7]. de faibles niveaux biliaires intestinaux anormaux peuvent se produire chez les personnes atteintes biliaires ou hépatiques anomalies ou irrégularités dans la circulation entéro-hépatique, ce qui peut rendre ces personnes particulièrement sensibles à la diarrhée à cause de la survie accrue des bactéries ingérées et intestinales. En outre, les acides biliaires sont des laxatifs endogènes, de sorte que la malabsorption des acides biliaires dans l'intestin grêle, ce qui conduit à augmenter les niveaux de la bile dans l'intestin grêle terminal et le côlon, peuvent également provoquer la diarrhée [34].
Conclusion
B. les cellules végétatives de cereus ont été incapables de survivre au passage gastro-intestinal simulé par l'expérimentation in vitro en
, en dépit de la concentration élevée d'inoculum de 7,0 à 8,0 log UFC /ml et la culture de l'inoculum dans le composite de la matrice alimentaire lasagnes vert. La majorité des cellules végétales a été inactivée par l'acide gastrique, et les cellules survivantes ont ensuite été inactivée par la bile pendant la phase duodénum. En revanche, les spores de B. cereus ont survécu à la simulation du passage gastro-intestinal et sont restées les spores dans des conditions peu favorables à la germination (et l'excroissance). Par conséquent, la dose infectieuse pour B. cereus
varie probablement en fonction de la forme physiologique consommé, étant plus faible pour les spores très résistantes. Bien que la survie gastro-intestinale était similaire pour les différentes souches, leur tendance de sporulation varie considérablement, ce qui a des implications importantes pour la survie gastro-intestinal potentiel et donc la dose infectieuse des différents B. cereus
souches
. Déclarations
auteurs de fichiers originaux soumis pour les images
Voici les liens vers les auteurs de dossiers soumis originaux pour les images. de fichier d'origine pour la figure 1 13099_2012_68_MOESM2_ESM.pdf Auteurs 13099_2012_68_MOESM1_ESM.pdf Auteurs fichier d'origine pour la figure 2 intérêt concurrence
Nous, tous les auteurs, déclarer que nous avons aucun conflit d'intérêts. SC les contributions de
Auteurs, MU et TVdW conçu les expériences; SC et SH effectué les travaux expérimentaux et traités les résultats; SC a écrit le manuscrit aidé par MU, NB et TVdW. Tous les auteurs ont lu et approuvé le manuscrit final.
 Que sont les acides gras à chaîne courte et pourquoi devriez-vous vous en soucier ?
Que sont les acides gras à chaîne courte et pourquoi devriez-vous vous en soucier ?
 L'arme mystérieuse à l'intérieur de vous (Comprendre votre système immunitaire)
L'arme mystérieuse à l'intérieur de vous (Comprendre votre système immunitaire)
 Quels sont les 7 types de caca ? Tableau des selles Bristol
Quels sont les 7 types de caca ? Tableau des selles Bristol
 Les saisons changent :voici comment vous pouvez favoriser la santé immunitaire
Les saisons changent :voici comment vous pouvez favoriser la santé immunitaire
 Les avantages pour la santé intestinale commencent pendant la grossesse
Les avantages pour la santé intestinale commencent pendant la grossesse
 Qu'est-ce qui nuit vraiment à la santé intestinale de votre famille ?
Qu'est-ce qui nuit vraiment à la santé intestinale de votre famille ?
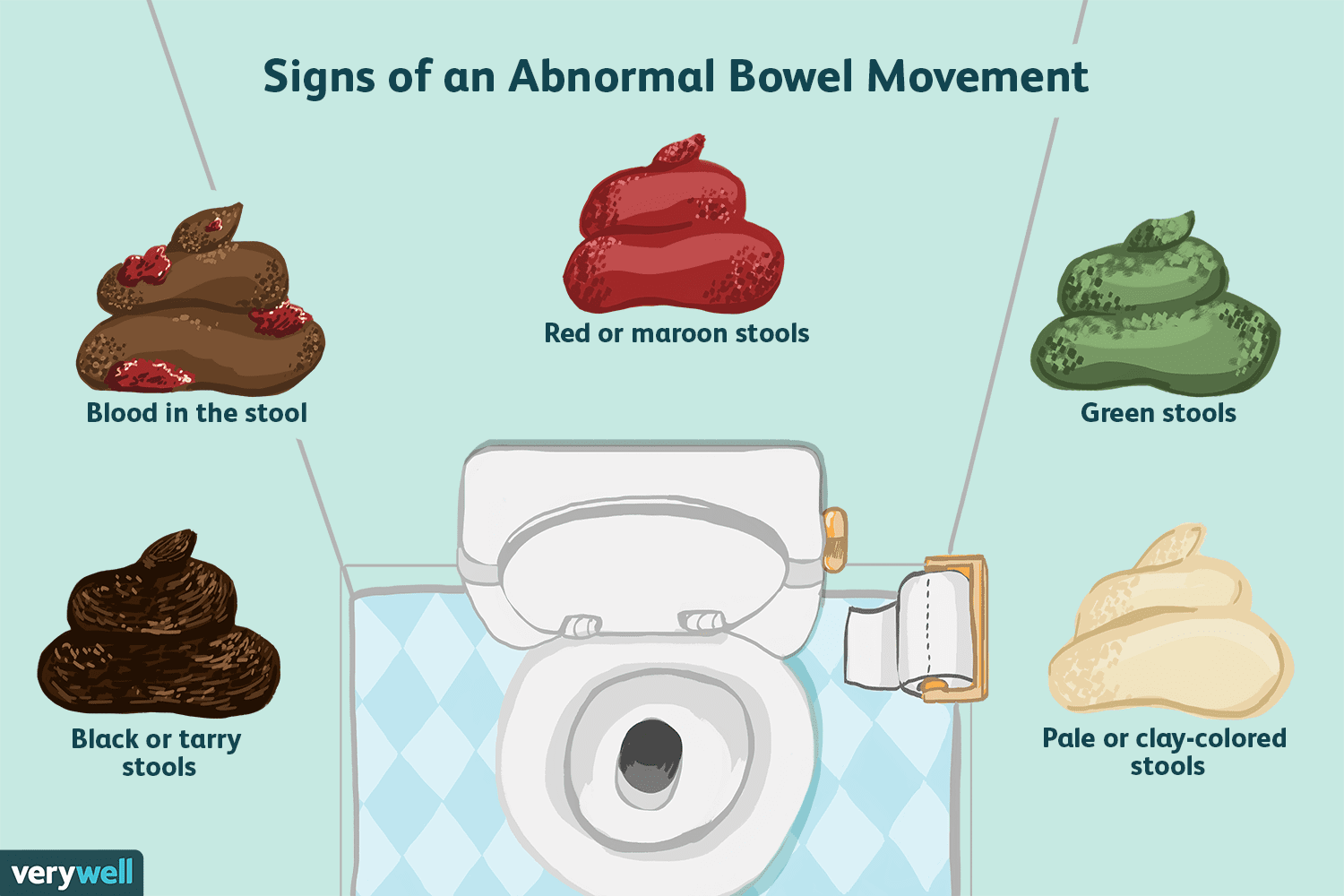 Ce que signifie avoir une selle normale
Quest-ce quune selle normale ? Il est difficile de savoir si vos selles sont normales. Ce nest probablement pas quelque chose dont vous discutez avec les gens, y compris votre fournisseur de soins de
Ce que signifie avoir une selle normale
Quest-ce quune selle normale ? Il est difficile de savoir si vos selles sont normales. Ce nest probablement pas quelque chose dont vous discutez avec les gens, y compris votre fournisseur de soins de
 Mutations génétiques non BRCA qui augmentent le risque de cancer du sein
En plus des mutations du gène BRCA dont on parle souvent, il existe un nombre important dautres mutations génétiques héréditaires qui augmentent le risque de développer un cancer du sein. En fait, on
Mutations génétiques non BRCA qui augmentent le risque de cancer du sein
En plus des mutations du gène BRCA dont on parle souvent, il existe un nombre important dautres mutations génétiques héréditaires qui augmentent le risque de développer un cancer du sein. En fait, on
 Les désintoxications et les nettoyages sont-ils sûrs ?
La désintoxication fait référence à lélimination des toxines du corps. Il existe des risques importants pour la santé associés aux désintoxications et aux nettoyages et ils ne sont pas particulièremen
Les désintoxications et les nettoyages sont-ils sûrs ?
La désintoxication fait référence à lélimination des toxines du corps. Il existe des risques importants pour la santé associés aux désintoxications et aux nettoyages et ils ne sont pas particulièremen