Une thérapie et d'imagerie technique virale oncolytique nouveau pour le cancer gastrique en utilisant un virus de la vaccine génétiquement portant le symporteur d'iodure de sodium de l'humain
Résumé cancers gastriques
Contexte de la survie globale ont pauvres malgré les récentes avancées dans les méthodes de détection précoce, les techniques de résection endoscopique, et des traitements de chimiothérapie. le traitement du virus de la vaccine a un potentiel thérapeutique prometteur pour divers cancers et a un profil de grande sécurité. Nous avons étudié l'efficacité thérapeutique d'un virus de la vaccine génétiquement modifiée nouveau portant le symporteur d'iodure de sodium de l'humain (h
NIS), le gène GLV-1 H153, les cancers gastriques et son utilité potentielle pour l'imagerie par
99mTc scintigraphie de pertechnétate et 124I la tomographie par émission de positons (TEP).
Méthodes
GLV-1 H153 a été testée contre cinq lignées cellulaires de cancer gastrique humain en utilisant cytotoxicité et dosages de plaques virales standards.
In vivo, les tumeurs sous-cutanées de flanc ont été générés chez des souris nudes avec des cellules de cancer gastrique humain, MKN-74. Les tumeurs ont été injectées avec soit ensuite GLV-1 H153 ou du PBS et suivies pour la croissance tumorale. 99mTc pertechnétate scintigraphie et résultats
GFP expression de 124I microTEP imagerie ont été réalisées., Un substitut pour l'infectivité virale, a confirmé une infection virale par 24 heures. À une multiplicité d'infection (MOI) de 1, 1 GLV-H153 obtenu > 90% de cytotoxicité dans MNK-74, OCUM-2MD3 et AGS sur 9 jours, et > 70% de cytotoxicité dans MNK- 45 et TMK-1.
In vivo, GLV-1 H153 était efficace dans le traitement des xénogreffes (p < 0,001) après 2 semaines de traitement. tumeurs GLV-1 H153-infectés ont été facilement visualisés par 99mTc pertechnétate scintigraphie et imagerie 124I microTEP 2 jours après les conclusions
GLV-1 H153 est un virus oncolytique efficace exprimant le h
protéine NIS qui peut efficacement régresser les tumeurs gastriques et permettre l'imagerie des tissus profonds. Ces données encourage son enquête continue dans les milieux cliniques.
Mots-clés
thérapie virale GLV-1 H153 cancer gastrique oncolytique sodium humain iodure symporteur (h
NIS) Contexte
Le cancer gastrique est l'un des plus répandus maligne tumeurs, en particulier en Asie [1]. Bien que les méthodes de détection précoce, le développement de la résection endoscopique ou chirurgicale, et chimiothérapies plus efficaces ont amélioré la survie globale chez les patients atteints de cancer gastrique, le pronostic des patients atteints de cancer gastrique avancé est encore faible [2-4]. La plupart des traitements de chimiothérapie conventionnels ont démontré l'efficacité modérée. Une explication possible de la résistance du cancer gastrique à la thérapie conventionnelle pourrait être sa non-susceptibilité à l'apoptose [5]. Cependant, les virus oncolytiques ont de grands effets thérapeutiques contre les cellules cancéreuses qui expriment des niveaux élevés de la ribonucléotide réductase, des enzymes de réparation de l'ADN, et sont donc résistantes à l'apoptose [6, 7]. Beaucoup de ces caractéristiques qui rendent les cellules cancéreuses gastriques résistantes à la chimiothérapie, les rendre sensibles à la thérapie virale oncolytique. Ainsi, la thérapie génique utilisant un virus oncolytique offre une alternative intéressante pour le traitement du cancer gastrique [8].
La thérapie virale oncolytique a été étudiée au cours du dernier siècle et connu le succès dans les essais précliniques et cliniques comme une modalité nouvelle de traitement du cancer [9 ]. le virus de la vaccine (VACV) des souches sont particulièrement intéressants comme agents antitumoraux potentiels, car ils peuvent incorporer de grandes quantités d'ADN étranger sans diminuer leur efficacité de réplication. En outre, VACV a montré un profil de sécurité grand chez l'homme [10-12]. Enfin, en plus de son potentiel thérapeutique, VACV a également été utilisé comme une technique d'imagerie non invasive permettant aux cliniciens de suivre la prestation de gène thérapeutique dans le corps [10, 13].
Dans cette publication, nous avons examiné le potentiel thérapeutique d'un roman VACV exprimant le sodium de l'humain iodure symporteur (h
NIS), GLV-1 H153, contre les cancers gastriques in vitro et in vivo
, et testé son potentiel comme outil d'imagerie. Matériaux et méthodes
lignées cellulaires
cellules AGS de cancer gastrique humain (lignée cellulaire d'adénocarcinome epithelial gastrique) ont été obtenues auprès de American type Culture Collection (ATCC, Manassas, VA) et ont été cultivées dans F-12 K de Ham moyenne. cellules humaines OCUM-2MD3 étaient un cadeau du Dr Masakazu Yashiro (Osaka City University Medical School, Japon) et ont été cultivées dans le milieu Eagle modifié par Dulbecco (DMEM). MKN-74 et TMK-1 cellules ont été fournies par le Dr T. Suzuki (Fukushima Medical College, Japon) et ont été cultivées dans Roswell Park Memorial Institute (RPMI). MKN-45 a été obtenu sous la forme d'un don du Dr Yutaka Yonemura (Université de Kanazawa, Japon) et a été maintenue dans RPMI. rein de singe vert africain fibroblaste (Cercopithecus aethiops
; CV-1) cellules utilisées pour les essais de plaque virales ont été achetées auprès de l'ATCC (Manassas, VA) et cultivées dans le milieu essentiel minimal (MEM). Tous les milieux ont été supplémentés avec 10% de FBS, 1% de pénicilline et de streptomycine à 1%.
Virus
GLV-1 H153 est un virus de la vaccine recombinant compétent pour la replication dérivée de la souche parentale, 1 GLV-H68, par l'intermédiaire d' la recombinaison homologue. Il comporte quatre cassettes insérées codant Renilla Aequorea de la protéine fluorescente verte luciférase (CUR-GFP), la protéine de fusion, un récepteur inverse inséré de la transferrine humaine (RTFR
), β-galactosidase, et symporteur d'iodure de sodium de l'humain (h
NIS) dans le F14.5
, J2R
(codant pour la thymidine kinase), et A56R
(encodage hémagglutinine) loci du virus genome.GLV-1 H153 a été fourni par Genelux Corporation (R & D installation à San Diego, CA, USA).
cytotoxicité test
4 × 10 4 cellules par puits de chaque lignée cellulaire ont été étalées dans des plaques à 12 puits et incubés dans un CO 5% 2 incubateur humidifié à 37 ° C pendant une nuit. GLV-1 H153 a été ajouté à chaque puits à différentes multiplicité d'infection (MOI) de 0,01, 0,1 et 1,0. cytotoxicité virale a été testée en utilisant une déshydrogénase de lactate (LDH) de dosage par jour. Les cellules ont été lavées une fois avec du PBS, puis lysées avec 1,35% de Triton X-100 (Sigma, St. Louis, MO). La intracellulaire lyse LDH communiqué suivant a ensuite été mesurée avec CytoTox 96® (Promega, Madison, WI) sur un spectrophotomètre (EL321e, Bio- Tek Instruments) à 490 nm. Les résultats sont exprimés en pourcentage de cellules survivantes qui ont été calculées comme la libération de la LDH des échantillons infectés par rapport au témoin non infecté. Toutes les conditions ont été testées en triple.
Viral test de réplication
surnageants de chaque infectée et on a recueilli tous les jours et immédiatement congelé à -80 ° C. Des dilutions en série de tous les échantillons de surnageant ont été faites pour effectuer des essais de plaque virale standard sur confluentes cellules CV-1. Tous les échantillons ont été mesurés en triple.
In vivo
thérapie murin flanc de la tumeur
Toutes les expériences animales ont été réalisées dans les protocoles approuvés et conformément aux directives éthiques du Comité soin et l'utilisation institutionnelle des animaux (IACUC) au Memorial Sloan Cancer Center -Kettering (MSKCC). MKN-74 xénogreffes ont été établies en 6 à 8 semaines d'âge souris nu féminin (NCI: Hsd: athymiques Nu-nu, Harlan) par voie sous-cutanée injectant 5 x 10 6 MKN-74 cellules dans le flanc droit. La croissance tumorale a été enregistré deux fois par semaine à l'aide d'un calibre et une tumeur volume numérique a été calculé en utilisant l'équation, un
× b
2 × 0,5, dans lequel un
et b
sont le plus grand et les plus petits diamètres, respectivement. Lorsque les tumeurs ont atteint un diamètre d'environ 6-8 mm en 10 jours, les animaux ont été regroupés en groupes témoins et traités avec les tailles des tumeurs équitables. Une dose unique de 2 x 10 6 unités de formation de plaques (UFP) de GLV-1 H153 dans 100 ul de PBS ou 100 ul de PBS comme témoin ont été injectés par voie intratumorale à chaque tumeur désigné. Les animaux ont été observés quotidiennement pour déceler tout signe de toxicité, et sacrifiés lorsque leurs tumeurs ont atteint un diamètre d'environ 15 mm.
Imagerie fluorescente (Maestro)
In vivo
images GFP ont été obtenues à l'aide du système CRi Maestro (Cambridge recherche et Instrumentation, Woburn, MA) en utilisant les filtres appropriés (excitation = 445-490 nm, émission = 515 nm filtre passe-temps, les paramètres d'acquisition = 500-720 en 10 nm). Après chaque image a été obtenue, il a été spectralement sans mélange pour éliminer la fluorescence de fond. Les images ont été quantifiés en utilisant région d'intérêt (ROI) des logiciels d'analyse qui est fourni avec le système Maestro.
In vivo
émission de photon unique calculé SPECT imagerie par tomographie
Cinq MKN-74 xénogreffes ont été intratumorale injectés avec 2 x 10 7 PFU GLV-1 H153 et 5 avec du PBS comme témoins. Deux jours après l'infection, 200 uCi de 99mTc pertechnétate a été administré par injection dans la veine caudale. 99mTc pertechnétate images ont été obtenues en 10 minutes, 3 heures après l'administration de radiotraceurs. L'imagerie a été effectuée en utilisant le sous-système de caméra gamma à double détecteur du X-SPECT petits animaux système SPECT-CT (Gamma Medica, Northridge, CA). Le système γ-caméra X SPECT a été calibré en imageant une taille de souris (30 ml) du cylindre rempli d'une concentration mesurée (MBq /ml) 99m en utilisant une fenêtre d'énergie de pic photoélectrique de 126-154 keV et faible consommation d'énergie haute résolution collimation. Les résultants Images 99mTc ont été exportés vers Interfile puis importés dans les ASIPro (Solutions Siemens pré-cliniques, Knoxville, TN) environnement logiciel de traitement d'image. Par analyse de la ROI, un facteur d'étalonnage de système (en cpm /pixel par MBq /ml) a été dérivé. images des animaux ont également été exportés vers Interfile puis importées dans ASIPro et paramétrés en fonction de la dose de pourcentage injecté désintégration corrigé par gramme (% ID /g) sur la base du facteur d'étalonnage de ce qui précède, l'activité administrée, le temps après l'administration de l'imagerie, et la durée de l'image.
In vivo
PET d'imagerie
Trois MKN-74 xénogreffes ont été injectés par voie intratumorale avec 2 x 10 7 PFU GLV-1 H153 et deux avec PBS. Deux jours après l'injection virale, 300 uCi de 124I a été administré par injection dans la veine caudale. Une heure après l'administration du traceur isotopique, les données en mode liste trois dimensions ont été acquises à l'aide d'une fenêtre d'énergie de 700 keV, afin de 350, et une fenêtre de cadencement de coïncidence de 6 nanosecondes. L'imagerie a été réalisée en utilisant une mise au point 120 microTEP dédié petit animal PET scanner (Concorde Microsystems Inc, Knoxville, TN). Ces données ont été triées en histogrammes 2 dimensions par réarrangement de Fourier. Les taux de comptage dans les images reconstruites ont été converties en concentration d'activité (% ID /g) en utilisant un facteur d'étalonnage de système (MBq /mL par cps /voxel) dérivé d'image d'un fantôme de la taille de la souris remplie d'une solution aqueuse uniforme 18F. L'analyse des images a été réalisée en utilisant ASIPro différences significatives d'analyse
statistique entre les groupes ont été déterminées à l'aide t
test de Student (Excel 2007, Microsoft, Redmond, WA, USA).. Une valeur de p < Résultats de 0,05 a été considérée comme significative.
test de cytotoxicité
Tous les cinq lignées de cellules du cancer gastriques humaines étaient sensibles à Oncolyse par GLV-1 H153 (Figure 1). Le MKN-74, OCUM-2MD3, et des lignées de cellules AGS sont plus sensibles à la lyse virale par rapport à MKN-45 et TMK-1 cellules. Toutes les lignées cellulaires ont montré une réponse dépendante de la dose, avec une plus grande et plus rapide la destruction des cellules à des MOI élevées. Dans MKN-74, OCUM-2MD3, et des lignées de cellules AGS, plus de 90% des cellules ont été tuées par jour 9 à un MOI de 1. La lignée de cellules MKN-74 est particulièrement sensible à l'oncolyse virale, avec plus de 77% cellules tuées par jour 9 au MOI le plus bas de 0,01. La figure 1 Cytotoxicité de GLV-1 H153 contre les 5 lignées cellulaires de cancer gastrique humain in vitro. Toutes les lignées cellulaires ont subi une cytotoxicité significative à une MOI de 1, trois lignées cellulaires ont été sensibles à une MOI de 0,1, et deux lignées cellulaires ont démontré une sensibilité exquise GLV-1 H153, même à la plus faible MOI de 0,01. Le plus réplication virale
standard dosages de plaques virales ont démontré l'efficacité de la réplication virale GLV-1 H153 dans toutes les lignées gastriques de cellules cancéreuses à une MOI de 1 (figure 2). MKN-74 a démontré le titre viral le plus élevé avec un pic de titrage de 1,06 × 10 6 PFU par puits, une augmentation de 26 fois de la dose initiale, par jour 7. Figure 2 In vitro la quantification de la réplication virale par GLV-1 H153 dans des lignées cellulaires de cancer gastrique humain. Le virus a été recueilli à partir des puits de cellules infectées à une MOI de 1. Les dosages de plaques virales ont démontré une replication virale efficace dans les 5 lignées cellulaires, pour atteindre la prolifération virale plus élevée (1,06 x 106 virales unités formant des plaques par jour 7) dans la lignée cellulaire , MKN-74, ce qui représente une augmentation de 26 fois de sa dose initiale.
In vivo
murin xénogreffes thérapie avec GLV-1 H153
Pour établir les effets cytolytiques de GLV-1 H153 in vivo
, des souris porteuses de xénogreffes MKN-74 ont été traitées avec une seule dose d'une injection intra-tumorale de GLV-1 H153 ou de PBS. Les tumeurs traitées ont montré une régression tumorale soutenue /continue sur une période de quatre semaines. Par jour 28, le volume tumoral moyen du groupe de traitement était de 221,6 mm 3 (figure 3). Un animal a montré une régression complète de la tumeur. En revanche, toutes les tumeurs de contrôle a continué de croître avec un volume moyen de 1073.2 mm 3 par jour 28 (t
-test, comparant le traitement et le groupe témoin au jour 28, p < 0,001). Il n'y avait pas de changement significatif du poids corporel dans les deux groupes et aucune morbidité ou de la mortalité liée à GLV-1 H153 traitement n'a été observée. Figure 3 GLV-1 H153 supprime la croissance tumorale MKN-74. 2 x 106 particules virales de GLV-1 H153 ou PBS ont été injectés par voie intratumorale à des souris nues portant des tumeurs sous-cutanées de flanc MKN-74. L'inhibition de la croissance tumorale due à un traitement avec H153 GLV-1 a commencé le jour 15 (p < 0,001). Les volumes des tumeurs indiqués représentent la moyenne des volumes de 5 souris dans chaque groupe de traitement.
in vitro et in vivo l'expression de GFP
expression de la GFP a été contrôlée par microscopie à fluorescence à 1, 3, 5, 7 et 9 jours après l'infection virale à une MOI de 1,0. La plupart des cellules MKN-74 ont été infectés et exprimé GFP par jour 7 (figure 4A). In vivo,
signal GFP peut être détecté qu'à la xénogreffe injecté GLV-1 H153 (figure 4B). La figure 4 la protéine fluorescente verte (GFP) l'expression de MKN-74 in vitro et in vivo. A. MKN-74 cellules ont été infectées par GLV-1 H153 et ont montré une forte fluorescence verte par jour 7, ce qui démontre une infection efficace (grossissement 100 x). B. MKN-74 tumeurs de flanc ont été traités avec 2 x 106 particules virales de GLV-1 H153. fluorescence verte de la tumeur avec le scanner Maestro indique une infection réussie et la localisation spécifique de la tumeur de GLV-1 H153.
Fonctionnement h
expression NIS imagé par 99mTc-pertechnétate scintigraphie et 124I PET
Tous MKN-74 xénogreffes injectés avec GLV-1 H153 ont montré une accumulation localisée de 99mTc radioactivité dans les tumeurs du flanc alors qu'aucun cumul de radioactivité dans les tumeurs témoins (figure 5A). GLV-1 H153 infectées MKN-74 tumeurs ont également facilité 124I radioiodine absorption et autorisés pour l'imagerie par TEP (figure 5B), tandis que les tumeurs du PBS-injectés n'a pas pu être visualisées. Figure 5 L'imagerie nucléaire de GLV-1 H153-infectées MKN-74 xénogreffes. balayage pertechnétate A. 99mTc a été effectuée 48 heures après l'infection et 3 heures après l'administration de radiotraceurs. Tumeurs traitées avec GLV-1 H153 virus sont clairement visualisées (flèche). L'estomac et de la thyroïde sont dus à une expression native de NIS, et la vessie est vu de l'excrétion du radiotraceur. Rapport de B. Axial, coronale et sagittale d'un 124I image TEP 48 heures après GLV-1 H153 injection représente le signal amélioré dans GLV-1 H153-infectés MKN-74 tumeurs (flèche).
cancer gastrique est le quatrième cancer le plus fréquent et la deuxième cause la plus fréquente de décès liés au cancer dans le monde entier [1, 14]. Récurrence ou métastases à distance est l'une des complications les plus fréquentes et souvent la cause de la mort [15]. Alors que la chimiothérapie est une thérapie adjuvante utile par rapport à un traitement chirurgical seul, son potentiel thérapeutique est limitée [16]. La plupart des cancers gastriques sont résistants à l'heure actuelle disponibles régimes de chimiothérapie. Par conséquent, de nouveaux agents thérapeutiques sont nécessaires pour améliorer les résultats pour les patients atteints de cancer gastrique qui ne répondent pas aux thérapies conventionnelles. le traitement du virus oncolytique est une approche prometteuse pour le traitement du cancer qui dépend de la capacité du virus à infecter, se répliquent à l'intérieur et lyser une cellule hôte [17, 18]. Dans cette étude, nous avons décrit les effets cytotoxiques de GLV-1 H153, un VACV recombiné portant le gène h
NIS, sur des cellules de cancer gastrique in vitro
. Nous avons en outre démontré que GLV-1 H153 infectés xénogreffes de cancer gastrique exprimé fonctionnant h
protéine NIS qui a permis pour l'imagerie non-invasive de la tumeur et également une régression tumorale in vivo efficace.
Une variété de virus ont les propriétés oncolytiques représentés, y compris l'adénovirus, le virus de l'herpès simplex, le virus de la maladie de Newcastle, le virus de la stomatite vésiculaire, réovirus et [17]. Parmi les divers agents viraux oncolytiques, le virus de la vaccine présente plusieurs avantages. VACV se réplique exclusivement dans le cytoplasme sans utiliser le mécanisme de synthèse de l'ADN de l'hôte, réduisant ainsi le risque d'intégration du génome viral dans le génome de l'hôte [10]. Une grande quantité d'ADN étranger (jusqu'à 25 kb) peuvent être incorporés sans réduire de manière significative l'efficacité de la réplication virale [19]. En outre, la vaccine a été prouvé qu'ils ont un bon profil de sécurité tel qu'il a été historiquement donné à des millions au cours de la vaccination contre la variole. Il démontre également la réplication efficace et une large gamme de tropismes de la cellule hôte [10]. Plusieurs études précliniques ont montré que l'injection systémique de VACV recombinant dans des xénogreffes abouti à des titres viraux élevés dans toutes les tumeurs, ce qui indique une colonisation spécifique de la tumeur [11, 20, 21]. Il y a un petit problème que les patients qui ont reçu une vaccination contre la variole dans le passé ont un anticorps neutralisant contre le virus. Cela pourrait entraîner des compromis l'efficacité du traitement. Cependant, dans le sang, le complément joue un rôle plus important dans inactivant VACV que des anticorps neutralisants. Nous prévoyons donc que la présence d'anticorps neutralisants chez les patients ne doit pas entraver le traitement VACV; Cependant, une dose de traitement plus élevée peut être nécessaire. VACVs
par génie génétique ont montré une efficacité dans le traitement d'une large gamme de cancers humains [12]. GLV-1 H168 a déjà révélé être un vecteur diagnostique et thérapeutique efficace dans plusieurs modèles de tumeurs humaines, y compris les tumeurs du sein, le mésothéliome, le cancer du pancréas, et un carcinome à cellules squameuses [11] h
protéine NIS, qui est une membrane intrinsèque glycoprotéine avec 13 domaines transmembranaires putatifs, transporte activement à la fois Na + et I - ions à travers la membrane cellulaire [22]. Fonctionnement h
protéine NIS peut l'absorption de plusieurs radio-nucléotides disponibles dans le commerce, y compris 123I, 124I, 125I, 131I, 99mTc et 188Re [22, 23 ]. Dans cette étude, GLV-1 expression de h
protéine NIS infectés MKN-74 xénogreffes H153-médiation a entraîné une localisée 99mTc et 124I radiotracer absorption. Nos résultats suggèrent que l'expression h
du gène NIS par vecteur viral peut être utilisé comme une modalité d'imagerie non-invasive pour surveiller la progression et le traitement des effets de la tumeur.
Une injection intratumorale unique de GLV-1 H153 dans MKN-74 xénogreffes exposé GFP intratumorale localisée et h
expression NIS. De plus, il n'y avait aucune preuve de la propagation du virus à d'autres organes basés sur la GFP imagerie, 99mTc scintigraphie, et 124I PET, indiquant une infection virale spécifique de la tumeur et l'activité. Nous avons également démontré que GLV-1 H153 est efficace et sûr pour le traitement des tumeurs gastriques chez un modèle de xénogreffe murin. Le 1-H153 GLV groupe traité a été suivie en continu jusqu'au jour 35 et il n'y avait pas de recroissance de la tumeur (données non montrées entre les jours 28 et 35). Le groupe de contrôle a dû être sacrifié conformément à notre protocole animal approuvé le jour 28. Exprimant le h
gène NIS dans un tissu autrement non HNIs exprimant est passionnant. Il pourrait faire usage de la scintigraphie bien établie et la thérapie dans les autres non-thyroïdienne origine des cancers. Plusieurs études ont montré des résultats prometteurs dans une variété de tumeurs en utilisant un traitement à l'iode radioactif par l'intermédiaire d'une expression spécifique de tumeur du h
gène NIS, y compris carcinome thyroïdien médullaire [24], le cancer de la prostate [25], le cancer du côlon [26] et à la poitrine cancer [27]. expression h
NIS spécifique de la tumeur en utilisant GLV-1 H153 peut maximiser l'accumulation de radioiodine localisée et de minimiser l'absorption non spécifique dans d'autres organes. Sur la base de nos résultats prometteurs, il serait d'une importance clinique significative pour évaluer l'effet de la thérapie de combinaison de GLV-1 H153 et radioiodine.
Conclusion
Cette étude démontre une nouvelle VACV oncolytique modifié pour exprimer l'h
NIS peut infecter efficacement, se répliquent à l'intérieur et provoquer une régression du cancer gastrique dans un modèle de xénogreffe murin. expression de la GFP peut servir comme un substitut de l'infectivité virale. In vivo
, GLV-1 H153 cellules infectées peuvent être facilement visualisés avec scintigraphie 99mTc et imagerie 124I PET. Ces données fournissent un soutien supplémentaire pour les recherches futures de GLV-1 H153 comme agent de traitement et un outil d'imagerie non-invasive dans les paramètres cliniques
abréviations
VACV:.
Virus de la vaccine
HNIs:
sodium humain iodure symporteur
ATCC:
American type Culture Collection
RUC-GFP:
protéine fluorescente verte de luciférase-Aequorea de Renilla
LDH:
lactate déshydrogénase ()
IACUC:
Le Comité soin et l'utilisation des animaux institutionnels
MSKCC:
Memorial Sloan-Kettering Cancer Center
PFU:
unités de formation de plaques
MOI:
Multiplicité d'infection
PET:
tomographie par émission de positons
ROI:
Région d'intérêt
RTFR:
inverse du récepteur de la transferrine humaine inséré
SPECT:.
photon unique tomographie d'émission
Remerciements
services techniques de déclarations fournies par le Fonds pour l'MSKCC Petit-animal Imaging Core, soutenu en partie par les NIH Petit Programme de recherche sur l'imagerie -Animal (de SAIRP) Grant No R24 CA83084 et NIH Centre Grant Non P30 CA08748, sont appréciés.
auteurs fichiers originaux soumis pour les images
Voici les liens vers les auteurs originaux soumis fichiers pour les images . de fichier d'origine pour la figure 1 13046_2013_740_MOESM2_ESM.tiff Auteurs Auteurs 13046_2013_740_MOESM1_ESM.tiff fichier d'origine pour de fichier d'origine pour la figure 3 13046_2013_740_MOESM4_ESM.tiff Auteurs 'Figure 2 13046_2013_740_MOESM3_ESM.tiff Auteurs fichier d'origine pour la figure 4 fichier original 13046_2013_740_MOESM5_ESM.tiff Auteurs »pour la figure 5 intérêts concurrents Aucun
intérêts financiers concurrents existent pour Kyong-Hwa Jun, Tae-Jin Song, Sepideh Gholami, Joyce Au, Dana Haddad, Carson Joshua, Chun-Hao Chen, Kelly Mojica, Pat Zanzonico et Yuman Fong. Nanhai G. Chen, Qian Zhang, et Aladar A. Szalay sont affiliés à Genelux Corporation.
Contributions des auteurs
SG ont aidé à l'écriture en place du manuscrit. TS assistés dans les vivo
expériences et ont contribué à la conception de l'étude. JA a contribué à l'essai de cytotoxicité. DH a contribué à la vivo
PET et SPECT imagerie. JC a contribué à l'imagerie de fluorescence. CC a contribué à l'analyse statistique des données. KM a contribué à l'essai de la réplication virale. PZ a contribué à la conception de l'étude et des expériences d'imagerie radioactifs. NC et QZ ont contribué à la séquence virale et construction. AS et YF ont contribué à la conception de l'étude et l'achèvement du manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final.
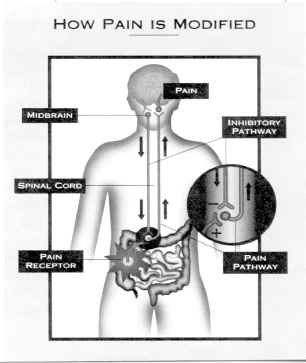 Syndrome de douleur abdominale à médiation centrale
Les personnes atteintes de troubles gastro-intestinaux (GI) fonctionnels peuvent présenter une variété de symptômes allant de la diarrhée ou de la constipation indolores à la douleur associée à la dia
Syndrome de douleur abdominale à médiation centrale
Les personnes atteintes de troubles gastro-intestinaux (GI) fonctionnels peuvent présenter une variété de symptômes allant de la diarrhée ou de la constipation indolores à la douleur associée à la dia
 La présence de sang rouge vif dans les selles est-elle grave ?
Les causes courantes de sang clair dans les selles qui ne sont pas graves comprennent les hémorroïdes, les fissures anales et les abcès. Le sang rouge vif dans les selles peut être grave lorsquil est
La présence de sang rouge vif dans les selles est-elle grave ?
Les causes courantes de sang clair dans les selles qui ne sont pas graves comprennent les hémorroïdes, les fissures anales et les abcès. Le sang rouge vif dans les selles peut être grave lorsquil est
 Que se passe-t-il si vous ne traitez pas une hémorroïde ?
Si vous avez des hémorroïdes légères, les laisser tranquilles peut être très bien. Lenflure et linconfort disparaissent généralement en quelques jours. Parfois, cependant, il peut y avoir des complica
Que se passe-t-il si vous ne traitez pas une hémorroïde ?
Si vous avez des hémorroïdes légères, les laisser tranquilles peut être très bien. Lenflure et linconfort disparaissent généralement en quelques jours. Parfois, cependant, il peut y avoir des complica