Résumé
Contexte
La voie anti-inflammatoire cholinergique est un mécanisme endogène par lequel le système nerveux autonome atténue l'activation des macrophages via les récepteurs nicotiniques de l'acétylcholine (nAChR). Ce concept n'a toutefois pas été démontrée au niveau cellulaire dans le tissu intact. À cette fin, nous avons étudié l'effet de la nicotine sur l'activation des macrophages résidents dans une préparation de l'estomac de la souris au moyen de l'imagerie calcique.
Les transitoires de calcium de
Méthodes ([Ca 2 +] i) dans les macrophages résidents ont été enregistrées dans une préparation de l'estomac de souris contenant plexus myentérique et les couches musculaires par Fluo-4. L'activation des macrophages a été obtenue par l'administration feuilletée focale de l'ATP. Les effets de la nicotine sur l'activation des macrophages ont été évalués et le nAChR impliqués a été pharmacologiquement caractérisé. La proximité des nerfs cholinergiques aux macrophages a été quantifiée par microscopie confocale. Expression de β2 et α7 nAChR a été évaluée par β2 immunohistochimie et fluorophore marqués α-bungarotoxine Résultats Dans 83% des macrophages fibres nerveuses variqueuses cholinergique ont été détectés à des distances <. 900nm. L'ATP induite [Ca 2 +] i augmentation a été inhibée de manière significative dans 65% ou 55% des macrophages par 100 uM ou 10 uM de nicotine, respectivement. Cet effet inhibiteur a été renversée par le nAChR de β2 préférant antagoniste dihydro-β-eryhtroidine mais pas par hexaméthonium (nAChR antagoniste non sélectif), mécamylamine (antagoniste α3β4 nAChR préférant), α-bungarotoxine ou méthyllycaconitine (tant α7 antagoniste du nAChR préférant ). Macrophages dans l'estomac expriment β2 mais pas α7 nAChR au niveau de la protéine, tandis que ceux de l'intestin expriment les deux sous-unités du récepteur. Cette étude est la première Citation:. Némethová A, Michel K, Gomez-Pinilla PJ, Boeckxstaens GE, Schemann M (2013 ) la nicotine diminue l'activation des tissus résidents macrophages dans le ventre de la souris à travers le acétylcholine des récepteurs β2 nicotinique. PLoS ONE 8 (11): e79264. doi: 10.1371 /journal.pone.0079264 Editeur: Yvette Tache, Université de Californie, Los Angeles, États-Unis d'Amérique reçues: 10 Juin 2013; Accepté 26 Septembre 2013; Publié: 1 Novembre 2013 | Droit d'auteur: © 2013 Némethová et al. Ceci est un article en accès libre distribué sous les termes de la licence Creative Commons Attribution, qui permet une utilisation sans restriction, la distribution et la reproduction sur tout support, à condition que l'auteur et la source originelle sont crédités Financement:. Ce travail a été soutenue par une subvention du 7e programme-cadre de l'Union européenne (IPODD), par la Deutsche Forschungsgemeinschaft Sche267 /9-1 à MS; par une subvention de la Fondation de recherche en Flandre (FWO, Ulysse et programme Hercules) à GEB, et par une bourse de recherche postdoctorale FWO à PJG. Les bailleurs de fonds ont joué aucun rôle dans la conception de l'étude, la collecte et l'analyse des données, la décision de publier, ou de la préparation du manuscrit Intérêts concurrents:.. Les auteurs ont déclaré aucun conflit d'intérêts existent Introduction En 2000, Tracey et ses collègues ont démontré que la stimulation électrique du nerf pneumogastrique fournit une entrée anti-inflammatoire à la rate. Dans un modèle de souris de la septicémie, la stimulation du nerf vagal (VNS) a entraîné une diminution de la production de cytokine pro-inflammatoire, un effet dépendant de récepteurs nicotiniques de l'acétylcholine a7 (nAChR) [1,2]. Cette soi-disant «voie anti-inflammatoire cholinergique" (ACFI) fonctionne à travers les nerfs spléniques adrénergiques faisant contacts synaptiques-like avec des cellules T-ß2 adrénergiques exprimant le récepteur spléniques. Après la libération de l'acétylcholine (Ach) à partir de ces cellules T est responsable de l'effet anti-inflammatoire sans doute en interagissant avec les macrophages α7nAChR exprimant [1,2]. En 2005, nous avons fourni des preuves que l'ACFI a également modulent le système immunitaire intestinal. Dans un modèle murin de l'iléus post-opératoire, nous avons montré que VNS réduit l'inflammation intestinale induite par manipulation de l'intestin grêle, un effet bénéfique dépend de nAChR α7, mais indépendante de la rate [3,4]. Ces données suggèrent que le système immunitaire de l'intestin est plutôt modulée directement par les terminaisons nerveuses vagales et /ou des neurones entériques. Comme les macrophages intestinaux résidents sont les principaux acteurs de déclenchement de cette réponse inflammatoire [5], ces cellules représentent la cible la plus probable de l'ACFI. Des études in vitro utilisant des macrophages péritonéaux isolés, les macrophages dérivés de cellules mononucléées du sang périphérique ou des lignées cellulaires macrophagiques ont en effet abondamment montré que la nicotine acétylcholine et de réduire la production de cytokines [1-3,6,7] et augmenter la phagocytose [6]. Néanmoins, il reste discutable dans quelle mesure leur phénotype ressemble vraiment à celui des macrophages résidents touchés par les neurones entériques, d'autant plus que l'expression du récepteur dans les macrophages peut être haut ou bas réglementés comme ils ont été isolés de leur environnement naturel. Par conséquent, nous avons décidé de développer une technique qui nous permettrait d'étudier l'effet de la nicotine sur l'activation des macrophages résidents dans leur environnement naturel. Comme les macrophages activés par l'ATP, un signal de danger bien connu pour les cellules immunitaires [8,9], révèlent une augmentation de la concentration intracellulaire de Ca 2+, vivre Ca 2 + imagerie a été choisie pour étudier les macrophages résidents dans intact plat feuille préparatifs de l'estomac de la souris. Cela nous a permis de comparer l'ATP évoqué Ca 2 + transitoires ([Ca 2 +] i) dans les macrophages situés dans les couches musculaires lisses avant et après application de la nicotine. Nous avons également utilisé plusieurs antagonistes avec des préférences connues pour les sous-unités nAChR spécifiques afin de fournir de nouvelles informations mécanistes dans les rôles des récepteurs de la nicotine exprimant les macrophages pour l'ACFI dans l'intestin. Ces constatations pharmacologiques ont été confirmées par immunohistochimie. Enfin, nous avons analysé la proportion des macrophages résidents qui sont à proximité des fibres nerveuses cholinergiques. Déclaration Tous les travaux de la souris a été réalisée selon les directives allemandes éthique pour les soins et le bien-être (Deutsches Tierschutzgesetz) et approuvé par le comité d'éthique de l'Etat de Bavière (Regierung Oberbayern, qui sert le Comité soin et l'utilisation des institutions pour la Technische Universität München) animal selon §4 et §11 Deutsches Tierschutzgesetz sous le numéro de référence 32 -568-2. des échantillons de tissus Homme de 12-16 semaines C57BL /6 (Charles River, Sulzfeld, Allemagne) ont été tués par dislocation cervicale. L'estomac a été récolté dans un tampon Krebs glacée contenant (en mM) 117 NaCl, 4,7 KCl, 1,2 MgCl 2 6 H 2O, 1,2 NaH 2PO 4, 25 NaHCO 3, 2,5 CaCl 2 2 H 2 O et de 11 glucose et ajusté à pH 7,4. L'estomac a été ouverte le long de la grande courbure et lavé avec de la glace froide Krebs. Sous l'inspection microscopique, l'estomac a été coincé sur un plat de Sylgard et la muqueuse et la sous-muqueuse ont été soigneusement enlevé. Au cours de la dissection, les tissus ont été continuellement perfusées avec une solution de Krebs glacée pour assurer la viabilité du tissu. Seule la partie antérieure ou postérieure de la moitié de l'estomac a été épinglé sur un petit anneau de Sylgard avec une ouverture centrale de 100 x 200 mm 2. Appartement préparations estomac feuille de souris étaient incubés dans une solution de Krebs modifiée (117 NaCl, 4,7 KCl, 1,2 MgCl 2 6 H 2O, 1,2 NaH 2PO 4, 20 NaHCO 3, 2,5 CaCl 2 2 h 2 O et 11 glucose) contenant 30 pM de l'indicateur de calcium fluorescent Fluo 4-acétoxyméthyl (AM) (Invitrogen) et mM de probénécide 1,25 (Sigma-Aldrich, Schnelldorf, Allemagne) pendant 2 h à température ambiante dans l'obscurité et gazés avec carbogène (95% O 2 - 5% de CO 2). L'anneau de Sylgard a été monté dans la chambre d'enregistrement avec le côté séreuse de l'estomac en regard du fond de la chambre. La chambre est reliée au système de perfusion pour permettre une perfusion continue avec une solution de Krebs carbogène dégazé à la température ambiante. Une période de sevrage thérapeutique de 1,5 h, on a laissé avant le début de l'expérience. La chambre de tissu a été monté sur un microscope à épifluorescence inversé (Zeiss Axio Observer A1, Carl Zeiss, Jena, Allemagne) équipé d'une caméra haute vitesse monochrome (Zeiss AxioCam HSm) et logiciels (Zeiss Axio Vision 4.8) pour l'acquisition et l'analyse. Fluo-4 était excité à l'aide d'une lumière bleue à diode électroluminescente (LED) Luxeon III (3W, 470nm longueur d'onde dominante, Philips Lumiled, Phillips, Hambur, Allemagne) et Fluo-4 signaux ont été détectés avec un cube de filtre F26-514 lumineux Ligne FITC BP (excitation: HC475 /35, dichroïque: 499, émission: HC530 /43, AHF Analysentechnik, Tübingen, Allemagne) en utilisant l'objectif X20 (A-plan, NA = 0,25, Zeiss). Les modifications apportées au système de mesure par rapport à la fluorescence (Δ F /F) de Fluo-4 changements de surveillance du calcium intracellulaire ([Ca 2 +] i). Ca 2 + transitoires ont été enregistrées à partir de 3 s avant l'administration locale de l'ATP pour un total de 14,5 s avec un taux de 2 Hz et le temps d'exposition de 200 ms cadre. Nous avons utilisé de l'ATP en tant qu'outil pour l'activation des macrophages, car il est un signal de danger libéré localement au niveau du site d'inflammation [8,9], et étant donné que l'ATP est connu pour induire la sécrétion de cytokines par les macrophages par augmentation de [Ca 2 +] i [10-12]. ATP (Sigma-Aldrich) et de la nicotine (Sigma-Aldrich) ont été appliquées localement par éjection de pression à partir de deux micropipettes avec des durées de 200 ms et 10 sec, respectivement. La position des micropipettes en sorte que les volumes éjectés recouverts régions de tissus identiques. Les micropipettes ont été remplis avec 1 mM d'ATP et 100 uM ou 10 uM de nicotine dissoute dans une solution de Krebs contenant mM de probénécide 1,25. Selon les courbes d'étalonnage publiées précédemment, nous estimons que toute substance appliquée par des impulsions d'éjection de pression sera diluée d'environ 1h10 une fois qu'il atteint le tissu [13]. L'administration locale de l'ATP et de la nicotine a permis la mesure des réponses à régions multiples (typiquement 4-5) dans le même tissu. La position des régions dans le tissu a été documentée en utilisant le système de coordonnées affichées sur la platine du microscope mobile. L'effet de la nicotine sur l'ATP induite par les transitoires de calcium et on a étudié à nouveau dans les mêmes régions, après addition de divers antagonistes des nAChR. Après l'enregistrement des réponses, les macrophages ont été visualisées par incubation essentielle du tissu avec l'allophycocyanine (APC), l'anti-F4 /80 anticorps marqué au rat anti-souris (1: 250, eBioscience, Francfort, Allemagne) pendant 1 h à température ambiante en l'obscurité et gazés avec carbogène. Le tissu a été lavé pendant 15 minutes. La platine du microscope a été repositionné pour trouver les régions où nous avons enregistré à partir. Images de macrophages marqués ont été acquises à l'aide rouge Z-LED P4 (3,5 W) de source d'excitation (625 longueur d'onde dominante nm, Seoul Semiconductor) et le filtre cube F46-006 ET jeu de filtres (excitation: ET 620/60, dichroïque: 660, émission: ET700 /75, AHF Analysentechnik, Tübingen, Allemagne). La superposition de Fluo-4 signaux et images de F4 /80 macrophage positif nous a permis d'analyser les réponses dans les macrophages individuels. Pour les macrophages résidents de tissus d'étiquette, nous avons utilisé d'abord l'étiquetage vital protocole décrit ci-dessus. Le tissu a été ensuite fixé pendant une nuit à la température ambiante dans une solution contenant 4% de formaldehyde et de l'acide picrique 0,2% dans un tampon phosphate 0,1 M, lavée 3 x 10 minutes dans du tampon phosphate et finalement mis à incuber pendant 1 h dans une solution contenant 0,5% de Triton X- 100, 0,1% de NaN 3, 4% de sérum de cheval dissous dans du PBS (tous de Sigma-Aldrich). Pour étiqueter varicosités cholinergiques, le tissu a été mis à incuber pendant une nuit dans la solution de blocage contenant de chèvre anti-transporteur vésiculaire de l'acétylcholine (VAChT; 1: 1000, Merck-Millipore, Darmstadt, Allemagne). Les tissus ont été lavés 3 x 10 min dans du PBS et incubées pendant 1,5 à 2 heures dans la solution de blocage contenant un anticorps anti-chèvre marqué au Cy3 (1: 500; Dianova, Hambourg, Allemagne). Les tissus ont été lavés 3 x 10 minutes dans du PBS et montées dans anti-fade substance (20% PBS /NaN 3, 80% de glycérol) sur--lysine L poly diapositives et sous une lamelle pour la visualisation. pour étiqueter β2 nAChR dans les macrophages résidents des tissus, gastriques préparations de montage entières libres de muqueuses de type sauvage et ß2 nAChR knock-out [14] les souris ont été fixées pendant 10 min dans une solution de PBS glacé contenant 4% de paraformaldehyde (PFA) . Les tissus ont ensuite été lavées 2 x 10 min dans du PBS et incubées pendant 2 h dans du PBS contenant 1% d'albumine bovine Fraction V albumine libre de protéase (BSA; Serva, Heidelberg, Allemagne) et 10% de sérum d'âne normale (NDS, Jackson Immuno, Pennsylvanie, États-Unis). Les tissus ont été incubées pendant 36 h avec du PBS contenant 1% de BSA, 5% PDN, de rat anti-souris F4 /80 (1: 500, clone BM8, BioLegend, San Diego, USA) et de lapin anti-souris β2 nAChR (1: 200; Santa Cruz Biotechnology, Heidelberg, Allemagne). Les tissus ont été lavés 3 x 10 min dans du PBS et incubées pendant 1 h dans du PBS contenant 1% de BSA, 5% PDN, un anticorps anti-rat de chèvre Alexa Fluor 647 marqué (1: 1000; Jackson ImmunoResearch, Pennsylvanie, États-Unis) et âne marqué au Cy3 anticorps anti-lapin (1: 1000; Chemicon, Millipore, Billerica, États-Unis). Les tissus ont été lavés 3 x 10 minutes dans du PBS et montées dans le réactif lent fondu (Invitrogen, Life Technologies, Gent, Belgique) sur des lames poly-L-lysine et sous une lamelle pour le label viewing.To α7nAChR dans les macrophages résidents des tissus, une morceau de l'estomac de la souris et de l'iléon ont été soumis à l'étiquetage vital utilisant Cy5 marqué α-bungarotoxine (Invitrogen) à 0,1 pg /ml dans du milieu RPMI 1640 (Lonza, Bâle, Suisse) à 4 ° C pendant 15 min [4]. Les tissus ont ensuite été fixées dans du PBS contenant 4% de PFA. La muqueuse et la sous-muqueuse ont été enlevés et les tissus ont été incubées pendant 2 heures dans une solution de blocage contenant 1% de BSA. Les tissus ont ensuite été incubées pendant 60 heures dans une solution de blocage contenant des anticorps de rat anti-souris de F4 /80 (clone BM8, BioLegend), suivi par 3 x 10 min lavages dans du PBS et incubées pendant 1 h dans du PBS contenant 1% de BSA et marqué au Cy3 anticorps anti-rat (1: 1000; Jackson Immuno, Pennsylvanie, États-Unis). Enfin, les tissus ont été lavés 3 x 10 minutes dans du PBS et montées en substance lente fondu sur des lames poly-L-lysine et sous une lamelle pour le visionnement. Les images ont été acquises à l'aide d'un LSM 510 (Carl Zeiss) microscope confocal avec plan-Neofluar x40 /1,3 huile DIC et plan Apochromat X63 /1.4 objectifs huile DIC. les longueurs d'onde laser de 543 nm et 633 nm ont été utilisées pour l'excitation des fluorophores et Cy3 ou Cy5 APC, respectivement. signaux Cy3 et APC ou Cy5 ont été détectés en utilisant le filtre fixe BP 565-615 IR et BP 650-710 IR, respectivement. piles d'images pour l'analyse quantitative en utilisant l'objectif x63 ont été numérisés avec une résolution XY de 1024 × 1024 qui couvrait une superficie de 95,5 × 95,5 um 2. Les premières et dernières tranches optiques ont été prélevés en haut et en bas de la surface extérieure d'un macrophage. La profondeur optique de chaque tranche était de 900 nm. Deux tranches consécutives se chevauchent pour 500 nm. Habituellement, entre 9 et 16 tranches ont été générées résultant en une profondeur de balayage de 3.2-6.0 um contenant entre 1-3 macrophages et VAChT fibres positives passage macrophages. piles d'images ont été analysées à l'aide Image J Pro. Images de ß2 et a7 macrophages nAChR marqué ont été prises avec l'objectif x63 et scannées avec une résolution XY de 1024 × 1024 qui couvrait une superficie de 95,5 × 95,5 um 2. La profondeur optique des images était de 900 nm. Pour bloquer l'action propagation potentielle dans les neurones, la tétrodotoxine (Biotrend, Köln, Allemagne) a été ajouté à la solution de Krebs perfuser à 1 uM. Pour la caractérisation pharmacologique, les bloqueurs nicotiniques suivants ont été ajoutés à la solution de Krebs perfuser le tissu: 200 uM hexaméthonium (Sigma-Aldrich), 100 pM de mécamylamine (Sigma-Aldrich), 10 uM dihydro-β-erythroidine (DHBE; Sigma-Aldrich) , 100 nM, 3 uM et 10 uM α-bungarotoxine (ABGT; Tocris) et 10 nM et 100 nM méthyllycaconitine (MLA, Tocris). Hexaméthonium, mécamylamine et DHBE ont été testées dans les concentrations qui ont pu abolir potentiels postsynaptiques excitateurs rapides nicotiniques en Guinée porc neurones myentériques [15] .Utilisation de 10 nM et 100 nM MLA est basée sur la concentration respectivement utilisé pour bloquer la sous-unité α7 contenant nAChR [16] et utilisés pour inhiber la sécrétion d'IL-6 par les macrophages péritonéaux isolés [3]. L'analyse des données et des statistiques Les changements relatifs maximales en fluorescence (Δ F /F) en réponse à l'administration de l'ATP a été exprimée en% d'augmentation au-dessus de la fluorescence basale avant administration ATP. Les analyses statistiques ont été réalisées avec Sigma Plot 9.0 (Systat Software Inc, Erkrath, Allemagne). Les données sont présentées sous forme de tracés de moustaches avec la médiane et le 25 e et 75 e percentiles, ainsi que le 10 e et 90 e percentiles. Non données appariées normalement distribuées ont été analysées par le Wilcoxon rank test. Les différences ont été considérées comme statistiquement significatives à P Résultats relation spatiale entre les macrophages résidents des tissus et des varicosités cholinergiques dans l'estomac de la souris Nous avons utilisé la microscopie confocale pour évaluer la proximité entre les macrophages /80-positifs F4 et fibres VAChT-positives nerveuses cholinergiques variqueuses dans l'estomac de la souris (figure 1A). Une analyse détaillée a révélé que 83% des 41 macrophages étudiés sont situés dans 900 nm à au moins une varice fibre nerveuse cholinergique (figure 1B-C). Reproductibilité de l'ATP évoqué [Ca 2 +] i signaux dans Microejection de l'ATP induit une forte apparition rapide [Ca 2 +] effet de la nicotine sur [Ca 2 +] i signaux dans les macrophages résidents de tissus Pour étudier l'effet de la nicotine sur l'ATP évoqué [Ca 2+] i on microejected signaux de nicotine pendant 10 secondes et immédiatement l'ATP réappliqués sur la même région. Un rationnel d'utiliser la nicotine comme sélective, non dégradé agoniste nAChR était d'imiter l'activation du récepteur nicotinique par libération d'acétylcholine des neurones cholinergiques. L'analyse des variations de [Ca 2 +] i dans tous les macrophages a révélé que la nicotine réduit significativement l'ATP évoqué [Ca 2 +] i signaux (Figure 2D et F). Une analyse plus détaillée des effets de la nicotine sur l'ATP induite par [Ca 2 +] i transitoires a révélé trois populations de macrophages (figure 2D-G). La nicotine à 10 et 100 uM atténué l'ATP évoqué [Ca 2 +] i signaux dans 55% et 65% des macrophages, respectivement. La [Ca 2 +] i signal resté inchangé dans 36% et 28% des macrophages après l'application de 10 uM et 100 uM de nicotine, respectivement. Dans un petit sous-ensemble, 10 uM et 100 uM de nicotine potentialise l'ATP évoqué [Ca 2 +] i réponse (9% et 7% des macrophages, respectivement). Pour éviter tout biais d'autres analyses sont basées sur les effets de la nicotine sur tous les macrophages indépendants de savoir si l'ATP induite [Ca 2 +] i signal a été diminué, augmenté ou inchangé. Rôle des neurones dans le nicotinique évoqué atténuation de l'activation des macrophages la nicotine active directement les neurones entériques et nous avons abordé la possibilité que l'activation de près par les neurones myentériques a contribué à la atténuée [Ca 2 +] i réponses dans les macrophages. Nous ne avons trouvé aucune preuve d'une telle voie inhibitrice indirecte parce que l'atténuation de l'ATP évoqué [Ca 2 +] i signal par la nicotine resté en présence de tétrodotoxine (figure 2C). Il est à noter cependant que la proportion de ces macrophages où la nicotine n'a pas modifié l'ATP évoqué [Ca 2 +] i signaux ont été considérablement réduits (28% contre 6%). Dans le même temps, les macrophages, dans lequel la nicotine ou inhibée potentialisé l'ATP évoqué [Ca 2 +] i signaux est passé de 65% à 71% et de 7% à 23%, respectivement. l'activation des macrophages par l'ATP et l'inhibition de la réponse par l'ATP 100 pM de nicotine ont été enregistrés de manière fiable dans chacune des 21 préparations illustrées sur la figure 2F. Cela nous a permis d'effectuer des études antagonistes, sans la nécessité de réétudier la réponse inhibitrice dans les macrophages traités avec des antagonistes. De plus, nous avons ainsi réduit le nombre de périodes d'enregistrement à un niveau qui ne compromet pas la force du signal et les réponses ATP reproductibles garantis. Afin d'étudier les nAChR sous-unités impliquées dans l'effet inhibiteur de la nicotine, nous avons testé cinq bloquants différents avec les préférences de sous-unités connues [17] (figure 3). L'effet inhibiteur de la nicotine sur l'ATP évoqués [Ca 2 +] i réponses était inchangé en présence du ganglionnaire non sélectif nAChR antagoniste hexaméthonium, les α3β4 nAChR préférant mécamylamine antagoniste ou a7 antagonistes des nAChR préférant α-bungarotoxine et méthyllycaconitine (figure 3A). Cependant, la β2 nAChR préférant antagoniste di-hydro-β-eryhtroidine inversé l'effet inhibiteur de la nicotine sur l'ATP évoqué [Ca 2 +] i réponses dans les macrophages (figure 3B). Bien que nous avons utilisé ABGT à des concentrations qui ont été décrites pour bloquer de manière fiable α7 nAChR dans les neurones et les macrophages alvéolaires isolés [18], nous étions inquiets qu'il pourrait être incapable d'antagoniser l'effet inhibiteur de la nicotine en raison de la concurrence défavorable au niveau du site de liaison. Cependant, cela semble peu probable parce que même à des concentrations de 3 uM et 10 uM ABGT n'a pas été en mesure d'inverser l'effet inhibiteur de la nicotine sur l'ATP évoqué [Ca 2 +] i réponses (figure 3A). ABGT aussi ne pas inverser l'atténuation provoquée par 10 uM de nicotine (figure 3C). Étiquetage des β2 mais pas a7 nAChR dans Pour fournir des preuves supplémentaires pour la participation de β2 nAChR mais pas de α7 nAChR de macrophages résidents de tissus dans l'effet inhibiteur de la nicotine sur l'ATP évoqué [Ca 2 +] i réponses, marquage immunohistochimique des ß2 nAChR et l'étiquetage vital de α7 nAChR par ABGT dans les macrophages de la musculeuse de l'estomac résidents ont été effectuées (Figure 4). La majorité des macrophages de la musculeuse de l'estomac résidents ont été ß2 nAChR-immunoréactive (figure 4A) supportant l'effet antagoniste observée de DHBE sur l'inhibition des réponses nicotinique de l'ATP. L'anticorps utilisé pour ß2 nAChR est spécifique en raison de l'absence de ß2 nAChR immunoréactivité dans un β2 nAChR souris knock-out (figure 4B). étiquetage Vital de α7 nAChR par ABGT a révélé l'absence de α7 nAChR dans les macrophages résidents de tissu l'estomac de la souris (figure 4C), en revanche, les macrophages intestinaux ont été marquées par ABGT (figure 4D). Le manque de α7 nAChR dans les macrophages résidents de l'estomac a confirmé l'absence d'antagonisme de a7 bloquants nAChR préférant ABGT et MLA sur l'effet inhibiteur de la nicotine sur l'ATP évoqué [Ca 2 +] i réponses dans ces cellules. Discussion à ce jour, l'effet de la nicotine a été étudié seulement dans les macrophages isolés ou des lignées de cellules macrophages. Ici, nous avons développé un in vitro modèle de l'estomac de la souris muscle-myentérique préparation du plexus pour étudier l'effet de la nicotine sur les macrophages résidents des tissus au sein de leur environnement naturel. La présente étude est donc la première à montrer que la nicotine inhibe directement l'activation des macrophages résidents de tissu à travers la sous-unité β2 contenant nAChR et fournit ainsi la base pour la signalisation fonctionnelle entre les neurones cholinergiques et les macrophages dans l'intestin. Notre conclusion est étayée par plusieurs lignes de preuves. Tout d'abord, l'ATP évoqué [Ca 2 +] i transitoires dans les macrophages est significativement réduite par la nicotine, même en présence de la tétrodotoxine nerf bloqueur. Deuxièmement, l'atténuation induite par la nicotine des réponses ATP dans les macrophages a été infirmée par DHBE, mais pas par hexaméthonium, mécamylamine, ABGT ou MLA. Les résultats pharmacologiques ont été soutenus par la démonstration de nAChR sous-unités ß2-positiv mais ABGT négatives sur les macrophages gastriques. En troisième lieu, la majorité des macrophages sont à proximité directe des fibres nerveuses cholinergiques variqueuses. Semblable proximité des macrophages à des fibres nerveuses a été observée chez les rats musculeuse intestinaux [3]. Notre critère utilisé pour définir la proximité entre les macrophages et les fibres nerveuses cholinergiques (900 nm à distance) est d'accord avec le concept de communication extrasynaptique . Selon cette conception d'une transmission sur la base du volume de diffusion peut se produire à 100 nm à des distances um entre la source et la cible [19]. Nous supposons que la plupart, sinon tous, les nerfs cholinergiques situés à proximité de macrophages provenaient de corps cellulaires neuronaux myentériques basés sur notre précédente observation que les fibres vagales ne contactent pas les macrophages résidents intestinaux [3], ce sont également pris en charge par les conclusions que gastrique vagal efférences presque exclusivement se terminent dans les ganglions gastro [20], où ils activent la majorité des neurones myentériques à travers les récepteurs nicotiniques [15]. Le ACFI représente un système physiologique pour contrôler l'activation des macrophages dans des conditions inflammatoires. L'effet anti-inflammatoire de l'activation ACFI a été montré in vivo Néanmoins, on opte pour une interprétation plutôt conservatrice de nos données et de conclure que β2 nAChR sont gravement impliqués dans l'inhibition de la nicotine de l'activité macrophage mais il est probable que, à la concentration utilisée dans notre étude DHBE de préférence des blocs a4ß2 nAChR. Notre préparation est idéalement adapté pour répondre dans les études futures de la contribution possible de α7β2 nAChR en étudiant l'effet de la nicotine dans les macrophages résidents des tissus de α7 nAChR, ß2 nAChR et α7β2 doubles souris knock-out nAChR. Des stratégies similaires devraient être utilisés pour étudier la signification d'un α4β2 nAChR. Il est important de noter que l'action antagoniste de DHBE est pas sélective pour les macrophages comme DHBE, comme hexaméthonium et mécamylamine, bloque également synapses nicotiniques dans l'estomac myentériques neurones [15]. Néanmoins, les récepteurs nicotiniques sur les macrophages doivent posséder des propriétés différentes de celles dans les neurones entériques étant donné que ni hexaméthonium ni mécamylamine inversés l'atténuation induite par la nicotine des réponses ATP évoquées dans les macrophages. Hexaméthonium et mécamylamine exercent leurs actions en obstruant les pores du canal nicotinique [23-25]. Leur incapacité à inverser l'inhibition de la nicotine des macrophages peut suggérer l'existence d'un nAChR atypique dans les macrophages. En effet, l'enregistrement de Ca 2 + transitoires en réponse à l'administration de nicotine a révélé une augmentation de [Ca 2 +] i dans seulement 13% des macrophages (6 sur 45 macrophages, données non présentées). Cette population est beaucoup plus faible que la proportion de macrophages dans laquelle la nicotine modulée ATP évoqué [Ca 2 +] i. Des preuves abondantes suggèrent que α7 nAChR joue un rôle crucial dans la réduction induite par la nicotine dans la production de cytokines macrophage [2,3,6,26]. Auparavant, nous avons en effet démontré que la nicotine n'a pas réussi à réduire la production de TNF-α dans les macrophages péritonéaux de souris α7 nAChR knock-out [6], alors que l'effet anti-inflammatoire dans l'intestin grêle de la stimulation du nerf vague dans notre modèle de l'iléus post-opératoire est perdu dans ces souris KO [4]. Dans la présente étude, cependant, l'effet de la nicotine sur l'activation des macrophages ATP induite n'a pas été bloquée par le nAChR de α7 préférant bloquants ABGT et MLA, argumentant contre la participation des nAChR a7. Cela est en outre soutenu par l'absence d'étiquetage des macrophages de l'estomac par nAChR préférant α7 α-bungarotoxine. Dans l'intestin, cependant, nous avons observé α-bungarotoxine des macrophages musculeuse marqués positifs [4 et cette étude], ce qui indique des différences spécifiques à la région dans le phénotype de ces cellules immunitaires. Bien que le manque apparent de ABGT sensible α7 nAChR dans notre étude semble contradictoire à nos conclusions précédentes, nous sommes très confiants que ces données ne sont pas dues à l'incapacité des ABGT à concourir pour le site de liaison de la même concentration utilisée dans nos blocs d'étude α7 neuronale nAChR dans le cerveau et dans
Conclusion
la démonstration de situ d'une inhibition de l'activation des macrophages par la nicotine suggérant la signalisation fonctionnelle entre les neurones cholinergiques et les macrophages dans l'estomac. Les données suggèrent que la sous-unité β2 du nAChR est impliqué de manière critique dans l'inhibition induite par la nicotine de ces macrophages résidents
Méthodes de
Imagerie Calcium
immunohistochimie
La microscopie confocale et analyse d'images
Pharmacologie
< 0,05. N de numéros donnés entre parenthèses indiquent le nombre de macrophages /tissus étudiés, soit un résultat basé sur des enregistrements de 20 macrophages dans 5 tissus (égale à 5 animaux) est présenté comme (20/5).
la caractérisation pharmacologique de l'effet inhibiteur de la nicotine sur les macrophages résidents de tissus
par la stimulation du nerf vagal dans des modèles murins de la septicémie et l'iléus post-opératoire [2,3] et in vitro
par l'administration de nicotine à isolé , les macrophages stimulés lipopolysaccharide [1-4,21]. Dans la présente étude, nous avons constaté que la nicotine réduit l'augmentation de l'ATP-induite dans intracellulaire de Ca 2+ dans les macrophages résidents dans l'estomac. Fait intéressant, cet effet a été infirmée par la β2 nAChR sous-unité préférant antagoniste DHBE suggérant l'implication de cette sous-unité dans la modulation de la nicotine à médiation des macrophages résidents. Cette observation est cohérente avec notre constatation antérieure selon laquelle DHBE inversé l'inhibition induite par la nicotine de facteur de nécrose tumorale-α (TNF-α) la libération et l'augmentation de la phagocytose dans les macrophages péritonéaux isolés [6]. Dans la ligne, la production de cytokines de la lignée de cellules de neuroblastome humain transfecté de manière stable avec α4β2 nAChR est significativement réduite par un traitement préalable à la nicotine [22]. Bien que ces données indiquent que les nAChR a4ß2 peuvent médier l'effet de la nicotine sur l'augmentation de l'ATP intracellulaire induite par Ca 2+, des données récentes indiquent que les sous-unités ß2 peuvent également assembler avec d'autres sous-unités alpha, y compris les sous-unités a7. Une publication récente discutant des propriétés électrophysiologiques de α7β2 nAChR exprimé dans des lignées de cellules épithéliales humaines, a montré que de faibles concentrations de DHBE antagonise α7β2 nAChR mais pas a7 nAChR [16]. Ceux-ci et d'autres données sur le profil pharmacologique de DHBE suggéreraient que DHBE est un antagoniste hautement sélectif des ß2 nAChR, mais ne fait pas de discrimination fiable entre les différents ensembles de α3, α4 ou α7 avec β2. Cependant, notre immunohistochimique et l'étiquetage vital des macrophages résidents gastriques ne favoriseraient pas la participation des α7 nAChR parce que les macrophages gastriques ne sont pas marqués par ABGT mais ont exprimé la sous-unité nAChR β2.
![Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep 19]](https://www.stomachillness.com/article/uploadfiles/202201/2022011910313996.png) Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep'19]
Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep'19]
 Symptômes d'une perforation de l'ulcère - Diagnostic de l'abdomen aigu
Symptômes d'une perforation de l'ulcère - Diagnostic de l'abdomen aigu
 Comment les efforts de dépistage de masse ont aidé à identifier plus de cas de maladie cœliaque chez les enfants
Comment les efforts de dépistage de masse ont aidé à identifier plus de cas de maladie cœliaque chez les enfants
 Une variante génétique commune explique pourquoi l'immunothérapie échoue souvent dans la maladie de Crohn
Une variante génétique commune explique pourquoi l'immunothérapie échoue souvent dans la maladie de Crohn
 Laxatifs contre la constipation
Laxatifs contre la constipation
 Le lien fascinant entre le Prilosec, l'acné et la polyarthrite rhumatoïde
Le lien fascinant entre le Prilosec, l'acné et la polyarthrite rhumatoïde
 Chirurgie de la colite ulcéreuse
Centre de chirurgie de la colite ulcéreuse Images du diaporama sur la colite ulcéreuse Diaporama sur les maladies inflammatoires de lintestin Répondez au quiz sur la colite ulcéreuse Trouvez un médec
Chirurgie de la colite ulcéreuse
Centre de chirurgie de la colite ulcéreuse Images du diaporama sur la colite ulcéreuse Diaporama sur les maladies inflammatoires de lintestin Répondez au quiz sur la colite ulcéreuse Trouvez un médec
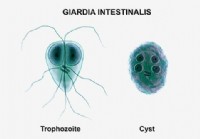 Giardiase (Giardia Lamblia)
Quest-ce que la giardiase ? La giardiase est une infection parasitaire de lintestin grêle. La giardiase (gee-ar-die-a-sis avec un G doux) est une infection de lintestin grêle causée par le parasite
Giardiase (Giardia Lamblia)
Quest-ce que la giardiase ? La giardiase est une infection parasitaire de lintestin grêle. La giardiase (gee-ar-die-a-sis avec un G doux) est une infection de lintestin grêle causée par le parasite
 Les microbes pourraient prédire des issues fatales chez les patients ventilés COVID-19
La présence de Mycoplasme salivaire dans les voies respiratoires inférieures des patients ventilés infectés par COVID-19 est associée à une probabilité accrue de mourir. Le résultat faisait partie d
Les microbes pourraient prédire des issues fatales chez les patients ventilés COVID-19
La présence de Mycoplasme salivaire dans les voies respiratoires inférieures des patients ventilés infectés par COVID-19 est associée à une probabilité accrue de mourir. Le résultat faisait partie d