absztrakt
Caveolin-1 (Cav1) egy állvány fehérje és patogén receptor nyálkahártyáján a gyomor-bél traktusban. Krónikus fertőzés gyomor hámsejteket Helicobacter pylori katalógusa ( H. Pylori katalógusa) egyik fő kockázati tényezője az emberi gyomorrák (GC), ahol Cav1 gyakran leszabályozott. Azonban, a funkció a Cav1 H. pylori fertőzés Szerző összefoglaló katalógusa fertőzés baktérium Helicobacter pylori katalógusa ( H. pylori katalógusa) főként gyermekeket érinti a fejlődő országokban, akik veszélyben vannak a haladást, hogy gyomorrák (GC), mint a felnőttek sok év után a perzisztens fertőzés, különösen a törzsek, amelyek pozitív az onkogén virulencia faktor CagA. Felszámolására H. pylori katalógusa antibiotikumok által a választandó kezelés, de az is megváltoztathatja a hajlamot allergiák és más tumor típusok. Így új diagnosztikus vagy prognosztikus markerek van szükség, amely érzékeli a korai molekuláris változások a gyomor nyálkahártyájának az átmenet során a krónikus gyulladás a rák. Tanulmányunkban azt találtuk, hogy a tumor szupresszor Caveolin-1 (Cav1) csökken fertőzés esetén az H. pylori bevezető hivatkozás: Hitkova I, Yuan G, Anderl F, Gerhard M, Kirchner T, Reu S, et al. (2013) Caveolin-1 Védi B6129 egerek ellen Helicobacter pylori katalógusa gyomorhurut. PLoS Pathog 9 (4): e1003251. doi: 10,1371 /journal.ppat.1003251 katalógusa Vágó: Steven R. Blanke, University of Illinois, Amerikai Egyesült Államok Beérkezett: 2012. május 23., Elfogadva: február 4, 2013; Megjelent: április 11, 2013 katalógusa Copyright: © 2013 Hitkova et al. Ez egy nyílt hozzáférésű cikk feltételei szerint terjeszthető a Creative Commons Nevezd meg! Licenc, amely engedélyezi a korlátlan használatát, a forgalmazás és a reprodukció bármilyen adathordozón, feltéve, hogy az eredeti szerző és a forrás jóváírásra. Katalógusa Forrás: Ez a tanulmány ben támogatták az EB és MPAE a Deutsche Krebshilfe (108287) és a DFG (BU-2285). MPAE is támogatták a Deutsche Krebshilfe (107885), a DFG (SFB 824, TP B1), Else Kröner Stiftung (Nr P14 /07 //A104 /06) és a BMBF (Mobimed 01EZ0802; KMU-innovativ No 0315116B. A finanszírozók nem volt szerepe a tanulmány tervezés, adatgyűjtés és elemzés, döntés, hogy közzéteszi, vagy a készítmény a kézirat. katalógusa Érdekütközés: a szerzők kijelentették, hogy nem ellentétes érdekek léteznek. katalógusa Bevezető Helicobacter pylori katalógusa ( H. pylori katalógusa) egy Gram-negatív baktérium, amely colonizes gyomor kb. 50% -át a világ népességének, és növeli annak a kockázatát, krónikus gyomorhurut, gyomorfekély-betegség, gyomor nyálkahártya-asszociált limfoid szövet (MALT) limfóma, nyálkahártyával atrófia és a gyomorrák (GC) [1], [2]. ennek alapján a etiológia, H. pylori a két fő H. pylori katalógusa toxinok [4], CagA és VacA, beépítik a gyomor hámsejtek injekció útján bakteriális IV típusú szekréciós rendszer (CagA) [5], vagy közvetlen behelyezéshez lipid raftok (VacA) [6], [7]. Lipid raft koleszterin és szfingolipid gazdag mikrodomének a plazmamembrán [8], [9], amelyeket kihasználva a sok kórokozó, beleértve a vírusokat, parazitákat és baktériumokat, hogy megkönnyítse felvételét egész szervezet és /vagy internalizálása méreganyagok gazdasejt [ ,,,0],10], [11], [12]. Például a Neisseria spec katalógusa. használ lipid raftok és a Rho-közvetített jeltovábbítás az aktin citoszkeleton, hogy hozzáférjen a citoszolba [13]. Pseudomonas aeruginosa katalógusa hasznosítja lipid raft-asszociált toll-like receptor 2 fertőzése tüdőhámsejtekhez [14]. Katalógusa Caveolin-1 (Cav1) a 21-24 kDa nagy és lényeges szerkezeti fehérje caveolák, egy speciális formája a lipid raft mikrodomének. Caveolák vannak 50-100 nm-es lombikba /cső alakú invaginations a plazma membrán bőséges a makrofágokban, endoteliális és simaizom-sejtek, I. típusú pneumociták és adipociták, ahol részt vesznek a celluláris transzport folyamatok beleértve endocitózis, koleszterin efflux és a membrán forgalom [15] , [16]. Ebben az összefüggésben, Cav1 is jár, mint egy inhibitora clathrin-független endocitózis és a blokk kórokozó /toxin-felvétel [17], [18]. Keresztül való kötődését állványzat domain, Cav1 közvetlenül gátolja a nagyszámú receptorok és enzimek, így például a tirozin-kinázok Src és a Ras család, a G-proteineket és a nitrogén-oxid szintézist [15]. Amellett, hogy szerepet membrán forgalom, Cav1 képezi tehát egy vezérlő platform szabályozása sejtproliferáció és túlélés [19]. Cav1 is fejt ki fontos funkciója a sejtek mozgékonyságát és a migráció, azon belül epitheliális, stroma és endothel szövetekben érvényesítésével sejt-sejt kapcsolatok, sejt-mátrix adhézió és az immunválaszt [20], [21], [22], [23] . Cav1 közvetlenül kötődik a koleszterin, és a transzkripció a Cav1 negatívan szabályozza a transzkripciós faktor szterin-reszponzív elem-kötő protein-1 (SREBP1) [24]. SREBP1 van kötve, hogy az endoplazmás retikulum (ER) mint egy inaktív 125 kDa prekurzor és aktiválódik körülmények között a koleszterin-hiány proteolitikus hasítással a Golgi-készülékbe. Ez a hasítás követ transzlokáció az aktív 68 kD SREBP1 a sejtmagba, ahol kötődik szterin-reszponzív elemek (SRE-k) a megcélzott gének, beleértve Cav1, részt vesz a koleszterin szintézisét és zsírsavak [25]. H. pylori Ezért feltételeztük, hogy a koleszterin-kötő fehérjék SREBP1 és Cav1 célpontjai H. pylori Anyagok és módszerek katalógusa Etika nyilatkozat katalógusa az állatkísérletek végeztek egyetértésben etikai irányelvek a Technische Universität München (német állatvédelmi törvény, Deutsches Tierschutzgesetz) és hagyott jóvá (7.2-1-54-2531-74-08) által Bajorország kormánya (Regierung von Obb., München, Németország). katalógusa Állatok katalógusa Homozygota Cav1 knockout (Cav1-KO) (törzs Cav1tm1Mls /J; raktári szám 004585), és kontroll vad típusú (WT) (törzs B6129SF2 /J; raktári szám 101045) egereket (8 hetes) kaptuk a Jackson Laboratory (Bar Harbor, Maine), és fenntartotta a vegyes alapon egy patogénmentes egér létesítmény [28], [ ,,,0],29]. Kísérleti gyomorfekély végeztük indometacin közzétett előtt [30]. Fertőzés egerek egér-adaptált CagA /VacA szállítás hiányos H. pylori Reagensek katalógusa Vegyszerek a Merck (Darmstadt, Németország), vagy Sigma (Taufkirchen, Németország). Poliklonális antiszérumok voltak SREBP1 (# PA1-46142, Thermofisher Scientific, Waltham, MA), Cav1 (N-20, SC-894), SREBP1 (C-20, SC-366), CagA (B-300, az SC-25766) , FAK (A-17, SC-557), foszfo-FAK (Tyr-397, az SC-11765), a Hsp90 alfa /béta (H-114, SC-7947), Lamin A /C (H-110, SC- 20681, mind a Santa Cruz Biotech., CA), az általános és a foszfo ERK1 /2 (p44 /p42), a p38, JNK (összes Cell Signaling, Danvers, MA, USA), és a Ki-67 (SP6, a DCS GmbH, Hamburg, Németország ). Egér monoklonális antitestek voltak Cav1 (ɢ406), és foszfo-Cav1 (pY14,ɣ338) (mindkettőt a BD /transzdukció által Lab., San Jose, CA), DLC-1 (C-12, SC-271915) és a béta-aktin (AC-15, SC-69879) (mindkettő Santa Cruz Biotech.). A makrofág-specifikus patkány anti-egér F4 /80 antitestet (# MF48000) kapunk (Invitrogen Life Technologies, Darmstadt, Németország). Csirke anti- H. pylori Sejtkultúra katalógusa Az emberi embrionális vese (HEK-293), Madin-Darby kutya vese ( MDCK), a szülői humán GC-sejtvonalak (AGS, MKN45, N87) (összes az American Type Culture Collection, Rockville, MD), és stabilan transzfektált klónokat generált ezek tartottuk a korábban leírt [37]. Fertőzés sejtek a sejt-adaptált CagA szállítás jártas H. pylori katalógusa törzs G27 végeztük, mint korábban. [36] katalógusa DNS-konstrukciók A expressziós plazmid pEGFP-CagA említették máshol [38]. A ~800 bp-s fragmentumot a proximális emberi Cav1 promóter (AF019742, pozíció 69-859) [24] volt, PCR-rel amplifikáltuk a genomi DNS-humán normál máj és beklónoztuk a KpnI /HindlII helyeire pGL3-Luc luciferáz riporter plazmiddal ( Promega GmbH, Mannheim, Németország). Izoform 4. Az emberi DLC1 mRNS [39] (DLC1v4, NM_001164271.1) amplifikáltuk humán hepatoma HepG2-sejtek és beillesztik a BamHI /NotI helyekre az expressziós vektor pTarget (PT, Promega GmbH). Tranziens transzfekció és luciferáz vizsgálati eljárásokat végeztünk, mint korábban [37]. H. pylori Ex vivo Egész gyomrukat kivágtuk egerek és kolónia képződését lényegében úgy határozzuk meg, mint leírt [31] . Egy antrális csík a gyomor lemértük, helyeztük 5 ml Brucella táplevesben és vortexeltük 10 perc. Hígításait 1:10, 1:100 és 1:1000 állítottunk elő, és 100 ul mindegyik hígítást agarlemezre H. pylori A megmaradó gyomrot kimostuk steril vízben. Egy antrális csík volt vágva, folyékony nitrogénben lefagyasztottuk és -80 ° C-on, amíg az RNS extrakció. A többi a gyomor helyeztük 3 ml 4% -os (w /v) paraformaldehid (PFA) foszfáttal pufferolt sóoldattal (PBS), és inkubáltuk 24 órán át 4 ° C-on. Ezután a gyomrot felvágjuk mentén a nagyobb és a kis görbület két részre, majd a kiszáradás és a paraffinba való beágyazás a szövettani elemzéshez. A sejteket fertőzünk a H. pylori kimutatása immunprecipitált proteineket SDS-PAGE és a WB végeztük, mint korábban [41]. Mátrix segítette lézer deszorpciós /ionizációs tömegspektrometria (MALDI-MS) írták le részletesen [29]. Katalógusa Immunfluoreszcenciás katalógusa A festést végeztünk hármas színes üzemmódban megjelenítő 4,6 diamino-2-fenil (DAPI), Alexa-488 és -594 digitális fényképezőgéppel csatlakoztatott (Axiovision, engedje 4,4) fluoreszcens mikroszkóp (Axiovert 200M, Carl Zeiss MicroImaging GmbH, Hallbergmoos, Németország). Konfokális mikroszkópia (Axiovert 40, Zeiss) és 3D-rekonstrukció H. pylori katalógusa-fertőzött sejteket LSM510 (Zeiss) és Volocity (improvizálás, Tübingen, Németország) került sor, mint korábban. [37] katalógusa A kórszövettani értékelés és immunhisztokémiai (IHC) hotelben A krónikus aktív gastritis által meghatározott egyidejű jelenléte mind neutrofil polymorphnuclear (PMN) és a mononukleáris sejtek (limfociták és a plazma sejtek) belül a gyomor nyálkahártyáját. Aktív (PMN) és krónikus (mononukleáris) infiltrátum értékeltük az alábbiak szerint: paraffinba ágyazott gyomor szövetet vágjuk 3 jim-es metszeteket egy félautomata mikrotom (Leica Microsystems GmbH, Wetzlar, Németország). A metszeteket ezután megfestjük hematoxilinnel & Eozin (H &E) megoldásokat. A hisztopatológiai analízist végeztünk három patológusok (CR, SR, tk) vak, hogy a tanulmány beállítás. A morfológiai elváltozások a gyomornyálkahártya szerint osztályozzák a frissített Sydney rendszer [32], [42]. Az osztály a gyomorhurut pontozták sűrűsége alapján az intramucosalis gyulladásos beszűrődés mononukleáris és PMN sejtek előtt közzé [43]: nincs (0), enyhe (1+), közepes (2+) és súlyos (3+). Ezen túlmenően, hiperpláziás vagy regeneratív epiteliális változtatások, elvesztése parietalis sejtek és gyakoriságát nyiroktüszőkben vagy limfoid aggregátumok észleltek. Az intenzitás a H. pylori csip (Kit az Upstate, Millipore GmbH, Schwalbach, Németország), és minden más módszer végeztünk a korábban ismertetett módon [45]. Az oligonukleotidokat táblázatban vannak felsorolva az S1. életképessége adherens sejtek mértük 1- (4,5-dimetil-tiazol-2-il) 3,5-difenil-formazán (MTT ) vizsgálattal (Roche Diagnostics GmbH, Mannheim, Németország) a gyártó által ajánlott. Annak meghatározására, sejtadhézió, 1 × 10 4 sejteket oltottunk 6 cm-es sejttenyésztő Edények 1-6 óra hosszat, majd az ismétlődő mosás PBS-sel. A fennmaradó adherens sejteket fixáltuk 4% (w /v) PFA PBS-ben, megfestettük kristályibolya, és ezt követően számláltuk ImageJ (NIH, Bethesda, MD). Sebgyógyító vizsgálatokat végeztünk lényegében a [46]. Röviden, a sejteket összefolyásig 6 cm-es csészékben, és egy 5 mm-es karcolás vezettünk be az egyrétegű használva egy fordított kék tip majd inkubáltuk a sejttenyésztő lemezeket további 24, 48 és 72 órán át. Seb lezárása követtük után fixálás és festés sejtek kristályibolya a világos látóterű mikroszkóppal (Axiovert 200M, Carl Zeiss MicroImaging GmbH). Katalógusa Statisztika katalógusa Az eredmények átlagértékek ± S. E. legalább 5 állat genotípusa vagy 3 független kísérlet különböző sejt-részeket. A szoftver GraphPad Prism (4.0 változat, La Jolla, CA) alkalmaztunk az adatok elemzésére. P-értékek (* p < 0,05) számítottuk ki Student t és Fisher Exact teszt. Katalógusa csatlakozási számok katalógusa Ember: Cav1: NM_001753.4, Q03135; B2M: NM_004048.2, P61769; IL8: NM_000584.3, P10145; DLC1 v1: NM_182643.2, Q96QB1; DLC1 v4: NM_001164271.1, Q96QB1; ACS: NM_018677.3, Q9NR19; HMGCoAS: NM_001098272.2, Q01581; HMGCoAR: NM_000859.2, P04035; LDLR: NM_000527.4, P01130; béta-aktin: P60709; Lamin A: P02545; Lamin C: P02545; Hsp90 alpha: P07900; Hsp90 béta: P08238; ERK1 (p44): P27361; ERK2 (p42): P28482; FAK: Q05397; JNK1: P45983; JNK2: P45984; p38: Q16539; Src: P12931; SREBP1: P36956; Ki-67: P46013; Egér: Cav1: NM_007616.4, P49817; B2M: NM_009735.3, Q91XJ8; TNFalfa: NM_013693.2, P06804; IFNgamma: NM_008337.3, P01580; IL1beta: NM_008361.3, P10749; IL6: NM_031168.1, P08505; CD4: NM_013488.2, P06332; CD19: NM_009844.2, P25918; CD25: NM_000417.2, P01589; CD86: NM_019388.3, P42082; CCL5: NM_013653.3, P30882; CXCL1: NM_008176.3, P12850; PPARg2: NM_015869.4, P37231; TFF2: NM_009363.3, Q9QX97; Kutya: B2M: NC_006612, XP_850148; H. pylori Eredmények katalógusa Cav1-hiányos egerek fokozott gastritis után fertőzés CagA-szállítási inkompetens H. pylori Annak felmérése szövettani változásokat indukált gyomor szöveti után H. pylori fertőzés katalógusa, B6129 WT és Cav1-KO egerekben fertőződött egér-adaptált és CagA szállítás hiányos H. pylori katalógusa törzs SS1. Az egereket leöltük 11 hónappal később, és a H. pylori Cav1-hiány elősegíti makrofágoknak a fertőzött gyomornyálkahártya katalógusa Annak megállapítására, a személyazonosságát az immunsejtek, amelyek hozzájárulnak a H. pylori katalógusa val kapcsolatos gyulladás Cav1-KO egerekben, RT-qPCR elemzése a citokinek sejtfelszíni markerek és kemokinek végeztünk (2A.). Összhangban a megfigyelt gyulladás, H. pylori Hasonló eredményeket kaptunk kísérletek bevezetésével gyors gyomor sérülés egerekben injekcióval indometacin [30] (Fig.S1). Összhangban a fokozott szöveti károsodás Cav1-KO gyomor (* p = 0,0161, a WT versus Cav1 nem változtat tapadását H. pylori katalógusa törzsek sem túlélés az emberi GC sejtek Annak megállapítására funkciójának Cav1 során H. pylori Cav1 védi az emberi GC-sejtek ellen CagA okozta átrendeződés a citoszkeleton katalógusa A formáció a tű-szerű nyúlványok ( "kolibri") egy tipikus morfológiai fenotípus AGS sejtek válasz fertőzés CagA-szállítási jártas H. pylori alátámasztására ezeket a megállapításokat, sejtadhézió és a seb lezárása aránya kifejezettebb AGS /Cav1 képest AGS /EV-sejtek (Fig.S2). Összhangban a funkciója, mint a cél fehérjét CagA és alkatrész fokális összenövések [48], WB elemzések (ábra. 4D) is kimutatható magasabb (0,4 ± 0,1 AGS /EV versus katalógusa 1,4 ± 0,1 AGS /Cav1 , * p = 0,0012; n = 3 klón) foszforilezett fokális adhéziós kináz (FAK) a Cav1 expresszáló fertőzött sejtek H. pylori CagA szállítás illetékes H. pylori Cav1 kimutatták, hogy foszforilálják citoszol tirozin-kinázok (Src, Abl) ba tirozin 14 [49], és foszforilált Cav1 és src egyaránt aktiválja a kis GTP Rho /Rac /Cdc42, amelyek szabályozzák a citoszkeleton funkciókat [13], [50]. Azonosítására szolgáló molekuláris mechanizmus, ahogy Cav1 véd CagA kapcsolatos sejt stressz, felmértük a jelátviteli utak által kezdeményezett CagA szállítás jártas H. pylori Nem sikerült felismerni a közvetlen interakció, vagy mennyiségi kolokalizációját CagA fehérje vagy a H. pylori katalógusa G27 baktériumok Cav1 a CoIP vagy immunfluoreszcens kísérletekkel (6A., B). Gentamicin védelmi vizsgálatok során kiderült, hogy a teljes összeg a befecskendezett intracelluláris CagA független is volt Cav1 jelenléte (ábra. 6C). Így Cav1 sem gátolta tapadását H. pylori azonosításához egy jelölt fehérje, amely ellen védelmet biztosítani CagA egy Cav1-függő a módon egy fehérje kölcsönhatás képernyő alapján MALDI-MS végeztük (ábra. 7a). AGS /Cav1 sejteket fertőztünk, 16 óra, H. pylori Ez az eredmény arra ösztönzött minket, hogy megerősítsék a cDNS variáns 4. emberi DLC1 [39] Az emberi hepatoma HepG2 sejtekben ( . 7c). A cDNS-t helyezünk a expressziós vektorba pTarget (Pt-DLC1v4), majd tranziens transzfekció be szülői AGS vagy HEK293 sejteket 24 órán át. WB elemzések észlelt expresszióját ~110 kDa fehérje, amely összhangban áll a várt méretét DLC1v4 [39]. Átmenetileg transzfektált AGS sejteket ezután fertőzött H. pylori
és patogenezise GC ismeretlen maradt. Megmutatjuk, hogy itt Cav1-hiányos egerek fertőzött 11 hónapig a CagA szállítás hiányos H. pylori
törzs SS1 kifejlesztett súlyosabb gyomorhurut és szöveti károsodás, beleértve az elmaradt parietális sejtek és foveolar hiperplázia, és megjelenik az alacsonyabb kolonizáció a gyomornyálkahártya mint a vad típusú B6129 alomtársak. Cav1-null egerekben mutatott fokozott beszivárgása a makrofágok és a B-sejtek és szekrécióját kemokinek (RANTES), de már csökkentett CD25 + szabályozó T-sejteket. Cav1-hiányos humán GC-sejtek (AGS), fertőzött CagA szállítás jártas H. pylori
törzs G27, érzékenyebbek voltak CagA kapcsolatos citoszkeletális stressz morfológiával ( "zümmögő madár"), mint a AGS stabilan transzfektált sejteket Cav1 (AGS /Cav1). Fertőzés AGS /Cav1 sejtek váltott a felvétel P120 RhoGTPase aktiváló protein /törölni májrák-1 (p120RhoGAP /DLC1) a Cav1 és ellensúlyozta CagA indukált citoszkeleton átrendeződést. Humán GC sejtvonalak (MKN45, N87) és az egér gyomor szöveti, H. pylori
leszabályozott endogén kifejezése Cav1 függetlenül CagA. Elvileg, H. pylori
aktivált szterin-érzékeny elemet megkötő protein-1 (SREBP1) elfojtani transzkripció a humán Cav1 gént szterin-reszponzív elemek (SRE) a proximális promoter Cav1. Ezek az adatok azt védő szerepe Cav1 ellen H. pylori
indukált gyulladás és szövetkárosodás. Azt javasoljuk, hogy H. pylori katalógusa hasznosítja leszabályozza Cav1 aláásni a gazdaszervezet immunválaszát és előmozdítása jelzés a virulencia faktorok gazdasejtekben. katalógusa
, és CagA volt elegendő, de nem szükséges, hogy ez a down-regulációja. Elvesztése Cav1 okozta H. pylori
-függő aktiválása szterin-reszponzív elem-kötő protein-1 (SREBP1), és ez az esemény eltörölte a kölcsönhatás a Cav1 P120 RhoGTPase-aktiváló fehérje /törölni májrák-1 (p120RhoGAP /DLC1), egy második jóhiszemű katalógusa tumor szupresszor a gyomor szöveteit. Meggyőzően, Cav1 és DLC1 jelenthet a molekuláris markerek H. pylori
-fertőzött gyomornyálkahártya előtt neoplasztikus transzformáció az epithelium.
besorolása mint I. osztályú rákkeltő az egészségügyi Világszervezet (WHO) 1994-ben [3]. katalógusa
kimutatták, hogy bontják a koleszterin a gazdasejtből membrán, és a fogadó koleszterin megváltoztatja a onkogén tulajdonságai CagA [26], [27].
fertőzés és /vagy effektor funkciókat. Konkrétan azt kérdezte, hogy (i) H. pylori katalógusa hasznosítja Cav1 megkönnyítése befecskendezés és down-stream jelzését CagA a gyomornyálkahártya-sejtek vagy (ii) Cav1 egyfajta védő "akadálymentes érvényesítése" protein, amely ellensúlyozza a betegség által kiváltott H. pylori
. Ennek tesztelésére a fenotípusok eredő H. pylori
fertőzés vizsgáltuk Cav1-hiányos egerekben és humán GC sejtvonalakban. Adataink azt mutatják, hogy Cav1 védett B6129 egerek ellen H. pylori katalógusa val kapcsolatos gyomorhurut és a szöveti károsodás in vivo katalógusa függetlenül CagA. H. pylori
is aktiválódik SREBP1 és le-szabályozott expressziójának a rágcsáló és humán Cav1 függetlenül CagA. Emellett Cav1 ellensúlyozható CagA függő citoszkeleton átrendeződést in vitro katalógusa toborzásával a tumor szupresszor törölni májrák-1 (DLC1). Katalógusa
törzset SS1 végeztük orális szondán keresztül leírt [31]. Az átlagos idő az egereket a különböző genetikai háttérrel (C57BL /6, B6129, BALB /c) figyelembe a haladást, hogy a krónikus gyomorhurut és azon túl (gyomor atrophia, hyperplasia, diszplázia) [32] között változik 10 és 15 hónap után fertőzés a szabványosított hivatkozást törzs SS1 [28], [33], [34], [35]. Ezért úgy döntöttünk, hogy végre az elemzés ezen az időhatáron belül. Katalógusa
poliklonális Ab alkalmaztunk leírt [36]. A citokinek ELISA-val mérjük (R &D Systems, Minneapolis, MN) alkalmazásával a gyártó utasításai szerint. Legördül vizsgálatok a kis GTP Rho /Rac /Cdc42 vásároltunk Biocat (Heidelberg, Németország). Katalógusa
baktérium kultúra
SS1 és G27 baktériumokat nyertünk ki -80 ° C-on glicerin készletek és növesztjük Wilkins-Chalgren (WC) véres agar lemezeken alatt mikroaerob körülmények között (10% CO 2, 5% O2, 85% N2; 37 ° C) 2-3 nap. Az egér-adaptált H. pylori
SS1 takarítottunk agar lemezeken in vivo katalógusa fertőzések korábban publikált [31]. Az SS1 törzs volt PCR-pozitív a cagA
gén és mRNS, de nem adja funkcionális CagA fehérje [40], nyilvánvaló hiánya a "zümmögő madár" fenotípus fertőzött AGS sejtekben (adatokat nem mutatjuk) . A sejt-adaptált H. pylori
baktérium CagA-szállítási jártas G27 tömeg
és a CagA-deléciós mutáns G27 Delta cagA
begyűjtöttük agar lemezekre, és ezt követően termesztett folyamatos együtt tenyésztve MDCK sejtekben leírtak [36].
számszerűsítését telepképző egységek (CFU)
szelektív WC véres agar lemezeken. A baktériumtelepeket után határozzuk meg 5 nap, és normalizáltuk a súlya a megfelelő gyomor darab.
feldolgozása egér gasztrikus szövet
gentamicin protection assay
G27 törzs 2 óra és 24 óra fertőzési multiplicitással (MOI) 500:1. Ezt követően a sejteket háromszor mostuk PBS-sel, hogy a maradék baktériumok eltávolítására, és arra emellett inkubáljuk 2 órán át 37 ° C-on, nedvesített atmoszférában DMEM /F12 (10% FCS-t, 10% Brucella táplevesben) kiegészített gentamicin (200 ug /ml ), penicillin /sztreptomicin (100 ng /ml) és klóramfenikolt (100 ng /ml). Hiánya extracelluláris baktériumok megerősítette a mikroszkóp alatt, és a sejteket ezt követően lizáltuk kimutatására intracelluláris CagA Western blot (WB).
Coimmunoprecipitation (CoIP) és Western-blot (WB)
kolonizáció a gyomornyálkahártya került rögzítésre, mint enyhe (kevés és egyetlen baktériumok egy véletlenszerű eloszlás), közepes (egyszeri és fürtözött baktériumok egy folytonos eloszlás) és súlyos (sűrű bakteriális klaszterek lefedő gyomornyálkahártya folyamatos rétegek). Több tucat különböző régióiban a gyomor határoztuk meg. Immunhisztokémiai (IHC) végeztük paraffin leírtak előtt [44].
Elektroforetikus mobilitás-eltolódásos vizsgálati eljárás (EMSA), a kromatin immunprecipitációt (chip), reverz transzkripciós PCR (RT-PCR) és kvantitatív PCR (qPCR)
sejtszintű vizsgálatok
: CagA: YP_002266135.1, B5Z6S0; UreB: YP_626814.1, Q1CV82. Katalógusa
SS1 katalógusa
t izoláltunk kimetszettük gyomor szöveti [31]. Cav1-KO egerek kevésbé voltak bakteriális kolonizáció a gyomornyálkahártya mint a WT egerekben (7,3 ± 2,4 tömeg versus
1.6 ± 0.5 KO × 10 3 CFU /mg gyomorban szövet; * p = 0,0141; N = 15 per genotípus) (1A.). Kórszövettani analízis kimutatta, hogy mind a WT mind Cav1-KO egerek kifejlesztett aktív krónikus gastritis kíséretében beszűrődése mononukleáris és polymorphnuclear (PMN) sejtek a gyomor nyálkahártyáját (ábra. 1B). Ezzel szemben a nem fertőzött WT és Cav1-KO egerek nem voltak intramucosalis gyulladás (az adatokat nem mutatjuk be). Ehelyett a gastritis jelentős javulás mutatkozott H. pylori katalógusa-fertőzött Cav1-KO egerekben, mint a fertőzött WT egerek (ábra. 1C). In Cav1-KO egerek átlagos pontszám gyomorhurut (0,7 ± 0,2 WT versus katalógusa 1,7 ± 0,1 KO; * p = 0,0002, n = 15 per genotípus) súlyosabb volt (1. táblázat), mint a vad típusú egerek és a gyomornyálkahártya kiállított intramucosalis B-sejtes tüszők, foveolar hyperplasia és a veszteség a parietális sejtekben. Ez az adat azt jelzi, hogy Cav1-hiány van társítva fokozott gyulladásos válasz a gyomornyálkahártya és egy kevésbé hatékony kolonizációja H. pylori katalógusa.
SS1 indukált expressziója TNFalfa és IFNgamma a gyomornyálkahártya mind WT és KO egerek. Ezen kívül megállapítottuk, megnövekedett mRNS expressziója CD19 (B-sejtek) (1,6 ± 0,3 tömeg versus
3,3 ± 0,9 KO; p = 0,0512; n = 15 per genotípus) és a RANTES (CCL5) (1,3 ± 0,2 WT versus katalógusa 2,1 ± 0,6 KO; p = 0,0449; n = 15 per genotípus) a gyomor szöveteiben H. pylori katalógusa-fertőzött Cav1-KO egerekben, mint a fertőzött WT egerekben. Ezzel szemben, a mRNS-szintjét a CD4 (T-helper sejtek), CD25 (T-szabályozó sejtek) és a CD86 (antigénprezentáló sejt) elnyomja H. pylori
függetlenül Cav1 állapotát. Immunhisztokémiai (IHC) észlelt jelentős növekedés intramucosalis F4 /80-pozitív makrofágok gyomor szöveteiben fertőzött Cav1-KO egerek képest WT alomtársaik (ábra. 2b). CD3-pozitív limfociták volt található körül, és belül intramucosalis tüszők (az adatokat nem mutatjuk be).
KO, n = 9 per genotípus), azzal jellemezve, gyulladás, erózió és fekély, Cav1-deficiens egerekben is kifejezte nagyobb mennyiségben mRNS-ek kódoló fekély gyógyulását fehérjék hármaskaréj faktor-2 (TFF2) (0,8 ± 0,3 tömeg versus
2,3 ± 0,4 KO; * p = 0,0048; n = 9 per genotípus) és a peroxiszóma proliferátor-aktivált receptor gamma (PPARg) (0,6 ± 0,2 WT versus katalógusa 2,5 ± 0,5 KO; * p = 0,0008; n = 9 per genotípus). Összegezve, ezek az adatok azt mutatták, hogy veszteség Cav1 növeli a hajlamot az egerek gyomor gyulladás és szövetkárosodás. Katalógusa
fertőzés in vitro
, a humán gyomornyálkahártya sejtvonalat AGS-t alkalmaztunk, melyet stabilan transzfektáltunk Cav1 expressziós plazmiddal (AGS /Cav1) vagy üres vektor (AGS /EV) [37]. Először azt vizsgáltuk, hogy Cav1 befolyásolja a sejtek túlélését követően H. pylori fertőzés
(3A.). AGS klónok és anélkül Cav1 fertőztünk 48 órán a sejt-adaptált CagA-szállítási illetékes H. pylori
törzs G27 különböző multiplikák fertőzés (MOI) kezdve 1:100 a 1:2000. Kolorimetriás MTT assay során kiderült, hogy Cav1 nem volt hatása a teljes túlélésre AGS sejteken H. pylori fertőzés
. Hasonló eredményeket kaptunk CagA-szállítási inkompetens H. pylori
SS1 és Western-blot (WB) elemzés kimutatására az expressziós és foszforilációja túlélés kinázok (Akt /PKB, ERK1 /2, p38MAPK) (az adatokat nem mutatjuk). Mivel mindkét H. pylori katalógusa és Cav1 kölcsönhatásba belül lipid tutajok, kértük, hogy tapadását baktérium sejtekhez függ jelenlétében Cav1. AGS /Cav1 és AGS /EV-sejteket fertőztünk (MOI = 10) A G27 (ábra. 3B, C) vagy SS1 (az adatokat nem mutatjuk be) a baktériumokat 30 percig, majd a mosás és az azt követő inkubációs friss tápközegben 2 órán keresztül. Ezután a sejteket festettük immunfluoreszcens mikroszkópia, és a baktériumok száma, amelyek csatlakoztak a Cav1-t expresszáló vagy üres vektorral transzfektált sejteket megszámoltuk (ábra. 3B, C). Nem találtak különbséget a tapadás között nem figyeltek AGS /Cav1 és AGS /EV-sejtek, ami arra utal, hogy Cav1 nem befolyásolja tapadását H. pylori baktérium katalógusa fogadó sejtek. katalógusa
törzseket és transzlokációját CagA a citoszolba [47]. Annak vizsgálata a szerepe Cav1 ebben stressz indukálta átrendeződése az aktin citoszkeleton, AGS /Cav1 és AGS /EV fertőztünk, 16 óra, H. pylori katalógusa G27 tömeg katalógusa vagy izogén mutáns Delta cagA katalógusa (MOI = 100). A fertőzött sejteket megfestettük a fent leírt módon, és a számok a hosszúkás AGS sejteket meghatároztuk (4a., B). Cav1-hiányos AGS sejtek esetében jóval több hosszúkás morfológiákat mint Cav1 expresszáló sejtek (11 ± 0,8% AGS /EV versus katalógusa 4 ± 0,8% AGS /Cav1; * p = 1,1 × 10 -8; n = 3 klón). Ahogy az várható volt, nem "zümmögő madár" fenotípust kapunk, a fertőzött sejtek a CagA-szállítási hiányos SS1 vagy a CagA-deléciós mutáns G27 Delta cagA
törzsek, amelyek egyaránt képtelen beadni funkcionális CagA fehérjét a gazda sejtek (az adatokat nem mutatjuk be). AGS /EV-sejtek is készített több IL8 mRNS után H. pylori katalógusa G27-fertőzés, mint AGS /Cav1 sejteket (64 ± 19 EV versus katalógusa 19 ± 6 Cav1; * p = 0,0176; n = 3 klón) (ábra. 4C). Ezek az adatok azt mutatták, hogy Cav1 véd CagA kapcsolatos sejt stressz. Katalógusa
G27. Ezek az adatok megerősítik, hogy a AGS /Cav1 fertőzött sejtek CagA-szállítási illetékes H. pylori katalógusa fenntartották kiterített epiteliális alakú képest hangsúlyos hosszúkás fenotípusa Cav1 /EV-sejtek. katalógusa
G27 kiváltja kötődését p120RhoGAP /DLC1 hogy Cav1 humán GC sejtekben
G27. Fertőzés AGS sejtek által kiváltott gyors foszforilációja Cav1 AGS /Cav1 sejtek és az Src mindkét AGS /Cav1 és AGS /EV sejteket. Ez az eredmény azt mutatja, hogy Cav1 jár downstream CagA függő Src aktiváló de felfelé az aktiválás a kis GTP (ábra. 5A, B). Összhangban ezzel a következtetéssel, fehérje szintjét foszforilált JNK, amely lakik alábbi Src, magasabbak voltak AGS /EV sejtek képest AGS /Cav1 sejtekben. Katalógusa
baktériumok sem injekció CagA a gazdasejtbe, hanem csökkentette a down-stream hatásait CagA intracelluláris jelátvitelt.
G27 (MOI = 100), majd a sejtek lízise szobahőmérsékleten MES-pufferolt 1% (v /v) Triton-X100. Protein sávok kicsapjuk Cav1 antiszérum tettük láthatóvá ezüstfestéssel, és peptidek azonosítottuk MALDI-MS, mint korábban publikált [29]. Egy adott fehérje fragmentuma ~95 kDa tartalmazott megfelelő peptidek variánsa 4. P120 Rho GTP-áz aktiváló protein /törölni májrák-1 (p120RhoGAP /DLC1) [51], [52], egy tumor szupresszor társított fokális adhéziók és Caveolák /lipid tutajok [53]. DLC1 4. változatot (DLC1v4) egy előre megjósolt méretű ~110 kDa és gazdagodott a mintákban sejtek volt fertőzött H. pylori
G27 képest nem fertőzött sejtek (táblázat S2). Ezeket az eredményeket megerősítette CoIP a Cav1 és az endogén DLC1 fehérje AGS /Cav1 sejtek (ábra. 7b), jelezve, hogy H. pylori katalógusa G27 kiváltott specifikus felvételének DLC1 hogy Cav1 fertőzött humán gyomornyálkahártya-sejtek. katalógusa
G27 (MOI = 100) további 16 órán át. Immunfestés kimutatta, hogy DLC1 önmagában katalógusa nem gátolja kialakulását az CagA kiváltott "kolibri" fenotípus (19 ± 2% AGS /DLC1 versus katalógusa 19 ± 2% AGS /EV; n = 3 klón) összehasonlítva az üres vektorral transzfektált sejtek (ábra. 8A, B). Ehelyett DLC1 támogatni sejtek szétterjedését (20 ± 3% AGS /DLC1 versus katalógusa 11 ± 2% AGS /EV; * p = 0,0067; n = 3 klón) összhangban szerepe szabályozásában fokális összenövések [ ,,,0], H. H. pylori fertőzés
. pylori
.
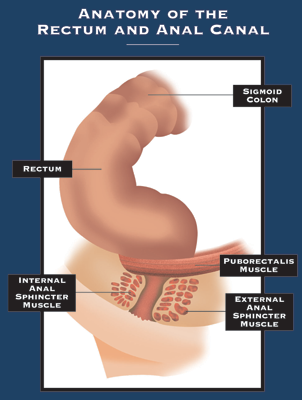 Anális sipolyok
Mi az anális sipoly? A fisztula abnormális kapcsolat két szerv vagy két szövetfelület között. Az anális fistula (fistula-in-ano) az anális csatorna és a bőr közötti kapcsolat. A fistula-in-ano okának
Anális sipolyok
Mi az anális sipoly? A fisztula abnormális kapcsolat két szerv vagy két szövetfelület között. Az anális fistula (fistula-in-ano) az anális csatorna és a bőr közötti kapcsolat. A fistula-in-ano okának
 7 jel arra utal, hogy IBS-e SIBO-s lehet
7 jel arra utal, hogy az IBS-je SIBO lehet Ez a hónap az irritábilis bél szindróma (IBS) tudatosításának hónapja, és ma bemutatjuk azt a 7 jelet, amely arra utal, hogy az Ön IBS-e SIBO lehet. Tehát m
7 jel arra utal, hogy IBS-e SIBO-s lehet
7 jel arra utal, hogy az IBS-je SIBO lehet Ez a hónap az irritábilis bél szindróma (IBS) tudatosításának hónapja, és ma bemutatjuk azt a 7 jelet, amely arra utal, hogy az Ön IBS-e SIBO lehet. Tehát m
 Biztonságosak a vastagbéltisztítók?
Mi az a vastagbéltisztítás? A szakértők szerint kevés tudományos kutatás támasztja alá, hogy a vastagbéltisztítók valóban működnek vagy biztonságosak. A vastagbél tisztítása az ókorba nyúlik vis
Biztonságosak a vastagbéltisztítók?
Mi az a vastagbéltisztítás? A szakértők szerint kevés tudományos kutatás támasztja alá, hogy a vastagbéltisztítók valóban működnek vagy biztonságosak. A vastagbél tisztítása az ókorba nyúlik vis