alapon
A kolinerg gyulladásgátló pálya egy endogén mechanizmus, amellyel a vegetatív idegrendszer csillapítja makrofág aktiváció keresztül nikotinos acetilkolin receptorok (nAChR). Ez a koncepció azonban nem igazolták a sejtek szintjén az ép szövetekben. Ebből a célból, az általunk hatását vizsgáltuk a nikotin az aktiválási rezidens makrofágok egy egér gyomor készítmény útján kalcium képalkotás.
Kalcium tranziensek ([Ca 2 +] i) a rezidens makrofágok rögzített egér gyomor tartalmazó készítmény plexus myentericus és az izom rétegek Fluo-4. Makrofágok aktiválása értük el fokális puff beadása ATP. A hatások a nikotin a makrofágok aktiválása értékelték, és a nAChR érintett volt farmakológiailag jellemezték. A közelsége kolinerg idegek makrofágok mennyiségileg konfokális mikroszkóppal. Expressziója β2 és α7 nAChR értékeltük β2 immunhisztokémiai fluorofór-jelölt α-bungarotoxin. Katalógusa Eredmények katalógusa 83% makrofágok kolinerg visszeres idegrostokat detektáltuk távolságok < 900nm. Az ATP által kiváltott [Ca 2 +] i növelik jelentősen csökkent a 65% vagy 55% a makrofágok 100 jiM vagy 10 nM nikotin, ill. Ez a gátló hatás megfordítható a β2 nAChR preferáló antagonista dihidro-β-eryhtroidine de nem hexametónium (nem-szelektív nAChR-antagonista), mekamilamin (α3β4 nAChR-preferáló antagonista), α-bungarotoxin vagy metillycaconitint (mind α7 nAChR-preferáló antagonista ). A makrofágok a gyomorban kifejezni β2 de nem α7 nAChR fehérje szinten, míg a bélben expressz mindkét receptor alegységek. Katalógusa Következtetés katalógusa Ez a tanulmány az első katalógusa situ Citation: Némethová A, Michel K, Gomez-Pinilla PJ, Boeckxstaens GE, Schemann M (2013 ) a nikotin csillapítja aktiválása Tissue Resident makrofágok egér gyomor keresztül β2 nikotin acetilkolin receptor. PLoS ONE 8 (11): e79264. doi: 10,1371 /journal.pone.0079264 katalógusa Szerkesztő: Yvette Tache, University of California, Los Angeles, Amerikai Egyesült Államok katalógusa Beérkezett: június 10, 2013; Elfogadva: szeptember 26, 2013; Megjelent: november 1, 2013 katalógusa Copyright: © 2013 Némethová et al. Ez egy nyílt hozzáférésű cikk feltételei szerint terjeszthető a Creative Commons Nevezd meg! Licenc, amely engedélyezi a korlátlan használatát, a forgalmazás és a reprodukció bármilyen adathordozón, feltéve, hogy az eredeti szerző és a forrás jóváírásra. Katalógusa Forrás: Ez a munka támogatott a támogatást az Európai Unió 7. keretprogram (IPODD), amely a Deutsche Forschungsgemeinschaft Sche267 /9-1 MS; által nyújtandó, a Research Foundation-Flandria (FWO, Odüsszeusz és Hercules program) a GEB, és egy FWO posztdoktori ösztöndíjjal PJG. A finanszírozók nem volt szerepe a tanulmány tervezés, adatgyűjtés és elemzés, döntés, hogy közzéteszi, vagy a készítmény a kézirat. Katalógusa Érdekütközés: A szerzők kijelentették, hogy nem ellentétes érdekek léteznek. Katalógusa Bevezető 2000-ben, Tracey és munkatársai kimutatták, hogy az elektromos stimulálása a vagus ideg biztosít erős gyulladáscsökkentő bemenetet a lépben. Egy egér modellben a szepszis, vagus ideg stimuláció (VNS) csökkenését eredményezte a pro-gyulladásos citokin termelést, amely hatás függ α7 nikotinos acetilkolin receptorok (nAChR) [1,2]. Ez az úgynevezett "kolinerg gyulladásgátló pálya" (CAIP) keresztül működik adrenerg lép idegek így szinaptikus-szerű kapcsolatokat β2 adrenerg receptort expresszáló lép-T-sejtek. Későbbi acetilkolin felszabadulását (ACh) ezekből a T-sejtek felelősek a gyulladáscsökkentő hatás feltehetően kölcsönhatásban α7nAChR expresszáló makrofágok [1,2]. 2005-ben bizonyították, hogy a CAIP is modulálja a bél immunrendszert. Egy egér modellben a posztoperatív ileus, azt mutatta, hogy VNS csökkentett bél manipuláció okozta gyulladás a vékonybél, jótékony hatással függ α7 nAChR de független a lépben [3,4]. Ezek az adatok arra utalnak, hogy a bél immunrendszer inkább közvetlenül modulált vagus idegvégződések és /vagy enterikus neuronok. Rezidens bél makrofágok a fő szereplői kiváltó ezen gyulladásos válasz [5], ezek a sejtek képviselik a legvalószínűbb célpontja a CAIP. In vitro vizsgálatok segítségével izolált peritoneális makrofágok, perifériás vér mononukleáris sejt-eredetű makrofágok vagy makrofág sejtvonalak valóban bőségesen igazolta, hogy az acetil-kolin és a nikotin csökkenti citokintermelést [1-3,6,7], és növeli a fagocitózis [6]. Mindazonáltal, továbbra is kérdéses, hogy milyen mértékben a fenotípust tényleg hasonlít a rezidens makrofágok által érintett enterikus neuronok, különösen a receptor expresszióját a makrofágokban lehet felfelé vagy lefelé szabályozni, mivel azok már izoláltak természetes környezetben. Ezért úgy döntöttünk, hogy dolgozzon ki egy olyan technikát, amely lehetővé tenné számunkra, hogy tanulmányozza a hatását a nikotin az aktiválási rezidens makrofágok a természetes környezetükben. A makrofágok által aktivált ATP-t, egy jól ismert veszély jel immunsejtek [8,9], növekedést mutat intracelluláris Ca 2+, élő Ca 2+ képalkotó választották, hogy tanulmányozza a rezidens makrofágok intakt lapos lapos egér gyomor készítmények. Ez lehetővé tette számunkra, hogy hasonlítson az ATP által kiváltott Ca 2+ tranziensek ([Ca 2 +] i) a makrofágokban található, a simaizom rétegek alkalmazása előtt és után a nikotin. Mi tovább használt többféle antagonisták ismert preferenciák specifikus nAChR alegységek annak érdekében, hogy további mechanisztikus betekintést szerepeinek nikotin receptort expresszáló makrofágokban a CAIP a bélben. Ezek farmakológiai eredmények megerősítették immunohisztokémiával. Végül elemeztük az aránya rezidens makrofágok, amelyek közel kolinerg idegrostok. Katalógusa Módszerek katalógusa Etikai Nyilatkozat katalógusa Minden egér munkát végeztek szerint a német irányelvek az állatok gondozásáért és jólétéért (Deutsches Tierschutzgesetz), és jóváhagyta a bajor állam etikai bizottság (Regierung Oberbayern, amely arra szolgál, mint a gazdasági Care and Use Committee a Technische Universität München) szerint 4.§ és §11 Deutsches Tierschutzgesetz hivatkozási szám alatt 32 -568-2. a szövetminták Férfi 12-16 hetes C57BL /6 egereket (Charles River, Sulzfeld, Németország) megöljük. A gyomrot betakarított jéghideg Krebs pufferben (mm) 117 NaCl, 4,7 KCI, 1,2 MgCl 2 6 H 2O, 1,2 NaH 2PO 4, 25 NaHCO 3, 2,5 CaCI 2 2 H 2O és 11 glükóz, pH-ját 7,4-en. A gyomrot megnyílt a nagyobb görbület mentén, és mossuk jéghideg Krebs. A mikroszkopikus vizsgálat, a gyomrot tűzött le a SYLGARD edénybe, és a nyálkahártya és nyálkahártya alatti óvatosan eltávolítjuk. A boncolás, a szövetet folyamatosan perfundáltuk jéghideg Krebs-oldatot, hogy biztosítsák életképességét a szövetet. Csak az elülső vagy hátulsó fele a gyomor volt tűzve egy kis SYLGARD gyűrű egy központi nyílás, 100 x 200 mm-es 2. sík lap egér gyomor készítmények voltak inkubáljuk módosított Krebs-oldatba (117 NaCl, 4,7 KCl, 1,2 magnézium-klorid 2 6 H 2 O, 1,2 hidrid 2PO 4, 20 NaHCO 3, 2,5 CaCI 2 2 H 2O és 11 glükóz), amely 30 uM a fluoreszcens kalcium indikátor Fluo 4-acetoxi-metil (AM) (Invitrogen) és 1,25 mM probenecid (Sigma-Aldrich, Schnelldorf, Németország) 2 órán át szobahőmérsékleten, sötétben és a gázt a Carbogen (95% O 2 - 5% CO 2). A SYLGARD gyűrű volt szerelve a felvétel kamra serosa oldalán a gyomor felé néző alja a kamrából. A kamrát csatlakozik a perfúziós rendszer lehetővé teszi a folyamatos perfúzió Carbogen-elgázosított Krebs-oldattal, szobahőmérsékleten. Kimosódási időszak 1,5 órán hagytuk, mielőtt az a kísérlet megkezdése. A szöveti kamrába szerelt fordított epifluoreszcens mikroszkóppal (Zeiss Axio Observer A1, Carl Zeiss Jena, Németország) ellátott nagy sebességű fekete-fehér kamera (Zeiss AxioCam HSM) és szoftver (Zeiss Vision Axio 4.8) beszerzését és elemzését. Fluo-4 izgatott volt egy kék fénykibocsátó dióda (LED) Luxeon III (3W, 470nm domináns hullámhossz, Philips Lumiled, Phillips, Hambur, Németország) és a Fluo-4 jelek detektálására szűrővel kocka F26-514 világos vonal FITC BP (gerjesztés: HC475 /35, dichroic: 499, emisszió: HC530 /43, AHF Analysentechnik, Tübingen, Németország) segítségével X20 objektív (A-terv, NA = 0,25, Zeiss). A rendszer mért relatív változásait fluoreszcencia (Δ F /F) Fluo-4 felügyelet változását az intracelluláris kalcium ([Ca 2 +] i). Ca 2 + tranziensek jegyeztek kiindulási 3 ek előtt helyi beadása ATP összesen 14,5 s egy frame rate 2 Hz és az expozíciós idő 200 ms. felhasznált ATP-t, mint eszköz a makrofág aktiváció, mivel ez az a veszély jel megjelent helyileg a gyulladás helyén [8,9], és mivel az ATP ismert, hogy indukálja a citokin szekréciót makrofágok keresztül növekedése [Ca 2 +] i [10-12]. katalógusa ATP (Sigma-Aldrich) és a nikotin (Sigma-Aldrich) helyileg alkalmazott nyomás kiesés két mikropipetták időtartama 200 ms és 10 sec, ill. A helyzet a mikropipetták biztosította, hogy a kilépő mennyiségek hatálya alá tartozó azonos szöveti régióban. A mikropipetták tele voltak 1 mM ATP-t és 100 uM vagy 10 jiM nikotint feloldjuk tartalmazó Krebs-oldattal 1,25 mM probenecidet. Szerint a korábban közzétett kalibrációs görbék, úgy becsüljük, hogy bármely olyan anyag által alkalmazott nyomás ejekciós impulzusokat kell hígítani körülbelül 01:10, amint eléri a szövet [13]. Helyi beadás az ATP és a nikotin megengedett mérése válaszok a több régió (általában 4-5) ugyanabban a szövetben. A tartományok helyzetét a szövetben dokumentálták a koordinátarendszer jelenik meg a mobil mikroszkóp színpadon. A hatás a nikotin ATP által kiváltott kalcium tranziensek ismét vizsgáltuk ugyanabban a régiókban hozzáadása után különféle nAChR antagonisták. A felvétel után a válaszokat, makrofágok tettük láthatóvá létfontosságú inkubálása a szövet allofikocianin (APC) jelzett patkány anti-egér anti-F4 /80 antitestet (1: 250, eBioscience, Frankfurt, Németország), 1 óra, szobahőmérsékleten a sötét és elgázosították a Carbogen. A szövetet mossuk 15 percig. A mikroszkóp színpad helyezni, hogy megtalálják a régiókban, ahol felvett. Képek a jelzett makrofágok szerezte a piros Z-LED P4 (3,5 W) gerjesztő forrás (625 nm domináns hullámhossz, Seoul Semiconductor), és szűrjük kocka F46-006 ET szűrő szett (gerjesztés: ET 620/60, dichroic: 660, emisszió: ET700 /75, AHF Analysentechnik, Tübingen, Németország). Az overlay Fluo-4 jelek és képek F4 /80 pozitív makrofágok lehetővé tette számunkra, hogy elemezze a válaszokat az egyes makrofágok. Katalógusa Az immunhisztokémiai katalógusa címke szöveti rezidens makrofágok, először használta a létfontosságú címkézés az előzőkben ismertetett protokoll. A szövetet ezután fix éjszakán át szobahőmérsékleten olyan oldatban, amely 4% -os formaldehid és 0,2% pikrinsavat tartalmazott 0,1 M foszfát pufferben, majd 3 * 10 perc foszfát pufferben, és végül 1 órán át inkubáltuk egy oldatot, amely 0,5% Triton X- 100, 0,1% NaN 3, 4% lószérum PBS-ben oldott (mind a Sigma-Aldrich). A címke kolinerg varikozitások, a szövetet egy éjszakán át inkubáljuk a blokkoló oldatban tartalmazó kecske anti-vezikuláris acetilkolin transzporter (VAChT; 1: 1000; Merck-Millipore, Darmstadt, Németország). A szöveteket mostuk 3 x 10 percig, PBS-ben, és inkubáltuk 1,5 - 2 óra hosszat a blokkoló oldatban tartalmazó Cy3-jelzett anti-kecske ellenanyaggal (1: 500; Dianova, Hamburg, Németország). A szöveteket mostuk 3 x 10 percig PBS-ben és szerelt anti-fading anyag (20% PBS /NaN 3, 80% glicerin) poli-L-lizinnel bevont csúszdák és lefedtük megtekintésre. címke β2 nAChR szöveti rezidens makrofágok, nyálkahártya-mentes gyomor whole mount készítmények a vad típusú és a p2 nAChR knock-out [14] egereket fixáltuk 10 percig jéghideg PBS-oldattal, amely 4% -os paraformaldehiddel (PFA) . A szöveteket ezután mostuk 2 x 10 percig PBS-ben és 2 órán keresztül inkubáljuk PBS-ben, amely 1% proteáz-mentes Albumin Bovine Fraction V albumin (BSA; Serva, Heidelberg, Németország), és 10% normál szamár-szérum (NDS; Jackson Immuno, Pennsylvania, USA). A szöveteket inkubáltuk 36 óra tartalmazó PBS-sel 1% BSA-t, 5% NDS, patkány anti-egér F4 /80 (1: 500; klón BM8, BioLegend, San Diego, USA) és a nyúl anti-egér β2 nAChR (1: 200; santa Cruz Biotechnology, Heidelberg, Németország). A szöveteket mostuk 3 x 10 percig PBS-ben és 1 órán át inkubáltuk PBS-ben, amely 1% BSA-t, 5% NDS, Alexa Fluor® 647-jelzett kecske anti-patkány antitesttel (1: 1000; Jackson Immuno, Pennsylvania, USA) és Cy3-jelzett szamár anti-nyúl antitesttel (1: 1000; Chemicon, Millipore, Billerica, USA). A szöveteket mostuk 3 x 10 percig PBS-ben és szerelt lassú fading reagens (Invitrogen, Life Technologies, Gent, Belgium) poli-L-lizinnel bevont csúszdák és lefedtük a viewing.To címke α7nAChR szöveti rezidens makrofágok, egy darab egér gyomor és a csípőbél vetettük alá létfontosságú címkézés segítségével Cy5-jelzett α-bungarotoxin (Invitrogen), 0,1 ug /ml RPMI 1640 közegben (Lonza, Basel, Svájc), 4 ° C-on 15 percig [4]. A szöveteket ezután rögzített tartalmazó PBS-ben 4% PFA. A nyálkahártya és a nyálkahártya alatti szövetre eltávolítottuk, és a szöveteket inkubáltuk 2 órán blokkoló oldatban, amely 1% BSA-ban. A szöveteket ezután inkubáltuk 60 órán blokkoló oldatban tartalmazó patkány anti-egér F4 /80 (klón BM8, BioLegend), majd 3 x 10 percig mostuk PBS és 1 órán át inkubáltuk PBS-ben, amely 1% BSA-t és Cy3-jelzett anti-patkány antitesttel (1: 1000; Jackson Immuno, Pennsylvania, USA). Végül a szöveteket mostuk 3 x 10 percig PBS-ben és szerelt lassú fading anyag poli-L-lizinnel bevont csúszdák és lefedtük megtekintésre. a képeket használ LSM 510 (Carl Zeiss) konfokális mikroszkóp Plan-Neofluar x40 /1.3 Olaj DIC és a Plan Apochromat X63 /1.4 Olaj DIC célkitűzéseket. Lézeres hullámhosszai 543 nm-nél és 633 nm-nél használtunk a gerjesztés az fluorofórok Cy3 és APC vagy Cy5, ill. Cy3 és APC vagy Cy5 jelek alkalmazásával detektáltuk a szűrő meghatározza BP 565-615 IR és BP 650-710 IR, ill. képhalmaitól mennyiségi elemzésének segítségével X63 cél beszkennelt XY felbontása 1024 × 1024, amely fedett terület 95,5 × 95,5 um 2. Az első és utolsó optikai szeleteket vettünk a tetején és alján a külső felületének egy makrofág. Az optikai mélység minden szelet volt 900 nm. Két egymást követő szeletek átfedik 500 nm. Általában 9 és 16 között szeleteket keletkezett így a beolvasási mélység 3,2-6,0 um tartalmazó 1-3 makrofágok és VAChT pozitív fonalak keresztezési makrofágok. Képhalmaitól elemeztük Image J Pro. Katalógusa Képek a β2 és α7 nAChR-jelölt makrofágok vettük fel a X63 objektív és szkennelt XY felbontása 1024 × 1024, amely fedett terület 95,5 × 95,5 um 2. Az optikai mélység a képek volt 900 nm-en. blokkolásához akciós potenciál terjedési a neuronokban, tetrodotoxin (Biotrend, Köln, Németország) adtunk a átáramló Krebs oldat 1 um. A farmakológiai jellemzése, a következő nikotinsav-blokkolókat adtunk a Krebs-oldatot átáramló a szövet: 200 uM hexametónium (Sigma-Aldrich), 100 uM mekamilamin (Sigma-Aldrich), 10 uM dihidro-β-erythroidine (DHBE; Sigma-Aldrich) , 100 nM, 3 uM és 10 uM α-bungarotoxin (ABGT; Tocris) és 10 nM és 100 nM metillycaconitint (MLA, Tocris). Hexametónium, mekamilamin és DHBE teszteltünk a koncentrációk, amelyek képesek voltak megszüntetni nikotin gyors serkentő posztszinaptikus potenciálok tengerimalac myentericus neuronok [15] .A használatát 10 nM és 100 nM MLA alapul koncentráció illetve használni, hogy megakadályozza α7 alegységet tartalmazó nAChR [16] és gátlására alkalmazott IL-6 szekréciót izolált peritoneális makrofágok [3]. katalógusa Az adatok elemzése és a statisztikák katalógusa A maximális relatív változása fluoreszcencia (Δ F /F), válaszul a ATP beadás fejeztük% -os növekedést fenti bazális fluoreszcencia előtt ATP beadásra. A statisztikai elemzéseket végeztünk a Sigma Plot 9.0 (Systat Software Inc, Erkrath, Németország). Az adatokat whisker diagramot a medián és a 25 -én és 75 th percentil, valamint a 10 -én és 90 th százalékosztályok. Nem normális eloszlású párosított elemeztük a Wilcoxon tesztet. A különbségeket akkor tekintettük statisztikailag szignifikánsnak P katalógusa < 0.05. N katalógusa számok zárójelben, számokat makrofágok /szövetek tanult, azaz eredményeként felvételek alapján 20 makrofágok 5 szövetekben (egyenlő 5 állat) be (20/5). Katalógusa Eredmények katalógusa térbeli kapcsolata szöveti rezidens makrofágok és kolinerg varikozitások egér gyomor katalógusa Mi használt konfokális mikroszkóppal értékelésére környéke között F4 /80-pozitív makrofágok és VAChT pozitív visszér kolinerg idegrostok az egér gyomor (1A). Részletes elemzés feltárta, hogy 83% -a 41 makrofágok tanulmányozott belül találhatók a 900 nm és legalább egy visszeres kolinerg ideg rost (1B-C). Microejection ATP által kiváltott erős, gyors kialakulását [Ca 2 +] i átmeneti makrofágok érte el a csúcsot 8-10 mp után a kérelmet, majd lassú visszatér a kiindulási [Ca 2 +] i szint (2A és Film S1). Mivel nem volt mindig teljes felépülés a kiindulási értékre a rögzítési periódus alatt, a maximális [Ca 2 +] i jelet az elemzéshez használt összes kísérlet. Nem tachyphylaxiát volt megfigyelhető, mivel a maximális amplitúdó [Ca 2 +] i jel válaszként egy második ATP-adagolás után 10 perccel az első, nem különbözött a kezdeti maximális válasz (2b ábra). hatása nikotin [Ca 2 +] i jeleket szöveti rezidens makrofágok katalógusa hatásának vizsgálatára a nikotin ATP kiváltotta [Ca 2+] i jelek azt microejected nikotin 10 másodpercig, majd azonnal újra alkalmazható ATP rá ugyanabban a régióban. Egy racionális használata a nikotin, mint a szelektív, nem degradált nAChR agonista volt, hogy utánozza nikotin receptor aktiváció acetilkolin felszabadulását származó kolinerg neuronok. Elemezve a változások [Ca 2 +] i minden makrofágok kiderült, hogy a nikotin szignifikánsan csökkentette az ATP által kiváltott [Ca 2 +] i jelek (2D ábra és F). A részletesebb elemzés a hatását a nikotin az ATP által kiváltott [Ca 2 +] i-tranziensek során három populáció makrofágok (2D ábra G). A nikotin a 10 és 100 uM legyengített az ATP-kiváltotta [Ca 2 +] i jeleket 55% és 65% a makrofágok, ill. A [Ca 2 +] i jel változatlan maradt 36% és 28% a makrofágok alkalmazását követően 10 jiM és 100 jiM nikotin, ill. Egy kis részét, 10 nM és 100 nM nikotin fokozta az ATP-vel kiváltott [Ca 2 +] i válasz (9%, illetve 7% makrofágok -kal). Katalógusa Hogy ne torzítás további elemzés alapjául nikotin hatásai az összes makrofágok független attól, hogy az ATP által kiváltott [Ca 2 +] i jel csökkent, nőtt vagy nem változott. katalógusa szerepe neuronok a nikotinos kiváltott csillapítása makrofág aktiváció katalógusa a nikotin közvetlenül aktiválja enterális neuronok és megvizsgáltuk annak lehetőségét, hogy aktiválását közeli myenterikus neuronok hozzájárult a legyengített [Ca 2 +] i válaszok makrofágok. Nem találtunk semmilyen bizonyítékot az ilyen közvetett gátló út, mert a csillapítás az ATP-vel kiváltott [Ca 2 +] i jel nikotin maradt jelenlétében tetrodotoxin (2C ábra). Érdemes megjegyezni azonban, hogy azoknak az aránya, makrofágok, ahol a nikotin nem változtatta meg az ATP által kiváltott [Ca 2 +] i jeleket drasztikusan csökkent (28% vs 6%). Ugyanakkor, a makrofágok, amelyek a nikotin gátolja vagy potencírozza az ATP kiváltotta [Ca 2 +] i jeleket nőtt 65% -ról 71% és 7% -ról 23% -ra. a makrofágok aktiválása által ATP és a gátlás az ATP válasz 100 jiM nikotin megbízhatóan rögzítve mind a 21 készítmények ábrán 2F. Ez lehetővé tette számunkra, hogy végre antagonisták tanulmányok szükségessége nélkül restudy gátló válasz azokban makrofágok kezelt antagonisták. Sőt, ezzel csökkentette a felvétel időszakokat olyan szintre, amely nem veszélyeztetheti a jelerősséget és a garantált reprodukálható ATP válaszokat. Annak érdekében, hogy tanulmányozzuk a nAChR-alegységek részt vesz a gátló hatása a nikotin, teszteltük öt különböző blokkolók ismerten alegység preferenciák [17] (3. ábra). A gátló hatást a nikotin ATP-kiváltotta [Ca 2 +] i válaszok nem változott a jelenléte a nem-szelektív ganglion nAChR antagonista hexametónium a α3β4 nAChR-preferáló antagonista mekamilamin vagy α7 nAChR-preferáló antagonisták α-bungarotoxin és metillycaconitint (3A ábra). Azonban a β2 nAChR-preferáló antagonista di-hidro-β-eryhtroidine megfordította a gátló hatása nikotin ATP-kiváltotta [Ca 2 +] i válaszok makrofágok (3B ábra). Bár használt ABGT olyan koncentrációkban, amelyek leírták, hogy megbízhatóan megakadályozza α7 nAChR a neuronokban és izolált alveoláris makrofágok [18], voltunk az érintett, hogy esetleg nem lesz képes, hogy antagonizálják a gátló hatása nikotin miatt kedvezőtlen verseny a kötőhely. Azonban ez nem tűnik valószínűnek, mert még koncentrációban 3 uM és 10 uM ABGT nem volt képes visszafordítani a gátló hatása a nikotin ATP kiváltotta [Ca 2 +] i válaszok (3A ábra). ABGT egyáltalán nem is fordított a csillapítás által kiváltott 10 nM nikotin (3C, ábra). Címkézése β2 de nem a7 nAChR szöveti rezidens makrofágok katalógusa A további bizonyítékot arra, hogy vonják β2 nAChR de nem α7 nAChR gátló hatása a nikotin ATP kiváltotta [Ca 2 +] i válaszok immunhisztokémiai a p2 nAChR és létfontosságú címkézése α7 nAChR által ABGT rezidens makrofágok gyomor muscularis végeztünk (4. ábra). A legtöbb rezidens makrofágok gyomor muscularis arra p2 nAChR-immunreaktív (4A) támogatja a megfigyelt antagonista hatását DHBE nikotinos gátlása ATP válaszokat. Az alkalmazott antitest p2 nAChR konkrét hiánya miatt a p2 nAChR immunreaktivitás a β2 nAChR knockout egér (4B ábra). Katalógusa Vital címkézése α7 nAChR által ABGT kiderült hiányában α7 nAChR szöveti rezidens makrofágok az egér gyomor (4C), ezzel szemben, az intesztinális makrofágokat jelöltük ABGT (ábra 4d). A hiányzó α7 nAChR gyomor muscularis rezidens makrofágok megerősítette, hogy nincs antagonizmusa α7 nAChR-preferáló blokkolók ABGT és az MLA a gátló hatása a nikotin ATP kiváltotta [Ca 2 +] i válaszok ezekben a sejtekben. Discussion a dátum, a hatás a nikotin vizsgálták csak az izolált makrofágokban vagy makrofág sejtvonalakban. Itt az általunk kifejlesztett egy in vitro katalógusa modellje egér zúzógyomrukat-plexus myentericus készítmény hatásának vizsgálatára a nikotin szöveti makrofágok rezidens azok természetes környezetben. Ez a jelen tanulmány tehát az első, hogy azt mutatják, hogy a nikotin közvetlenül gátolja aktiválását szöveti rezidens makrofágok keresztül β2 alegységet tartalmazó nAChR, és ezáltal biztosítja az alapot a funkcionális jelátviteli között kolinerg neuronok és makrofágok a bélben. A következtetést támasztja alá több sornyi bizonyítékok. Először is, az ATP által kiváltott [Ca 2 +] i tranziensek makrofágok jelentősen csökken a nikotin jelenlétében is az ideg-blokkoló tetrodotoxin. Másodszor, a nikotin által indukált csillapítás ATP válaszok makrofágok megfordult DHBE, de nem hexametónium, mekamilamin, ABGT vagy MLA. A farmakológiai eredmények alátámasztották demonstrációja β2-positiv de ABGT-negatív nAChR alegységek a gyomor makrofágok. Harmadszor, a legtöbb makrofágok közvetlen szomszédságában visszeres kolinerg idegrostok. Hasonló közelsége makrofágok idegrostok volt megfigyelhető a patkány intesztinális muscularis [3]. kritérium meghatározására használt közelsége között makrofágok és kolinerg ideg rostok (a 900 nm-távolság) egyetért a koncepció extraszinaptikus kommunikáció . E koncepció szerint a diffúzió kötet átviteli előfordulhatnak 100 nm-um közötti távolság a forrás és a cél [19]. Feltételezzük, hogy a legtöbb, ha nem az összes, kolinerg idegek közvetlen szomszédságában makrofágok származott myenterikus idegsejt szervek alapján a korábbi megfigyelés, hogy a vagus rostok ne forduljon bél rezidens makrofágok [3], Ezt támasztja alá az is megállapítást, hogy a gyomor vagus efferens rostokat szinte kizárólag végződnek enterális ganglionokban [20], ahol aktiválják a legtöbb myentericus neuronok keresztül nikotinos receptorok [15]. A CAIP jelent élettani rendszer ellenőrzésére makrofág aktiváció során gyulladásos állapotok. A gyulladásgátló hatás CAIP aktiválás Kimutatták in vivo Ennek ellenére azt választhatják a meglehetősen konzervatív értelmezése adataink arra következtet, hogy β2 nAChR kritikusan részt nikotin gátolja a makrofágok aktivitását, bár valószínű, hogy a használt koncentrációjú vizsgálatunkban DHBE előnyösen blokkok α4β2 nAChR. A készítmény kiválóan alkalmas, hogy foglalkozzon a jövőbeli vizsgálatokban a lehetséges hozzájárulását α7β2 nAChR által gyakorolt hatását vizsgálták, nikotin szöveti rezidens makrofágok α7 nAChR, p2 nAChR és α7β2 nAChR dupla knock-out egerekben. Hasonló stratégiákat kell használni, hogy tanulmányozza a jelentősége, α4β2 nAChR. Katalógusa Fontos megjegyezni, hogy az antagonista hatása DHBE nem szelektív makrofágok DHBE, mint hexameto és mekamilamint is blokkolja nikotinos szinapszisok gyomor- myenterikus neuronok [15]. Mindazonáltal, a nikotinos receptorok makrofágok kell rendelkeznie, különböző tulajdonságú, mint az enterikus neuronok, mivel sem hexametónium sem mekamilamin megfordította a nikotin által indukált csillapítás az ATP-kiváltotta válaszokat a makrofágok. Hexameto és mekamilamin fejtik ki intézkedései eltömődés a pórusok a nikotinos csatorna [23-25]. Hogy képtelenek megfordítani a nikotin gátolja a makrofágok feltételezik az atipikus nAChR szaporodását. Valóban, a rögzítés Ca 2+ tranziensek válaszul nikotin alkalmazás mellett végzett megnövelt [Ca 2 +] I csak 13% makrofágok (6 a 45 makrofágok; az adatokat nem mutatjuk). Ez a populáció sokkal kisebb, hogy az arány a makrofágok, amelyek a nikotin modulált az ATP által kiváltott [Ca 2 +] i. Sok bizonyíték azt sugallja, hogy α7 nAChR döntő szerepet játszik a nikotin által indukált csökkenését makrofág citokin termelés [2,3,6,26]. Korábban azt valóban kimutatták, hogy a nikotin nem csökkentette a TNF-α termelés peritoneális makrofágokban a α7 nAChR knockout egerekben [6], mivel a gyulladáscsökkentő hatás a vékonybélben a vagus ideg stimuláció a modellben a posztoperatív ileus elvész ezekben KO egerek [4]. A jelen tanulmányban azonban a nikotin hatásának ATP-indukálta makrofág aktiváció nem blokkolja a α7 nAChR preferáló blokkolók ABGT és MLA ellen érvel bevonásával α7 nikotinos acetilkolin receptorok. Ezt támasztja alá az a címkézés hiánya a gyomor muscularis makrofágok α7 nAChR-preferáló α-bungarotoxin. A bélben, azonban tettük megfigyelni α-bungarotoxin pozitív jelölt muscularis makrofágok [4, és ez a tanulmány], jelezve a régió-specifikus különbségek a fenotípus ezen immunsejtek. Bár a nyilvánvaló hiánya ABGT érzékeny α7 nAChR vizsgálatunkban tűnik ellentmondásosnak a korábban látottakhoz, mi eléggé abban, hogy ezek az adatok nem miatt képtelenek a ABGT versenyezni a kötőhely azonos koncentrációban alkalmazott vizsgálatunkban blokkok neuronális α7 nAChR az agyban és a elszigetelt alveoláris makrofágok [18].
támasztható alá gátlása a makrofág aktiválást nikotin ami arra utal, funkcionális jelátviteli között kolinerg neuronok és makrofágok a gyomorban. Az adatok arra utalnak, hogy a β2 alegységének nAChR kritikusan részt vesz a nikotin által kiváltott gátlás ilyen rezidens makrofágok. Katalógusa
Kalcium képalkotó
Konfokális mikroszkópia és képanalízis
Pharmacology
reprodukálhatósága ATP kiváltotta [Ca 2 +] i jeleket szöveti rezidens makrofágok katalógusa
farmakológiai jellemzése gátló hatásának nikotin szöveti rezidens makrofágok
által bolygóideg-stimuláció egér modellekben a szepszis és a posztoperatív ileus [2,3] és a in vitro
nikotin beadás izolált lipopoliszacharidot stimulált makrofágok [1-4,21]. A jelen vizsgálatban azt találtuk, hogy a nikotin csökkenti az ATP által kiváltott növekedés a sejten belüli Ca 2+ a rezidens makrofágok a gyomorban. Érdekes, hogy ez a hatás megfordul a β2 nAChR alegység preferáló antagonista DHBE ami arra utal, bevonása ennek alegység a nikotin-mediált moduláció a rezidens makrofágok. Ez a megfigyelés összhangban van a korábbi megállapítást, hogy DHBE fordított nikotin által indukált gátlását a tumor nekrózis faktor-α (TNF-α) kiadás és a megnövekedett fagocitózis izolált peritoneális makrofágok [6]. A vonal, citokin termelését humán neuroblasztóma sejtvonal stabilan transzfektálva α4β2 nAChR jelentősen csökken a nikotin előkezelés [22]. Bár ezek az adatok arra utalnak, hogy α4β2 nAChR közvetítheti a hatását a nikotin az ATP által kiváltott növekedés a sejten belüli Ca 2+, újabb bizonyítékok azt mutatják, hogy β2 alegységek is össze más α alegységek, beleértve α7 alegységek. Egy nemrégiben publikáció tárgyalja a elektrofiziológiai tulajdonságai α7β2 nAChR kifejezett humán epiteliális sejtvonal, azt mutatta, hogy alacsony koncentrációjú DHBE antagonizálta α7β2 nAChR de nem a7 nAChR receptor [16]. Ezek és más adatokat a farmakológiai profilját DHBE azt sugallják, hogy DHBE egy rendkívül szelektív antagonista p2 nAChR de nem megbízhatóan megkülönböztetést különböző részegységek, α3, α4 vagy α7 a β2. Azonban a immunhisztokémiai és létfontosságú címkézése gyomor rezidens makrofágok nem kedvez bevonásával α7 nAChR mert gyomor- makrofágok nem jelöltük ABGT de kifejezte a β2 nAChR alegység.
 A bélbaktériumok előre jelezhetik a pulmonális hipertónia kockázatát
A bélbaktériumok előre jelezhetik a pulmonális hipertónia kockázatát
 A 6,5 milliárd dolláros PPI műhiba rejtély
A 6,5 milliárd dolláros PPI műhiba rejtély
 Mikor kell aggódnom, hogy vér van a székletemben?
Mikor kell aggódnom, hogy vér van a székletemben?
 Akut mezenterialis lymphadenitis – Az akut has diagnózisa
Akut mezenterialis lymphadenitis – Az akut has diagnózisa
 Befolyásolhatja-e az emésztőrendszere a test többi részét?
Befolyásolhatja-e az emésztőrendszere a test többi részét?
 Gyorsabban túljutni a megfázáson mikrobióma erejével
Gyorsabban túljutni a megfázáson mikrobióma erejével
 Az IBS értelmezése a reggeli televízión
Április az IBS tudatosság hónapja! Elmentem a reggeli televízióban, hogy megvitassam az IBS megértését, konkrétan az IBS és a FODMAP mítoszainak lerombolását! Pontosabban azok a mítoszok, amelyeket gy
Az IBS értelmezése a reggeli televízión
Április az IBS tudatosság hónapja! Elmentem a reggeli televízióban, hogy megvitassam az IBS megértését, konkrétan az IBS és a FODMAP mítoszainak lerombolását! Pontosabban azok a mítoszok, amelyeket gy
 A speciális szénhidrát diétát 124 éves kutatás és tesztelés támogatja
Az 1900-as évek elején a kutatók lázasan dolgoztak azon, hogy megértsék a zsírok, fehérjék és szénhidrátok szerepét a cöliákiás betegekben. Eleinte az volt az elmélet, hogy a fehérje a probléma; akko
A speciális szénhidrát diétát 124 éves kutatás és tesztelés támogatja
Az 1900-as évek elején a kutatók lázasan dolgoztak azon, hogy megértsék a zsírok, fehérjék és szénhidrátok szerepét a cöliákiás betegekben. Eleinte az volt az elmélet, hogy a fehérje a probléma; akko
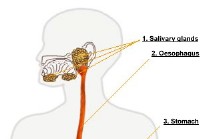 Az étel megemésztése
Az emésztőrendszer az a hely, ahol a szervezet az elfogyasztott táplálékot tápanyagokká bontja, amelyek felszívódhatnak a szervezetben. Az emésztőrendszer üreges szervek sorozata, amelyek folyamatos
Az étel megemésztése
Az emésztőrendszer az a hely, ahol a szervezet az elfogyasztott táplálékot tápanyagokká bontja, amelyek felszívódhatnak a szervezetben. Az emésztőrendszer üreges szervek sorozata, amelyek folyamatos