Però, la tolleranza dell'ospite all'infezione da agenti patogeni non è ugualmente sviluppata in tutti gli organismi. Per esempio, è noto che il microbioma intestinale dei topi protegge più efficacemente dall'infezione con determinati agenti patogeni, come il batterio Salmonella typhimurium, rispetto al microbioma intestinale umano.
Ciò solleva l'interessante possibilità che l'analisi delle differenze tra le interazioni ospite-microbioma nell'uomo e in altre specie, come i topi, e individuare i singoli tipi di batteri che proteggono o sensibilizzano contro determinati agenti patogeni, potrebbe portare a tipi completamente nuovi di approcci terapeutici.
Però, mentre la composizione del microbioma intestinale e il suo effetto sulle risposte immunitarie dell'ospite sono stati ben studiati nei topi, non è possibile studiare come il microbioma interagisce direttamente con le cellule epiteliali che rivestono l'intestino in condizioni altamente definite, e quindi scoprire ceppi batterici specifici che possono indurre tolleranza dell'ospite a patogeni infettivi.
Ora, un team collaborativo guidato dal direttore fondatore di Wyss Donald Ingber, M.D., dottorato di ricerca al Wyss Institute for Biologically Inspired Engineering di Harvard e Dennis Kasper, M.D. presso la Harvard Medical School (HMS) ha sfruttato la tecnologia microfluidica Organs-on-Chip (Organ Chip) di Wyss per modellare le diverse sezioni anatomiche dell'intestino del topo e la loro simbiosi con un complesso microbioma vivente in vitro.
I ricercatori hanno ricapitolato gli effetti distruttivi di S. typhimurium sulla superficie epiteliale intestinale in un Colon Chip di topo ingegnerizzato, e in un'analisi comparativa dei microbiomi murini e umani sono stati in grado di confermare che il batterio commensale Enterococcus faecium contribuisce alla tolleranza dell'ospite all'infezione da S. typhimurium. Lo studio è pubblicato su Frontiere nella microbiologia cellulare e delle infezioni .
Il progetto è stato avviato nell'ambito di un progetto "Technologies for Host Resilience" (THoR) supportato dalla DARPA presso il Wyss Institute, il cui obiettivo era scoprire contributi chiave alla tolleranza alle infezioni studiando le differenze osservate in alcune specie animali e nell'uomo. Usando un Colon Chip umano, Il gruppo di Ingber aveva mostrato in uno studio precedente come i metaboliti prodotti da microbi derivati da feci umane e di topo hanno un potenziale diverso di influenzare la suscettibilità all'infezione con un patogeno enteroemorragico E. coli.
La ricerca biomedica dipende fortemente da modelli animali come topi, che senza dubbio hanno enormi vantaggi, ma non forniscono l'opportunità di studiare i processi normali e patologici all'interno di un particolare organo, come l'intestino, primo piano e in tempo reale. Questo importante studio di prova del concetto con il gruppo di Dennis Kasper evidenzia che la nostra piattaforma Intestine Chip di topo ingegnerizzata offre esattamente questa capacità e offre la possibilità di studiare le interazioni ospite-microbioma con microbiomi di specie diverse in condizioni altamente controllabili in vitro ."
Donald Ingber, M.D, dottorato di ricerca, Direttore Fondatore, Wyss Institute for Biologically Inspired Engineering ad Harvard
"Dato il profondo livello di caratterizzazione dell'immunologia del topo, questa capacità potrebbe aiutare notevolmente a far progredire il lavoro dei ricercatori che attualmente utilizzano questi animali per fare ricerche sul microbioma e sulle risposte dell'ospite. Consente loro di confrontare i risultati ottenuti direttamente con i chip dell'intestino umano in futuro in modo che l'attenzione possa concentrarsi sull'identificazione delle caratteristiche della risposta dell'ospite che sono più rilevanti per gli esseri umani." Ingber è anche Judah Folkman Professor of Vascular Biology presso HMS e Ospedale pediatrico di Boston, e Professore di Bioingegneria presso la Harvard John A. Paulson School of Engineering and Applied Sciences.
Nel loro nuovo studio, il team si è concentrato sul tratto intestinale del topo. "Tradizionalmente è stato estremamente difficile modellare le interazioni ospite-microbioma al di fuori di qualsiasi organismo poiché molti batteri sono strettamente anaerobici e muoiono in normali condizioni di ossigeno atmosferico. La tecnologia Organ Chip può ricreare queste condizioni, ed è molto più facile ottenere cellule intestinali e immunitarie primarie dai topi che dover fare affidamento su biopsie umane, " ha detto la prima autrice Francesca Gazzaniga, dottorato di ricerca, un borsista post-dottorato che lavora tra i gruppi di Ingber e Kasper e ha guidato il progetto.
Gazzaniga e i suoi colleghi hanno isolato cripte intestinali da diverse regioni del tratto intestinale del topo, compreso il duodeno, digiuno, ileo, e colon, hanno portato le loro cellule attraverso una fase intermedia "organoide" in coltura in cui si formano e crescono piccoli frammenti di tessuto, che hanno poi seminato in uno dei due canali paralleli microfluidicamente perfusi dei chip d'organo di Wyss per creare chip intestinali specifici della regione.
Il secondo canale perfuso indipendentemente imita la vascolarizzazione del sangue, ed è separato dal primo da una membrana porosa che permette lo scambio di nutrienti, metaboliti, e molecole secrete che le cellule epiteliali intestinali utilizzano per comunicare con le cellule vascolari e immunitarie.
Il team ha poi perfezionato lo S. typhimurium come agente patogeno. Primo, hanno introdotto l'agente patogeno nel lume epiteliale del Colon Chip di topo ingegnerizzato e hanno ricapitolato le caratteristiche chiave associate alla rottura dell'integrità del tessuto intestinale note dagli studi sui topi, compresa la rottura delle aderenze normalmente strette tra le cellule epiteliali vicine, diminuzione della produzione di muco, un picco nella secrezione di una chemochina infiammatoria chiave (l'omologo del topo dell'IL-8 umana), e cambiamenti nell'espressione genica epiteliale. In parallelo, hanno dimostrato che il Colon Chip di topo supporta la crescita e la vitalità di complessi consorzi batterici normalmente presenti nei microbiomi intestinali di topi e umani.
Mettendo insieme queste capacità, i ricercatori hanno confrontato gli effetti di specifici consorzi di topi e microbi umani che erano stati precedentemente mantenuti stabilmente nell'intestino di topi "gnotobiotici" alloggiati in condizioni prive di germi dal team di Kasper. Raccogliendo microbiomi complessi dalle feci di quei topi, e poi inoculandoli nei Colon Chips, i ricercatori hanno osservato la variabilità da chip a chip nella composizione del consorzio, che ha permesso loro di mettere in relazione la composizione microbica con gli effetti funzionali sull'epitelio ospite.
"L'utilizzo del sequenziamento 16s ci ha dato un buon senso delle composizioni microbiche dei due consorzi, e un numero elevato di una singola specie, Enterococcus faecium, generato da uno solo di loro nel Colon Chip, ha permesso al tessuto intestinale di tollerare meglio l'infezione, "ha detto Gazzaniga. "Questo ha piacevolmente confermato i risultati del passato e ha convalidato il nostro approccio come una nuova piattaforma di scoperta che ora possiamo utilizzare per studiare i meccanismi che sono alla base di questi effetti, nonché il contributo dei contributi vitali delle cellule immunitarie alla tolleranza dell'ospite, così come i processi infettivi che coinvolgono altri agenti patogeni."
"La tecnologia dell'intestino di topo su un chip fornisce un approccio unico per comprendere la relazione tra il microbiota intestinale, immunità dell'ospite, e un microbico patogeno. Questa importante interrelazione è difficile da studiare nell'animale vivente perché ci sono così tanti fattori incontrollabili.
La bellezza di questo sistema è che essenzialmente tutti i parametri che si desidera studiare sono controllabili e possono essere facilmente monitorati. Questo sistema è un utile passo avanti, " disse Kasper, che è il William Ellery Channing Professor di Medicina e Professore di Immunologia presso HMS.
I ricercatori ritengono che il loro approccio comparativo in vitro potrebbe scoprire interazioni specifiche tra agenti patogeni e batteri commensali con cellule epiteliali e immunitarie intestinali, e che i batteri che migliorano la tolleranza identificati potrebbero essere utilizzati nelle terapie future, che possono aggirare il problema aumentando la resistenza antimicrobica dei ceppi batterici patogeni.
 Cosa sono i leganti le tossine? (E 5 motivi per cui potresti averne bisogno)
Cosa sono i leganti le tossine? (E 5 motivi per cui potresti averne bisogno)
 Trigger e prevenzione dell'IBS (sindrome dell'intestino irritabile)
Trigger e prevenzione dell'IBS (sindrome dell'intestino irritabile)
 Cause di sanguinamento da varici esofagee
Cause di sanguinamento da varici esofagee
 Che cos'è la rettopessi a resezione laparoscopica e aperta?
Che cos'è la rettopessi a resezione laparoscopica e aperta?
 La tua guida alla differenza tra alimenti fermentati e probiotici
La tua guida alla differenza tra alimenti fermentati e probiotici
 Microbiota Mondays Episodio 1
Microbiota Mondays Episodio 1
 Cosa sono gli ossalati? (Cibi da mangiare o non mangiare per la salute)
Gli antinutrienti sono composti subdoli che rubano attivamente i nutrienti dal tuo corpo quando li mangi. Gli antinutrienti includono cose come lectine, fitati e ossalati (di cosa parleremo oggi). L
Cosa sono gli ossalati? (Cibi da mangiare o non mangiare per la salute)
Gli antinutrienti sono composti subdoli che rubano attivamente i nutrienti dal tuo corpo quando li mangi. Gli antinutrienti includono cose come lectine, fitati e ossalati (di cosa parleremo oggi). L
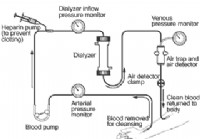 Trattamento emodialitico per insufficienza renale
Trattamento di emodialisi per il centro per linsufficienza renale Fai il test sulle malattie renali Immagini della presentazione dei calcoli renali Immagini di presentazione di alta pressione sanguign
Trattamento emodialitico per insufficienza renale
Trattamento di emodialisi per il centro per linsufficienza renale Fai il test sulle malattie renali Immagini della presentazione dei calcoli renali Immagini di presentazione di alta pressione sanguign
 Allergie legate a un maggiore consumo di cibo spazzatura,
suggerisce un nuovo studio Molte allergie alimentari infantili potrebbero essere dovute al consumo di cibo spazzatura, secondo un nuovo studio. Bambini con allergie alimentari, e bambini che mangiano
Allergie legate a un maggiore consumo di cibo spazzatura,
suggerisce un nuovo studio Molte allergie alimentari infantili potrebbero essere dovute al consumo di cibo spazzatura, secondo un nuovo studio. Bambini con allergie alimentari, e bambini che mangiano