LIM homeodomein transcriptiefactor Isl1 regisseert normale pyloric ontwikkeling door zich te richten GATA3
Abstracte achtergrond
Afwijkingen in pyloric ontwikkeling of in contractiele functie van de pylorus oorzaak reflux van de twaalfvingerige darm inhoud in de maag en het risico van maag- metaplasie en kanker. Afwijkingen van de pyloric regio zijn ook gekoppeld aan aangeboren afwijkingen, zoals het relatief vaak voor bij pasgeborenen hypertrofische pylorusstenose, en primaire duodenogastrische reflux. Daarom is het begrijpen van pyloric ontwikkeling is van grote klinische relevantie. Hier hebben we de rol van de LIM homeodomein transcriptiefactor Isl1 in pyloric ontwikkeling.
Resultaten
Onderzoek van Isl1 meningsuiting in het ontwikkelen van maag muis door immunohistochemie, ganse berg in situ
hybridisatie en real-time kwantitatieve PCR aangetoond dat Isl1 wordt sterk tot expressie gebracht in maag- muis, voornamelijk in de gladde spierlaag van de pylorus. Isl1 expressie werd onderzocht met immunofluorescentie in menselijke hypertrofe pylorusstenose waar de meeste gladde spiercellen bleken Isl1 drukken. Isl1
functie in de embryonale ontwikkeling van de maag werd onderzocht met behulp van een tamoxifen-induceerbare Isl1
knockout muismodel. Isl1
tekort leidde tot bijna volledige afwezigheid van de pyloric buitenste longitudinale spierlaag op embryonale dag 18,5, wat in overeenstemming is met GATA3
null muis fenotype. Chromatine immunoprecipitatie, luciferase assays en elektroforetische mobiliteit shift assays bleek dat Isl1 zorgt normale pyloric ontwikkeling door direct gericht GATA3
.
Conclusies Inloggen Deze studie toont aan dat de Isl1-GATA3
transcriptie regulerende as is essentieel voor normale pyloric ontwikkeling. Deze bevindingen zijn zeer klinisch relevant en kan helpen om beter te begrijpen routes die leiden tot pyloric ziekte.
Trefwoorden
α-gladde spier actine GATA3 Isl1 pylorus Achtergrond
gewervelde darm is een opmerkelijke structuur die opneemt en verteert voedsel, absorbeert voedingsstoffen, en verwijdert afvalstoffen. De darm komt uit een eenvoudige buisvormige structuur bestaande uit drie kiemlagen waaronder een onderliggende endoderm, een omringende splanchnische mesoderm en ectoderm een [1-3]. In muizenembryo's, wordt de darm patroon langs de anterior-posterior, rug-buik, links-rechts, en radiale assen. De darm buis bestaat uit de voordarm, middendarm en einddarm langs de anterior-posterior as [4, 5]. Naarmate de ontwikkeling vordert, voordarm leidt tot de slokdarm, maag, lever, longen en pancreas. De middendarm vormt de dunne darm en de dikke darm ontwikkelt tot de dikke darm [1, 5-8]. Ondernemingen De maag wordt afgeleid van de achterste voordarm. De maag morfologisch opzichte van de buis om voordarm embryonale dag 9,5 (E9.5) en de uitbreiding van de pre-gastrische mesenchym maakt het domein van de maag zichtbaar begin ten E10.5 [9]. Mesenchymale cellen van de maag differentiëren in vier verschillende concentrische lagen, waaronder lamina propria, muscularis mucosae en circulaire en longitudinale gladde spier in verschillende stadia van embryonale ontwikkeling [10]. Bij E11.5, de maag is duidelijk vergroot. De maag gladde spieren onderscheidt op E13 en is uitdrukkelijk laag α-gladde spier actine (α-SMA) -positieve cellen verschijnen en een cirkelvormige spierlaag vormen gehele maag [11]. De gladde spierlaag dikker in het vernauwde toekomstige pylorische sfincter gebied rond E14.5 [2, 9]. Bij E18.5, de pylorische sfincter begint te werken bij het voorkomen van het terugstromen van duodenale inhoud in de maag [9]. Ondernemingen De achterste gedeelte of pylorus van de maag is de anatomische overgang tussen de maag en de twaalfvingerige darm. Aan het uiteinde van de pylorus, kunnen de verschillende valvulaire flappen van de pylorische sfincter zichtbaar [2]. Onder normale fysiologische omstandigheden, de maag afhangt van de peristaltische contractie te slijpen en duwen de gedeeltelijk verteerd voedsel en de pylorus vertrouwt op zijn verdikte pylorische sfincter om de stroming van voedsel regelen in de dunne darm. Afwijkingen in pylorische ontwikkeling of in de contractiele functie van de pylorus veroorzaken reflux van maag- inhoud in de maag en het risico van maag- metaplasie en kanker [12, 13]. Afwijkingen van de pylorus zijn aan aangeboren afwijkingen [14-16]. Daarom is veel aandacht besteed aan de regulerende elementen en routes van maag ontwikkeling, met name pylorus en pylorus sfincter ontwikkeling.
Vorige gegevens kuiken gesuggereerd dat bot morfogenetisch eiwit (BMP) signalering regelt mesenchymale expressie van Nkx2.5
en SOX9
, die het karakter van de pylorus epitheel beïnvloedt, maar heeft geen effect op pylorische gladde spiercellen [5, 17], hetgeen suggereert dat mesenchymale signalering door onbekende factoren beïnvloedt de pylorus epitheliaal fenotype. In de muis worden moleculaire mechanismen van vorming pyloric weinig begrepen, met relatief weinig van de factoren die nodig zijn voor de normale ontwikkeling pylorus te zijn geïdentificeerd. Degenen die zijn voorzien van SOX9
[17], Six2
[9], Bapx1
[18], Nkx2.5
[3, 17], Gremlin
[9], en GATA3
[19, 20]. Ablatie van het homeodomein transcriptiefactor Six2
, uitgedrukt in posterior maag, verstoort verdikking van de pylorische gladde spierlaag en verzwakt vernauwing van de pylorus sluitspier. Bovendien, het verlies van Six2
elimineert SOX9
meningsuiting, en vermindert Nkx2.5 Kopen en Gremlin
meningsuiting in de pylorus, hoewel deze uitdrukking later herstelt [9], wat suggereert dat Six2
, SOX9
, Nkx2.5
en Gremlin
nodig zijn voor pyloric ontwikkeling. Daarnaast Nkx2.5
, SOX9
en GATA3 Wat zijn co-expressie gebracht in de dorsale pyloric buitenste longitudinale spier (OLM) laag die rijpt tussen E14.5 en E16.5. Na verwijdering van Nkx2.5 golfreizen of GATA3
, de dorsale pyloric OLM is vrijwel afwezig en vernauwing van de pylorus sluitspier wordt verzwakt [20]. Ondernemingen De LIM homeodomein (LIM-HD) transcriptiefactor Isl1 was oorspronkelijk In totaal hebben gefunctioneerd als insulinegen versterker bindend eiwit [21]. Isl1 bestaat uit twee tandem LIM domeinen en een homeodomein. Het homeodomein, met een helix-draai-helix structuur, bindt aan regulerende DNA sequenties van doelgenen, terwijl de LIM domeinen voornamelijk betrokken bij eiwit-eiwit interacties die de activiteit van de LIM-HD [22] te reguleren. Isl1 cruciale rol speelt in cel bepalen, proliferatie en differentiatie van het zenuwstelsel [23, 24], hart [25] en hypofyse [26]. Daarnaast is Isl1 expressie gedetecteerd in de maag mesenchym [27, 28] en gastrointestinale epitheel in zowel embryonale en volwassen muizen [29]. De rol van Isl1 in de maag ontwikkeling moet nog worden onderzocht. In de huidige studie onderzochten we Isl1 expressie in de maag. Isl1 was sterk tot uiting in de maag achterste in de vroege stadia van ontwikkeling en is voornamelijk beperkt tot de gladde spiercellen van de pylorus. Om Isl1
functie in de maag ontwikkeling te onderzoeken, hebben we gebruik gemaakt van een tamoxifen-induceerbare knockout muismodel. Een induceerbare model was nodig omdat Isl1 - /-
mutanten sterven op ongeveer E10.5 als gevolg van defecten in het hart formatie. Onze resultaten tonen aan dat Isl1 is van vitaal belang voor de vorming van de pyloric OLM laag tijdens maag organogenese.
Resultaten
Isl1 wordt uitgedrukt in de maag embryonale muis
We onderzochten Isl1
mRNA niveaus in de maag embryonale muis door real time kwantitatieve PCR (RT-qPCR) en de ganse berg in situ
hybridisatie (WISH). Isl1
mRNA werd aanvankelijk gedetecteerd bij E11.5 door RT-qPCR. Isl1
bereikte het hoogste niveau in E13.5, gevolgd door een scherpe daling op E14.5, en had geen significante veranderingen in de volwassenheid (Extra file 1: Figuur S1a). Dit resultaat was vergelijkbaar met een eerder rapport [29]. De lokalisatie van Isl1
mRNA expressie werd onderzocht met behulp van WISH. We voerden Isl1
WISH in embryonale maag E11.5, E13.5 en E14.5. Bij E11.5, werd Isl1
gelokaliseerd in de achterste helft van de maag (Extra file 1: Figuur S1b). Echter, de Isl1
WISH signaal was veel sterker en gecondenseerd in de pylorus door E13.5 (figuur 1A). Zoals maag ontwikkeling vorderde, de pylorus bleef Isl1
en expressie van Isl1
uitgebreid tot de potentiële pyloric sluitspier bij E14.5 (Extra file 1: Figuur S1b) uit te drukken. Echter, de Isl1
WISH signaal verzwakt aanzienlijk van E13.5 naar E14.5. Deze Isl1
WISH resultaten eens met Isl1
RT-qPCR resultaten. Figuur 1 Isl1 uitgedrukt in maag- muis. (A) embryonale maag WISH analyse toonde aan dat Isl1
expressie beperkt tot de pylorus bij E13.5 (pijl). (B) Immunohistochemische kleuring voor Isl1 in de maag. Secties van embryo's werden gerangschikt in rostraal van caudale sequentie bij E11.5 en E13.5, en Isl1 expressie werd voornamelijk gelokaliseerd in het mesenchym van de maag achterste. Bij E14.5 en E18.5, werd Isl1 sterk tot expressie gebracht in gladde spiercellen van de pylorus, hoewel er enkele Isl1-positieve cellen in de lamina propria (pijlpunten). Vergrote afbeeldingen in omkaderde gebieden zijn hieronder weergegeven originele afbeeldingen. D, twaalfvingerige darm; Liv, lever; Pa, pancreas; St, maag. Schaal bars van de originele beelden: 100 pm; schaalbalken vergrote afbeeldingen:. 50 pm
We vervolgens beoordeeld Isl1 eiwit expressie door immunohistochemie. Resultaten toonden dat Isl1 voornamelijk gelokaliseerd aan de maag achterste mesenchym van E11.5 tot E13.5, waarna Isl1 expressie gebracht in gladde spiercellen van de pylorus (Figuur 1B en aanvullende bestandsinformatie 1: Figuur S1c) en was ook detecteerbaar in de lamina propria (Figuur 1B, pijlpunten). In maag volwassen muizen, waren slechts een paar Isl1-positieve cellen waargenomen in de gladde spierlaag. (Extra file 1: Figuur S1c)
Isl1-positieve cellen zijn co-expressie met α-gladde spier actine in de maag van embryonale muis
om te zien of Isl1 expressie werd met betrekking tot spierontwikkeling van de pylorus glad, onderzochten we de expressie van Isl1 en de vroegste gladde spier marker α-SMA met behulp van immunofluorescentie. Resultaten toonden aan dat het percentage Isl1-positieve cellen die α-SMA geleidelijk verhoogd (Figuur 2). Bij E11.5 werden geen α-SMA positieve cellen gedetecteerd, hoewel Isl1 werd sterk tot expressie gebracht in het mesenchym van de maag posterior. Bij E14.5, een subset van Isl1-positieve cellen, in hoofdzaak in de inwendige kringspier (ICM) van de pylorus, werden α-SMA positieve. Door E16.5 heeft pyloric OLM al ondergaan differentiatie [20]. Bij E18.5 de meeste Isl1-positieve cellen in de pylorus waren α-SMA positieve. Isl1 expressie volhardde in volwassen pyloric ICM en OLM en lamina propria cellen ook tot uiting Isl1 (Extra file 1: Figuur S2). Daarnaast werd Isl1 in humane monsters van hypertrofische pylorusstenose onderzocht met immunofluorescentie en resultaten toonden dat Isl1 ook tot expressie werd gebracht in humane gladde spiercellen van de pylorus (aanvullende bestandsinformatie 1: Figuur S3). Daarom zijn deze resultaten suggereren dat Isl1 kan deelnemen aan de vorming van pyloric sluitspier. Figuur 2 Dubbele immunokleuring voor Isl1 en α-gladde spier actine in muizen gladde spiercellen van de dorsale pylorus. Isl1 en α-SMA co-expressie in gladde spiercellen op E11.5, E14.5 en E18.5. Gele stippellijnen markeren de epitheliale basismembraan, witte dikke stippellijnen geven ICM en OLM grens, en wit gestippelde lijnen geven OLM en pancreas grens. Red kleuring Isl1, groen kleuring wordt a-SMA, en DAPI nucleaire tegenkleuring (DNA) is blauw. α-SMA, α-actine van gladde spieren; ICM, binnenste cirkelvormige spieren; OLM, buitenste longitudinale spier; Pa, pancreas; St, maag. Schaal bars. 50 pm Isl1 expressie
effectief weggenomen in Isl1
MCM /F
induceerbare knockout muizen Belgique Om effecten van Isl1
ablatie op de maag ontwikkeling te onderzoeken, hebben we gebruik gemaakt Isl1
MCM /F
induceerbare Cre (Isl1
MCM /Del
) muizen (figuur 3A) en Isl1
F /+ m
ijs waren als controles gebruikt [30, 31]. Embryo's werden gegenotypeerd door middel van PCR op E18.5 (Extra file 1: Figuur S4) en intacte of mutant Isl1
mRNA werd gekenmerkt door semi-kwantitatieve PCR (Figuur 3B). Figuur 3 Efficiëntie van Isl1 ablatie in magen van Isl1 MCM /Del mutant muis magen op E18.5. (A) Tamoxifen-induceerbare Cre recombinase uitgesneden DNA-sequenties geflankeerd door twee loxP plaatsen
. (B) Isl1
RNA spiegels waren ablatie in Isl1
MCM /Del
mutant magen zoals gezien door semi-kwantitatieve PCR. Isl1
F /+ m
ijs toonde een 592 basenparen product terwijl Isl1
MCM /Del
muizen genereerde een 303 basenparen product. (C) Isl1 was significant neerwaarts gereguleerd op het eiwit niveau in Isl1
MCM /Del
mutant magen zoals aangetoond door western blot. Expressie van embryo's in E11.5 werd gebruikt als positieve controle. (D) Isl1 eiwitexpressie in Isl1
F /+ een
nd Isl1
MCM /Del
embryonale pylorus. Isl1 expressie was significant verminderd in Isl1
MCM /Del
embryonale magen, zoals gezien door immunofluorescentie. Afbeeldingen in Isl1
F /+ een
nd Isl1
MCM /Del
op dezelfde dia werden verwerkt en gefotografeerd bij dezelfde belichting. Vergrote beelden van de boxed gebieden worden getoond aan de rechterzijde van de gefuseerde beelden. Geel pijlpunten tonen vertegenwoordiger Isl1-positieve cellen, en witte pijlpunten tonen vertegenwoordiger Isl1-negatieve cellen. Gele stippellijnen markeren de epitheliale basale membraan. Schaal bars. 50 pm
Western blot-analyses toonden aan dat Isl1 eiwitgehalten in embryonale maag van Isl1
MCM /Del
muizen waren beduidend lager dan die in Isl1
F /+ m
ijs (Figuur 3C). Immunofluorescentie resultaten toonden aanzienlijk verminderd Isl1 kleuring in pylorus van Isl1
MCM /Del
muizen in vergelijking met controles (Figuur 3D). Deze gegevens tonen aan dat Isl1
uitdrukking was effectief down-gereguleerd in Isl1
MCM /Del
mutant magen.
Pyloric afwijkingen in Isl1
MCM /F
mutanten
Om effecten van Isl1
ablatie op de maag ontwikkeling te onderzoeken, vergeleken we morfologische en histologische verschillen tussen Isl1
MCM /Del Kopen en Isl1
F /+ s
tomachs op E18.5. Bij E18.5, werd gele vloeistof waargenomen in Isl1
MCM /Del
magen, maar niet in de magen van Isl1
F /+ l
ittermates (Figuur 4A, asterisk) . Histologisch onderzoek toonde aan dat de dorsale pyloric spierlaag glad was veel dunner in de pylorus van Isl1
MCM /Del
muizen vergeleken met controles (Figuur 4B). We hebben gekeken naar de expressie en distributie van α-SMA in beide Isl1
MCM /Del
mutanten en Isl1
F /+ p
ylorus. Immunofluorescentie resultaten toonden aan dat Isl1 tekort leidde tot bijna volledige afwezigheid van de pyloric OLM laag op E18.5, en de resterende cellen werden losjes georganiseerd (Figuur 5A, sterretjes). Bovendien, vernauwing van de pylorus sluitspier werd verzwakt in Isl1
MCM /Del
mutant magen in vergelijking met een vernauwing in Isl1
F /+ s
tomachs (Figuur 5B) . Verder analyseerden we de expressie van gladde spier specifiek eiwit calponine-1 op E18.5 en immunofluorescentie resultaten toonden aan dat verlies van Isl1 ook resulteerde in vrijwel geen calponine-1 expressie in de dorsale pylorus OLM laag, vergelijkbaar resultaat met α- SMA (Extra file 1: Figuur S5). SOX9 wordt uitgedrukt in zowel epitheel en mesenchym [9] en is vereist voor de ontwikkeling van OLM en de vorming van pylorische sfincter vernauwing [20]. Onze resultaten toonden dat immunofluorescentie SOX9 bleef op normale niveaus in de maag epitheel van Isl1
MCM /Del
muizen op E14.5 en E18.5 (figuur 6, pijlen), maar het gebied van pylorische gladde spier expressie SOX9 was significant verminderd in Isl1
MCM /Del
mutanten op E14.5 (figuur 6A, sterretjes) en afwezig E18.5 (figuur 6B, sterretjes). Zo werd Isl1
nodig voor SOX9
expressie in dorsale pyloric OLM cellen. Deze resultaten geven aan dat Isl1 is essentieel voor het reguleren van de ontwikkeling van de muis pylorische gladde spier. Figuur 4 en histologische veranderingen in maag- of Isl1 MCM /Del mutanten. (A) Bruto en microscopisch bewijs voor maag gebreken in Isl1
MCM /Del
muizen. uitzicht op E18.5 hele monteren in Isl1
F /+ een
nd Isl1
MCM /Del
muis magen. Isl1
MCM /Del
mutant magen ontbrak een functionele pyloric sluitspier (pijlpunt), waardoor reflux vloeistof waardoor zoals waargenomen in mutant embryo's. Gele vloeistof wordt aangeduid met asterisk. (B) hematoxyline en eosine kleuring van Isl1
F /+ een
nd Isl1
MCM /Del
muis pylorus op E18.5. De dorsale pyloric gladde spieren (zwarte doos regio) was prominent in Isl1
F /+ e
mbryos, maar was veel dunner in Isl1
MCM /Del
embryo's. De rest van de pylorus werd histologisch normaal. Groene stippellijnen markeren de epitheliale basale membraan. Vergrote afbeeldingen in omkaderde gebieden zijn hieronder weergegeven originele foto's. Schaal bars van de originele foto's: 200 micrometer; schaalbalken vergrote afbeeldingen: 50 pm. H &. E, hematoxyline en eosine
Figuur 5 Verlies van Isl1 verstoort de vorming van de dorsale pyloric buitenste longitudinale spier. (A) Immunofluorescentie van Isl1 en α-SMA in Isl1
F /+ een
nd Isl1
MCM /Del
embryonale pylorus op E18.5. Verlies van Isl1 resulteerde in vrijwel volledige verlies van α-SMA positieve cellen in de dorsale pylorische OLM (sterretjes). Gele stippellijnen markeren de epitheliale basismembraan en wit gestippelde lijnen geven ICM en OLM grens. Red kleuring Isl1, groen kleuring wordt a-SMA, en DAPI nucleaire tegenkleuring (DNA) is blauw. Schaalbalken: 50 urn. (B) α-SMA immunofluorescentie van Isl1
F /+ een
nd Isl1
MCM /Del
embryonale pylorus op E18.5. Vergeleken met Isl1
F /+ e
mbryos, de pylorus sluitspier vernauwing was breder Isl1
MCM /Del
dieren. Sluitspier vernauwing metingen worden getoond. Gele balken af te bakenen van de pylorus en markeer het duidelijk verschil in breedte tussen Isl1
F /+ een
nd Isl1
MCM /Del
samples. Gegevens zijn gemiddelde ± SEM (n
= 6 muizen per groep), * P Restaurant < 0,05 (Student's t
-test). Schaalbalken: 50 urn. α-SMA, α-actine van gladde spieren; ICM, binnenste cirkelvormige spieren; OLM, buitenste longitudinale spier.
Figuur 6 Verlies van Isl1 elimineert de dorsale pyloric buitenste longitudinale spier SOX9 expressie. (A) Dubbele immunokleuring voor Isl1 en SOX9 in de dorsale pylorus op E14.5. Aangezien Isl1, het domein van mesodermale cellen (sterretjes) expressie SOX9 kleiner. (B) Dubbele immunokleuring voor Isl1 en SOX9 in de dorsale pylorus op E18.5. Induceerbare Isl1 knockout effectief geëlimineerd Isl1 expressie, met bijkomende verlies van SOX9 uitdrukking in het dorsale OLM cellen (sterretjes). SOX9 expressie was normaal in de maag epitheel in beide stadia (pijlpunten). Gele stippellijnen markeren de epitheliale basismembraan en witte stippellijnen aparte ICM en OLM. Red kleuring Isl1, groen kleuring SOX9 en DAPI nucleaire tegenkleuring (DNA) is blauw. Schaalbalken: 50 urn. ICM, binnenste cirkelvormige spieren; OLM, buitenste longitudinale spier.
Expressie en distributie van proteïne genproduct 9,5 (PGP9.5), een enterische zenuwstelsel marker [32], was intact op E18.5 in Isl1
MCM /Del
mutant magen (Extra file 1: Afbeelding S6). Alvleesklier en duodenale homeobox gen 1 (Pdx1) wordt uitgedrukt in epitheelcellen van de antrale pylorus-segment en de rostrale duodenum [33]. Onze immunofluorescentie resultaten toonden aan dat Pdx1 expressie was vergelijkbaar in Isl1
MCM /Del
muizen in vergelijking met de controles op E18.5 (Extra file 1: Figuur S7). Bovendien, de muis maag en duodenale epitheliale grenzen vastgesteld tussen E14.5 en E16.5 [34], deze periode samenviel met de ontwikkeling van de OLM laag [20]. We testten de integriteit van het maag-darm epitheliale kleine pylorus grens bij E18.5 door het onderzoeken van expressie van een darm-specifieke epitheliale marker Cdx2 [19]. Onze immunohistochemie resultaten toonden dat de positie van de epitheliale pylorische grens Isl1
MCM /Del
muizen was vergelijkbaar met die van de controles (aanvullende bestandsinformatie 1: Figuur S8). Deze resultaten geven aan dat verlies van Isl1 geen invloed innervatie of epitheliale ontwikkeling van de pylorus.
Verlies van Isl1 heeft geen invloed op proliferatie of apoptose van pylorische inwendige kringspier en buitenste longitudinale spiercellen Belgique Om te zien of Isl1 expressie was gerelateerd naar cel proliferatie van de pylorus, onderzochten we co-lokalisatie van Isl1 en de proliferatieve marker broomdeoxyuridine (BrdU) met behulp van immunofluorescentie in Isl1
F /+ m
ijs. Onze resultaten toonden aan dat BrdU-positieve cellen waren dicht bij E11.5 en verspreid over de ICM en OLM regio's op E14.5 en E18.5 (Extra file 1: Figuur S9a). Daarnaast is het aandeel van de uitdijende ICM en OLM cellen was niet significant verschillend tussen Isl1
MCM /Del Kopen en Isl1
F /+ m
ijs bij E18.5 ( extra file 1:. Figuur S9b) Belgique Om een potentiële impact op apoptose te beoordelen, onderzocht we gesplitst Caspase 3 expressie op E18.5, en onze immunofluorescentie resultaten toonden aan dat er geen caspase 3-positieve cellen in pyloric ICM of OLM laag van Isl1
MCM /Del Kopen en Isl1
F /+ m
ijs (Extra file 1: Figuur S10). Deze gegevens tonen aan dat Isl1 ablatie heeft geen invloed op proliferatie of apoptose van pyloric ICM en OLM cellen.
Verlies van Isl1 resulteert in verminderde expressie van GATA3
, Gremlin
en Nkx2.5
aangezien een aantal factoren, waaronder Bapx1
[18], Barx1
[35], GATA3
[19, 36], Gremlin
[5], Nkx2.5
[2] en [9], zijn gemeld Six2
betrokken te zijn bij de regulering van pyloric ontwikkeling, hebben we onderzocht de effecten van het verlies van Isl1 op de expressie van deze genen op E14.5 en E18.5. RT-qPCR resultaten toonden aan dat het verlies van Isl1
had geen invloed op de expressie van Bapx1 golfreizen of Barx1
op een van beide of E14.5 E18.5 (Figuur 7A, B). Bij E18.5, α-SMA Kopen en Six2
mRNA niveaus waren significant lager in Isl1
MCM /Del
muizen in vergelijking met de controlegroep (Figuur 7B). Op beide E14.5 en E18.5, Nkx2.5
, GATA3
en Gremlin
mRNA niveaus in de maag van Isl1
MCM /Del
muizen waren lager dan controles (Figuur 7A, B). GATA3
mRNA niveaus waren ongeveer 70% verminderd in beide stadia onderzocht (Figuur 7A, B). Gebaseerd op deze resultaten, onderzochten we Isl1
, GATA3
, Gremlin
en Nkx2.5
meningsuiting in Isl1
MCM /F
mutant en Isl1
F /+ s
tomachs behulp van WISH. Resultaten toonden dat expressie van elk van deze genen hoofdzakelijk werd beperkt tot de pylorus regio, zoals verwacht; GATA3
expressie werd verder verlaagd mutant magen; en Gremlin Kopen en Nkx2.5
had slechts subtiele veranderingen (figuur 7E, F). Isl1 Kopen en GATA3
meningsuiting waren de sterkst getroffen (figuur 7C, D). Deze resultaten waren in overeenstemming met de RT-qPCR data en suggereren dat Isl1 reguleert de expressie van GATA3
, Gremlin
en Nkx2.5
. Figuur 7 Afwijkende genexpressie in hindstomach in Isl1 MCM /Del mutanten. (A) RT-qPCR analyse van mRNA niveaus van hindstomach verrijkt transcriptiefactoren bij E14.5 geeft significante vermindering van de α-SMA
, Six2 Nkx2.5
, GATA3
en Gremlin
mRNA in Isl1
MCM /Del
mutant magen (n
= 4). Alle resultaten werden genormaliseerd tot niveaus van GAPDH mRNA
. (B) RT-qPCR analyse van mRNA-niveaus van transcriptiefactoren hindstomach verrijkt op E18.5 geeft een aanzienlijke vermindering van Nkx2.5
, GATA3
en Gremlin
mRNA in de Isl1
MCM /Del
mutant magen (n
= 4). Alle resultaten werden genormaliseerd tot niveaus van GAPDH mRNA
. Gegevens zijn gemiddelde ± SEM (n = 6
muizen per groep). * P Restaurant < 0,05 versus Isl1
F /+
; ** P Restaurant < 0,01 versus Isl1
F /+
(Student's t
-test). (CF) WISH mRNA analyse bevestigde verlies van Isl1
, GATA3
, Gremlin
en Nkx2.5
mRNA expressie op E14.5 in de Isl1
MCM /Del
mutant magen. Isl1 Kopen en GATA3
mRNA werden zwaar down-gereguleerd in Isl1
MCM /Del
muizen, terwijl Gremlin Kopen en Nkx2.5
meningsuiting enigszins werden verlaagd. Pijlen wijzen naar de pylorus sluitspier.
Isl1 richt GATA3 Kopen en activeert de transcriptie
GATA3
selectief wordt uitgedrukt in de pylorus van de ontwikkeling van muizenembryo [19, 20]. Expressie van zowel Isl1 Kopen en GATA3
mRNA werd waargenomen in de pylorus op E14.5, maar of GATA3 en Isl1 worden uitgedrukt in dezelfde cellen niet is onderzocht. Daarom onderzochten we de expressie van Isl1 en GATA3 door immunofluorescentie analyses. Resultaten toonden dat Isl1 en GATA3 eiwitten werden tezamen tot expressie gebracht in dezelfde cellen van de pylorus bij E14.5 en E18.5 in Isl1
F /+ c
ontrole- magen (Figuur 8). Bovendien, het gebied GATA3 expressie was aanzienlijk kleiner in Isl1
MCM /Del
mutant pylorus spierlaag op E14.5 (figuur 8A) en werd verloren E18.5 in de pylorus OLM laag glad (Figuur 8B). Zo werd Isl1
nodig voor GATA3
uitdrukking in het dorsale pyloric OLM laag. Om te onderzoeken of Isl1 regelt pyloric ontwikkeling door rechtstreeks reguleren GATA3
, voerden we bioinformatica analyse van de GATA3 genoomplaats. De muis GATA3
-gen bevat verschillende vermeende Isl1 reactie-elementen (ATTA /TAAT) aan -2832 basenparen (bp) naar 1002 bp uit de transcriptie initiatie plaatsen [37]. We identificeerden 10 gebieden die vermoedelijk Isl1 bevatte bindingsplaats (figuur 9A) en 10 paren overeenkomstige primers werden ontworpen om deze regio's na chromatine immunoprecipitatie (ChIP) onderzoeken waarin antilichamen tegen Isl1 amplificeren. Immunogeprecipiteerd genomisch DNA werd verkregen van pylorus gebieden van muizenembryo's op E14.5. Van de 10 vermeende Isl1 bindende gebieden, twee afzonderlijke gebieden, in het -2558 bp tot -2303 bp (regio P1) en -1081 bp tot -855 bp (regio P6), werden bezet door Isl1 eiwit. Dit resultaat werd bevestigd door semi-kwantitatieve PCR (figuur 9B) en de vouw werkwijze van verrijking (figuur 9C). Figuur 8 Verlies van Isl1 elimineert de dorsale pyloric buitenste longitudinale spier GATA3 expressie. (A) Dubbele immunokleuring voor Isl1 en GATA3 in de dorsale pylorus op E14.5. De regio mesodermale cellen (sterretjes) uitdrukken GATA3 was kleiner in de Isl1
MCM /Del
pylorus dan Isl1
Fl +
. (B) Dubbele immunokleuring voor Isl1 en GATA3 in de dorsale pylorus op E18.5. Induceerbare Isl1 knockout effectief geëlimineerd Isl1 expressie, met bijkomende verlies van GATA3 uitdrukking in het dorsale OLM cellen (sterretjes). Gele stippellijnen markeren de epitheliale basismembraan en wit gestippelde lijnen geven de ICM en OLM grens. White pijlpunt geeft aan niet-specifieke vlek. Alle auteurs gelezen en goedgekeurd het definitieve manuscript.
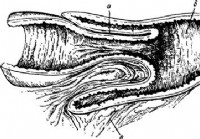 Onbegaanbaarheid van de implementatie van ingewanden - Diagnose van acute buik
Implementatie of vdviganiye van een stuk darm in een ander als de reden van intestinale onbegaanbaarheid, wordt niet in alle landen met een identieke frequentie waargenomen. Volgens grote Engelse stat
Onbegaanbaarheid van de implementatie van ingewanden - Diagnose van acute buik
Implementatie of vdviganiye van een stuk darm in een ander als de reden van intestinale onbegaanbaarheid, wordt niet in alle landen met een identieke frequentie waargenomen. Volgens grote Engelse stat
![Beste gastro-enterologen (GI) artsen in FL bijgewerkt [Sep 19]](https://www.stomachillness.com/article/uploadfiles/202201/2022011910313996.png) Beste gastro-enterologen (GI) artsen in FL bijgewerkt [Sep'19]
Als u op zoek bent naar de beste gastro-enteroloog (GI) artsen in FL, dan bent u van harte welkom in onze gids, waar u allesomvattende informatie ontvangt die alle informatie biedt die u nodig hebt. I
Beste gastro-enterologen (GI) artsen in FL bijgewerkt [Sep'19]
Als u op zoek bent naar de beste gastro-enteroloog (GI) artsen in FL, dan bent u van harte welkom in onze gids, waar u allesomvattende informatie ontvangt die alle informatie biedt die u nodig hebt. I
 Ter verdediging van aardappelen:hoe resistent zetmeel uit aardappelen de darmflora beïnvloedt
Ondanks hun populariteit hebben aardappelen de reputatie een ongezond voedingsmiddel te zijn dat rijk is aan zetmeelrijke koolhydraten. Werk van het laboratorium van Dr. Thomas Schmidt van de Universi
Ter verdediging van aardappelen:hoe resistent zetmeel uit aardappelen de darmflora beïnvloedt
Ondanks hun populariteit hebben aardappelen de reputatie een ongezond voedingsmiddel te zijn dat rijk is aan zetmeelrijke koolhydraten. Werk van het laboratorium van Dr. Thomas Schmidt van de Universi