Caveolina-1 (CAV1) é uma proteína do receptor de andaime e agente patogénico na mucosa do tracto gastrointestinal. A infecção crônica das células epiteliais gástricas pelo Helicobacter pylori Autor Resumo A infecção com a bactéria Helicobacter pylori Citation:. Hitkova I, Yuan G, Anderl F, Gerhard M, Kirchner T, Reu S, et al. (2013) Caveolina-1 Protege B6129 Mice contra Helicobacter pylori editor: Steven R. Blanke, da Universidade de Illinois, Estados Unidos da América Recebido: 23 de maio de 2012; Aceito: 04 de fevereiro de 2013; Publicação: 11 de abril de 2013 Direitos de autor: © 2013 Hitkova et al. Este é um artigo de acesso aberto distribuído sob os termos da Licença Creative Commons Attribution, que permite uso irrestrito, distribuição e reprodução em qualquer meio, desde que o autor original ea fonte sejam creditados Financiamento:. Este estudo foi apoiado por subsídios à EB e MPAE do Deutsche Krebshilfe (108.287) e DFG (BU-2285). MPAE também é apoiada por doações do Deutsche Krebshilfe (107885), DFG (SFB 824, TP B1), Else Kröner Stiftung (Nr P14 /07 //A104 /06) e BMBF (Mobimed 01EZ0802;. KMU-innovativ Sem 0315116B A financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito CONFLITO dE iNTERESSES:.. os autores declaram que não há interesses concorrentes existem Introdução Helicobacter pylori os dois principais H. pylori Caveolina-1 (CAV1) é a 21-24 kDa importante e essencial estrutural proteína de cavéolas, uma forma especializada de microdomínios jangada lipídica. Cavéola é 50-100 balão nm /invaginações tubulares da membrana de plasma abundante em macrófagos, células endoteliais e células musculares lisas, pneumócitos tipo I e adipócitos, em que participam em processos de transporte celular, incluindo endocitose, o efluxo de colesterol e do tráfego de membrana [15] , [16]. Neste contexto, CAV1 também pode agir como um inibidor da endocitose independente de clatrina e bloco de patógeno /absorção de toxina [17], [18]. Através da ligação ao seu domínio de andaimes, CAV1 inibe directamente um grande número de receptores e enzimas, incluindo as tirosina-quinases Src e de Ras família, G-proteínas e óxido nítrico sintases [15]. Em adição a um papel no tráfego de membrana, CAV1 constitui, portanto, uma plataforma de controlo para a regulação da proliferação celular e sobrevivência [19]. CAV1 também exerce uma função importante na motilidade celular e migração e, dentro epitelial, estromal e tecidos endoteliais, através da aplicação de contactos célula-célula, adesão célula-matriz e as respostas imunitárias [20], [21], [22], [23] . CAV1 liga-se diretamente colesterol, e transcrição de CAV1 é regulada negativamente pelo factor de transcrição de esteróis de resposta de ligação elemento de proteína-1 (SREBP1) [24]. SREBP1 está ligado ao retículo endoplasmático (ER) como um precursor inactivo de 125 kDa e é activado, sob condições de deficiência de colesterol por clivagem proteolítica no aparelho de Golgi. Esta clivagem é seguida pela translocação da substância activa de 68 kDa SREBP1 para o núcleo onde se liga a elementos responsivos de esterol (SREs) de genes alvo, incluindo CAV1, envolvida na síntese de colesterol e ácidos gordos [25]. H. pylori Por isso, a hipótese de que o de ligação de colesterol e proteínas SREBP1 CAV1 são alvos de H. pylori Ética declaração os estudos em animais foram realizados de acordo com as diretrizes éticas da Technische Universität München (Alemanha animal Welfare Act, Deutsches Tierschutzgesetz) e tinha sido aprovado (7.2-1-54-2531-74-08) por o governo da Baviera Animais Homozigoto CAV1 knockout (CAV1-KO) (Cav1tm1Mls tensão /J; estoque número 004.585) (Regierung von OBB, Munique, Alemanha.). e combinados selvagem controle do tipo (WT) (estirpe B6129SF2 /J, o número de ações 101.045) ratos (8 semanas) foram obtidos do Laboratório Jackson (Bar Harbor, Maine) e mantidos em um fundo misto em uma instalação do rato livre de patógenos [28], [ ,,,0],29]. ulceração gástrica experimental foi realizado com a indometacina como publicado antes [30]. Infecção de camundongos com a adaptação do rato CagA /VacA de entrega deficiente H. pylori produtos químicos foram da Merck (Darmstadt, Alemanha) ou Sigma (Taufkirchen, Alemanha). anti-soros policlonais foram SREBP1 (# PA1-46142, Thermofisher Scientific, Waltham, MA), CAV1 (N-20, SC-894), SREBP1 (C-20, SC-366), CagA (b-300, SC-25766) , FAK (A-17, SC-557), fosfo-FAK (Tyr-397, SC-11765), Hsp90 alfa /beta (H-114, SC-7947), lamina A /C (H-110, SC- 20681, tudo a partir de Santa Cruz Biotech., CA), ERK1 geral e fosfo /2 (p44 /p42), p38, JNK (todos da Cell Signaling, Danvers, MA) e Ki-67 (SP6, DCS GmbH, Hamburgo, Alemanha ). Os anticorpos monoclonais de ratinho foram CAV1 (ɢ406) e fosfo-CAV1 (pY14,ɣ338) (ambos a partir de BD /Transdução Lab., San Jose, CA), DLC-1 (C-12, SC-271915) e da beta-actina (AC-15, SC-69879) (ambos a partir de Santa Cruz Biotech.). O anti-rato de F4 anticorpo de rato específico para macrófagos /80 (# MF48000) foi obtido a partir de Invitrogen (Life Technologies, Darmstadt, Alemanha). Frango anti- H. pylori rim embrionário humano (HEK293), Madin-Darby de rim canino ( MDCK), linhas celulares de CG humanas parentais (AGS, MKN45, N87) (todas da American Type Culture Collection, Rockville, MD) e os clones gerados estavelmente transfectadas mesmos foram mantidas como descrito anteriormente [37]. A infecção de células com a adaptação de células CagA-delivery proficiente H. pylori ADN construções O plasmídeo de expressão pEGFP-CagA foi mencionado em outros lugares [38]. O fragmento ~800 pb do promotor humano CAV1 proximal (AF019742, posição 69-859) [24] foi amplificado por PCR a partir do ADN genómico de fígado humano normal, e clonado nos sítios Hindi II /Kpnl do plasmídeo repórter de luciferase pGL3-Luc ( Promega GmbH, Mannheim, Alemanha). A isoforma 4 do ARNm DLC1 humano [39] (DLC1v4, NM_001164271.1) foi amplificado a partir de células de hepatoma HepG2 humanos e inserido nos locais BamHI /NotI do vector de expressão pTarget (PT, Promega GmbH). ensaios de transfecção e transitória da luciferase foram realizados como antes [37]. Cultura bacteriana H. pylori Ex vivo estômagos inteiras foram excisadas de ratos, e a formação de colónias foi determinada essencialmente como descrito [31] . Uma tira antral do estômago foram pesados, colocados em 5 ml de caldo de Brucella e agitadas durante 10 min. As diluições de 1:10, e 1:100 1:1000 foram preparadas, e 100 ul de cada diluição foi plaqueada em H. pylori O estômago remanescente foi lavado com água estéril. Uma tira antral foi cortado, congelado em azoto líquido e armazenado a -80 ° C até à extracção do ARN. O resto do estômago foi colocado em 3 ml de 4% (w /v) de paraformaldeído (PFA) em solução salina tamponada com fosfato (PBS) e incubadas durante 24 h a 4 ° C. Em seguida, o estômago foi cortado ao longo da pequena curvatura maior e em duas metades, seguido por desidratação e incorporação em parafina para análise histológica. As células foram infectadas com o a detecção das proteínas imunoprecipitadas por SDS-PAGE e WB foi realizada como anteriormente [41]. assistida por matriz de laser espectrometria de massa de Dessorção /ionização (MALDI-MS) foi descrito em detalhe em [29]. A coloração foi realizada em modo de triplo-4,6- cor visualizando diamidino-2-phenylindole (DAPI), Alexa-488 e -594 usando um conectado à câmera digital (Axiovision, solte 4.4) microscópio de fluorescência (Axiovert 200M, Carl Zeiss MicroImaging GmbH, Hallbergmoos, Alemanha). A microscopia confocal (Axiovert 40, Zeiss) e 3D-reconstrução do H. pylori A avaliação histopatológica e imuno-histoquímica (IHQ) crônica ativa gastrite foi definida pela presença simultânea de ambos polimorfonucleares neutrófilos (PMN) e células mononucleares (linfócitos e células de plasma) dentro da mucosa gástrica. Activo (PMN) e crónica (mononuclear) infiltrado foi avaliada como se segue: tecido gástrico incluídos em parafina foi cortada em secções de 3 um, utilizando um micrótomo semi-automático (Leica Microsystems GmbH, Wetzlar, Alemanha). As secções foram então coradas com Hematoxilina & Eosina (H & E) soluções. A análise histopatológica foi realizada por três patologistas (CR, SR, TK) cegos para a configuração do estudo. alterações morfológicas na mucosa gástrica foram classificados de acordo com o sistema de Sydney atualizado, [42] [32]. O grau de gastrite foi pontuada com base na densidade de infiltrados inflamatórios intramucosal de células mononucleares e PMN como publicado antes de [43]: nenhum (0), ligeira (1+), moderada (2+) e grave (3+). Além disso, a hiperplasia ou alterações epiteliais regenerativos, perda de células parietais e a frequência de folículos linfóides ou agregados linfóides foram anotados. A intensidade da H. pylori chip (Kit de Upstate, Milipore GmbH, Schwalbach, Alemanha) e todos os outros métodos foram realizados como descrito anteriormente [45]. Os oligonucleótidos estão listados na Tabela S1. Viabilidade de células aderentes foi medida através de 1- (4,5-dimetiltiazol-2-il) 3,5-difenil-formazan (MTT ) ensaio (Roche Diagnostics GmbH, Mannheim, Alemanha) como recomendado pelo fabricante. Para determinar a adesão celular, 1 × 10 4 células foram semeadas em placas de cultura celular de 6 cm para 1 a 6 horas, seguida por lavagem com PBS repetitivo. As restantes células aderentes foram fixadas com 4% (w /v) de PFA em PBS, coradas com violeta de cristal e em seguida contados utilizando o ImageJ (NIH, Bethesda, MD). Os ensaios de cicatrização de feridas foram realizadas essencialmente como descrito em [46]. Resumidamente, as células foram cultivadas até à confluência em pratos de 6 cm, e um 5 milímetros zero foi introduzido na monocamada utilizando uma ponta azul invertida seguida por incubação das placas de cultura de células durante mais 24, 48 e 72 h. fechamento da ferida foi monitorada após fixação e coloração de células com violeta de cristal usando microscopia de campo claro (Axiovert 200M, Carl Zeiss MicroImaging GmbH). Estatísticas Os resultados são médias ± S.E. a partir de, pelo menos, 5 animais de cada genótipo ou 3 experiências independentes de diferentes passagens celulares. O software GraphPad Prism (versão 4.0, La Jolla, CA) foi usado para analisar os dados. Os valores de p (* P < 0,05) foram calculados usando teste exato de Fisher t de Student e Os números de acesso Humano: CAV1:. NM_001753.4, Q03135; B2M: NM_004048.2, P61769; IL8: NM_000584.3, P10145; v1 DLC1: NM_182643.2, Q96QB1; v4 DLC1: NM_001164271.1, Q96QB1; ACS: NM_018677.3, Q9NR19; HMGCoAS: NM_001098272.2, Q01581; HMGCoAR: NM_000859.2, P04035; LDLR: NM_000527.4, P01130; beta-actina: P60709; Lamina A: P02545; Lamin C: P02545; alfa Hsp90: P07900; beta Hsp90: P08238; ERK1 (p44): P27361; ERK2 (p42): P28482; FAK: Q05397; JNK1: P45983; JNK2: P45984; p38: Q16539; Src: P12931; SREBP1: P36956; Ki-67: P46013; Mouse: CAV1: NM_007616.4, P49817; B2M: NM_009735.3, Q91XJ8; TNFalfa: NM_013693.2, P06804; IFNgama: NM_008337.3, P01580; IL1beta: NM_008361.3, P10749; IL6: NM_031168.1, P08505; CD4: NM_013488.2, P06332; CD19: NM_009844.2, P25918; CD25: NM_000417.2, P01589; CD86: NM_019388.3, P42082; CCL5: NM_013653.3, P30882; CXCL1: NM_008176.3, P12850; PPARg2: NM_015869.4, P37231; TFF2: NM_009363.3, Q9QX97; Dog: B2M: NC_006612, XP_850148; H. pylori Resultados camundongos CAV1 deficientes exibir reforçada gastrite após a infecção com incompetente CagA de entrega H. pylori Para avaliar as alterações histológicas induzidas no tecido gástrico em cima H. pylori CAV1 por deficiência promove o recrutamento de macrófagos na mucosa gástrica infectada Para avaliar a identidade das células imunológicas que contribuem para a H. pylori Resultados semelhantes foram obtidos a partir de experiências de introdução de lesão gástrica rápida em murganhos por injecção de indometacina [30] (Fig.S1). Consistente com os danos de tecido aumentada em estômagos CAV1-KO (* p = 0,0161, WT relação Para avaliar a função do CAV1 durante H. pylori CAV1 protege as células GC humanos contra rearranjo induzida pelo CagA do citoesqueleto A formação de projeções em forma de agulha ( "pássaro do zumbido") é um típico fenótipo morfológica de células AGS em resposta à infecção com CagA de entrega proficiente H. pylori Em apoio a estas conclusões, a adesão celular e as taxas de fechamento da ferida foram mais pronunciados no AGS /CAV1 em comparação com células AGS /EV (Fig.S2). Consistente com a sua função como uma proteína alvo de CagA e o componente de adesões focais [48], análise de WB (Fig. 4D) também detectados níveis mais elevados (0,4 ± 0,1 AGS /EV> 1,4 ± 0,1 AGS /CAV1 , * P = 0,0012; n = 3 por clone) da quinase de adesão focal fosforilada (FAK) em CAV1-expressando células infectadas com H. pylori CagA-delivery competente H. pylori CAV1 foi mostrado para ser fosforilada por tirosina quinases citosólicas (Src, Abl) em tirosina 14 [49], e fosforilada CAV1 e src tanto activar as pequenas GTPases Rho /Rac /Cdc42 que regulam as funções do citoesqueleto [13], [50]. Para identificar o mecanismo molecular subjacente como CAV1 protege contra o estresse celular relacionados com CagA, avaliou-se as vias de sinalização iniciadas pelo CagA-delivery proficiente H. pylori Não foi possível detectar uma interacção directa ou co-localização quantitativa de CagA proteína ou H. pylori Para identificar uma proteína candidata, que confere protecção contra CagA numa CAV1-dependente forma, uma tela de interacção de proteínas com base em MALDI-MS foi realizada (Fig. 7A). células AGS /CAV1 foram infectadas durante 16 horas com H. pylori Este resultado nos levou para amplificar o cDNA da variante 4 de DLC1 humana [39] a partir de células HepG2 de hepatoma humano (Fig . 7C). O ADNc foi inserido no vector de expressão pTarget (PT-DLC1v4) seguido por transfecção transitória em AGS parental ou células HEK293 durante 24 h. As análises WB detectada expressão de uma proteína ~110 kDa, consistente com o tamanho previsto de DLC1v4 [39]. AGS células transitoriamente transfectadas foram então infectados com H. pylori
( H. pylori
) é um importante fator de risco para o cancro gástrico humano (GC), onde CAV1 é frequentemente regulada para baixo. No entanto, a função de CAV1 em H. pylori
infecção e patogênese da GC permaneceu desconhecida. Mostramos aqui que os ratos CAV1 deficientes, infectados durante 11 meses com a CagA de entrega deficiente H. pylori
estirpe SS1, desenvolveu-se mais grave gastrite e danos nos tecidos, incluindo a perda de células parietais e hiperplasia foveolar, e exibida inferior a colonização da mucosa gástrica da mesma ninhada de B6129 de tipo selvagem. camundongos CAV1 nulos se observado aumento na infiltração de macrófagos e células B e secreção de quimiocinas (RANTES), mas tinham níveis reduzidos de CD25 + células T reguladoras. células CAV1 deficientes em humanos GC (AGS), infectadas com o CagA-delivery proficiente H. pylori
G27 tensão, foram mais sensíveis ao estresse morfologias do citoesqueleto relacionados com CagA ( "pássaro do zumbido") em comparação com células AGS estavelmente transfectadas com CAV1 (AGS /CAV1). A infecção de células AGS /CAV1 provocou o recrutamento de p120 RhoGTPase-Activar /excluídos no cancro-1 no fígado (p120RhoGAP /DLC1) para CAV1 e neutralizadas rearranjos do citoesqueleto induzidas pelo CagA de proteína. Em linhas de células humanas GC (MKN45, N87) e tecido do estômago do rato, H. pylori
expressão endógena regulada de CAV1 independentemente do CagA. Mecanicamente, H. pylori
activado esterol-responsivo proteína-1 (SREBP1) para reprimir a transcrição do gene CAV1 humano a partir de elementos de esterol-sensível (SREs) no promotor proximal CAV1 de ligação ao elemento. Estes dados sugerem um papel protetor de CAV1 contra H. pylori
inflamação e dano tecidual induzida. Propomos que H. pylori
exploits para baixo-regulação da CAV1 para subverter a resposta imune do hospedeiro e para promover a sinalização de seus fatores de virulência em células hospedeiras.
( H. pylori
) afeta principalmente as crianças dos países em desenvolvimento que estão em risco de progredir para o câncer gástrico (GC) como adultos após muitos anos de infecção persistente, especialmente com cepas que são positivo para o oncogênico CagA fator de virulência. Erradicação da H. pylori
por antibióticos é o tratamento de escolha, mas podem também alterar a susceptibilidade a alergias e outros tipos de tumores. Assim, são necessários novos marcadores de diagnóstico ou prognóstico que detectam alterações moleculares precoces na mucosa do estômago durante a transição da inflamação crônica ao câncer. Em nosso estudo, descobrimos que o supressor de tumor caveolin-1 (CAV1) é reduzido após a infecção com H. pylori
e CagA foi suficiente mas não é necessário para esta infra-regulação. Perda de CAV1 foi causado por H. pylori
activação dependente de esterol-responsivo proteína-1 (SREBP1), e este evento aboliu a interacção de CAV1 com p120 RhoGTPase-proteína de activação /suprimido no cancro-1 fígado (p120RhoGAP /DLC1) de ligação ao elemento, uma segunda bona fide
supressor tumoral no tecido gástrico. Conclusivamente, CAV1 e DLC1 podem constituir marcadores moleculares romance no H. pylori
mucosa gástrica infectado antes da transformação neoplásica do epitélio
gastrite. PLoS Pathog 9 (4): e1003251. doi: 10.1371 /journal.ppat.1003251
( H. pylori
) é uma bactéria Gram-negativa que coloniza o estômago de aprox. 50% da população do mundo e aumenta o risco de desenvolvimento de doenças crônicas gastrite, úlcera péptica, úlcera gástrica tecido linfóide associado à mucosa (MALT), atrofia da mucosa e cancro gástrico (GC) [1], [2]. com base nesta etiologia, H. pylori foi classificada
como uma classe I cancerígeno pela Organização Mundial de Saúde (OMS) em 1994 [3].
toxinas [4], CagA e VacA, são internalizados em gástrica células epiteliais por via de injecção do sistema de secreção de tipo IV bacteriana (CagA) [5] ou por inserção directa em jangadas lipídicas (VacA) [6], [7]. jangadas lipídicas são colesterol e rica em esfingolipídios microdomínios da membrana do plasma [8], [9], que são explorados por muitos agentes patogénicos, incluindo vírus, bactérias e parasitas, para facilitar a absorção de organismos inteiros e /ou internalização de toxinas em células hospedeiras [ ,,,0],10], [11], [12]. Por exemplo, Neisseria especificação
. utiliza jangadas lipídicas e sinalização mediada por Rho-do citoesqueleto de actina para ganhar acesso ao citosol [13]. Pseudomonas aeruginosa
explora células epiteliais receptor toll-like 2 para a infecção de pulmão associada à jangada de lipídios [14].
tem sido demonstrado que metabolizam o colesterol da membrana da célula hospedeira, e o colesterol hospedeira altera as propriedades oncogénicas de CagA [26], [27].
funções de infecção e /ou efetoras. Especificamente, nós nos perguntamos se (i) H. pylori
exploits CAV1 para facilitar a injeção e de sinalização a jusante de CagA em células epiteliais gástricas ou (ii) CAV1 age como um protetor de proteína "de aplicação de barreira" que neutraliza a doença provocada por H. pylori
. Para testar isso, os fenótipos que resultam de H. pylori
foram estudadas em ratinhos deficientes em CAV1 e em linhas de células humanas de GC. Nossos dados mostraram que CAV1 protegida ratos B6129 contra H. pylori
-relacionados gastrite e dano tecidual in vivo
independentemente do CagA. H. pylori
também activado SREBP1 e expressão regulada de murino e CAV1 humana independentemente do CagA. Além disso, CAV1 contrariado rearranjos do citoesqueleto CagA-dependentes in vitro
pelo recrutamento do supressor de tumor suprimido no fígado câncer-1 (DLC1).
Materiais e Métodos
SS1 estirpe foi realizado por gavagem oral como descrito [31]. Os ratos tempo médio de diferentes origens genéticas (C57BL /6, B6129, BALB /c) tomar para progredir para gastrite crônica e além (atrofia gástrica, hiperplasia, displasia) [32] varia entre 10 e 15 meses após a infecção com a referência padronizada estirpe SS1 [28], [33], [34], [35]. Decidimos, portanto, para realizar nossa análise dentro deste prazo.
Reagentes
Ab policlonal foi utilizado como descrito [36]. citocinas do soro foram medidos por ELISA (R & D Systems, Minneapolis, MN) de acordo com as instruções do fabricante. Pull-down ensaios para as pequenas GTPases Rho /Rac /Cdc42 foram comprados de Biocat (Heidelberg, Alemanha).
cultura celular
G27 estirpe foi realizada como antes [36].
SS1 e bactérias G27 foram recuperados a partir de -80 ° C stocks de glicerol e cultivadas em Wilkins-Chalgren (WC) placas de agar de sangue sob condições microaeróbias (10% CO2, 5% O2, 85% N2; 37 ° C) durante 2-3 dias. O H-adaptado mouse. pylori
SS1 foi colhida a partir de placas de agar para in vivo
infecções conforme publicado anteriormente [31]. A estirpe foi SS1-PCR positiva para o cag
gene e ARNm, mas não injectar proteína CagA funcional [40], como é evidente pela ausência do fenótipo "pássaro do zumbido" em células infectadas AGS (dados não mostrados) . O H adaptado de células. pylori
bactérias CagA-delivery proficiente G27 em peso
eo CagA-mutante de deleção G27 Delta cagA
foram colhidas a partir de placas de ágar e, posteriormente cultivadas em co-cultura contínua com células MDCK como descrito [36].
quantificação de unidades formadoras de colónias (CFUs)
ágar sangue WC selectivos. O número de colónias bacterianas foi determinada após 5 dias e normalizada para o peso das peças correspondentes do estômago.
Processamento de tecido gástrico do rato
Gentamicina ensaio de protecção
estirpe G27 durante 2 a 24 h a uma multiplicidade de infecção (MOI) de 500:1. Em seguida, as células foram lavadas três vezes com PBS para remover as bactérias residuais e foram adicionalmente incubadas durante 2 h a 37 ° C numa atmosfera humidif içada em meio DMEM /F12 (10% de FCS, 10% de caldo de Brucella), suplementado com gentamicina (200 ug /ml ), penicilina /estreptomicina (100 ug /ml) e cloranfenicol (100 ug /ml). Ausência de bactérias extracelulares foi confirmada sob o microscópio, e as células foram subsequentemente lisadas para a detecção de CagA intracelular por Western Blot (WB).
Coimmunoprecipitation (CoIP) e Western blot (WB)
Imunofluorescência
células infectados com LSM510 (Zeiss) e Volocity (Improvisação, Tübingen, Alemanha) foi feito como antes [37].
colonização da mucosa gástrica foi registada como ligeira (poucas e simples bactérias em uma distribuição aleatória), (bactérias individuais e agrupados em uma distribuição descontínua) e moderadas (agregados bacterianos densas que cobrem a mucosa gástrica em camadas contínuas) severas. foram determinadas várias dezenas de diferentes regiões do estômago. A imuno-histoquímica (IHQ) foi realizada em secções de parafina, como descrito anteriormente [44].
electroforética ensaio de desvio de mobilidade (EMSA), imunoprecipitação da cromatina (ChIP), transcrição reversa PCR (RT-PCR) e PCR quantitativa (qPCR)
ensaios celulares
: CagA: YP_002266135.1, B5Z6S0; UreB:. YP_626814.1, Q1CV82
SS1
infecção, B6129 WT e ratos CAV1-KO foram infectadas com o deficiente adaptada-rato e CagA de entrega H. pylori
estirpe SS1. Os ratinhos foram sacrificados 11 meses mais tarde, e H. pylori
foi isolado a partir de tecido de estômago ressecado [31]. CAV1-KO ratinhos mostrou que a colonização bacteriana menos da mucosa gástrica do que os ratos WT (7,3 ± 2,4 wt relação
1,6 ± 0,5 × 10 KO 3 CFU /mg de tecido do estômago; * p = 0,0141; n = 15 por genótipo) (Fig. 1A). A análise histopatológica revelou que camundongos tanto WT e CAV1-KO desenvolveu gastrite crónica activa acompanhada por infiltração de polimorfonucleares (PMN) mononuclear e na mucosa gástrica (Fig. 1B). Em contraste, não infectados ratinhos WT e KO-CAV1 teve nenhuma inflamação intramucosa (dados não mostrados). Em vez disso, a gastrite foi realçada no H. pylori
ratinhos infectados CAV1-KO em comparação com ratinhos WT infectados (Fig. 1C). Em camundongos CAV1-KO, a pontuação média de gastrite (0,7 ± 0,2 WT contra
1,7 ± 0,1 KO; * p = 0,0002, n = 15 por genótipo) foi mais grave (Tabela 1) do que em ratinhos WT , e a mucosa do estômago exibiu intramucosal folículos das células B, hiperplasia foveolar e perda de células parietais. Estes dados indicam que CAV1-deficiência está associada com um aumento da resposta inflamatória na mucosa gástrica e uma colonização menos eficiente por H. pylori
.
-relacionados inflamação em ratinhos CAV1-KO, a análise de RT-qPCR seleccionados de citocinas, quimiocinas e marcadores de superfície foi executado (Fig. 2A). Consistente com a inflamação observada, H. pylori
expressão induzida SS1 de TNFalfa e IFNgama na mucosa gástrica de ambos os ratinhos WT e KO. Além disso, afirmado que uma expressão aumentada de ARNm de CD19 (células B) (1,6 ± 0,3 relação
3,3 ± 0,9 KO; p = 0,0512, n = 15 por genótipo) e RANTES (CCL5) (1,3 ± 0.2 WT contra
2,1 ± 0,6 KO; p = 0,0449; n = 15 por genótipo) em tecido gástrico de H. pylori
infectados ratos CAV1-KO comparação com ratinhos WT infectados. Em contraste, os níveis de ARNm de células CD4 (células T auxiliares), CD25 (células T reguladoras) e CD86 (células apresentadoras de antigénio) foram suprimidas por H. pylori
independentemente do estado CAV1. A imuno-histoquímica (IHQ) detectou um aumento acentuado da F4 intramucoso macrófagos /80-positivas no tecido gástrico de ratos infectados CAV1-KO em comparação com WT littermates (Fig. 2B). linfócitos CD3-positivas foram localizadas em torno e dentro de folículos intramucosal (dados não mostrados).
KO, n = 9 por genótipo), caracterizada por inflamação, erosão e ulceração, os ratinhos deficientes em CAV1 também expressaram quantidades aumentadas de mRNAs que codificam para a úlcera proteínas cura trefoil fator-2 (TFF2) (0,8 ± 0,3 WT contra
2,3 ± 0,4 KO; * p = 0,0048; n = 9 por genótipo) e peroxissoma receptor- ativado por proliferadores gamma (PPARg) (0,6 ± 0,2 WT contra
2,5 ± 0,5 KO; * p = 0,0008; n = 9 por genótipo). Em suma, estes dados indicam que a perda de CAV1 aumenta a susceptibilidade de camundongos a danos inflamação e tecido gástrico.
CAV1 nem aderência altera de H. pylori
cepas de nem a sobrevivência das células GC humanos
infecção in vitro
, a linhagem humana gástrica células epiteliais foi usada AGS que tinham sido transfectadas de forma estável com o plasmídeo CAV1 expressão (AGS /CAV1) ou vazio vetor (AGS /EV) [37]. Em primeiro lugar, examinamos se CAV1 influencia a sobrevivência celular em cima H. pylori
infecção (Fig. 3A). clones AGS com e sem CAV1 foram infectados durante 48 h com a adaptação de células CagA-delivery competente H. pylori
estirpe G27 em diferentes multiplicidades de infecção (MOI) variando de 1:100 para 1:2000. ensaios MTT colorimétrico CAV1 revelou que não teve nenhum efeito sobre a sobrevivência geral de células AGS mediante H. pylori
infecção. Resultados semelhantes foram obtidos com incompetente CagA de entrega H. pylori
SS1 e por análise Western Blot (WB) a detecção da expressão e fosforilação de quinases de sobrevivência (AKT /PKB, ERK1 /2, p38MAPK) (dados não mostrados). Uma vez que tanto H. pylori Comprar e CAV1 interagir dentro de jangadas lipídicas, foi perguntado se a adesão de bactérias às células depende da presença de CAV1. AGS /CAV1 e células /EV AGS foram infectadas (MOI = 10) com G27 (Fig. 3B, C) ou SS1 (dados não mostrados) bactérias durante 30 min, seguido de lavagem e posterior incubação em meio fresco durante 2 h. Em seguida, as células foram coradas para a microscopia de imunofluorescência, e o número de bactérias que adere ao CAV1-expressar ou células transfectadas com vector vazio foram contadas (Fig. 3B e C). Não foram observadas diferenças de adesão entre AGS /CAV1 e células AGS /EV, sugerindo que CAV1 não influencia a adesão do H. pylori
bactérias às células hospedeiras.
tensões e translocação de CagA para o citosol [47]. Para examinar o papel do CAV1 neste rearranjo induzida pelo estresse do citoesqueleto de actina, AGS /CAV1 e AGS /EV foram infectadas durante 16 horas com H. pylori
G27 em peso
ou o mutante isogênico Delta cagA
(MOI = 100). As células infectadas foram corados tal como descrito acima, e os números de células foram determinados AGS alongados (Fig. 4A, B). células AGS CAV1 deficientes mostraram morfologias consideravelmente mais alongados do que as células CAV1 expressando (11 ± 0,8% AGS /EV contra
4 ± 0,8% AGS /CAV1; * p = 1,1 × 10 -8; N = 3, por clone). Como esperado, nenhum fenótipo "pássaro do zumbido" foi obtida em células infectadas com o CagA-SS1 entrega deficiente ou mutante CagA-supressão G27 Delta cagA
que são ambos capazes de injectar proteína CagA funcional nas células hospedeiras (dados não mostrados). células AGS /EV também produziu mais mRNA IL8 em cima H. pylori
infecção G27 do que as células AGS /CAV1 (64 ± 19 EV contra
19 ± 6 CAV1; * p = 0,0176; n = 3 por clone) (Fig. 4C). Estes dados indicaram que CAV1 protege contra o estresse celular relacionados com CagA.
G27. Estes dados confirmaram que as células AGS /CAV1 infectadas com CagA-delivery competente H. pylori
mantiveram a sua forma epitelial propagação-out, em comparação com o fenótipo alongada estressado de células CAV1 /EV.
G27 desencadeia ligação de p120RhoGAP /DLC1 para CAV1 em células GC humanos
G27. A infecção de células AGS evocou uma fosforilação rápida de CAV1 nas células AGS /CAV1 e de Src em ambos os AGS células /CAV1 e AGS /EV. Este resultado indicou que CAV1 actua a jusante da activação de Src dependentes de CagA, mas a montante da activação das GTPases pequenas (Fig. 5A, B). Consistente com esta conclusão, os níveis de proteína JNK de fosforilada, que reside abaixo da Src, foram mais elevados nas células AGS /EV em comparação com células AGS /CAV1.
bactérias G27 com CAV1 em CoIP ou experiências de imunofluorescência (Fig. 6A, B). ensaios de protecção de gentamicina revelou que a quantidade total de CagA intracelular injetada também foi independente da presença de CAV1 (Fig. 6C). Assim, CAV1 nem inibiu a adesão de H. pylori
bactérias nem a injecção de CagA na célula hospedeira, mas em vez reduziu os efeitos a jusante de CagA na sinalização intracelular.
G27 (MOI = 100), seguido de lise das células à temperatura ambiente em MES-buffered 1% (v /v) de Triton-X100. bandas de proteína precipitada pelo anti-soro CAV1 foram visualizadas por coloração com prata, e foram identificados péptidos por MALDI-MS, tal como publicado anteriormente [29]. Um fragmento da proteína de -95 kDa continha péptidos correspondentes a variante 4 do p120 Rho GTPase-activating protein /suprimido no fígado cancro-1 (p120RhoGAP /DLC1) [51], [52], um supressor de tumor associado com adesões focais e /caveolae jangadas lipídicas [53]. variante DLC1 4 (DLC1v4) tem um tamanho previsto de ~110 kDa e foi enriquecida em amostras de células que tinham sido infectados com H. pylori
G27 em comparação com células não infectadas (Tabela S2). Estes resultados foram confirmados por CoIP de CAV1 e proteína DLC1 endógeno em células AGS /CAV1 (Fig. 7B), o que indica que H. pylori
G27 evocou uma contratação específica de DLC1 para CAV1 em células epiteliais gástricas humanas infectadas.
G27 (MOI = 100) para obter 16 h. imunofluorescência revelou que DLC1 per se
não inibiu a formação do fenótipo "pássaro do zumbido" induzida por CagA (19 ± 2% AGS /DLC1 contra
19 ± 2% AGS /EV; N = 3, por clone) em comparação com células transfectadas com vector vazio (Fig. 8A, B). Em vez disso, DLC1 promovido espalhando celular (20 ± 3% AGS /DLC1 contra
11 ± 2% AGS /EV; * p = 0,0067; n = 3 por clone) consistente com o seu papel na regulação de adesões focais [ ,,,0],pylori
estirpes. H. H. pylori
infecção. pylori
.
 7 razões pelas quais você está inchado
7 razões pelas quais você está inchado
 Encontrar tratamento para retocele
Encontrar tratamento para retocele
 Pólipos do cólon (pólipos intestinais)
Pólipos do cólon (pólipos intestinais)
 O melhor parceiro de equipe de tag de dieta SCD:naltrexona em dose baixa?
O melhor parceiro de equipe de tag de dieta SCD:naltrexona em dose baixa?
 Coisas legais e gratuitas – porque ficamos trancados no porão
Coisas legais e gratuitas – porque ficamos trancados no porão
 Micróbios podem predizer resultados fatais em pacientes ventilados com COVID-19
Micróbios podem predizer resultados fatais em pacientes ventilados com COVID-19
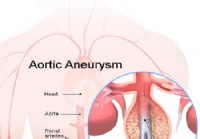 Aneurisma da aorta abdominal
Fatos que você deve saber sobre aneurismas da aorta abdominal Imagem de stent enxertado para reparar um aneurisma de aorta abdominal Qual é a definição médica de aórtica aneurisma? Um aneurism
Aneurisma da aorta abdominal
Fatos que você deve saber sobre aneurismas da aorta abdominal Imagem de stent enxertado para reparar um aneurisma de aorta abdominal Qual é a definição médica de aórtica aneurisma? Um aneurism
 Pacientes devem ficar atentos a problemas após cirurgia de cólon
Últimas notícias sobre câncer Você não precisa ser fumante para ter câncer de pulmão Progresso no câncer de pulmão leva ao declínio geral Medicamentos imunológicos combatem o câncer de endométrio As
Pacientes devem ficar atentos a problemas após cirurgia de cólon
Últimas notícias sobre câncer Você não precisa ser fumante para ter câncer de pulmão Progresso no câncer de pulmão leva ao declínio geral Medicamentos imunológicos combatem o câncer de endométrio As
 A microbiota rural e urbana diferem desde tenra idade,
encontra novo estudo Um novo estudo mostrou que as diferenças no microbioma intestinal humano entre as pessoas que vivem nas áreas rurais e nas áreas urbanas da Nigéria começam em uma idade muito jov
A microbiota rural e urbana diferem desde tenra idade,
encontra novo estudo Um novo estudo mostrou que as diferenças no microbioma intestinal humano entre as pessoas que vivem nas áreas rurais e nas áreas urbanas da Nigéria começam em uma idade muito jov