Abstract
Auto-Imunes resultados gastrite da quebra de tolerância de células T a H gástrica + /K + ATPase. O H gástrica + /K + ATPase é responsável pela acidificação de suco gástrico e é composto por uma subunidade α (H /Ka) e uma subunidade β (H /Kβ). Aqui nós mostramos que CD4 + T células de ratinhos H /Ka-deficiente (H /Ka - /-) são altamente patogênico e auto-imune gastrite pode ser induzida em subletal irradiados ratinhos de tipo selvagem por transferência adotiva de não fracionada CD4 + células T de H /Ka - /- ratos. Todos os ratinhos receptores desenvolvido de forma consistente a forma mais grave da gastrite auto-imune 8 semanas após a transferência, com hipertrofia da mucosa gástrica, a completa depleção das células parietais e zimogénica, e presença de auto-anticorpos a H + /K + ATPase no soro. Além disso, foi demonstrado que a doença afetou significativamente o peso do estômago e pH do estômago de ratos destinatário. Depleção de células parietais neste modelo de doença exigido a presença de ambos H /Ka e H /Kβ desde transferência de H /Ka - /- CD4 + células T não resultou em depleção de células parietais no H /ratinhos receptores - Ka - /- ou H /Kβ - /. A consistência da gravidade da doença, a utilização de células T policlonais e uma resposta de células T específico para o auto-antigénio gástrica tornar este um modelo de doença ideal para o estudo de diversos aspectos da auto-imunidade específica de órgãos, incluindo a prevenção e tratamento da doença. Citation: Tu E, Ang DKY, Hogan TV, Leia S, Chia CPZ, Gleeson PA, et al. (2011) um modelo conveniente de grave, alta incidência auto-imune gastrite causada por células Polyclonal T efetoras e sem perturbação de células T reguladoras. PLoS ONE 6 (11): e27153. doi: 10.1371 /journal.pone.0027153 editor: Ciriaco A. Piccirillo, McGill University Health Center, Canadá | Recebido: 21 Janeiro, 2011; Aceito: 11 de outubro de 2011; Publicação: 09 de novembro de 2011 Direitos de autor: © 2011 Tu et al. Este é um artigo de acesso aberto distribuído sob os termos da Licença Creative Commons Attribution, que permite uso irrestrito, distribuição e reprodução em qualquer meio, desde que o autor original ea fonte sejam creditados Financiamento:. Este trabalho foi apoiado por bolsas de investigação a partir do National Health and Medical Research Council da Austrália e da Universidade de Melbourne. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito Conflito de interesses:. Os autores podem confirmar que Simon Leia estava na Universidade de Melbourne quando este estudo foi concluída e que a Novo Nordisk é o seu endereço atual. Os autores declararam não existem interesses conflitantes. gastrite auto-imune é um excelente sistema para investigar a perda de tolerância de células T a auto-tecidos, uma vez que é uma doença auto-imune bem caracterizada com um antigénio alvo conhecido e o modelo de rato da doença tem muitas semelhanças com o equivalente humano. A anemia perniciosa, a fase final de gastrite auto-imune, tem uma prevalência estimada de 1,9% na população adulta ocidental com idade superior a 60 anos [1], que representa a causa mais comum de vitamina B 12 deficiência em idosos [2] . gastrite auto-imune apresenta infiltração de células mononucleares na submucosa que se estende para dentro da mucosa gástrica, o esgotamento das células parietais gástricas e zimogénica e hipertrofia da mucosa gástrica [1]. O antigénio alvo na gastrite auto-imune foi identificado como o gástrica H + /K + ATPase expressa pelas células parietais gástricas [3] - [5]. O gástrica H + /K + ATPase é uma bomba de protões membrana responsável pela acidificação do suco gástrico, e é um heterodímero que consiste numa subunidade catalítica α (H /Ka) e uma glicoproteína β subunidade (H /Kβ). Estudos anteriores demonstraram que ambos H /Ka e H /Kβ são orientados na gastrite auto-imune [4], [6] - [8]. É bem documentado que, em ambos os ratos e homem, CD4 + células T que reconhecem o gástrica H + /K + ATPase iniciar gastrite auto-imune, enquanto + células T CD8 e células B são ineficazes ao fazê-lo [7] - [17]. No entanto, após o início da doença, auto-anticorpos para o H + /K + ATPase são produzidos e são uma ferramenta de diagnóstico muito útil da doença, embora eles não são patogénicas [3], [16], [18 ]. ratinhos BALB /c foram mostrados para ser o mais susceptível a gastrite auto-imune induzida por linfopenia com uma incidência de 30-90% [19], [20]. A doença pode ser induzida por timectomia de ratinhos 3 dias de idade ou para adultos timectomia combinada com uma dose única de ciclofosfamida [19], [21]. Apesar disso, é difícil de avaliar os efeitos terapêuticos dos tratamentos administrados a ratinhos thymectomised desde um espectro de gravidade da doença de ligeira a grave é sempre observada e incidência é variável, assim, grandes tamanhos de grupo são necessários para testar a significância estatística. Além disso, a cirurgia envolvidos e manutenção pós-operatório dos animais é tecnicamente exigente. gastrite auto-imune, também pode ser induzida em ratinhos BALB /c ratinhos através de imunização com antigénios gástrica H + /K + ATPase [5]. No entanto, a doença é reversível após a cessação da imunização e tem uma severidade baixa. A transferência de células T BALB /c depletados de células T reguladoras (Treg) em ratinhos receptores atímicos provoca gastrite auto-imune grave [15]. Portanto, é impossível para dissecar a relação entre as células T auto-reactivas e células Treg durante o desenvolvimento da doença neste cenário vez que as células Treg estão ausentes. alta incidência de gastrite auto-imune espontânea é observado em camundongos transgênicos expressando um determinado TCR para H /Ka [8]. No entanto, estes ratos não representam um modelo de doença ideal para todos os experimentos porque a natureza monoclonal das células T patogênicas não recapitular a resposta policlonal que ocorre em condições fisiopatológicas. A partir desta perspectiva, foi desenvolvido um modelo de doença que contou com a transferência de células policlonal T de /Ka-deficiente (H /Ka - /-) H ratos em camundongos de tipo selvagem subletal irradiados. Demonstrou-se que os ratos que receberam as células T não fraccionadas a partir de H /Ka - /- murganhos todos sucumbiu à gastrite auto-imune mais grave com alterações patológicas observadas em todo o estômago inteiro. Além disso, estas alterações patológicas afectado significativamente a fisiologia do estômago. Nós demonstramos a utilidade deste modelo, mostrando que o desenvolvimento de gastrite auto-imune neste modelo era estritamente dependente da presença de ambos H + /K + ATPase aep subunidades. T elevado e resposta das células B em H /Ka - /- ratos após a imunização com H + /K + ATPase a fim de ter um sistema que é adequado para o estudo de diferentes aspectos da auto-imunidade, foi estabelecido um modelo de doença em que a doença é causada por células T policlonais patogénicos e a gravidade da doença é consistentemente grave. Uma resposta de células T a H /Ka é necessário para o aparecimento de gastrite auto-imune e pode ser a fonte dominante de epítopos auto-reactivos gástricas [7], [8], [22]. Como a tolerância das células T a H /Ka era improvável de ocorrer em H /Ka - /- ratos, investigamos se as células T que eram específicas para H + /K + ATPase e capaz de causar a gastrite estavam presentes em H /Ka - /-. camundongos para determinar se houve elevada respostas imunes a H + /K + ATPase no H /Ka - /- ratinhos relativamente a ratinhos de tipo selvagem, os ratos foram imunizados duas vezes com purificada gástrica H + /K + ATPase. Após a imunização, os auto-anticorpos específicos para H + /K + ATPase foram detectados no imunizados H /Ka - /- ratos, mas não em ratinhos de tipo selvagem (Figura 1A). resposta das células T a in vitro CD4 + células T de H /Ka - /- ratos foram Para determinar se transferência adoptiva de células T de H /Ka - /- ratos seria capaz de causar gastrite auto-imune, que enriqueceu CD4 + T células de ambos H /Ka - /- ratos ou de tipo selvagem para -85 % de pureza e transferido 5 × 10 7 destas células em camundongos de tipo selvagem subletal irradiados. Uma vez que foi demonstrado anteriormente que o H + /K-específica da ATPase + CD4 + células T foram rapidamente eliminadas na periferia e incapaz de induzir a gastrite auto-imune em ratinhos não-irradiados de tipo selvagem [24], toda ratinhos receptores utilizados neste estudo foram levemente irradiados a 600 rads para melhorar a sobrevivência de células T transferidas a partir de H /Ka - /-. Oito semanas após a transferência, os ratinhos que receberam H /Ka - /- células CD4 + T todos desenvolvidos as formas mais graves da gastrite auto-imune (pontuação 5 e 6). Isto foi demonstrado pela depleção completa das células parietais e células zimogénica, e hipertrofia da mucosa gástrica (Figura 2A, 2B). Em contraste, os ratinhos que receberam tipo selvagem CD4 + células T foram completamente livre de gastrite (Figura 2A, 2B), que indicou que a gastrite auto-imune em ratinhos que receberam H /Ka - /- CD4 + células T não foi causado por irradiação per se as alterações patológicas no estômago de ratos gástricas afetou significativamente sua fisiologia estômago. Hipertrofia da mucosa gástrica resultou no aumento das rugas estômago (Figura 2C) e um aumento no peso do estômago (Figura 2D). Em segundo lugar, a depleção de células parietais causou um aumento do pH do estômago devido à falta de secreção de ácido (Figura 2E). Além disso, os auto-anticorpos específicos para o gástrica H + /K + ATPase poderia ser detectado em todos os ratinhos gástricas (Figura 2F). Os auto-anticorpos atinge níveis elevados em todos os ratinhos de 6 semanas após a transferência (Figura 2G). Juntos, estes resultados demonstraram a presença de alta patogenicidade H + /K células T específicos ATPase + em H /Ka - /-. Camundongos gastrite auto-imune foi causado por CD4 + T mediada por células inflamação Os ratos com gastrite auto-imune induzida pela transferência de H /Ka - /- CD4 + células T tinham significativamente mais células em sua linfa paragastric-drenagem estômago nodos em comparação com ratinhos normais e ratinhos que receberam células T + CD4 a partir de dadores de tipo selvagem. Em contraste, não houve diferença no tamanho do nódulo linfático inguinal entre ratinhos gástricas e não-gástricas (Figura 3A). Isto sugere que o aumento da celularidade dos gânglios linfáticos paragastric em ratinhos gástricas foi causada por inflamação gástrica local e não pela sobrevivência preferencial ou expansão de H /Ka - /- CD4 + células T, em comparação com o tipo selvagem CD4 + T após a transferência nestas experiências, as células do doador H /Ka -. /- ou ratos de tipo selvagem pode ser diferenciada de células receptoras, porque eles suportaram diferentes alelos CD90. A população de doadores no linfonodo paragastric de ratos que receberam H /Ka - /- CD4 + T células tinham significativamente mais + células T CD4 com um fenótipo efetoras /memória (CD44 hiCD62 LO) em comparação com os ratinhos que receberam células CD4 tipo selvagem + células T. No entanto, os níveis de células T efectoras /memória foram semelhantes no nódulo linfático não-drenagem (Figura 3B). Juntos, estes resultados sugerem que o desenvolvimento de gastrite auto-imune em ratinhos que receberam células CD4 + células T a partir de H /Ka - /- ratos foi causada por uma resposta inflamatória mediada pelas células T no ambiente gástrico, em vez de um resposta mais generalizada. o desenvolvimento de gastrite auto-imune neste modelo de doença não foi associada com um nível reduzido de T reguladoras (Treg) células uma vez que ratinhos gástricas contidos proporções semelhantes de células T reguladoras no nódulo linfático em relação ao não paragastric -gastritic controlos (Figura 4A, 4B). Na verdade, significativamente mais células Treg foram encontrados no estômago de ratos com gastrite auto-imune (Figura 4A, 4C) H /Ka -. /- CD4 + células T induzida rapidamente dano tecidual no estômago a gravidade da gastrite auto-imune foi analisada em vários pontos de tempo após a transferência de H /Ka - + células T CD4 T - /. depleção moderada das células parietais e células zimogénica, como indicada por uma pontuação de gastrite de 4 [24], pode ser observado tão cedo como 2 semanas após a transferência e a doença progrediu rapidamente com a maioria dos ratinhos que mostra gastrite grave, como mostrado por uma gastrite pontuação de 5 e 6, 4 semanas depois da transferência (Figura 5). Demonstrámos que os ratos com gastrite auto-imune tinha um maior peso do estômago do que os ratos livres de doenças devido à hipertrofia da mucosa gástrica (Figura 2D). Por isso, nós investigamos se o peso do estômago pode ser usado como uma medida quantitativa para a gravidade da gastrite auto-imune. Para outro teste se o peso do estômago poderia diferenciar entre diferentes gravidades do gastrite auto-imune, examinamos os ratos neonatal-thymectomised como poderia ser obtido um maior número de ratos com pontuações doença variáveis. Nós descobrimos que havia diferenças significativas no peso do estômago média entre cada um dos cinco primeiros níveis de gastrite auto-imune (escore 0-4) (Figura 6). No entanto, os pesos médios das pontuações do estômago gastrite 4, 5 e 6 não foram significativamente diferentes um do outro (Figura 6). Isto é provavelmente devido ao facto de que o grau de hipertrofia da mucosa gástrica não aumentar à medida que a doença progride para as fases finais a hipótese de que a patogenicidade de CD4 + células T a partir de H /Ka - /- ratos foi causado pela a falta de tolerância a H /Ka na ausência desta auto-antigénio gástrico. Para testar isso, as células T + CD4 foram transferidos do H /Ka - /- ratos em subletal irradiados H /Ka - ratos e de tipo selvagem - /. Demonstrou-se que H /Ka, na ausência de H /Kβ, não pode ser apresentado pelas moléculas do MHC [25] (S Allen, comunicação pessoal). Nós, portanto, transferido CD4 + T células de H /Ka - /- ratos em subletal irradiados H /Kβ - /- ratos e comparou-os com H /Ka - /- e de tipo selvagem ratos destinatário. A análise do ataque auto-imune na mucosa gástrica é complicada em H /Ka - /- e H /Kβ - /- murganhos pelas mudanças que ocorrem na mucosa gástrica uma vez que uma falta de ácido gástrico nestes murganhos resulta em níveis elevados da hormona gastrina trófico. Isto leva a hipertrofia constitutiva e depleção de células zimogénica [26],. Por conseguinte, a fim de avaliar se uma resposta auto-imune ataca a mucosa gástrica nestes ratinhos, que em vez determinada a prevalência de células parietais, que são normalmente empobrecido em gastrite auto-imune, mas são encontrados em abundância em H /Ka - /- e H /Kβ - /- ratos, e também a presença de auto-anticorpos gástricas a morfologia do estômago em H /Ka -. /- ratos ou H /Kβ - /- ratos não foi afetada pela transferência de H /Ka - /- CD4 + células T (Figura 7A, 7B). Em particular, não houve depleção de células parietais, indicando a falta de uma resposta auto-imune. Em contraste, a depleção completa de células parietais foi observada em ratinhos de tipo selvagem beneficiários que receberam H /Ka - /- CD4 + células T (Figura 7C). Desde estômagos de H /Ka - /- e H /Kβ - /- camundongos pareciam diferente de ratos normais e gástricas, não foi possível avaliar estes ratos usando nosso sistema de gastrite pontuação padrão. No entanto, H + /K auto-anticorpos específicos ATPase +, outra marca registrada de gastrite auto-imune, não foram detectados no soro de ambos H /Ka - /- e H /Kβ - /- ratos destinatário, mas foram detectados em ratinhos de tipo selvagem receptores (Figura 7D). Estes resultados demonstraram que era necessária a presença de ambas as subunidades aep para a depleção de células parietais por H /Ka - /-. CD4 + T células Discussão gastrite auto-imune pode ser induzida em ratinhos BALB /c por vários meios, incluindo a timectomia neonatal, a timectomia adulto com ciclofosfamida [19], [21], a imunização com gástrica H + /K + ATPase [5] e geração de H + /K ratinhos transgénicos específicos ATPase + TCR [7], [8]. No entanto, um sistema imunitário dominadas pelas células T com uma única especificidade como observado em ratinhos transgénicos TCR não se assemelha a condições fisiológicas normais. Além disso, timectomia e imunização não conferem a gravidade da doença consistentes e são tecnicamente exigente, o que o torna inconveniente para usar estes modelos para a análise de imunoterapias. Por isso, desenvolveu um novo modelo de doença que contou com a transferência de células T de H /Ka - /-. Ratos, uma população policlonal que continha células T altamente gastritogenic Nós descobrimos que a imunização de H /Ka - /- ratos com purificada H + /K + ATPase induziu uma resposta de células T vigorosa como o resultado da falta de tolerância da célula T para o auto-antigénio gástrico, o que indicou a presença de H + /K a população de células de doadores do H /Ka - /- ratos foi enriquecido a -85% CD4 + células T por um procedimento de "selecção negativa" porque o principal objetivo deste trabalho foi produzir um simples , modelo de doença de baixo custo e conveniente. Conclui-se que é o CD4 + células T no inoculo que causaram a gastrite auto-imune, uma vez que foi firmemente estabelecida por vários estudos que CD4 + células T e não outros tipos de células são capazes de iniciar a gastrite auto-imune [7 ] - [17]. É claro que as populações de células T e B reactivas ao H + /K + ATPase estão presentes no repertório de ratinhos normais [5], [14] - [16], [21], [24 ], [28] - [33]. Por isso, sugerimos que o H + /K + ATPase-específicos de células T e B a partir do receptor são então recrutados para a lesão e as células derivada do receptor B são responsáveis pela produção de auto-anticorpos. foi anteriormente documentado que as células T CD4 + T a partir de H /Kβ - /- ratos induzir a gastrite auto-imune em ratinhos BALB /c atímicos, mas não nos ratinhos do tipo selvagem irradiados [24]. CD4 + células T de H /Ka - /- ratos causou gastrite em ratinhos de tipo selvagem irradiados sugerindo que esta população é mais patogênico de CD4 + células T de H /Kβ - /- ratos . Estes dados suportam um papel mais dominante para a resposta imune contra H /Ka na patogênese da gastrite auto-imune, consistentes com as descobertas em ratos transgénicos TCR [7], [8]. Ao contrário de outros modelos de doenças que utilizaram células Treg células policlonal T -depleted de ratinhos de tipo selvagem para induzir a auto-imunidade [15], não foi necessário para remover as células Treg de H /Ka - /- CD4 + população de células T para a indução de gastrite auto-imune grave. Além disso, o desenvolvimento de gastrite auto-imune em ratinhos receptores não foi causada por um nível reduzido de células Treg da população de dadores de ratinhos desde gástricas continha proporção semelhante de células T reguladoras no nódulo linfático paragastric comparação com os controlos não-gástricas. Nós já demonstraram que as células Treg de H /Ka - /- ratos foram tão eficazes como as células Tregs de ratinhos de tipo selvagem na supressão /células H Ka-específicas T auto [34]. Portanto, nossos resultados aqui apoiar o trabalho anterior indicando que repertórios de células T que não haviam sido submetidos a supressão de células T periféricas são incapazes de ser suprimida pela população de células normais Treg [24], [35]. Apesar de um nível normal células de Treg foi detectado no nó de linfa de ratos paragastric gástricas, e uma percentagem significativamente mais elevada de células T reguladoras foi encontrado no estômago de ratos gástricas em comparação com ratinhos normais, células Treg não foram capazes de prevenir ou suprimir a doença. Isto é consistente com a constatação de que, embora as células Treg acumulado no SNC quando encefalomielite alérgica experimental foi provocada [36], que não foram capazes de impedir a expansão e a função das células T específicas de glicoproteína de mielina de oligodendrócitos, uma vez que o meio de citocina inflamatória local rendeu as células T patogênicas resistentes à supressão Treg. a depleção de células parietais é uma característica da gastrite auto-imune e a principal razão que a anemia perniciosa é uma doença com risco de vida porque as células parietais produzir fator intrínseco, a falta de que é fatal . Descobrimos que a depleção de células parietais neste modelo de doença era dependente da presença de ambos H + /K + ATPase subunidades como CD4 + células T de H /Ka - /- ratos somente induziu depleção de células parietais em ratinhos de tipo selvagem, mas não no H /Ka - /- e H /Kβ - /- ratos. depleção de células parietais não foi causada por resposta das células T para o H /Kβ desde H /Ka - /- CD4 + células T não induziu depleção de células parietais no H /Ka - /- ratos destinatário enquanto H /Kβ foi expressa nestes ratinhos [26]. Por outro lado, a ausência de parietal depleção de células em H /Kβ - ratinhos receptores que receberam H /Ka - - //- CD4 + células T reforçado nossos estudos anteriores que sugerem a necessidade de H /Kβ para que H /Ka a ser apresentado pelo MHC moléculas [22]. Juntos, estes resultados sugerem que a depleção de células parietais, neste modelo de transferência desenvolvido como uma consequência de respostas imunitárias a H /Ka por CD4 + células T de H /Ka - /- ratos. Notamos que em trabalhos anteriores, descobrimos que células parietais não estão esgotados tanto no H /Ka - /- nem H /Kβ - /- ratos após timectomia neonatal, o que evidencia a consistência deste novo modelo com resultados obtidos com este modelo anterior, bem estabelecida. também demonstramos aqui que o peso do estômago pode ser usado como uma medida quantitativa da gravidade da doença, uma vez hipertrofia da mucosa gástrica foi observada em ratinhos com gastrite auto-imune e resultou no aumento do peso do estômago [37]. Houve uma correlação significativa entre o peso do estômago e da gravidade da gastrite auto-imune em ratinhos que receberam H /Ka - /- CD4 + células T. Essa correlação foi ainda confirmada em ratos neonatal-thymectomised, com o peso do estômago média em cada gastrite marcar sendo significativamente diferente para outro. No entanto, devido à variação dentro dos grupos, grande tamanho da amostra será necessária se o peso do estômago é para ser utilizada para estimar a gravidade da doença. Portanto, o exame histológico combinado com peso do estômago pode ser visto como medidas complementares para avaliar a gravidade da gastrite auto-imune Nós mostramos que a gastrite auto-imune induzida por transferência adoptiva de H /Ka -. /- CD4 + células T representado um modelo de doença excelente para a dissecação de resposta auto-imune e o desenho de terapias intervencionistas para doenças auto-imunes. Neste modelo de doença, gastrite auto-imune foi causada por uma população de células T policlonal não fraccionada que continham células T patogénicas específicas para um único antigénio, e a gravidade da doença consistente de alta qualidade é observada em todos os ratinhos receptores. Além disso, mostramos que a gravidade da doença pode ser facilmente determinada pelo peso do estômago, pH do estômago e do exame histológico da seção de estômago. Ética declaração Este trabalho busca para se obter um conhecimento mais detalhado de doença auto-imune e os mecanismos imunológicos que impedem que a auto-imunidade em indivíduos normais. À medida que o sistema imunológico é uma rede extremamente complexa, integrada, os animais são necessários para avaliar correctamente estes problemas. A maioria dos procedimentos foram realizados ensaios clínicos em amostras de sangue e de tecido retiradas de murganhos que são mantidos em excelentes condições de alojamento . Os ratinhos foram monitorizados de perto e mortos se severamente afetados ou angustiado. Ao término de cada experimento, os ratos foram mortos por asfixia com CO2 ou deslocamento cervical, que estão associados com um mínimo de desconforto. Todos os experimentos são cuidadosamente planejadas para reduzir o número de animais e são realizados em estrita observância às diretrizes ditadas pela Universidade do Comitê de Ética em Experimentação animal da Melbourne; a Prevenção da Crueldade contra os Animais Act 1986; e do Código NHMRC /CSIRO /AAC australiano de Prática para o Cuidado e Utilização de animais para fins científicos (1997). Este trabalho foi aprovado pela Universidade do Comitê de Ética Melbourne animal sob o número projeto de 0.706.327,3. Ratos BALB /cCrSlc [38], BALB /cCrSlc.CD90.1 congênica, H /Ka - /- [26], H /Kβ - /- [ ,,,0],27] e BALB.B6- camundongos cong�icas Gasa Anti-CD3-FITC (145-2C11), anti-CD90.1- FITC (HIS51), anti-CD90.2-FITC (30H-12), anti-CD62L-PE (MEL-14), anti-CD4 PerCP (RM4-5), e anti-CD8-APC (53-6,7) foram adquiridos a partir de BD Pharmingen; anti-CD44-APC (IM-7) foi adquirido a partir de eBioscience. coloração intracelular de Foxp3 foi realizada utilizando anticorpos anti-Foxp3-APC (FJK-16S) e Foxp3 Coloração Kit (eBioscience) de acordo com as instruções do fabricante. A citometria de fluxo foi realizada num Becton Dickinson FACSort citómetro de fluxo e analisadas utilizando o software CellQuest Pro ou Beckman Coulter ciano e analisadas usando software de Cúpula. porco purificada gástrica H + /K + ATPase foi preparada numa proporção 01:01 com adjuvante completo de Freund (Life Technologies). Os ratinhos foram injectados por via subcutânea em cada lado da base da cauda. H /Ka - /- e ratinhos BALB /cCrSlc ratinhos foram imunizados duas vezes com 30 ug de H + /K + ATPase, com um mês de intervalo entre as imunizações. Uma semana após a segunda imunização, os ratinhos foram sacrificados para os seus soros e nodos linfáticos inguinais. H + /K auto-anticorpos específicos ATPase + foram detectados por ELISA. As células dos nodos linfáticos inguinais foram usadas num ensaio de proliferação de células T. 1 × 10 5 as células foram cultivadas durante 72 horas com 2 × 10 4 DC do baço de ratinhos BALB /cCrSlc. proliferação de células T foi avaliada por incorporação de 3H-timidina durante os últimas 16 horas de cultura. As células T foram cultivadas em triplicado com qualquer DC com o antigénio (50 ug de membrana gástrica /ml de ratinho) ou com DC sozinhos. gástricas membranas foram preparadas a partir de estômagos de ratinho como anteriormente descrito [5] CD4 + células T foram enriquecidas a >. 85% de pureza a partir de nódulos linfáticos e baços de H /Ka - /- e camundongos BALB /cCrSlc. As suspensões de células isoladas foram incubadas numa mistura de F4 /80 e B220 sobrenadantes de hibridoma mais anticorpo anti-CD8 (53.6.72, BioXCell). As células não-T CD4 + foram removidos usando anti-rato IgG-revestido esferas magnéticas (Dynal, Invitrogen). CD4 + (5 × 10 7) células T a partir de qualquer H /Ka - /- ou camundongos BALB /cCrSlc foram injetadas em subletal irradiados (600 rads) congênica tipo selvagem BALB /cCrSlc.CD90.1 ratinhos por via intraperitoneal. Em algumas experiências, purificou-H /Ka - /- CD4 + células T foram injectadas irradiadas BALB /cCrSlc, H /Ka - /- e H /Kβ - /- ratos. Todos os ratinhos receptores foram irradiados a 600 rads um dia antes da transferência de células T. Oito semanas mais tarde, os ratos receptores foram mortas e estômagos, nódulos linfáticos e soros foram colhidos. BALB /cCrSlc e BALB.B6- camundongos cong�icas Gasa secções de estômago foram examinadas para a presença de alterações patológicas como previamente descrito [24]. Pontuação foi realizada de uma forma cega e cada lâmina foi classificada independentemente por pelo menos duas pessoas. A fim de medir o pH do estômago, os ratos foram fome durante a noite antes do sacrifício. Estômagos foram cortadas aberto e lavadas em 1 ml de solução salina que foi recolhido e medido por um medidor de pH. um ELISA para detectar H + /K ATPase auto-anticorpos específicos + foi realizada utilizando porco purificada H + /K + ATPase tal como previamente descrito [29]. A análise estatística A análise estatística foi realizada utilizando GraphPad Prism 5.0 (GraphPad). Os dados foram analisados utilizando o teste U de Mann-Whitney ou teste de correlação de Spearman e um valor de P < 0,05 foi considerado significativo
Introdução
Resultados
reestimula�o com H + /K + ATPase também foi significativamente maior no H /Ka - /- ratos do que em ratinhos de tipo selvagem (Figura 1B). Portanto, como já foi anteriormente demonstrada em H /Kβ - /- ratos [23], há também uma resposta de células T e B significativa a H + /K + ATPase em H /Ka - /-. camundongos que não está presente em ratinhos de tipo selvagem
altamente patogénica
ratinhos
, mas sim, o inoculo de células T.
peso do estômago pode ser usado como uma medida quantitativa da gastrite auto-imune
A indução de gastrite auto-imune por H /Ka -. /- CD4 + células T era dependente da presença de H /Ka e H /Kβ
Materiais e Métodos
[20] foram previamente descritos. Ambos H /Ka - /- H e /Kβ - /- ratos foram retrocruzados superior a 10 vezes a ratinhos BALB /cCrSlc. H /Ka - /- ratos foram cruzados com ratinhos BALB /c.CD90.1 para gerar H /Ka - /-. Camundongos CD90.1. Todos os ratinhos foram mantidos numa instalação para animais convencional na Ciência e Biotechnology Institute Bio21 molecular, da Universidade de Melbourne. Todos os ratos e os experimentos foram aprovados pela Universidade de Comissão de Ética Experimentação Animal Melbourne.
Os anticorpos e citometria de fluxo análise
Ensaio de respostas de células T em murganhos imunizados com H + /K + ATPase
A indução de gastrite auto-imune em ratinhos
foram utilizados nos experimentos timectomia. timectomia neonatal foi realizada como previamente descrito [20].
O exame histológico dos estômagos e medição do pH gástrico
H + /K enzima específica ATPase + ligada ensaio imunoenzimático (ELISA)
.
 Doença hepática gordurosa não alcoólica:o que você deve saber
Doença hepática gordurosa não alcoólica:o que você deve saber
 Doença celíaca:sintomas, glúten nos alimentos, testes de alergia ao glúten e mais
Doença celíaca:sintomas, glúten nos alimentos, testes de alergia ao glúten e mais
 A pesquisa diz que na infecção canina SARS-CoV-2,
A pesquisa diz que na infecção canina SARS-CoV-2,
 Quanto tempo dura uma fundoplicatura de Nissen laparoscópica?
Quanto tempo dura uma fundoplicatura de Nissen laparoscópica?
 Aderências abdominais (tecido cicatricial no abdômen)
Aderências abdominais (tecido cicatricial no abdômen)
 Por que a qualidade de sua dieta é a melhor receita para uma microbiota intestinal mais saudável e uma saúde melhor
Por que a qualidade de sua dieta é a melhor receita para uma microbiota intestinal mais saudável e uma saúde melhor
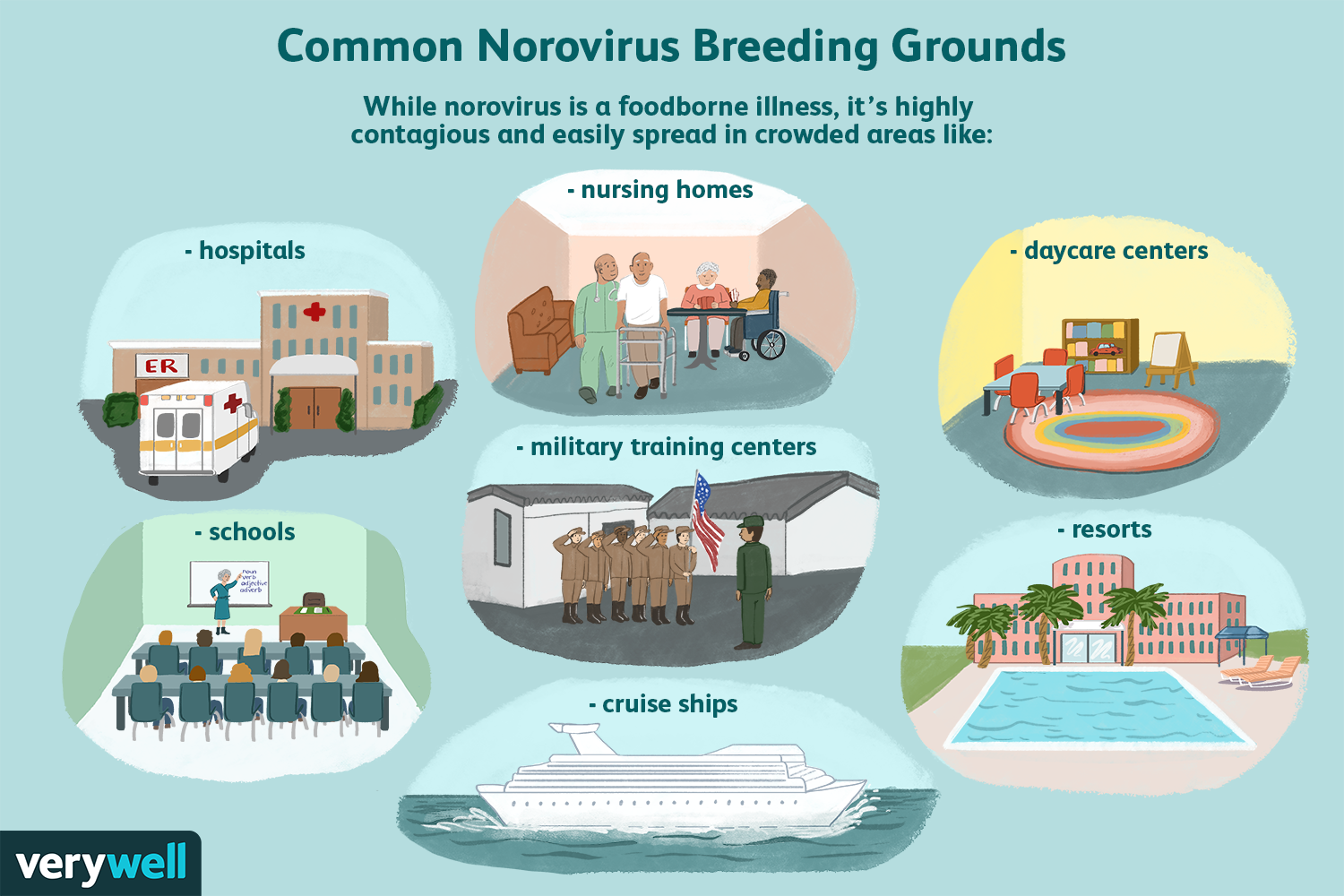 O que é norovírus?
Norovírus é a causa número um de gastroenterite (gripe estomacal) nos Estados Unidos. É um vírus altamente contagioso que causa inflamação no estômago e intestinos. Isso leva a sintomas como cólicas a
O que é norovírus?
Norovírus é a causa número um de gastroenterite (gripe estomacal) nos Estados Unidos. É um vírus altamente contagioso que causa inflamação no estômago e intestinos. Isso leva a sintomas como cólicas a
 constipação crônica
A constipação é a dificuldade de evacuar. A maioria das pessoas experimentou constipação aguda pelo menos uma vez. Ainda assim, a constipação não é considerada um problema crônico, a menos que você te
constipação crônica
A constipação é a dificuldade de evacuar. A maioria das pessoas experimentou constipação aguda pelo menos uma vez. Ainda assim, a constipação não é considerada um problema crônico, a menos que você te
 Lidando com a síndrome do intestino irritável
Acredita-se que a síndrome do intestino irritável (SII) afete de 25 a 45 milhões de americanos, principalmente mulheres desde o final da adolescência até o início dos 40 anos. A condição é uma mistura
Lidando com a síndrome do intestino irritável
Acredita-se que a síndrome do intestino irritável (SII) afete de 25 a 45 milhões de americanos, principalmente mulheres desde o final da adolescência até o início dos 40 anos. A condição é uma mistura