Uma equipe de pesquisa liderada pelo Dr. Aixin YAN, Professor Associado da Divisão de Pesquisa de Biologia Molecular e Celular, Faculdade de Ciência, em colaboração com o Professor Clínico Honorário Patrick CY WOO do Departamento de Microbiologia, Faculdade de Medicina Li Ka Shing, a Universidade de Hong Kong (HKU), relataram o desenvolvimento de uma plataforma baseada em CRISPR tipo I transferível e integrativa que pode editar de forma eficiente os diversos isolados clínicos de
Pseudomonas aeruginosa , uma superbactéria capaz de infectar vários tecidos e órgãos e uma importante fonte de infecções nosocomiais.
p A técnica pode acelerar a identificação de determinantes de resistência de patógenos multirresistentes (MDR) e o desenvolvimento de novas estratégias anti-resistência.
p A pesquisa abriu um novo caminho para editar genomicamente essas espécies bacterianas selvagens e isolados, tais como aqueles com significância clínica e ambiental e aqueles que formam o microbioma humano. Ele também forneceu uma estrutura para aproveitar outros sistemas CRISPR-Cas amplamente difundidos em genomas procarióticos e expandir os kits de ferramentas baseados em CRISPR. A pesquisa foi publicada na principal revista científica
Pesquisa de ácidos nucléicos .
Fundo
p O sistema CRISPR-Cas compreende o sistema imunológico adaptativo em procariotos que desarma os vírus invasores por meio da clivagem de seu DNA. Devido à sua capacidade única de direcionar e alterar sequências de DNA, CRISPR-Cas foi explorado como o método de edição de genoma de próxima geração.
p O método é baseado no sistema Classe 2 tipo II CRISPR / Cas9, que revolucionou a genética e a pesquisa biomédica em uma infinidade de organismos e recebeu o Prêmio Nobel de Química em 2020. Contudo, os sistemas CRISPR-Cas Classe 2 representam apenas ± 10% dos sistemas CRISPR-Cas codificados naturalmente em procariotos. Suas aplicações para editar genomas bacterianos são bastante limitadas.
p Notavelmente, Os sistemas CRISPR-Cas pertencentes a diferentes classes e tipos são continuamente identificados, e eles servem como um reservatório profundo para a expansão dos kits de ferramentas baseados em CRISPR. Os sistemas CRISPR-Cas mais diversos e amplamente distribuídos são o sistema tipo I, que representa 50% de todos os sistemas CRISPR-Cas identificados e tem o potencial de expandir os kits de ferramentas baseados em CRISPR com vantagens distintas não acessíveis com os sistemas de classe 2, como alta especificidade, mínimo fora da segmentação, e capaz de grandes deleções de fragmentos.
p Contudo, sistema CRISPR-Cas tipo I articula-se em um complexo efetor de múltiplos componentes denominado como Cascata para interferir no DNA que não é prontamente transferível para hospedeiros heterólogos, dificultando a aplicação generalizada destes CRISPR naturalmente abundantes para edição de genoma e terapêutica.
Principais conclusões
p Anteriormente, a equipe identificou um sistema CRISPR-Cas tipo I-F altamente ativo em um multirresistente clínico
P. aeruginosa estirpe PA154197 que foi isolada de um caso de infecção da corrente sanguínea no Queen Mary Hospital. Eles caracterizaram este sistema CRISPR-Cas e desenvolveram com sucesso um método de edição de genoma aplicável no isolado MDR com base neste sistema I-F CRISPR-Cas nativo. O método permitiu a rápida identificação dos determinantes de resistência do isolado clínico MDR e o desenvolvimento de uma nova estratégia anti-resistência (
Relatórios de Célula , 2019, 29, 1707-1717).
p Para superar a barreira de transferência do complexo tipo I em cascata para hospedeiros heterólogos, neste estudo, a equipe clonou todo o tipo I-F
cas operon em um vetor proficiente de integração mini-CTX e distribuiu o cassete em hospedeiros heterólogos por conjugação, uma abordagem de transferência de DNA comum na natureza. O vetor mini-CTX permitiu a integração de todo o Cascade ao conservado
attB locus genético no genoma dos hospedeiros heterólogos, permitindo-lhes abrigar um sistema "nativo" tipo I-F CRISPR-Cas que pode ser expresso de forma estável e funcionar.
p A equipe mostrou que o tipo I-F Cascade transferido exibe uma capacidade de interferência de DNA significativamente maior e maior estabilidade de cepa do que o sistema Cas9 transferível e pode ser empregado para edição de genoma com eficiência (> 80%) e simplicidade, isto é, por uma transformação em uma etapa de um único plasmídeo de edição.
p Além disso, eles desenvolveram um sistema transferível avançado que inclui uma cascata de tipo I-F altamente ativa e uma recombinase para promover a aplicação do sistema em cepas com uma capacidade de recombinação homóloga pobre, selvagem
P. aeruginosa isola sem informação de sequência do genoma, e em outro
Pseudomonas espécies.
p Por último, os genes do tipo I-F Cascade introduzidos podem ser facilmente removidos dos genomas do hospedeiro através da deleção mediada por I-F Cascade de grandes fragmentos de DNA, resultando na edição do genoma sem cicatrizes nas células hospedeiras. A aplicação do sistema transferível para repressão gênica também foi demonstrada, destacando as aplicações robustas e diversas do sistema transferível I-F CRISPR desenvolvido.
p O Dr. Aixin Yan previu que este novo método será estendido para editar não apenas patógenos, mas também microbioma para promover a saúde humana.
p Acreditamos que a tecnologia e as terapias baseadas em CRISPR trarão novas esperanças para combater superbugs no futuro . "
Dr. Aixin YAN, Professor adjunto, Divisão de Pesquisa para Biologia Molecular e Celular, Faculdade de Ciência, A Universidade de Hong Kong
 Como encontrar um profissional de medicina funcional confiável
Como encontrar um profissional de medicina funcional confiável
 Qual é o melhor remédio para colite ulcerativa?
Qual é o melhor remédio para colite ulcerativa?
 O panorama geral:como ter um plano pode transformar seu caminho de cura
O panorama geral:como ter um plano pode transformar seu caminho de cura
 Aumento dos riscos de biodefesa representados pela biologia sintética
Aumento dos riscos de biodefesa representados pela biologia sintética
 Couve de Bruxelas assada com óleo de abacate com laranja e romã
Couve de Bruxelas assada com óleo de abacate com laranja e romã
 Granola caseira amigável ao intestino
Granola caseira amigável ao intestino
 5 maneiras simples de combater o refluxo ácido hoje
O refluxo ácido é um distúrbio no qual uma variedade de sintomas comumente experimentados pode se somar e resultar na própria condição. Sintomas como azia, inchaço, arrotos, regurgitação, soluços cons
5 maneiras simples de combater o refluxo ácido hoje
O refluxo ácido é um distúrbio no qual uma variedade de sintomas comumente experimentados pode se somar e resultar na própria condição. Sintomas como azia, inchaço, arrotos, regurgitação, soluços cons
 Exame de sangue oculto nas fezes
O que é um exame de sangue oculto nas fezes? A causa subjacente da mudança na cor, textura ou forma das fezes é responsável por quaisquer sintomas. Fonte:Getty Images O teste de sangue oculto na
Exame de sangue oculto nas fezes
O que é um exame de sangue oculto nas fezes? A causa subjacente da mudança na cor, textura ou forma das fezes é responsável por quaisquer sintomas. Fonte:Getty Images O teste de sangue oculto na
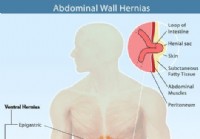 Hérnia (hérnia abdominal) 9 tipos, sintomas, causas e cirurgia
O que é uma hérnia abdominal? Foto de uma mulher com dor de hérnia Uma hérnia abdominal ocorre quando um órgão ou outro pedaço de tecido se projeta através de um enfraquecimento em uma das paredes m
Hérnia (hérnia abdominal) 9 tipos, sintomas, causas e cirurgia
O que é uma hérnia abdominal? Foto de uma mulher com dor de hérnia Uma hérnia abdominal ocorre quando um órgão ou outro pedaço de tecido se projeta através de um enfraquecimento em uma das paredes m