p Nossa abordagem oferece aos pesquisadores a oportunidade de encontrar respostas para perguntas sobre a biologia do muco normal e associada a doenças, como suas contribuições para doenças inflamatórias intestinais e cânceres, e complexas interações hospedeiro-microbioma. Mais importante, usamos células derivadas de pacientes para revestir esses dispositivos e, portanto, isso representa uma abordagem totalmente nova para a medicina personalizada, onde pode ser possível estudar como o muco funciona ou disfunções em um paciente específico, e adaptar a terapia de acordo. "p Ingber também é Professor Judah Folkman de Biologia Vascular na Harvard Medical School e do Programa de Biologia Vascular no Hospital Infantil de Boston, bem como Professor de Bioengenharia na Escola de Engenharia e Ciências Aplicadas John A. Paulson de Harvard. Sua equipe faz parte de uma colaboração multi-institucional apoiada por uma bolsa Grand Challenge do Cancer Research UK, em que sua equipe Wyss investiga como as alterações relacionadas à inflamação contribuem para a formação de cânceres, incluindo cânceres de cólon. O Grande Desafio é uma ambiciosa iniciativa internacional de pesquisa do câncer, apoiando equipes de cientistas líderes mundiais para enfrentar alguns dos desafios mais difíceis do câncer, e dando a eles a liberdade de experimentar novas abordagens em grande escala. p A abordagem da equipe começa com células de cólon derivadas de pacientes de ressecções de cólon e biópsias endoscópicas que são inicialmente cultivadas como "organoides", minúsculas bolas organizadas de tecido do cólon que contêm principalmente células-tronco epiteliais. Depois de fragmentar os organóides, suas células são usadas para preencher a parte superior de dois canais paralelos de um chip microfluídico que são separados por uma membrana porosa. Simplesmente perfundindo os canais continuamente com meio nutriente, as células-tronco do cólon crescem em uma folha contínua e formam células caliciformes altamente funcionais que secretam muco. p "O crescimento das células no chip sob fluxo resulta em cerca de 15% das células epiteliais se diferenciando espontaneamente em células caliciformes. Distribuídas por todo o epitélio, estes produzem uma camada de muco semelhante a in vivo, "disse a primeira autora Alexandra Sontheimer-Phelps, um estudante de graduação da Universidade de Freiburg, Alemanha, trabalhando no grupo de Ingber. "Ao mesmo tempo, outras células epiteliais que continuam se dividindo também reabastecem a população de células caliciformes, assim como no cólon vivo, o que significa que o chip pode ser mantido em condições de estado estacionário por mais de duas semanas, o que o torna muito útil para estudos de longo prazo. " p A equipe de Wyss mostrou que o epitélio do cólon no chip está totalmente polarizado com marcadores distintos restritos ao seu lúmen exposto, lado secretor de muco e seu lado oposto de ligação à membrana. Suas células caliciformes secretam a principal proteína mucina 2 do muco (MUC2), que, quando ligada a cadeias complexas de moléculas de açúcar, se reúne em uma rede multi-molecular ou gel que absorve água. "Nossa abordagem realmente produz a estrutura de duas camadas do muco do cólon normal com uma camada interna densa que mostramos ser impenetrável às partículas que simulam bactérias que fluem através do canal intestinal, e uma camada externa mais solta que permite a entrada de partículas. Isso nunca foi realizado antes in vitro, "disse Sontheimer-Phelps. p Para investigar a funcionalidade do muco, ela e seus colegas de trabalho expuseram o chip ao mediador inflamatório PGE2. O muco sofreu um rápido inchaço em minutos e independente de qualquer nova secreção de muco, e esse processo de acúmulo de muco pode ser visualizado em culturas vivas, observando-se os fragmentos de lado com iluminação de campo escuro. Esta resposta dinâmica pode ser bloqueada pela inibição de um canal iônico específico, que bombeia íons para o epitélio do cólon e permite passivamente que as moléculas de água sigam e, aparentemente, isso leva ao inchaço do muco quando estimulado por sinais como PGE2. p Há muito que se pensa que o muco é um passivo, barreira do hospedeiro, mas está se tornando cada vez mais claro que as espécies microbianas afetam sua estrutura e função, além de se alimentar de seus carboidratos como fonte de energia. "Nosso sistema in vitro nos deixa um passo mais perto de descobrir como espécies bacterianas individuais e comunidades microbianas mais complexas podem afetar o muco e vice-versa, e também como essa interação complexa afeta o desenvolvimento de doenças intestinais. Também temos agora um teste para descobrir novas drogas terapêuticas e estratégias probióticas que podem prevenir ou reverter essas doenças ", disse Ingber.Donald Ingber, M.D., Ph.D., Diretor Fundador, investigador sênior do estudo
 O infliximabe pode prejudicar a eficácia de algumas vacinas COVID-19
O infliximabe pode prejudicar a eficácia de algumas vacinas COVID-19
 Pacientes devem ficar atentos a problemas após cirurgia de cólon
Pacientes devem ficar atentos a problemas após cirurgia de cólon
 As descobertas iniciais do Projeto Microbioma Humano geraram "centenas de estudos subsequentes"
As descobertas iniciais do Projeto Microbioma Humano geraram "centenas de estudos subsequentes"
 O que é um sinal de micção frequente?
O que é um sinal de micção frequente?
 Tipos de tubos de alimentação e seus usos
Tipos de tubos de alimentação e seus usos
 Atopia e doença atópica
Atopia e doença atópica
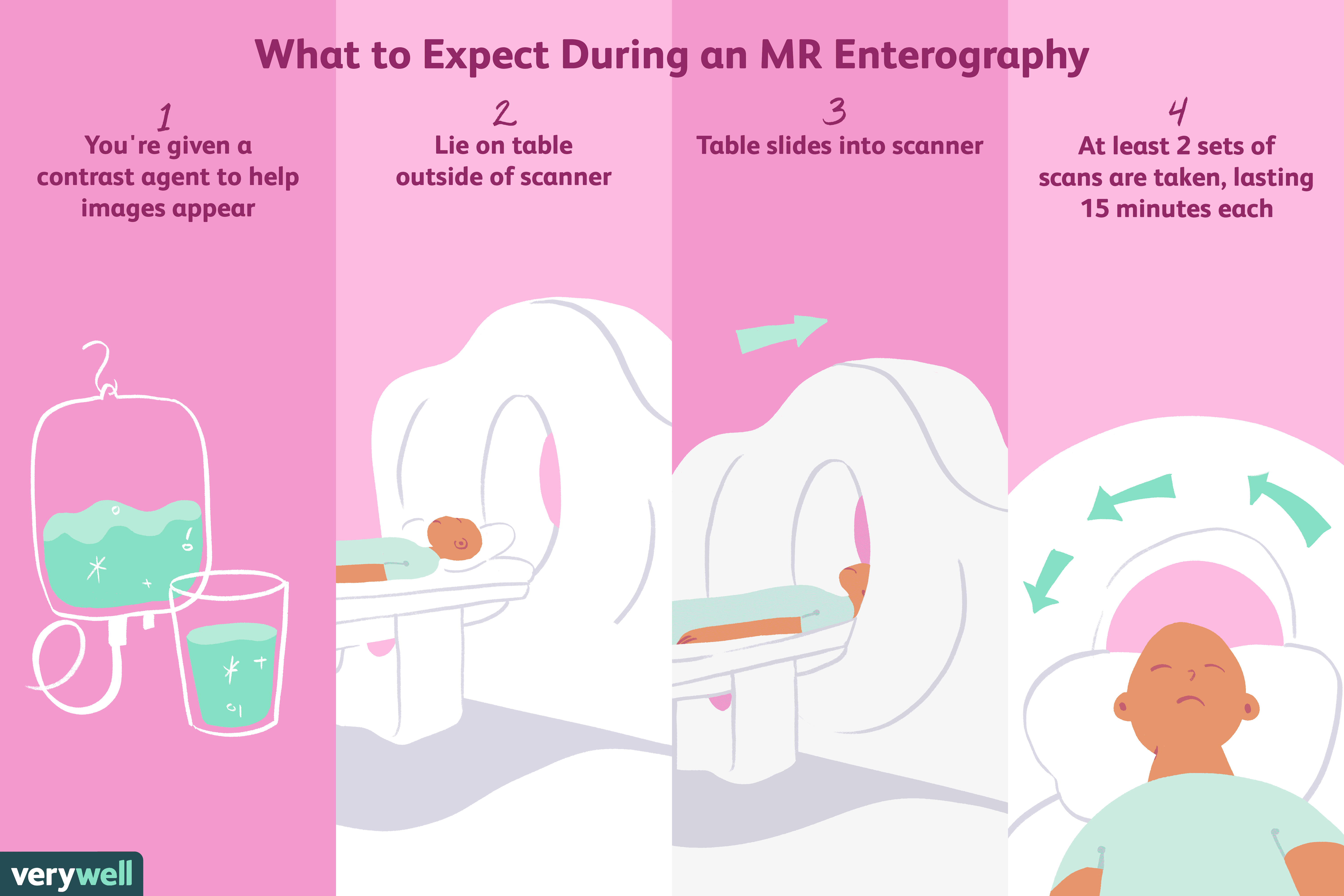 O que é enterografia por ressonância magnética?
A enterografia por ressonância magnética (MR) é um exame de imagem médica indolor, não invasivo e livre de radiação usado para diagnosticar problemas no intestino delgado. Uma forma especializada de r
O que é enterografia por ressonância magnética?
A enterografia por ressonância magnética (MR) é um exame de imagem médica indolor, não invasivo e livre de radiação usado para diagnosticar problemas no intestino delgado. Uma forma especializada de r
 Fungos e bactérias no intestino podem afetar igualmente a saúde humana e a gravidade da doença
O microbioma intestinal tem recebido muita atenção, mas uma nova pesquisa mostra que os fungos no intestino também são um microorganismo importante no funcionamento e na saúde do intestino, que então
Fungos e bactérias no intestino podem afetar igualmente a saúde humana e a gravidade da doença
O microbioma intestinal tem recebido muita atenção, mas uma nova pesquisa mostra que os fungos no intestino também são um microorganismo importante no funcionamento e na saúde do intestino, que então
 Se você fosse um projeto de intestino, como você seria?
Ao longo dos anos, fomos chamados de alguns apelidos bem interessantes… “Os caras do SCD.” “Os caras digestivos.” “Os caras do intestino furado.” E simplesmente o velho “Jordan e Steve…” E
Se você fosse um projeto de intestino, como você seria?
Ao longo dos anos, fomos chamados de alguns apelidos bem interessantes… “Os caras do SCD.” “Os caras digestivos.” “Os caras do intestino furado.” E simplesmente o velho “Jordan e Steve…” E