A validação de um método inovador que combina tanto HER2 imunohistoquímica e HER2 prata cor dual-in situ
hibridação em um slide para testes de carcinoma gástrico da arte abstracta
Fundo
avaliação do estado HER2 é um pré-requisito para o estabelecimento de uma estratégia de tratamento adequado no câncer gástrico. cancros gástricos são avaliações muito heterogêneos e distintos de amplificação do gene e chumbo expressão da proteína para incertezas na localização de clones distintos e são morosos. Este estudo avalia a equivalência do método inovador que combina ambas as plataformas genes e proteínas em um slide.
Métodos
imuno-histoquímica (IHQ) e HER2 prata de duas cores de hibridização in situ (SISH) como métodos simples (IHC /SISH) e plataforma de gene-proteína combinando ambos os métodos em uma lâmina (gene /proteína) foram realizados em coletados aleatoriamente 100 casos de adenocarcinoma gástrico. Resultados do IHC /SISH foram comparados com a coloração gene /proteína.
Resultados
96 de 100 amostras foram avaliável. Na coloração gene /proteína, patologistas foram capazes de avaliar a amplificação do gene e a expressão da proteína consequente ao nível da célula individual. Nos ensaios de comparação, a amplificação do gene foi observada em 14,6% em ambos, SISH convencional e uma plataforma de gene /proteína (uma concordância de 100%;-Kappa coeficiente κ = 1,0). Proteína pontuações de expressão por IHC eram 70,8% (0), 10,4% (1+), 9,4% (2+), e 9,4% (3+). A expressão de proteína pelo método de gene /proteína foram: 70,8% (0), 11,5% (1+), 7,3% (2+) e 10,4% (3+) de pacientes. Havia concordâncias completas em avaliação de IHC de casos com pontuação 0 (100,0%; k = 1). Alto concordâncias são mostrados na pontuação 1+ (98.96%; κ = 0,947) e 3+ (96,88%; k = 0,825) casos e boas concordâncias em 2+ casos (95,83%; κ = 0,728).
Conclusões
Este romance combinado tem a vantagem de ser capaz de avaliar tanto gene eo status de proteína na mesma célula cancerígena e pode ser de particular interesse para a investigação e cuidados do paciente.
artigo categoria
doença Biomarcadores.
Palavras-chave
cancro gástrico HER2 imuno-histoquímica de prata de hibridação in situ do gene-proteína de fundo do ensaio in the oncogene HER2 (também referido como HER2 /neu ou erbB-2) no cromossoma 17q21, codifica um receptor cinase da tirosina transmembranar de 185 kDa que pertence à família dos receptores do factor de crescimento epidérmico (EGFR), composta por EGFR /HER1, HER2, HER3, e HER4. activação HER2 desempenha um papel central na proliferação celular e sobrevivência, em grande parte mediada pela via de Ras-MAPK. Também inibe a morte celular através do alvo de fosfatidilinositol-3'-quinase AKT-mamífero de rapamicina (mTOR) via. Sobreexpressão de Her2 foi descrita em uma variedade de tumores sólidos [1-7]. amplificações de genes são raras em outras doenças e terapia anti-HER2 é actualmente validada apenas em cancro da mama e cancros gástricos.
Com base nos resultados do ensaio ToGA [8], o trastuzumab foi aprovado para o adenocarcinoma metastático da junção gastro-esofágico e no estômago terapia de combinação em os EUA e Europa. Exigência é prova de HER2 sobre-expressão. Na Europa, este é definido por um resultado IHC 3+ ou um IHC 2+ e FISH positivo ou resultado SISH (razão ≥ 2,0). IHC foi considerado o principal método porque IHC positivo negativo ou semanalmente (1+) pacientes não beneficiar de trastuzumab no julgamento de toga, embora fossem ISH positivo. Na literatura, no entanto, há uma variação considerável na positividade imunohistoquímica determinado. Aqui, a percentagem de adenocarcinomas gástrico avançado HER2 positivos varia de estudo para estudo, de 5% a 30% [9], provavelmente devido a diferentes protocolos de análise e critérios de interpretação.
Sub-estudos prospectivos de dois dos ensaios randomizados adjuvantes de trastuzumab contra nil no cancro da mama demonstrou que aproximadamente 20% dos ensaios HER2 realizados em instituições no local (no departamento de patologia do local de tratamento primário) estão incorretos quando o mesmo espécime foi reavaliado em um volume alto, laboratório central [10, 11 ].
ao contrário do cancro da mama, a histopatologia do cancro gástrico em termos de HER2 é considerado ser mais heterogéneo e a sobre-expressão focal de amplificação do gene é frequentemente observada [12]. Portanto, dificuldades em determinar o status HER2 são esperados para ser mais pronunciada do que no cancro da mama. No geral, tomados estes resultados em consideração, são necessários, métodos reproduzíveis e tempo poupando mais fiáveis para avaliar o estado de HER2 no câncer gástrico. Apenas poucos estudos publicados que combinam IHC e em métodos de hibridização in situ (mas não SISH) em uma lâmina foram conduzidos [13-16]. Teses estudos utilizaram padrão IHC e cromogénicos ou hibridização fluorescente in situ (CISH ou FISH) como métodos únicos e comparou-os com uma análise simultânea (combinado em um slide) e encontraram boa concordância com os resultados de coloração única. Tanto quanto é do nosso conhecimento, contudo, não há estudos que comparam directamente os resultados de ambos imuno-histoquímica (IHQ) e prata de hibridização in situ (SISH) quando cada um é utilizado separadamente com os resultados de utilizá-los em combinação com uma única secção em gástrica carcinomas.
no presente estudo, a expressão da proteína e amplificação do gene HER2 estatuto de 100 adenocarcinomas gástricos e carcinomas da junção esofagogástrica foram examinadas por IHC convencional e métodos individuais ISH (IHC /SISH) e em paralelo pelo método inovador combinando ambos os métodos (gene /proteína). O objetivo deste estudo foi avaliar a equivalência da nova plataforma gene-proteína em comparação com os métodos de coloração única.
Métodos
Pacientes e amostras de tecido
amostras de tumores fixadas em formalina e embebidos em parafina (FFPE) de 100 pacientes com adenocarcinoma gástrico ou a junção gastroesofágico foram selecionados a partir de um arquivo de tecido de amostras no Instituto de Patologia da Krankenhaus Nordwest. O projeto foi realizado com a permissão do comitê de ética responsável. Para cada caso, quatro métodos de coloração diferentes foram usados de acordo com as MANUFACTURER'S procedimentos aprovados pela FDA: hematoxilina e eosina (H & E) para avaliar a adequabilidade da amostra e para confirmar o subtipo histológico, imuno-histoquímica (IHQ) para avaliar a proteína HER2 expressão, prata hibridação in situ (SISH) para avaliar a amplificação do gene e a plataforma gene nova proteína que combina IHC e SISH sobre uma corrediça. a imuno-histoquímica
IHC foi realizada com o anticorpo monoclonal de coelho aprovado pela FDA Ventana CAMINHO clone 4B5 e com a DAB Detection Kit UltraView (Ventana) em um Stainer XT BenchMark automático (Ventana, Tucson, AZ). Resumidamente, as secções de tecido foram desparaf inadas com EZ Prep a 75 ° C e 76 ° C, o calor pré-tratado celular condicionado 1 (CC1) para recuperação de antigénios a 76 ° C - 100 ° C e, em seguida, incubadas com o anticorpo primário anti-HER2 para 16 min a 37 ° C, após inactivação da peroxidase endógena utilizando UV-inibidor durante 4 min a 37 ° C. As lâminas foram incubadas com um anticorpo secundário seguido pela aplicação de HRP Universal multímero durante 8 min. Os anticorpos foram detectados utilizando cromogénio (por 38 min). Antes da montagem, as lâminas foram contrastadas com hematoxilina II durante 4 min e anilagem reagente durante 4 min. Para apoiar a validade da coloração e identificar artefatos experimentais, um controlo positivo foi incluído em cada corrida.
Prata hibridização in situ
SISH duas cores foi realizada de acordo com o INFORM cocktail HER2 duplo ISH DNAProbe e Kit UltraView SISH Detecção DNP /UltraView RED ISH DIG Kit de detecção para HER2 e Chr 17 quantificação e procedimento (Ventana /Roche). Ambas as sondas foram marcadas com 2,4-dinitrofenol (DNP) e digoxigenina (DIG). As lâminas de tecido foram desparafinadas com EZ Prep a 65 ° C-76 ° C e calor pré-tratados com o EZ Prep-diluída Condicionador celular 2 (CC2) a 90 ° C, seguido de digestão com protease com ISH Protease 3 durante 16 min a 37 ° C. As secções de tecido de ADN genómico e as sondas de HER2 e Chr 17 nick-translation foram co-desnaturado por tratamento térmico durante 20 min a 80 ° C, seguido por um passo de hibridação durante 6 h a 44 ° C. Os sinais de HER2 foram detectados utilizando anticorpo anti-DNP de coelho durante 20 min a 37 ° C e incubadas com um anticorpo anti-coelho de cabra conjugado com HRP durante 16 min a 37 ° C, após três lavagens de restringência 8 min. O sinal foi detectado como depósitos de prata com acetato de prata, hidroquinona e peróxido de hidrogênio. Para detecção Chr 17, as lâminas foram incubadas com anticorpo anti-DIG rato durante 20 min a 37 ° C e com um anticorpo anti-ratinho de cabra conjugado com AP-durante 24 min a 37 ° C. O sinal Chr 17 foi desenvolvido como coloração ponto vermelho com rápido fosfato de vermelho e naftol. As lâminas foram, finalmente, contrastadas com hematoxilina II e bluing reagente antes da montagem.
Gene /proteína
plataforma /proteína Gene combinando IHC e SISH em um slide. Para suportar a validade de coloração e identificar artefactos experimentais, um controlo positivo foi incluído em cada mancha de proteína run.For HER2 e para HER2 /CHR 17 hibridação, foram utilizados o Kit de Detecção de iVIEW DAB e UltraView Kits de Detecção. As amostras foram coradas sob várias condições de ensaio para implementar um protocolo óptimo necessário para alcançar resultados IHC /SISH de coloração comparáveis às dos testes de IHC e SISH indivíduo. A optimização foi efectuada no Laboratório de Ventana (Roche) e em parte no próprio trabalho. Os melhores resultados foram obtidos através da realização do processo de IHC antes do procedimento SISH.
As amostras foram desparafinados com EZ Prep a 72 ° C em 6 ciclos. Para a coloração de proteína HER2, as secções de tecido foram calor pré-tratados em CC1 para a recuperação de antigénios a 95 ° C e, em seguida, incubadas com o anticorpo primário anti-HER2, a 37 ° C durante 48 min após a inactivação da peroxidase endógena utilizando UV-inibidor durante 4 min a 37 ° C. As lâminas foram incubadas com um anticorpo secundário biotinilado seguido pela aplicação de estreptavidina conjugada com HRP durante 8 min. Uma reacção DAB cobre reforçada foi usado para visualizar a proteína. Para o gene HER2 e CHR 17 coloração, as amostras foram pré-tratadas com calor CC2 EZ Prep-diluído a 90 ° C durante quatro ciclos, seguido de digestão com protease com ISH Protease 2 durante 12 min a 37 ° C. As sondas foram desnaturadas durante 4 min a 80 ° C e hibridadas durante 6 h a 44 ° C, utilizando um cocktail de sondas DNP- e marcada com DIG. HybClear solução foi adicionado para bloquear a interacção entre a DNP e o depósito DAB durante a hibridação. Os sinais de genes foram detectados utilizando anticorpo anti-DNP de coelho durante 16 min a 37 ° C e incubadas com um anticorpo anti-coelho de cabra conjugado com HRP durante 16 min a 37 ° C, após quatro lavagens de restringência 8 min. O sinal foi desenvolvido por o depósito de prata com acetato de prata, hidroquinona e peróxido de hidrogénio. Para detecção Chr 17, as lâminas foram incubadas com anticorpo anti-DIG rato durante 16 min a 37 ° C e com um anticorpo anti-ratinho de cabra conjugado com AP-durante 24 min a 37 ° C. O sinal Chr 17 foi desenvolvido como coloração ponto vermelho com rápido fosfato de vermelho e naftol. Antes de montar, as lâminas foram contrastadas com hematoxilina II durante 8 minutos e bluing reagente para 4 min. Revisão
Patologia
As amostras foram independentemente interpretado por um patologista (AB) e um biólogo formado em histologia câncer gástrico (DW). Os observadores receberam as amostras aleatoriamente, isto é SISH, IHC, e método combinado não foram avaliados em associação uns com os outros, mas em separado para cada paciente. Consenso de ambos os revisores foi encontrado após cada avaliação. Como os resultados discordantes entre os dois métodos pode ser um resultado da variabilidade intra-observador, em vez de diferenças na qualidade de coloração, casos discordantes foram reavaliados por um terceiro observador que desconhecia os resultados da primeira avaliação, mas avaliou os casos discordantes (métodos) em associação uns com os outros. Finalmente, o consenso foi estabelecido entre o terceiro observador e os observadores primários.
Os resultados IHC foram interpretados usando o esquema de pontuação proposto para câncer gástrico por Hofmann et al. [17] e Rüschoff et ai. [18]: 0, nenhuma reactividade ou reactividade membranosa em < 10% das células tumorais; 1+, fraco /reactividade membranoso quase imperceptível em > 10% das células tumorais; 2+, fraco a moderado completa, lateral ou basolateral reactividade membranoso em > 10% das células tumorais; e 3+, forte completa, lateral ou basolateral reactividade membranosa em ≥ 10% de células tumorais. Online em SISH resultados, os números totais de HER2 e cromossoma 17 sinais foram contadas em pelo menos 20 núcleos das células do tumor em duas áreas diferentes. Os rácios de HER2 /Chr 17 foram interpretados de acordo com o esquema de pontuação FISH ToGA para o teste HER2 na junção gástrica e gastroesofágico (JGE) câncer da seguinte forma: < 2.0, o gene HER2 não amplificado; ≥ 2,0, gene HER2 amplificado [17]. Uma contagem média de seis ou mais foi considerado como amplificado. Análise
Estatística
A análise foi exploratório, sem hipótese ou amostra cálculos tamanho pré-definido. O número de 100 pacientes foram considerados suficientes para realizar os testes estatísticos propostos. Correlações entre IHC /SISH e gene /proteína foram estimados por meio do coeficiente kappa Cohen's (к). A interpretação valor kappa por Altmann [19] foi usado: к > 0,81, concordância muito boa; 0,61-0,80, boa concordância; 0,41-0,60 concordância moderada; ,40-,21, Acordo justo; ≪ 0,20, ligeira acordo. As análises estatísticas foram realizadas utilizando software WinStat (R.Fitch Software, Versão 2009.1).
Resultados As características dos pacientes
Noventa seis dos 100 casos de pacientes eram avaliável. Um caso foi excluído devido à ausência de células tumorais e três casos por sinais pobres na única coloração SISH.
A maioria dos pacientes eram do sexo masculino (67,7%) e ≥ 65 anos de idade (70,8%) (Tabela 1). A coorte consiste em pacientes com adenocarcinoma do meio para o estômago distal (50,0%) ou JGE (45,8%) com mais casos de Lauren`s intestinal (67,7%) do que os tumores difusa (28,1%). A classificação da maioria das amostras foi G3 (50,0%) seguido por G2 (39,6%) e tumores classificados como G2-3 (10,4%). 85,7% dos pacientes ressecados (n = 28) apresentaram metástase linfática (N palco) e 64,3% não apresentaram metástases distantes (fase M). Na metade dos pacientes ressecados, foi observado o estágio do tumor T3, seguido por T2 em 28,6%, T1 em 14,3% e estágio T4 em 7,1% dos características patients.Table 1 do paciente e a expressão de HER2 por subgrupos
total n = 96 (%)
positividade * (IHC 3+ ou SISH +) single n (%)
positividade * (IHC 3+ ou SISH +) combi n (%)
Sexo Feminino
27 (28,1) Página 2 (7,4)
1 (3.7)
Masculino
65 (67,7)
11 (16,9)
11 (16,9)
Unknown
4 (4.2) Sims 3 (75,0) Sims 3 (75,0)
Idade
18-94 anos (mediana 69)
≥ 65
68 (70,8)
12 (17,6)
11 (16,2) Art < 65
28 (29,2) página 4 (14,3) página 4 (14,3)
localização do tumor primário
Mid para o estômago distal
48 (50,0)
5 (10,4)
4 (8.3)
JGE
44 (45,8)
8 (18,2)
8 (18,2)
não especificado página 4 (4.2) Sims 3 (75,0) Sims 3 (75,0)
classificação Lauren
difusa
27 (28,1) Sims 3 (11,1)
2 (7,4)
Mixed página 4 (4.2)
1 (25,0)
1 (25,0)
intestinal
65 (67,7)
12 (18,5)
12 (18,5)
Biópsia /ressecção
Biópsia
68 (70,8)
10 (14,7)
9 (13,2)
ressecção
(29,2)
6 (21,4)
6 (21,4)
estágio 28 T (n = 28)
T 1
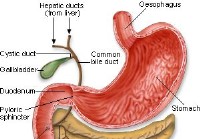 Câncer de pâncreas
Câncer de pâncreas
 Específicos amigos da dieta de carboidratos em destaque:Susan “A garota SCD”
Específicos amigos da dieta de carboidratos em destaque:Susan “A garota SCD”
 O triste estado da medicina americana:por que pacientes e profissionais estão sofrendo (e como podemos corrigi-lo)
O triste estado da medicina americana:por que pacientes e profissionais estão sofrendo (e como podemos corrigi-lo)
 O que é terapia com feixe de prótons para câncer?
O que é terapia com feixe de prótons para câncer?
 Síndrome de Fadiga Crônica (SFC) ou Doença de Intolerância ao Esforço Sistêmico (SEID)
Síndrome de Fadiga Crônica (SFC) ou Doença de Intolerância ao Esforço Sistêmico (SEID)
 hidromorfona (Dilaudid)
hidromorfona (Dilaudid)
 Como você sabe se tem sintomas de hemorroida ou algo mais sério?
O que são hemorroidas? Pequenas manchas de sangue podem ser um sintoma de hemorroidas, mas se houver sangue mais consistente durante os movimentos intestinais, pode ser ser um sinal de câncer de có
Como você sabe se tem sintomas de hemorroida ou algo mais sério?
O que são hemorroidas? Pequenas manchas de sangue podem ser um sintoma de hemorroidas, mas se houver sangue mais consistente durante os movimentos intestinais, pode ser ser um sinal de câncer de có
 Grandes fagos recém-descobertos borram a fronteira entre vida / não vida
Um novo estudo publicado na revista Natureza mostra que existem literalmente centenas de vírus grandes o suficiente para consumir bactérias, e com propriedades que são típicas de um organismo vivo,
Grandes fagos recém-descobertos borram a fronteira entre vida / não vida
Um novo estudo publicado na revista Natureza mostra que existem literalmente centenas de vírus grandes o suficiente para consumir bactérias, e com propriedades que são típicas de um organismo vivo,
 Compreendendo a SII na televisão para café da manhã
Abril é o mês de conscientização da IBS! Fui no café da manhã da televisão para discutir a compreensão do IBS, especificamente, desmascarar mitos no IBS e no FODMAP! Especificamente os mitos que eu co
Compreendendo a SII na televisão para café da manhã
Abril é o mês de conscientização da IBS! Fui no café da manhã da televisão para discutir a compreensão do IBS, especificamente, desmascarar mitos no IBS e no FODMAP! Especificamente os mitos que eu co