MicroRNA-206 suprime o crescimento de células de câncer gástrico e metástase
O câncer gástrico Abstract
é uma das principais causas de world-wide morte por câncer e carrega uma alta taxa de risco metastático. Além de outros oncogenes que codificam proteínas, e genes supressores de tumor, microARNs desempenhar um papel importante na progressão do cancro gástrico tumorigénico. Aqui, mostramos que o miR-206 é expresso em níveis significativamente baixos de uma coorte de tumores gástricos em comparação com os tecidos normais correspondentes, e de uma série de linhas celulares de cancro gástrico. Down-regulação do miR-206 foi particularmente significativa em tumores com metástase linfática, invasão local, e avançado estadiamento TNM. Descobrimos que a expressão forçada de miR-206 suprimiu a proliferação, colônia-formação, e xenotransplante tumorigénese de células SCG-7901, uma linha de células de câncer gástrico. A expressão forçada de miR-206 também suprimiu a migração SCG-7901 celular e invasão, bem como metástase em cultura de células ou modelos de ratos injectados com veia da cauda, respectivamente. O efeito anti-metastática de miR-206 é provavelmente mediada por segmentação metástase genes reguladores STC2, HDAC4, KLF4, IGF1R, FRS2, SFRP1, BCL2, BDNF, e K-ras, que foram drasticamente sub-regulada pela expressão estável de miR exógeno -206 em células SCG-7901. Tomados em conjunto, os nossos resultados indicam que o miR-206 é um supressor de tumor de câncer gástrico atuando em etapas que regulam a metástase.
Palavras-chave
O câncer gástrico miR-206 metástase de tumor supressor Introdução
câncer gástrico (CG) classifica o quarto câncer mais comum ea segunda principal causa de morte relacionada ao câncer em todo o mundo [1]. O prognóstico para pacientes com câncer gástrico avançado é pobre, apesar das recentes melhorias na gastriectomy, quimioterapia e radioterapia [2]. Desde GC é uma doença poligênica que surge como o resultado de múltiplos genes desregulações, elucidação da rede regulamentar GC tumorigênese é imperativo para o desenvolvimento de novas terapias direcionadas.
Tumorigênese no estômago é um processo de várias etapas que envolve alterações genéticas e epigenéticas de proteína -coding, bem como de não codificação proto-oncogenes e genes supressores de tumores. Interações entre hospedeiro, fatores ambientais e bacterianas também influenciam o progresso da doença. Helicobacter pylori
infecção (HP) foi estabelecido como um importante fator de risco para GC; os dois subtipos histológicos de cancro gástrico, o intestino e os subtipos difusas, estão ambas associadas com a infecção por HP, o que contribui para mais de 80% dos casos de [3], especialmente no cancro do antro /corpo gástrico [4]. Mecanisticamente, a infecção HP foi encontrado para causar um aumento de duas vezes na EGF e EGFR em tecidos de biópsia do antro gástrico, mas a sua erradicação reduz os níveis de ambos os factores para os dos controlos [5]. infecção pelo HP em pacientes com gastrite crônica também é significativamente associada com diminuição da regulação da caderina-E devido ao aumento da metilação do promotor [6], Considerando que a erradicação HP reduziu significativamente os níveis de MMP-9, uma metaloproteinase positivamente associado com a invasão tumoral e metástase [ ,,,0],7], no antro e do corpus mucosa [8].
em adição à infecção HP, existe uma grande variedade de causas que conduzem a expressão génica aberrante em cancro gástrico, e o mecanismo da metástase do cancro gástrico é muito complexo, bem . A sinalização MAPK Ras-dependente, o que eventualmente leva a um aumento da proliferação de cancro gástrico e é causada principalmente pela activação aberrações de K-ras, é frequentemente associada com o cancro gástrico do tipo intestinal [9]. Stanniocalcina 2 (STC2), uma glicoproteína segregada com funções importantes na homeostase do cálcio e do fosfato, foi relatado para ser expressa em altos níveis tecidos cancerosos gástricas, nódulo linfático e metástase, invasão venosa [10]. A taxa de sobrevida em 5 anos foi significativamente menor nos pacientes com expressão STC2 comparados aos pacientes sem expressão STC2 [11]. expressão foi relatado para mostrar aumento significativo da expressão em tecido de cancro gástrico em comparação com a mucosa normal adjacente, e níveis elevados de BDNF na frente invasiva BDNF (neutrophic factor derivado do cérebro-) foram correlacionadas com a invasão de vasos, linfa metástase, disseminação peritoneal, e pobre prognóstico em pacientes com câncer gástrico [12]. Apesar dos progressos na identificação dos genes reguladores acima, o mecanismo subjacente precisa causar metástase GC ainda está para ser determinada.
Desregulações de microRNAs desempenhar um papel muito importante na tumorigênese. O papel de microRNAs na tumorigénese cancro gástrico tem sido bem documentada. Aqui, vamos nos concentrar no miR-206, que junto com sua paralogs estreitamente relacionados miR-1, 133a e miR-133b, desempenha um papel muito importante na diferenciação muscular. Estes quatro microARNs são altamente conservadas em sequência e organização genómica, e são chamados myomiRs porque eles foram encontrados para ser expresso em níveis elevados no músculo [13]. MiR-1-1 /miR-133a-2, miR-1-2 /miR-133a-1, e miR-206 de forma /o miR-133b aglomerados em três regiões cromossómicas diferentes no genoma humano 20q13.33, 18q11.2 , e 6p12.2, respectivamente. No entanto, estes miARN pode agir como supressores tumorais em vários cancros humanos [14]; por exemplo, o miR-1 e miR-133a foram encontrados para ser frequentemente regulados negativamente em cancros da bexiga, e suprimir o crescimento do tumor por segmentação TAGLN2 [15]. MiR-1 e miR-206 foram mostrado possuir papéis supressores de tumores semelhantes em rabdomiossarcoma através bloqueando a expressão de c-Met [16]. MiR-206 também foi relatada para actuar como um supressor de tumor no cancro da mama [17], e cancro do pulmão [18]. Relatamos aqui que miR-206 expressão é inversamente associado com metástase linfática, invasão local, eo estadiamento TNM malignidade do GC, e forçá-expressão de miR-206 suprime o crescimento de células GC, tumorigênese e metástases.
Materiais e métodos
as amostras de tecido
cirurgicamente ressecados câncer gástrico humano e tecidos não tumorais adjacentes foram obtidos de 35 pacientes internados no Departamento de Cirurgia Gastrointestinal, o Hospital Afiliado da Universidade médica de Nanjing (Hospital de Changzhou Segundo Popular). O projeto foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Médica de Nanjing, e um termo de consentimento foi obtido de cada paciente inscrito no estudo. Todas as amostras de tecido foram processadas para armazenamento em azoto líquido e H &. E coloração para análise patológica As linhas de células e cultura de células
Humanos linhas celulares de cancro gástrico SGC-7901, BGC-823, AGS, célula gástrica não-maligna linha de GES-1 e células HEK293T foram adquiridos a partir do celular Resource Center, Xangai Instituto de Bioquímica e Biologia celular, da Academia chinesa de Ciências. Estas células foram mantidas numa incubadora de humidade a 37 ° C, 5% de CO
2 e SGC-7901, BGC-823, e GES-1 As células foram cultivadas em meio RPMI 1640, as células HEK293T em DMEM, e as células da AGS em F12K médio, respectivamente. Todos os meios de cultura foram suplementados com soro fetal bovino a 10% e antibióticos.
Extracção de ARN e quantitativa PCR em tempo real
ARN total a partir de tecidos ou linhas celulares gástricas foram extraídos utilizando o reagente Trizol (Takara) de acordo com as instruções do fabricante. Sintetizou-se ADNc com o kit de reagente PrimeScript RT (Takara). Quantitativa de RT-PCR foi realizada com um kit de SYBR Premix Ex Taq (Takara) de um sistema de PCR em tempo real 7500 (ABI) e analisados com o pacote de software de análise de SDS (versão 2.0.1, Applied Biosystems). Os iniciadores de PCR foram obtidos de Invitrogen, e a reacção foi de 95 ° C, 10 min, seguido de 40 ciclos de 95 ° C, 15 segundos e 60 ° C, 1 min. O ARNnp de U6 foi usada como um controlo interno. Os resultados foram apresentados como a mudança vezes, calculada utilizando a 2 -. △ método CT, e um rácio de expressão nos tumores em relação aos tecidos normais inferior a 1,0 foi considerado um preço tão baixo
Vector constrói
Pri -miR-206 foi amplificado a partir de ADN genómico humano normal por PCR utilizando os iniciadores: 206 Para-5'-ATAAGAATGCGGCCGCAGATGCGGGCTGCTTCTGGA-3 'e 206 5'-Rev-AGCTTTGTTTAAACCCTTGGTGAGGGAGTCATTTGC-3'. O fragmento de PCR foi inserido no vector de MSCV-P2GM para gerar P2GM-miR-206. O vector P2GM vazio foi utilizado como controlo.
Transfecção celular
plasmídeo de transfecção de células SGC-7901 foram realizadas utilizando lipofectamina 2000 (Invitrogen), e foram seleccionados clones estáveis que transportem P2GM-miR-206 ou o vector vazio para a resistência a puromicina (10 pg /ml). imita controlo negativo miR-206 e foram obtidos a partir de Ribobio (Cantão, China) e a transfecção de células em imita SGC-7901 foi feito usando Oligofectamine (Invitrogen). Resumidamente, as células SGC-7901 semeadas 1 dia antes foram transfectadas com 100 nm de miR-206 ou de controlo imita a atingir 50% de confluência. Após 48 h, as células foram processadas para análise adicional. Ensaio de proliferação celular
ensaio MTT foi utilizado para estimar a taxa de proliferação de células SGC-7901. Resumidamente, as células foram SGC-7901 trypsinzed 2 dias após a transfecção e re-semeadas a 2,5 x 10 3 células por poço em placas de 96 poços. MTT (brometo de 3- (4, 5-dimetiltiazol-2-il) -2, 5-difenil-tetrazoliumbromide) foi adicionado ao meio de cultura em intervalos especificados para horas xx, e a absorvância a 490 nm foi medida com um espectrofotómetro. Cada ensaio foi realizado em triplicado e repetidas três vezes de forma independente.
Ensaio de formação de colónias
células estáveis que transportem 7901 SCG-miR-206 ou o controlo vazio foram tripsinizadas e novamente plaqueadas a 1 x 10 3 por poço em seis placas -Bem. Após 14 dias em cultura em RPMI 1640 suplementado com 10% de FBS, as colónias foram fixadas com metanol a 3,7% e coradas com violeta de cristal a 0,1%. As colónias que contêm pelo menos 50 células foram contadas. Cada ensaio foi realizado em triplicado. A citometria de fluxo
SGC-7901 células transfectadas com miR-206 controlo mímica ou negativo foram tratadas com tripsina e ressuspensas em tampão de ligação 1 × a 1 × 10 6 células /ml. 100 ul desta suspensão de células foi incubada com 5 l de FITC-anexina V e iodeto de 5 ul propridium (PI) durante 15 minutos no escuro. A reacção foi terminada com a adição de 400 ul de 1 × tampão de ligação e analisou com (FACSCalibur utilizando o software CellQuest (Becton Dickinson). As células V-positivos e PI-negativas FITC-anexina foram consideradas como apoptótica e as experiências foram realizadas em
triplicado. os ensaios de migração e invasão
Wound healing migração celular foi avaliada através da medição do movimento das células dentro uma área acelular criado por raspagem da relva confluente de células com uma pipeta de ponta de 200 ul. o fechamento da ferida foi fotografada 48 h mais tarde sob um microscópio. para Transwell ensaios de migração, 5 × 10 4 células foram adicionadas para dentro da câmara superior da peça inserta (BD Ciência, Sparks, MD, EUA), ao passo que 1 × 10 5 as células foram usadas para Matrigel os ensaios de invasão. nestas experiências, as células foram tripsinizadas e ressuspensas em meio isento de soro antes de serem semeadas à câmara superior. o meio de cultura completo contendo 10% de FBS foi adicionado na câmara inferior. As células foram incubadas numa incubadora humidificada a 37 ° C durante 24 h. As células na membrana foram fixadas, coradas e contadas. Cada experimento foi realizado em triplicado.
Modelo de tumor xenoenxerto
ratos atímicos fêmea jovem (6 semanas de idade) foram adquiridos a partir do Centro de Pesquisa Animal Modelo da Universidade de Nanjing. Aproximadamente 1,5 x 10 6 células SGC-7901 estáveis que transportem P2GM-miR-206 ou o vector vazio foram injectadas subcutaneamente nos flancos inferiores de 5 ratinhos nus. Os volumes dos tumores foram medidos a cada 3 dias a partir do sexto dia pós injecção para a frente durante 24 dias antes de os animais foram sacrificados. O volume final e o peso foram medidos após os tumores foram dissecados. ratinhos nus foram manipulados e tratados de acordo com as orientações Animal Care NIH e do Comitê Use no experimento Centro Animal da Universidade de Nanjing Medical (Nanjing, Jiangsu, província, PR China).
análise estatística
análise estatística foi realizada utilizando o pacote SPSS (SPSS versão padrão 16.0, SPSS Inc). Os dados foram apresentados como média ± SEM. As amostras emparelhadas t-
-test foi utilizado na análise de diferencial de miR-206 de expressão entre tumor e tecidos normais. Para in vitro e in vivo, independente de amostras t
-test foi utilizado para avaliar a significância da diferença entre os grupos de tratamento e controle. valor <P; 0,05 foi considerado estatisticamente significativo.
Resultados
Down-regulação do miR-206 está correlacionada com tumorigênese humana câncer gástrico, invasão e metástase Online em uma ampla pesquisa de genoma para a expressão microRNA, que previamente identificados vários membros a família myomiR, nomeadamente o miR-1 /133a e miR-133b /206, cujos níveis foram reduzidos em um cancro neuroectodérmico (resultados não publicados). Estes microRNAs eram conhecidos principalmente para funcionar na diferenciação miogênica e, em menor grau, a tumorigênese dos cancros pediátricos. Para explorar se estes myomiRs pode também ter um papel na tumorigensis de cancros comuns no adulto, foram examinados os níveis de expressão em tempo real por quantificação haste-laçada RT PCR em uma coorte de tumores gástricos recém ressecados e os seus correspondentes tecidos normais, e descobriram que a proporção média de miR-206 em relação ao U6 snRNA dos 35 tumores foi 4 vezes menor do que a dos tecidos normais (Figura 1A). comparação de pares indicou que mais de 85% de tumores mostraram uma redução superior a duas vezes da expressão de miR-206 em comparação com os controlos correspondentes, com apenas dois pares mostrando aumento (Figura 1B). Expressão de miR-206 também foi diminuída em um certo número de linhas celulares de cancro gástrico humano, incluindo SGC-7901, BGC-823, MGC-803, e células de AGS, comparada com a de GES-1 células gástricas normal (Figura 1C). registos clínicopatológicos destes tumores mostrou que a redução da expressão de miR-206 foi significativamente associado com a metástase linfática, invasão local e a malignidade TNM, mas não com a idade, sexo, tamanho do tumor ou local (Tabela 1). Estes dados implicam que o miR-206 pode normalmente exercem um controlo inibidor sobre a tumorigénese gástrica, invasão e metástase. Figura 1 reduziu os níveis de expressão de miR-206 em tecidos de câncer gástrico e linhas celulares. (A) distribuição da expressão de miR-206 em uma coorte de 35 GC e não cancerosos tecidos humanos por qRT-PCR. O ARN U6 endógena foi usado como controlo interno. (B) Comparação Pairwise de expressão de miR-206 entre GC e correspondentes tecidos não cancerosos mostrando miR-206 expressão foi reduzida em 86% (30/35) dos pares de amostras. (C) A expressão relativa de miR-206 em quatro linhas de células GC e uma linha celular gástrica normal (GES-1).
Tabela 1 características clínico-patológicas de miR-206
Categorias
NO. dos pacientes
níveis relativos de miR-206 (média ± SEM)
P-valor
Sexo Masculino
21
0,49 ± 0,07
0,32
Feminino
14
0,40 ± 0,06
Idade (anos)
≥60
19
0,45 ± 0,05
0,93 Art < 60
16
0,46 ± 0,09
Diâmetro (cm)
≥5
13
0,46 ± 0,09
0,90 Art < 5
22
0,45 ± 0,05
Localização
Oriente e terço proximal
23
0,47 ± 0,06
0,65
terço distal
12
0,42 ± 0,07
grau de diferenciação
bem e moderadamente
12
0,48 ± 0,07
0,70
mal
23
0,44 ± 0,07
invasão local
T1 + T2
10
0,65 ± 0,07
0,01
T3 + T4
25
0,37 ± 0,05
metástases linfonodais
NO
14
0,57 ± 0,06
0,04
SIM
21
0,38 ± 0,07
estágio TNM
I + II
12
0,60 ± 0,07
0,02
III + IV
23
0,38 ± 0,06
expressão de miR-133a também foi encontrado para ser regulada para baixo nos tumores pelos critérios acima mencionados (arquivo adicional 1: Figura S1), mas a expressão de miR-1, cujos genes estão agrupados com aqueles que codificam miR-133a [14], não era (arquivo adicionais 2: Figura S2). Uma vez que o miR-206 é codificada por um único gene, foi escolhido para posterior análise.
MiR-206 inibe o crescimento de células de cancro gástrico
Para determinar se o miR-206 tem a propensão para suprimir tumorigenese cancro gástrico, que introduziu um sintéticos de cadeia dupla de miR-206 imita, 206mi, para alterar o nível de um total de miR-206 em células de cancro gástrico SGC-7901, as quais expressam um nível baixo de miR-206 em relação à de 1 IGE-células de controlo normal (Figura 1C) , e monitorizada a taxa de crescimento celular utilizando o corante de tetrazólio, 3- (4,5-dimetiltiazol-2-il) -2,5-difenil (MTT). Haste-laçada de PCR confirmou a nível elevado de miR-206 em células transfectadas SGC-7901 (Figura 2A), e os resultados do ensaio MTT indicaram que a taxa de crescimento destas células foi reduzida significativamente comparada com a das células receptoras não- imita específicos de controle, miR-ctrl, ao longo de um período de 5 dias (Figura 2B). Nós também gerado um plasmídeo pré-miR-206 expressando no vector P2GM, e análise-separação de células activada por fluorescência (FACS) mostrou o G1-fase prolongada e a fase S encurtado em P2GM-206 (P206) transfectados em comparação com o vetor P2GM transfectadas células SGC-7901 (Figura 2C), corroborando o resultado do experimento 206mi mímica acima. Aumentar artificialmente o nível total de miR-206 com 206 mi também resultou num aumento significativo de apoptose em 48 horas, em células SGC-7901 sobre os imitadores de controlo de células transfectadas, tal como determinado por análise de citometria de fluxo de PI e absorção dupla Anexina V (Figura 2D e e). Estes dados indicam que o miR-206 é um regulador potente anti-proliferativa de células gástricas cancerosas em cultura. Figura 2 A expressão forçada de miR-206 suprime a proliferação de células de cancro gástrico SGC-7901. (A) Níveis totais de miR-206 em células SGC-7901 transfectadas com o miR-ctrl ou imita os sintéticos de miR-206, 206mi (*** P < 0,0001). (B) Ensaios de MTT para SGC-7901 células transfectadas com miR-206 imita a uma concentração final de 100 nM. A partir de 24 h após a transfecção, os ensaios foi lida a cada 24 h durante 5 dias consecutivos. Os resultados são expressos como médias ± SEM de três experiências independentes. (*** P < 0,0001). (C) Uma distribuição do ciclo celular de células histograma representando SGC-7901 transientemente transfectadas com P2GM-miR-206 ou P2GM-Ctrl (100 nm). Os resultados representam as médias ± SEM de três experiências independentes (* P < 0,05). (D) Células coradas positivamente para a Anexina V-FITC e PI para negativo às 48 h pós-transfecção foram considerados como tendo sido submetidos a apoptose. (E) Taxa média apoptótica de três experiências independentes ± SEM estão apresentados (*** P < 0,0001).
MiR-206 inibe o crescimento de células cancerosas e de tumores de xenoenxerto de formação gástrica dependentes de ancoragem
Para examinar a longo prazo impacto de miR-206 no crescimento celular e formação de colónias, foi gerada uma linha estável de células SGC-7901, P2GM-miR-206, que expressa o miR-206 a partir de um vector constitutivamente activa, MSCV-P2GM, e uma linha de vector vazio células -carrying, P2GM-miRctrl. Em primeiro lugar, examinou-se o nível de expressão de miR-206 nestas duas linhas celulares estáveis e descobriram que o miR-206 foi drasticamente elevada em P2GM-miR-206 linha de células estável (Figura 3A). Em seguida, analisamos o efeito de miR-206 no crescimento dependente da ancoragem de células de baixa densidade semeadura tripsinizadas directamente na placa de petri e visualizar as colónias de células através de coloração com violeta de cristal após 14 dias de cultura. Os resultados mostraram que as células estáveis de controlo de transporte de vetor formada significativamente mais do que as colónias de células de miR-206 que expressam (Figura 3B e C). Nós injetamos ainda mais essas células estáveis por via subcutânea em duas partes traseiras inferiores bilaterais de ratos nus, e monitorado o crescimento do tumor ao dia. Vinte e quatro dias após a injecção, estes ratinhos foram sacrificados e os tumores foram excisados e pesados (Figura 3D e E). Os resultados mostraram que a média dos volumes dos tumores de miR-206 que sobre-expressam cresceram a um ritmo muito mais lento do que os tumores de controlo e o peso final foi significativamente menor do que a dos controlos (Figura 3F e G). Figura 3 miR-206 suprime o crescimento de células GC dependentes de ancoragem e formação de tumor xenoenxerto. (A) O nível de expressão de miR-206 em P2GM-miR-206 linha de células estável e células estáveis de controle de transporte de vetor (*** P < 0,0001). (B) Mil células SGC-7901 estáveis de miR-206 e controlo negativo foram plaqueadas em placas de 6 poços e um ensaio de formação de colónia efectuado. Os resultados representativos de formação de colónia de P2GM-miR-controle, P2GM-miR-206. (C) O número de colónias foi contado no 14º dia após a semeadura. células SGC-7901 estáveis de miR-206 cresceu para uma densidade mais baixa em comparação com NC. Os resultados representam as médias ± SEM de três experiências independentes (** P < 0,01). (D) As células SGC-7901 com uma expressão estável de miR-206 ou não foram inoculadas subcutaneamente em ambos os flancos de ratinhos nus (n = 5 por grupo). fotografias representativas de ratos sem pêlo 24 dias após a inoculação são mostrados. (E) Os ratos foram mortos e os tumores foram pesados 24 dias após a inoculação, os xenoenxertos com miR-206 sobre-expressão foram significativamente menores do que os xenoenxertos de controlo. (F) mostra a curva de crescimento do tumor (* P < 0,05 e ** P < 0,01). (L) Os tumores de cada grupo foram pesados imediatamente após a remoção. O peso médio do tumor é indicado como médias ± SEM (* P < 0,05).
MiR-206 inibe a invasão da célula cancerosa gástrica e a migração
Redução da expressão de miR-206 em tumores localmente invasivo e metastático (Tabela 1) sugere que este microRNA podem regular processo migratório celular. Para determinar se esse fato for o caso, realizamos cicatrização de feridas e transpo� ensaios de migração que utilizem as células SGC-7901 estáveis miR-206 que expressam. Os resultados mostraram que a sobre-expressão ectópica de miR-206 causou uma supressão da migração celular em células SGC-7901, como é evidente no ensaio de cicatrização da ferida (Figura 4A e B) e o ensaio de migração de células Transwell (Figura 4C e D). a sobre-expressão ectópica de miR-206 invasão celular SGC-7901 inibiu mais, como demonstrado pelo ensaio de invasão de Matrigel (Figura 4E e F). Assim, miR-206 exibida uma propriedade supressiva em ensaios de migração de células cancerosas e invasão in vitro. Figura 4 miR-206 suprime a migração de células GC e invasão in vitro. (A) O ensaio de cicatrização da ferida apresentaram diferentes motilidades celulares em miR-controlo, as células de miR-206. A expressão ectópica de miR-206, obviamente, inibiu a migração de células SGC-7901. (B) mostra os resultados estatísticos. Os dados representam as médias ± SEM de três experiências independentes. (** P < 0,01). A sobre-expressão de miR-206 capacidades significativamente impedida de migração celular (C) e invasão (E) em miR-206 expressando células SGC-7901 estáveis em comparação com o controlo negativo. (D, F) mostra os resultados estatísticos, respectivamente. Os dados representam as médias ± SEM de três experiências independentes. (** P < 0,01, *** P < 0,0001).
MiR-206 inibe a metástase hepática de GC in vivo
Para investigar o efeito de miR-206 em metástases in vivo, foram realizadas cauda -vein injecção do vector sozinho células P2GM com ratinhos nus P2GM-miR-206 e, 42 dias após a injecção, que colhidas e captou os fígados (Figura 5A, painéis superiores). H & E coloração das secções de tecido indicada a 7 vezes menor número de nódulos de tumores metastáticos por unidade de área nos fígados injectados com células P2GM-miR-206 do que aqueles injectados com células de controlo P2GM (Figura 5A, painéis inferiores e B). Além disso, os tamanhos de nódulos de tumor nos fígados injectados com células P2GM-miR-206 foram muito menores do que aqueles do grupo de controlo (Figura 5A). Este resultado sustenta fortemente que o miR-206 normalmente pode ter um papel supressor de tumores prevenir a metástase das células do cancro gástrico. Figura 5 miR-206 inibe a metástase hepática de GC in vivo. (A) representativos imagens macroscópicas de fígado de rato, 42 dias após a inoculação, (o superior). fotografias representativas de H & E manchado metástases hepáticas espontâneas. Ampliação: 10 x (A inferior). Os resultados mostram que os nódulos de tumor em grupo P2GM-miR-206 eram menores e menos, em comparação com o grupo de controlo. (B) O número de fígado loci metastático foram contados e comparados entre os ratinhos com SGC-7901 células de controle de vetores e células SGC-7901 expressam miR-206. Os dados representam as médias ± SEM, (*** P < 0,0001). (C) Nível de mRNA Relativa de alvos putativos de miR-206 entre SGC-7901-miR-P2GM e SGC-7901-miR-206 células. (D) O nível de mRNA em relação de alvos putativos de miR-206 entre GES-1 e linhas celulares SGC-7901.
Para determinar o mecanismo pelo qual miR-206 exerce seu papel anti-metastático, que procurou possível miR- 206 genes alvo utilizando uma combinação de ferramentas de aquisição de alvos de microRNA em linha, e com referências cruzadas dos candidatos resultantes para aquelas que têm sido relatados para desempenhar um papel na metástase. Em uma piscina de 20 desses genes, encontramos 9 deles (arquivo adicionais 3: Tabela S1), ou seja, STC2, HDAC4, KLF4, IGF1R, FRS2, SFRP1, BCL2, BDNF, e K-ras, foram drasticamente sub-regulada por miR-206 em células estáveis P2GM-miR-206 em comparação com os seus respectivos níveis nas células estáveis P2GM vetor (Figura 5C). Alguns destes genes alvo de miR-206 eram significativamente sobre-regulada nas células tumorais GC SCG-7901 em comparação com parentais GES-1 gástricas normais células (Figura 5D), o que sugere um acontecimento causal provável. Assim, miR-206 provavelmente inibe a metástase das células tumorais GC através de uma rede de genes reguladores.
Discussão
Embora desregulação dos miRNAs foi relatada em vários tipos de cancros humanos [19], expressão aberrante e potencial papel dos miRNAs no cancros gástricos foram escassos. Aqui, nós demonstramos que o miR-206 é frequentemente reprimidos em cancros gástricos humanos e linhas celulares de cancro. À luz do que a expressão reduzida de miR-206 descrita em vários tipos de tumores, os nossos resultados sugerem que a redução da expressão de miR-206 é provável um acontecimento pré-requisito na tumorigénese. Este requisito foi feito ainda mais relevante quando se descobriu que os baixos níveis de miR-206 foram significativamente associados com metástase linfática, invasão local, e estágio TNM. Esta ideia foi corroborada pelos resultados de expressão ectópica de miR-206 em linha de células de câncer de GC SCG-7901, que mostraram que miR-206 reprimida proliferação celular GC, a formação de colónias, invasão e migração. Finalmente, a capacidade de miR-206 para suprimir a metástase das células SCG-7901 para o fígado fornecida uma explicação clara para a correlação entre os níveis baixos de miR-206 e cancros gástricos invasivo e metastático. Recentemente STC2 foi identificado como um marcador preditivo de metástases em linfonodos em carcinoma de células escamosas do esôfago [20]. Expressão de TrkB e BDNF está associada com mau prognóstico em pacientes com NSCLC [21]. Vários estudos têm relatado que a expressão IGF1R é elevada em cancro da próstata metastático e progressão de resistência ao hormônio [22, 23]. expressão BCL2 no câncer de próstata primário é um marcador de mau prognóstico, com um risco aumentado de recorrência [24]. O que se disse acima sugerindo um papel oncogênico comum em cancro humano. Além disso, identificamos STC2, HDAC4, KLF4, IGF1R, FRS2, SFRP1, BCL2, BDNF e K-ras como alvos funcionais putativos de miR-206, como parte deles foram falou acima. Tomados em conjunto, os nossos resultados sugerem um papel supressor de tumores de miR-206 em cancro gástrico humano
Evidência de miR-206 como um supressor do crescimento tumoral foi avaliado em vários cancros:. MiR-206 foi encontrado pela primeira vez para ser regulada negativamente em ERalpha tecidos de cancro da mama humanas -positivas e introdução de miR-206 em células MCF-7 de cancro da mama dependente de estrogénio inibe o crescimento celular de um modo dose-dependente do tempo e [25]. Além disso, o miR-206 poderia promover o crescimento e diferenciação do tumor bloco miogénica em ratinhos xenoenxertados de regulação negativa do produto do proto-oncogene MET: receptor de tirosina-quinase Met [26]. Yan também descobriram que a inibição de miR-206 função poderia contribuir para a proliferação celular aberrante e migração, que conduz ao desenvolvimento rabdomiossarcoma pela supressão de C-Met [16]. Enquanto isso o miR-206 pode ser utilizado para inibir a migração de células HeLa e concentrar formação através da inibição da proteína tanto Notch3 ARNm e [27]. Além disso, o miR-206 foi regulada negativamente em metástases do cancro do pulmão alta em comparação com tumores metástases baixos e tecidos pulmonares normais, a sobre-expressão de miR-206 inibiu a migração e a invasão de células de cancro do pulmão [18]. MiR-206 expressão diminuição nos níveis de estrogênio receptor-α (ERa) -positivo endometrial endometrioid adenocarcinoma (CEE) e sua superexpressão inibiu a proliferação ERa-dependente, invasão prejudicada e interrupção do ciclo celular induzida de linhas celulares CEE ERa-positivos [28]. Todos estes resultados indicaram que o miR-206 pode desempenhar um papel supressor de tumor em vários cancros.
Metástase contribui para a maioria das mortes relacionadas com o cancro. GC classifica como a segunda principal causa de morte relacionada ao câncer em todo o mundo devido a sua alta taxa de metástase, incluindo linfonodo, peritônio, fígado etc Especialmente a taxa de sobrevida em 5 anos de tumor gástrico com metástases hepáticas não exceda 10% ea mediana sobrevivência sem qualquer tratamento é de cerca de 3 a 5 meses [29]. Genes múltiplos desempenhou um papel fundamental na metástase GC: tais como a sobre-expressão do receptor do factor de crescimento-I (IGF-IR) semelhante a insulina e a activação das suas vias de sinalização ambos desempenham papéis críticos no desenvolvimento e progressão do cancro gástrico. Bater-baixo de expressão Spl por RNA pequeno inibidor levou a uma diminuição da IGFIR expressão e crescimento atenuada e a metástase de células de cancro gástrico [30], de outra forma, o IGF1R pode ser regulada negativamente por miR-7 e a migração de células GC significativamente reduzida e invasão [31]. Adachi encontrado que o bloqueamento de IGF-IR está envolvida na supressão de invasão de células de cancro através da regulação negativa da matrilisina [32]. Todos os autores leram e aprovaram o manuscrito final.
 Genética:você tem uma sentença de morte pré-determinada?
Genética:você tem uma sentença de morte pré-determinada?
 Parte 5:quem não deve fazer a dieta elementar
Parte 5:quem não deve fazer a dieta elementar
 Conscientização sobre o câncer de mama:estatísticas, fatos e prevenção
Conscientização sobre o câncer de mama:estatísticas, fatos e prevenção
 O divertículo de Zenker é fatal?
O divertículo de Zenker é fatal?
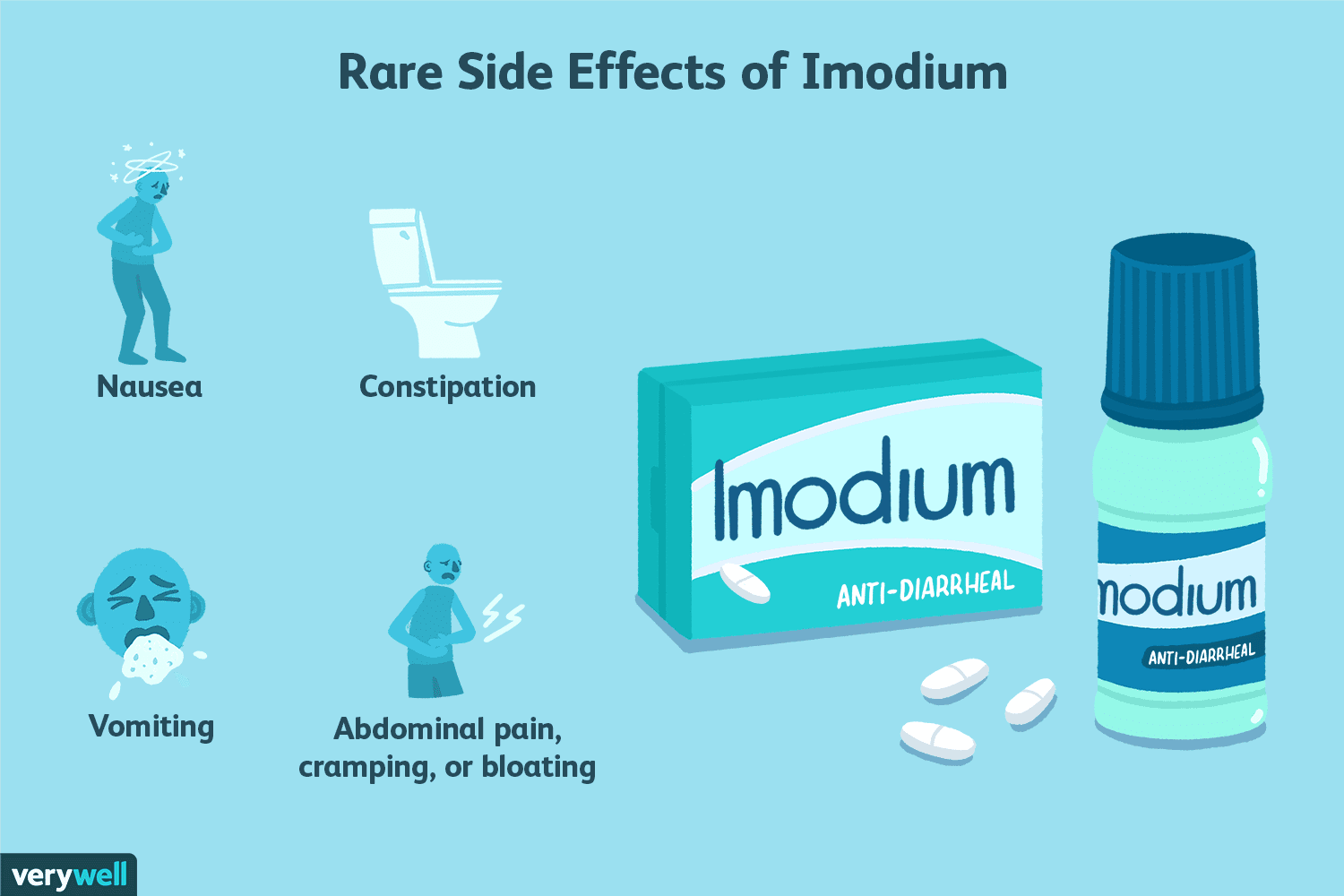 A segurança de tomar Imodium para tratar a diarreia
A segurança de tomar Imodium para tratar a diarreia
 Sangue nas fezes (sangramento retal, hematoquezia)
Sangue nas fezes (sangramento retal, hematoquezia)
 revisão da entrega em domicílio do sibo:dias 5 e 6
Os três dias finais do Yardmills O serviço de entrega em domicílio SIBO seguiu a Remoção e restauração fase 2 do Dr. Nirala Jacobi Protocolo de dieta bifásica SIBO. Alguns novos alimentos podem ser i
revisão da entrega em domicílio do sibo:dias 5 e 6
Os três dias finais do Yardmills O serviço de entrega em domicílio SIBO seguiu a Remoção e restauração fase 2 do Dr. Nirala Jacobi Protocolo de dieta bifásica SIBO. Alguns novos alimentos podem ser i
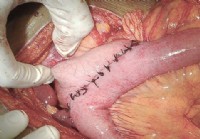 O que é um procedimento de gastrojejunostomia?
O que é um procedimento de gastrojejunostomia? A imagem mostra cerca de 10 polegadas de suturas em órgãos internos, a anastomose (abertura criada cirurgicamente) do estômago ao intestino delgado médi
O que é um procedimento de gastrojejunostomia?
O que é um procedimento de gastrojejunostomia? A imagem mostra cerca de 10 polegadas de suturas em órgãos internos, a anastomose (abertura criada cirurgicamente) do estômago ao intestino delgado médi
 O que é casca de psyllium:guia para benefícios e efeitos colaterais da fibra de psyllium
A casca de psyllium é uma fibra solúvel que auxilia a saúde digestiva. Também conhecido como ispaghula, o psyllium ajuda a aliviar diarreia, constipação, síndrome do intestino irritável e muito mais.
O que é casca de psyllium:guia para benefícios e efeitos colaterais da fibra de psyllium
A casca de psyllium é uma fibra solúvel que auxilia a saúde digestiva. Também conhecido como ispaghula, o psyllium ajuda a aliviar diarreia, constipação, síndrome do intestino irritável e muito mais.