MicroRNA-144 inibe a metástase do câncer gástrico, visando a expressão MET da arte abstracta
câncer gástrico (CG) continua a ser um dos tipos mais comuns de câncer maligno, e o mecanismo molecular subjacente à sua metástase ainda é em grande parte obscura. MicroRNAs surgiram como reguladores importantes da metástase devido à sua capacidade para agir em múltiplas vias de sinalização. Em nosso estudo, descobrimos que miR-144 é significativamente regulada negativamente em ambas as linhas de células GC altamente metastáticas e tecidos. Os resultados de ambos ganho-de-função e experiências de perda de função demonstram que o aumento da expressão de miR-144 reduziu significativamente a migração de células de GC, enquanto que o miR-144 diminuiu a expressão de migração de células de GC drasticamente aumentada. O proto-oncogene met (MET), que é muitas vezes amplificada em cancros humanos e as funções como um importante regulador do crescimento celular e a invasão do tumor, foi identificada como um alvo directo de miR-144. Além disso, o silenciamento do TEM utilizando pequena interferência RNA (siRNA) recapitulou a função anti-metastático de miR-144, enquanto restaurando a expressão de MET atenuou a função de miR-144 em células de GC. Além disso, descobrimos que o miR-144, visando MET, suprime a fosforilação de Akt. Por fim, observamos uma correlação inversa entre a expressão de miR-144 e mRNA MET em GC tecidos metastáticos. Em resumo, o miR-144 suprime a progressão por GC downregulating directamente a expressão de TEM, que impede que, subsequentemente, a activação da via de Akt pró-oncogénica. Reintrodução de miR-144 expressão em células de GC apresenta uma abordagem terapêutica atraente para bloquear a metástase do câncer gástrico.
Palavras-chave
microRNA miR-144 MET gástrica câncer de metástases Introdução
Globalmente, o câncer gástrico (GC) é uma dos tipos mais prevalente de doença maligna. Em 2008, cerca de 989.600 novos casos de GC foram diagnosticados. Além disso, GC foi implicado como causa de 738,000 mortes, fazendo GC a quarta neoplasia maligna mais comum ea principal causa de morte por câncer em todo o mundo [1]. Como o tumor progride, desenvolve-se a capacidade de invadir tecidos adjacentes e metastizar. O receptor do factor de crescimento de hepatócitos, Met, é conhecida por promover a motilidade e capacidade invasiva de células tumorais [2]. MET é um membro da família do receptor de tirosina-cinase e tem sido mostrado para ser regulada positivamente em muitos tumores [3-5]. Sugere-se que o nível de expressão de MET é aumentado por amplificação do gene ou através de hipóxia HIF1α. Em pacientes com GC metastático, amplificação MET e expressão da proteína forte não são pouco frequentes. Esses eventos parecem estar significativamente associada com a evolução clínica desfavorável [6]. Aproximadamente 10% dos pacientes brancos abrigar um ganho de cinco ou mais cópias do MET. Além disso, esse ganho em número de cópias do MET é significativamente associada com prognóstico desfavorável [7]. Além disso, os microARNs miR-34a /c foram mostrados para modular negativamente a expressão de TEM em linhas celulares derivadas de cancro da próstata, carcinoma hepatocelular e GC [8-10].
MicroRNAs (miARNs) são moléculas de ARN não-codificantes, aproximadamente 21-23 nucleótidos de comprimento, que regulam a expressão do gene ao nível da transcrição ou pós-transcricional [11-13]. expressão miRNA perfilar análises revelaram uma baixa regulação mundial dos níveis de miRNA maduras em tumores humanos em relação aos tecidos normais [14]. Além disso, miARN pode funcionar em qualquer um supressor de tumor ou função oncogénica, dependendo da função do seu alvo. Por exemplo, o miR-133b foi significativamente regulada para baixo em tecidos GC e exerceu o seu papel supressor de tumor em células de GC [15]. Expressão de miR-337-3p foi significativamente regulada negativamente em tecidos linfáticos metastáticos nó de pacientes de GC, e a indução da expressão de miR-337-3p fez reduzir a capacidade de invasão de células de cancro gástrico [16]. miR-25 promove a progressão por GC downregulating directamente expressão TOB1; Portanto, o aumento da expressão de miR-25 apresenta um potencial biomarcador não invasivo para o prognóstico de pacientes GC [17]. Além disso, o miR-7 é significativamente regulada negativamente em ambas as linhas celulares altamente metastáticas GC e tecidos metastáticos. A sobre-expressão de miR-7 inibe acentuadamente a metástase por GC direccionamento da expressão do oncogene do receptor de factor de crescimento 1 semelhante à insulina (IGF1R) [18]. Em linhas celulares de GC, a reintrodução de miR-144 de expressão resulta na repressão de ZFX, o qual aumenta moderadamente a susceptibilidade das células do cancro a quimioterapia 5-fluorouracilo. Em 93 casos de GC primário, diminuiu a expressão de miR-144 foi associada com mau prognóstico [19]. Estes exemplos têm destacado o papel fundamental dos miRNAs em malignidade GC e progressão do câncer.
Neste estudo, caracteriza as metas e definido o mecanismo de ação de miR-144 em GC. Ao induzir expressão ectópica de miR-144, descobrimos MET é um novo alvo de regulação miR-144. Esta descoberta foi confirmada em ambos os níveis de mRNA e proteína, e ensaios de luciferase gene repórter verificada ligação directa de miR-144 para o local de ligação do regulador na 3'UTR de TEM. Além disso, verificou-se que a expressão de MET correlaciona inversamente com o miR-144 níveis em um pequeno, mas bem documentado coorte GC. Nossa hipótese é que miR-144 inibe GC metástase, e que alguns dos essa inibição é mediada pela expressão de segmentação TEM.
Materiais e métodos
amostras de tecidos humanos e linhas celulares
amostras GC foram coletados de pacientes submetidos à cirurgia na Fudan University Shanghai Cancer Center entre 2012 e 2013. o protocolo foi aprovado pelo Comitê de Ética da Universidade Fudan de investigação Clínica, ea pesquisa foi realizada de acordo com as disposições da Declaração de Helsinki de 1975. Todas as amostras foram obtidas com o consentimento informado dos pacientes. A linha celular humana GC AGS (ATCC CRL-1739 ™), SNU-1 (ATCC CRL-5971 ™), SNU-5 (ATCC CRL-5973 ™), SNU-16 (ATCC CRL- 5974 ™) , NCI-N87 (ATCC CRL-5822 ™), e Kato III (ATCC HTB-103 ™) foram mantidas em DMEM contendo soro bovino fetal a 10%. Todas as linhas celulares foram mantidas em meios contendo penicilina (100 UI /ml) e estreptomicina (100 mg /ml) a 37 ° C com 5% de CO2. Os inibidores de miARN imita e foram adquiridos a partir da Ambion (Austin, TX, EUA).
Extração de RNA e PCR em tempo real
O ARN total foi extraído a partir de células utilizando TRIzol (Invitrogen, Carlsbad, CA). Para a análise de miARN, caudas poli (A) foram adicionados a ARN total utilizando poli (A) polimerase (Ambion, Carlsbad, CA) antes da transcrição reversa. O kit de detecção de miARN MiRcute qPCR (TIANGEN, Pequim, China) foi utilizado para quantificar os níveis de miR-144 de expressão de acordo com o protocolo fornecido. Foram utilizadas as seguintes condies de PCR: 95 ° C durante 30 s, seguido de 40 ciclos de 95 ° C durante 5 s e 60 ° C durante 31 s. A quantidade de alvo (Met /miR-144), normalizados para o gene constitutivo de GAPDH endógena /U6snRNA e em relação a uma amostra de referência, é dado pela seguinte equação: quantidade de alvo = 2- △△ CT
Microarray hibridação.
Resumidamente, as amostras de ARN foram utilizados para sintetizar o DNA complementar de cadeia dupla (ADNc), e de cadeia dupla de ADNc foi marcado e hibridado com o microarray (Arraystar, Rockville, MD). Após a hibridização e lavagem, lâminas processadas foram digitalizados com o scanner microarray Axon GenePix 4000B (Molecular Devices, Sunnyvale, CA). P valor foi calculado usando o teste t pareado. O limiar fixado para cima e para baixo-regulamentado genes foi uma mudança dobra > 2,0 e um valor de p < 0,05. agrupamento hierárquico foi realizada com base em genes diferencialmente expressos e miRNAs usando software Treeview Cluster da Universidade de Stanford (Palo Alto, CA).
rede miRNA-gene
Construímos a adjacência de rede entre dois genes, I e J, definido como uma potência de correlação de Pearson entre os correspondentes perfis de expressão genética, xi e xj. A matriz de adjacência, M (i, j), foi visualizado como um gráfico, e as propriedades topológicas deste gráfico foram examinados. Para fazer uma representação visual, apenas os mais fortes correlações (> 0,98) foram elaboradas em estas retribuições. Em redes de miARN-genes, cada gene corresponde a um nó. Dois genes são ligados por uma aresta, o que indica uma correlação forte. Dentro da análise de rede, um grau é a medida mais simples, o mais importante da centralidade de um gene dentro de uma rede e determina a importância relativa. Um grau é definido como o número de vizinhos directamente ligados
Previsão do sítio de ligação de miR-144
sítios de ligação putativos miR-144 na região não traduzida MET mRNA 3 'foram previstos pelo programa de destino Scan (http: //. www.targetscan.org). Posição 1430-1436 do TEM UTR 3 'tem um sítio de ligação conservados para miR-144 de segmentação. O plasmídeo
transfecção
As sequências de ORF de MET foram amplificados a partir do ADN genómico isolado a partir da linha de células SNU-5 e depois foram subclonados no vector plenti. O plasmídeo foi transfectado em células SNU-5 usando Lipofectamine 2000 (Invitrogen). Após 24 h, as células foram usadas para uma experiência de resgate.
Oligonucleótido transfecção
miR-144 imita, de miR-144 inibidor (anti-miR-144), e MET siARN (siARN-TEM) foram sintetizados por Genepharma , Xangai, China. Oligonucleótido transfecção foi realizada com reagentes Lipofectamine 2000 (Invitrogen, Carlsbad, CA, EUA). A concentração final de miR-144 imita, anti-miR-144 ou siRNA-TEM no sistema de transfecção foi de 100 nM. A eficiência de transfecção para os estudos individuais e co-transfectadas foi determinada por microscopia de fluorescência.
Immunoblotting
quantidades equivalentes de lisados celulares foram resolvidas por 7% de SDS /PAGE e foram transferidas para membranas de fluoreto de polivinilideno. A membrana foi incubada com um anticorpo policlonal de coelho anti-MET (1: 500, Abcam, ab47431), um anticorpo anti-ADAM12 policlonal de cabra (0,3 mg /ml, Abcam, ab28747), e um anticorpo policlonal de coelho anti-versicam (1 ug /ml, Abcam, ab19345). IRdye-anticorpos secundários marcados foram usados para quantificação do sinal de imunotransferência, e os sinais foram analisados por meio de um scanner Odyssey (LI-COR Biosciences, Lincoln, NE, EUA).
Ensaio de ARN-chip
interacções proteína-ARN são fixados com formaldeído, e cisalhamento da cromatina é combinado com o tratamento com ADNase para produzir complexos de ARN /proteína que pode ser imunoprecipitada com anticorpos contra proteínas Met. Ligações cruzadas são posteriormente revertida; ARN é recuperado e novamente tratado com ADNase para assegurar a ausência de ADN. ARN precipitado a partir do complexo imunológico, em seguida, ser analisada por PCR em tempo real. Neste ensaio RNA-chip, a seguinte fórmula ser usado:% de entrada (recuperação) = AE (Ct input-Ct da amostra) * Fd * 100%. Aqui, AE representa a eficiência de amplificação (10 (-1 /declive)) e Fd é um factor de diluição do ARN de entrada para equilibrar a diferença nas quantidades de ARN de amostra e a entrada de ARN-chip utilizado para PCR em tempo real.
ensaio da luciferase of the MET 3'UTR completo foi amplificado por PCR utilizando SNU-5 ADNc como modelo e clonado no vector de controlo pGL3. Utilizou-se mutagénese Quick Change para mutar o sítio de ligação putativo do miR-144 (Stratagene, Santa Clara, CA, EUA). e células SNU-5 AGS foram transfectadas com miR-144 imita /inibidores e pGL3 construções repórter da luciferase que alberga o TEM 3'UTR. Após 24 h, as actividades de luciferase de pirilampo e da luciferase da Renilla nos lisados celulares foram medidos com o Dual-Luciferase Assay System (Promega, Madison, WI, EUA). Os ensaios de migração
Para os ensaios de migração Transwell, 1 × 105 células foram plaqueadas na câmara superior contendo uma membrana não revestida. As células foram plaqueadas em meio isento de soro e meio suplementado com 10% (v /v) de soro foi utilizada como um quimioatractivo na cara inferior. As células foram incubadas a 37 ° C num incubador de cultura de tecido com 5% (v /v) de CO2. Após 16 h, as células que não migraram foram removidos a partir dos lados superiores das inserções de filtro de membrana Transwell. As células que migraram nos lados inferiores das inserções foram coradas com azul brilhante de Coomassie, e as células foram contadas. Ensaio de proliferação celular
As células transfectadas foram semeadas em placas de 96 poços a uma densidade de 1 × 104 células /bem. Um ensaio de proliferação celular foi realizado utilizando o Cell Counting Kit-8 (Dojindo, Kumamoto, Japão) de acordo com as instruções do fabricante. Antes da adição de CCQ-8, as células foram lavadas com meio de cultura quente girando a placa a 500 rpm durante 3 M e, em seguida, descartando o sobrenadante
iniciadores
Os seguintes iniciadores foram utilizados para PCR em tempo real.: miR-144: 5-TACAG TATAG ATGAT GTACT-3; U6snRNA: 5-CGCAA GGAUG ACACG CAAAU UCGUG AAGCG UUCCA UAUUU UU-3; SKIL iniciador directo: 5-GTTAA GCGAA CCTGT ACTTC TGT-3, o iniciador inverso: 5- GTAGG CGACA TGCTT TCTTG G-3; TEM iniciador directo: 5-GTCGG AGTAG AGCGT CGAGA-3, o iniciador inverso: 5-CAGCG CGATC AGGTA GAGC-3; TOP2A iniciador directo: 5-ACCAT TGCAG CCTGT AAATG A-3, iniciador de sentido inverso: 5-GGGCG GAGCA AAATA TGTTC C-3; ADAM12 iniciador directo: 5-TCAAC CTGGA TACCC GATTC C-3, iniciador inverso: 5-GCTCT GTCTG CCGAT GGAG-3; VCAN iniciador directo: 5-GTAAC CCATG CGCTA CATAA AGT-3, o iniciador inverso: 5-GGCAA AGTAG GCATC GTTGA AA-3. Os seguintes iniciadores foram utilizados para a aplicação integral TEM 3UTR: MET 3'UTR iniciador directo: 5-TCACT GCCTG ACCTT TA-3, TEM 3'UTR iniciador inverso: 5-ATCAC TTACT CCCAC AAT-3. O nucleótido siRNA para MET foi usado como segue: siRNA-MET frente: 5-GUGCC ACUAA CUACA UUUAU U-3, siRNA-MET reversa:. 5-UAAAU GUAGU UAGUG GCACU U-3 Análise Estatística
Os resultados são apresentados como médias ± SEM, e os dados foram analisados com o teste t de Student. Um valor de p < 0,05 foi considerado estatisticamente significativo.
Resultados Perfil expressão microRNA no câncer gástrico
Comparação de tecidos metastáticos peritoneal com amostras de focos primários de pares de GC usando análise de agrupamento hierárquico revelou variação sistemática na expressão dos miRNAs e genes (Figura 1A e B). Nossos dados sugerem que um conjunto de miRNAs e genes é frequentemente expressas de forma aberrante nos tecidos metastáticos peritoniais de GC. Além disso, também descobrimos que algumas moléculas previamente bem provadas, tais como miR-7 [18], miR-25 [17], TOB1 e IGF1R, não foram ser identificados em nossos microarrays. Nós pensamos que estes diferença pode ser induzida por diversidade de amostras clínicas vieram de diferentes áreas. Figura rede miRNA-gene 1 Core, incluindo 8 miRNAs-chave e seus alvos. análise hierárquica de agrupamento 27 miARNs (A) e 32 (B) genes que foram diferencialmente expressos entre os tecidos metastáticos em amostras peritoneais primárias e emparelhados de GC (maior do que 2,0 vezes; p < 0,05). valores de expressão são representadas em tons de vermelho e verde, indicando expressão acima e abaixo do valor da expressão média em todas as amostras. (C) A rede de miARN-gene mostra as relações entre 8 miARNs chave e genes associados a tumores que estão previstos para regular. As cores indicam os níveis de expressão anotada de miARNs e genes.
O miARN-gene-rede foi montado com o objectivo de identificar os miARNs chave que regulam a expressão do gene associado a tumores durante a progressão de metástases tumorais. Como os módulos co-expressão provavelmente correspondem a vias biológicas, que co-expressão focada em módulos que estão associadas a um elevado número de genes codificadores de proteínas. Além disso, NCBI RefSeq detalha as funções de muitos genes, que ajudaram a identificação de genes associados a GC. Usando este método, caracteriza o papel de miR-144 na focos metastáticos peritoneal de GC. Na rede de co-expressão do cancro, o miR-144 está ligado a 6 genes codificadores de proteínas que estão envolvidas no crescimento tumoral e metástases (Figura 1C).
Papel regulador de miR-144 em metástases do cancro gástrico
Para investigar miR- 144 função, primeiro analisou os níveis de miR-144 em um painel de 6 linhas celulares GC humanos. Como mostrado na Figura 2A, foram selecionados AGS, caracterizado regulada positivamente com miR-144, e SNU-5, caracterizada com miR-144 regulada negativamente, para um estudo mais aprofundado. A linha celular foi derivada AGS a partir de fragmentos de tumor gástrico que foram ressecados a partir de um doente que tinha recebido qualquer terapia prévia, enquanto SNU-5 foi derivado a partir de ascites de uma doente com carcinoma pouco diferenciado do estômago. Figura 2 miR-144 suprime a migração de células de GC. os níveis de (A) Expressão de miR-144 foram verificadas em um painel de 6 linhas de células humanas utilizando GC-tempo real método de PCR. (B) A migração de SNU 5-células tratadas com miR-144 imita foi verificada usando no-matrigel tratada transpoço câmara. (C) A migração de células AGS tratados com um inibidor de miR-144 foi verificada usando no-matrigel tratada transpoço câmara. (*** P < 0,001).
Em nosso estudo, observou-se uma estreita associação entre miR-144 perda e metástases no GC (Figura 1A e C). Do mesmo modo, estudos anteriores têm documentado inibição baseada em miR-144 da migração celular e invasão do tumor em carcinoma de células escamosas epiteliais. Nossa hipótese é que a reintrodução de expressão de miR-144 iria suprimir a migração de células cancerosas. De um modo adequado, a introdução de expressão de miR-144 inibiu a migração de células em SNU-5 (Figura 2B). Em comparação com SNU-5, células AGS tem um nível relativamente mais elevado de expressão de miR-144 endógeno. Não surpreendentemente, a inibição de miR-144 aumentou a migração de células AGS (Figura 2C). Na verdade, também realizado o ensaio de invasão usando Transwell tratados com Matrigel, e não há nenhuma diferença para a capacidade invasiva de SNU-5 /AGS células depois tratados com miR-144 /anti-miR-144 (dados não apresentados). Estes resultados ilustram que o miR-144 desempenha um papel importante na migração, mas não na invasão de células de GC.
MiR-144 afecta expressão
MET através da expressão ectópica de miR-144 em células SNU-5, determinou-se ADAM12 , VCAN e MET são supostos alvos miR-144. Como mostrado na Figura 3A, a expressão de miR-144 afectada drasticamente os níveis de mRNA de ADAM12, VCAN e MET. ADAM12, VCAN e encontrou níveis de expressão de proteína foram detectados por western blot em células cancerosas transfectadas com miR-144 imita. Tal como mostrado na Figura 3B, apenas se encontrou com os níveis de proteína foram reprimidos por miR-144. Isto indica que o miR-144 afecta MET expressão a nível da transcrição, talvez por meio de clivagem ou desestabilização da estrutura de ARNm. No entanto, também encontramos os níveis de proteína ADAM12 e VCAN não são diminuiu introdução exógena de miR-144. Nós pensamos que o ARNm e os níveis de proteína não pode ser directamente correlacionada por causa de meia-vida diferente. Pensámos também mostraram que pode ser devido à presença de miR-144 que foi continuamente reprimindo a tradução, num caso, mas não o outro. O MET: interação miR-144 também foi demonstrada em células vivas por ensaio de RNA-CHIP. Na verdade, endógena miR-144 foi encontrada associada com MET endógeno em anti-MET mas não imunoprecipitados anti-IgG a partir de células (Figura 3C). Figura 3 A expressão de MET foi regulamentada pelo miR-144. os níveis de (A) de ARNm de putativos miR-144 alvos foram examinados por PCR em tempo real em SNU-5 células transfectadas com miR-144 ou imita o miR-NC. níveis (B) Proteína de putativos miR-144 alvos foram examinadas por western blot em SNU 5 células transfectadas com miR-144 imita ou miR-NC. (C) As recuperações% de entrada das reações RNA-chip ilustra o enriquecimento pelo anticorpo TEM. ensaio de RNA-chip para miR-144 realizado em anticorpo anti-MET a partir de lisados de células. RNA-chip com um IgG não relacionada serviram como controle. (D) Um diagrama esquemático do local de ligação de miR-144 previsto na 3'UTR de TEM. células (E) SNU-5 foram transientemente co-transfectadas com LUC-MET 3'UTR e miR-144 mímico. (F) AGS células foram co-transfectadas transientemente com LUC-MET 3'UTR e um inibidor de miR-144. (L) mutação do local de ligação de miR-144 em MET 3'UTR aboliu a supressão de actividade da luciferase induzida por miR-144. A actividade de luciferase foi medida após 24 h e normalizada para a Renilla co-transfectadas. (* P < 0,05; ** p < 0,01; *** p < 0,001). Utilizando a análise de bioinformática
-base, foi identificado um local de ligação único para miARN miR-144 na 3 'UTR do TEM ARNm (Figura 3D). Para testar se o miR-144 liga-se directamente o 3'-UTR do mRNA TEM, realizamos ensaios de repórter de luciferase em células SNU-5. Os fragmentos derivados de PCR a partir de MET 3'UTR foram inseridos no vector de controlo pGL3 no sítio Xba1 (LUC-MET 3'UTR). A co-transfecção de LUC-MET 3'UTR e miR-144 imita em células SNU-5 resultou numa diminuição do sinal da luciferase (em comparação com o miR-NC), confirmando que a ligação de miR-144 para o 3 'UTR de MET tem um efeito inibidor direto (Figura 3E). A experiência inversa, conseguido através do bloqueio da produção endógena de miR-144 com um inibidor de miR-144 em células AGS, resultou no aumento do sinal da luciferase (Figura 3F). Um repórter da luciferase mutado no sítio de ligação de miR-144 também foi calculado (Figura 3D). A mutação do local de ligação de miARN abolida inibição de miR-144-mediada de actividade de luciferase (Figura 3G). Estes dados sugerem que a posição 1430-1436 do TEM 3'UTR é crítico para a regulação de genes de miR-144-mediada.
TEM medeia a resistência induzida miR-144 a migração
Usando PCR em tempo real, TEM Os níveis de expressão foram determinados para seis linhas celulares humanas GC. Como mostrado, as linhas de células com expressão reduzida "" níveis de miR-144 têm valores mais elevados de Met, em comparação com as linhas celulares com "upregulated" miR-144 níveis (Figura 4A). Usando testes não paramétricos, determinou-se uma correlação inversa significativa entre mRNA MET e expressão de miR-144 em amostras de GC metastáticos (Figura 4B). Figura 4 modulação TEM representa o efeito anti-metastática de miR-144. (A) Western blot mostrando a expressão MET em um conjunto de linhas de células GC humanos. (B) A correlação significativa inversa é observada entre os níveis de expressão de miR-144 e encontrou nos tecidos GC (n = 52). (C) O MET e fosforilada Akt foram inibidos pela expressão forçada de miR-144 ou siRNA-MET. (D, E) Os efeitos do miR-144 ou siRNA-MET sobre a migração e proliferação foram determinados em células SNU-5. (F) A MET e fosforilada Akt foram restaurados pela superexpressão de MET no miR-144 células imita-tratados SNU-5. (G, H) Os efeitos de miR-144 combinados com MET-ORF na migração e proliferação de células SNU-5. (I) O MET e fosforilada Akt foram up-regulada através do bloqueio de miR-144 em células AGS. (J, K) Os efeitos de anti-miR-144 sobre a migração e proliferação de células AGS.
As funções proteína Met como uma tirosina-cinase do receptor e desempenha um papel fundamental na promoção do crescimento celular e da migração por transdução extracelular estímulos para os circuitos de sinalização intracelular. Um componente importante do mecanismo de sinalização intracelular, é a PI3K (fosfoinositida 3-quinase) via [20,21]. Porque miR-144 inibe TEM expressão, temos a hipótese de que o miR-144 em última análise poderia diminuir a fosforilação de Akt e ativação através da diminuição da sinalização TEM. Assim, examinamos os níveis de fosforilação de Akt após miR-144 superexpressão e observaram uma diminuição significativa da fosforilação de Akt (Figura 4C).
Decidimos investigar se induzida por miR-144 downregulation MET teve um efeito sobre a migração de células tumorais e proliferação. Nós transfectadas miR-144 e siRNA para MET (siRNA-MET) em células SNU-5. A migração celular foi avaliada 16 horas após a transfecção por Transwell ensaio, enquanto a proliferação das células foi determinada através de CCK-8. Como mostrado nas Figuras 4D e E, a transfecção com miR-144 inibiu a migração celular e a proliferação, em comparação com o controlo. Do mesmo modo, diminuir a expressão da proteína MET utilizando siRNA também diminuiu a migração de células tumorais e proliferação. Para determinar se
MET é o mediador fundamental de efeito de miR-144 sobre a migração e proliferação celular, construímos duas vector de expressão de MET. Um dos quais contém apenas a sequência de estrutura de leitura aberta do gene MET (Met-ORF), e um outro vector contém as sequências de nucleótidos de comprimento completo do gene MET, incluindo sequência 3'UTR (Met-cheia de comprimento). Nós, então, realizada análise de Western blot 48 h após transfecção de MET-ORF /longo MET-cheia em miR-144 SNU-5 células imita-tratados (Figura 4F). Comparado com o grupo controle negativo (vazio vector), expressão ectópica de MET-ORF aumentou significativamente a expressão total de MET e fosforilada Akt. Além disso, a expressão de met-ORF promovido a migração e proliferação de células de GC (Figura 4G e H). A sobre-expressão de MET aboliu a inibição induzida por miR-144 de migração e proliferação celular. Em contraste, o nível de proteína de MET e fosforilada por AKT aumentada nas células AGS tratados com anti-miR-144 (Figura 4I), e bloqueio do miR-144 também promoveu a migração e proliferação de células de AGS (Figura 4J e K). Estes resultados indicam que MET é um alvo fundamental para o efeito anti-migração de miR-144 em células humanas GC.
Discussão No presente estudo, nós identificamos assinaturas de um pequeno número de genes miARNs e não sobrepostos que são expressas de forma aberrante em tecidos metastáticos peritoneais de GC, em relação aos tecidos emparelhados primárias. Análise de miARN e perfis de expressão de genes no gene da rede miARN identificado miR-144 como um regulador de vias principais oncogénicos, tais como a proliferação e a migração. pacientes GC com metástases peritoneais apresentaram menores níveis de expressão de miR-144 do que pacientes sem metástases. Esta constatação implica miR-144 como um potencial supressor de tumor no GC. Além disso, o miR-144 está associada com os mecanismos de metástase. Os nossos resultados correspondem com os resultados de estudos anteriores sobre a função de miR-144 na proliferação de cancro, migração e invasão [22,23]. miR-144 inibe a metástase de células cancerosas, visando a uma desintegrina e ADAMTS5 membro metaloproteinase (ADAM) família de proteínas. desregulação MicroRNA está associada com o aumento da capacidade de invasão e metástase tumoral, bem como a redução prognóstico do paciente em certos cancros epiteliais [24]. Nós investigamos ainda mais o papel de miR-144 desregulamentação no GC. Estudámos o efeito da expressão de miR-144 na linha de células SNU-5, tal como é caracterizada por uma baixa expressão de miR-144. A expressão ectópica de miR-144 em SNU-5 células resulta em alterações fenotípicas profundas, tais como diminuição da migração. A experiência inversa, impedindo o miR-144 expressão, foi realizada na linha celular de AGS, a qual tem um nível relativamente elevado de expressão endógena de miR-144. Inibição da expressão de miR-144 resultou em aumento da migração de células AGS.
Para investigar o mecanismo por trás miR-144-dependente diminuiu migração de GC, foram identificados os alvos putativos para miR-144 como previsto por miRNA-gene-rede. miR-144 sobre-expressão pode reduzir a expressão de MET em ambos os níveis de mRNA e proteína, e, correspondentemente, os ensaios de repórter de luciferase revelou que o miR-144 pode interagir directamente com a TEM 3'UTR. Em seguida, avaliamos os níveis de expressão se reuniram em uma coorte de 52 pacientes do GC e descobriram que miR-144 níveis são inversamente correlacionada à expressão TEM. Por essa razão, temos a hipótese de que o miR-144 inibe GC tumorigênese, visando a expressão TEM. TEM também tem sido descrito como um alvo de miR-34a /c em outros modelos celulares e é conhecido por promover a motilidade e a capacidade invasiva de células tumorais. Superexpressão de MET está intimamente correlacionado com a invasão do tumor eo prognóstico do paciente em GC [6]. No GC, MET superexpressão é um fator prognóstico independente e alvo potencial da droga. Além disso, MET superexpressão pode prever quais pacientes podem se beneficiar da terapia-alvo com inibidores de MET [25]. Em nosso estudo, a expressão MET foi significativamente associada com a diferenciação GC, TNM e metástase [26]. Determinou-se que as mudanças na proliferação e migração celular através de miR-144 pode ser exercida através da regulação da expressão de MET. miR-144 repressão leva ao aumento dos níveis de MET, o que pode explicar o fenótipo metástase de células miR-144-empobrecido. Curiosamente, o miR-144 influenciada sinalização do factor de crescimento de hepatócitos (HGF). De HGF, como o ligando de MET, pode induzir a activação de MET em células epiteliais. Enquanto MET superexpressão não poderia restaurar completamente GC qualidades tumorigênicos, migração de células GC e proliferação foram parcialmente restaurada após MET superexpressão. Portanto, miR-144 pode regular outros genes em células de GC. Estudos anteriores demonstraram que o TEM pode induzir GC tumorigénese através da activação da via PI3K. Neste estudo, descobrimos que miR-144 atenuou significativamente a fosforilação de Akt, e que Akt fosforilação foi completamente restaurado com superexpressão de TEM. Nossos resultados sugerem que miR-144 regula a fosforilação de Akt através de regulamentação MET em GC.
Em conclusão, nosso estudo identificou uma base para a diminuição do nível de miR-144 visto na GC tecidos metastáticos. miR-144 foi identificado como um potencial supressor de tumor no GC e tem sido associada com os mecanismos de metástases GC. Além disso, o miR-144 inibe GC tumorigênese, visando MET, e, posteriormente, o PI3K /Akt. Para o nosso conhecimento, esta é a primeira vez que miR-144 foi mostrado para alvejar MET em células GC. Portanto, mais estudos que exploram o papel anticancerígeno de miR-144 podem contribuir para o desenvolvimento de novas estratégias terapêuticas para o GC.
Notas
Jun Liu e Hui Xue contribuíram igualmente para este trabalho.
Declarações
Agradecimentos
Este estudo foi apoiado pela National Science Foundation Natural da China (Grant No. 81.201.897). Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados e análise, decisão de publicar ou preparação do manuscrito.
Conflito de interesses
Os autores declaram que não têm interesses conflitantes. Contribuições
Autores '
JL realizou os estudos de biologia molecular. HX redigido o manuscrito. JZ realizou a análise bioinformática. Todos os autores leram e aprovaram o manuscrito final.
 Tomografia computadorizada de crianças no pronto-socorro com foguetes de dor de estômago
Tomografia computadorizada de crianças no pronto-socorro com foguetes de dor de estômago
 Austin Gastroenterology comemora 20 anos servindo a região central do Texas
Austin Gastroenterology comemora 20 anos servindo a região central do Texas
 O H. pylori é contagioso? Sintomas e testes
O H. pylori é contagioso? Sintomas e testes
 As 7 melhores gorduras para um intestino saudável (e 5 para evitar)
As 7 melhores gorduras para um intestino saudável (e 5 para evitar)
 peritonite
peritonite
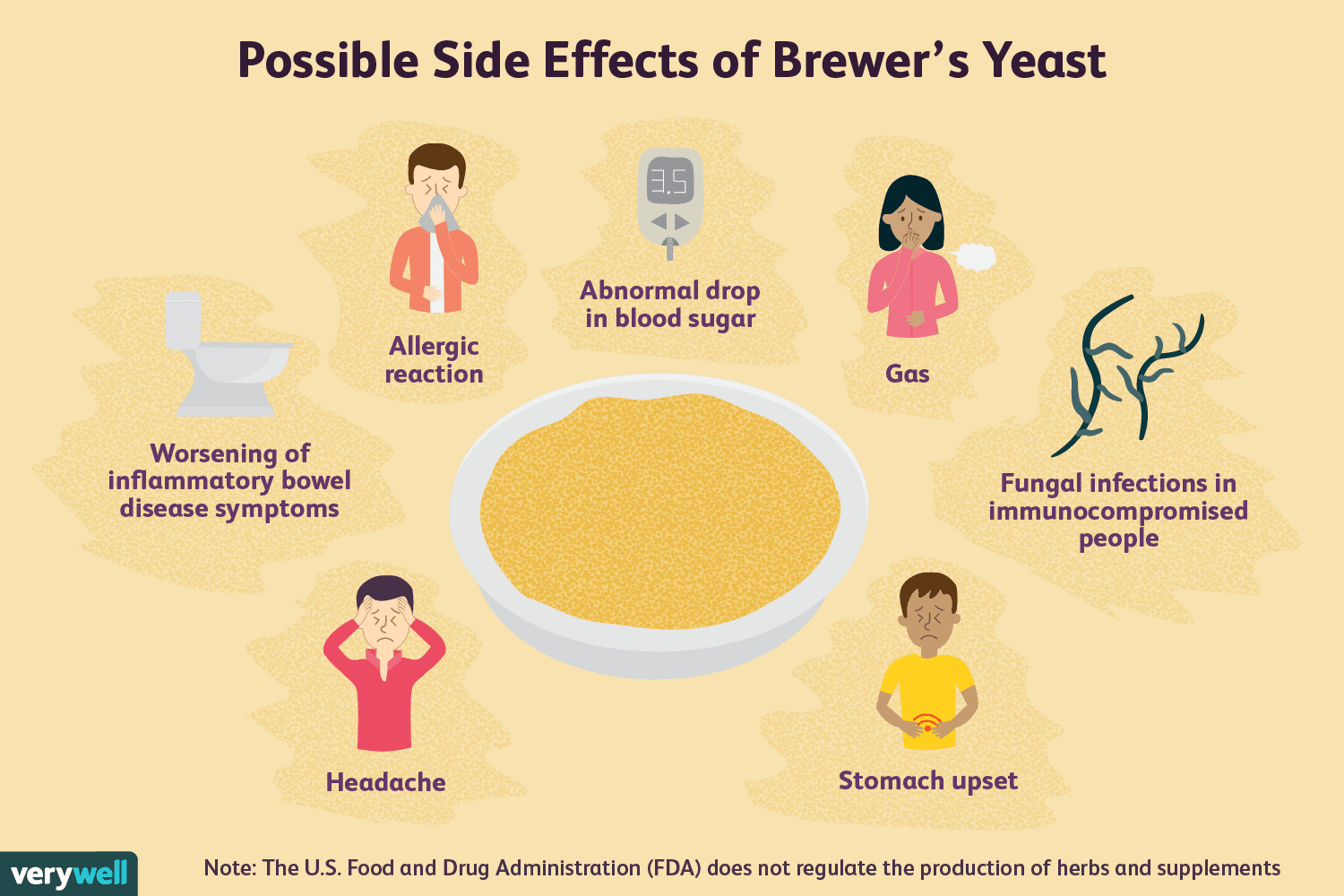 Os benefícios para a saúde da levedura de cerveja
Os benefícios para a saúde da levedura de cerveja
 Como se livrar de náuseas e vômitos
Definição e fatos de náusea e vômito Náuseas e vômitos são sintomas de uma doença subjacente e não são decorrentes de uma doença específica. Náuseas e vômitos são sintomas de uma doença ou condi
Como se livrar de náuseas e vômitos
Definição e fatos de náusea e vômito Náuseas e vômitos são sintomas de uma doença subjacente e não são decorrentes de uma doença específica. Náuseas e vômitos são sintomas de uma doença ou condi
 Micróbios pulmonares podem ajudar a prever resultados em pessoas gravemente doentes
Um novo estudo publicado no American Journal of Respiratory and Critical Care Medicine mostra que registrar a maneira como os organismos que vivem nos pulmões mudam em tipo e número pode refletir a
Micróbios pulmonares podem ajudar a prever resultados em pessoas gravemente doentes
Um novo estudo publicado no American Journal of Respiratory and Critical Care Medicine mostra que registrar a maneira como os organismos que vivem nos pulmões mudam em tipo e número pode refletir a
 Cirurgias de desvio intestinal:ileostomia, colostomia, reservatório ileoanal e ileostomia continental
Cirurgias de derivação intestinal:Ileostomia, Colostomia, Reservatório Ileoanal e Centro de Ileostomia Continente Faça o teste de pancreatite Melhore a saúde digestiva Apresentação de slides sobre pro
Cirurgias de desvio intestinal:ileostomia, colostomia, reservatório ileoanal e ileostomia continental
Cirurgias de derivação intestinal:Ileostomia, Colostomia, Reservatório Ileoanal e Centro de Ileostomia Continente Faça o teste de pancreatite Melhore a saúde digestiva Apresentação de slides sobre pro